El presente documento supone una puesta al día del documento multidisciplinar HEMOMAS, publicado en el año 2016 con el aval de las Sociedades Científicas Españolas de Anestesiología y Reanimación (SEDAR), Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) y de Trombosis y Hemostasia (SETH).
El objetivo de este documento fue revisar y actualizar las recomendaciones existentes sobre el manejo de la hemorragia masiva (HM). Se siguió una metodología basada en elementos del método ADAPTE (búsqueda y adaptación de guías publicadas en el ámbito específico de la HM desde 2014, más búsqueda bibliográfica en PubMed y EMBASE desde enero-2014 hasta junio-2021). Tras la revisión de nueve guías y 207 artículos seleccionados, se actualizaron las 47 recomendaciones existentes en el artículo original, manteniendo, suprimiendo o modificando cada una de ellas y sus grados de recomendación y evidencia. Consensuadamente, los autores aprobaron la redacción final del artículo y las 41 recomendaciones resultantes.
This document is an update of the multidisciplinary document HEMOMAS, published in 2016 with the endorsement of the Spanish Scientific Societies of Anaesthesiology (SEDAR), Intensive Care (SEMICYUC) and Thrombosis and Haemostasis (SETH).
The aim of this document was to review and update existing recommendations on the management of massive haemorrhage. The methodology of the update was based on several elements of the ADAPTE method by searching and adapting guidelines published in the specific field of massive bleeding since 2014, plus a literature search performed in PubMed and EMBASE from January 2014 to June 2021.
Based on the review of 9 guidelines and 207 selected articles, the 47 recommendations in the original article were reviewed, maintaining, deleting, or modifying each of them and the accompanying grades of recommendation and evidence. Following a consensus process, the final wording of the article and the resulting 41 recommendations were approved by all authors.
El manejo de la hemorragia masiva (HM) incluye un conjunto de herramientas y acciones destinadas a controlar el sangrado y a reponer los componentes hemostáticos perdidos de forma precoz, minimizando la coagulopatía asociada que puede poner en peligro la vida1,2.
En los últimos años, con el establecimiento y difusión de protocolos multidisciplinares y la publicación de excelentes guías3–5 se ha conseguido mejorar su manejo, sobre todo en las primeras horas del shock hemorrágico. Sin embargo, el sangrado incontrolado sigue siendo la principal causa de muerte prevenible tras un traumatismo6.
En el año 2015 se formó un grupo multidisciplinar con el objetivo de revisar la literatura existente y realizar un documento que facilitase la toma de decisiones a todos los implicados en el tratamiento de la HM7. Avalada por las Sociedades Científicas Españolas de Anestesiología y Reanimación (SEDAR), Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) y de Trombosis y Hemostasia (SETH), se redactó una guía con 47 recomendaciones o sugerencias de actuación.
En 2021 se decidió actualizarla, dado el tiempo transcurrido y las novedades aparecidas en los múltiples aspectos que se contemplan en el tratamiento de la HM. Las mismas Sociedades Científicas han avalado el trabajo de actualización, realizado con una metodología específica que permitiera la revisión y, en su caso, modificación de las recomendaciones existentes.
Como en el documento original, debido a sus particularidades y manejo específico, la hemorragia obstétrica, en el paciente pediátrico y la hemorragia digestiva, se han excluido de esta guía, que incluye la HM en el paciente politraumatizado, en todo el ámbito del perioperatorio y los cuidados intensivos.
Materiales y métodosPara actualizar este documento, un grupo de 10 expertos (los autores firmantes del manuscrito), se reunieron en mayo de 2021 para establecer el proceso de revisión. Se acordó actualizar las recomendaciones del consenso previo en función de otras guías de práctica clínica existentes y de una revisión actualizada de la literatura. La sistemática del proceso de actualización se basó en elementos del método ADAPTE, a través de la búsqueda y adaptación de las guías y los artículos publicados. El proceso del ADAPTE se describe en detalle en otras publicaciones8; en este proyecto se inició con la identificación de las habilidades y recursos necesarios para llevar a cabo el proceso, seguido de la fase de adaptación: búsqueda y selección de las guías, recogida de la información contenida en ellas en forma de matriz de recomendaciones y, si procedía, adaptación de las recomendaciones recogidas. La selección de los temas a tratar por la guía fueron los de la guía original. La última fase del ADAPTE, donde se obtiene la opinión de decisores afectados por la guía actualizada, no se realizó.
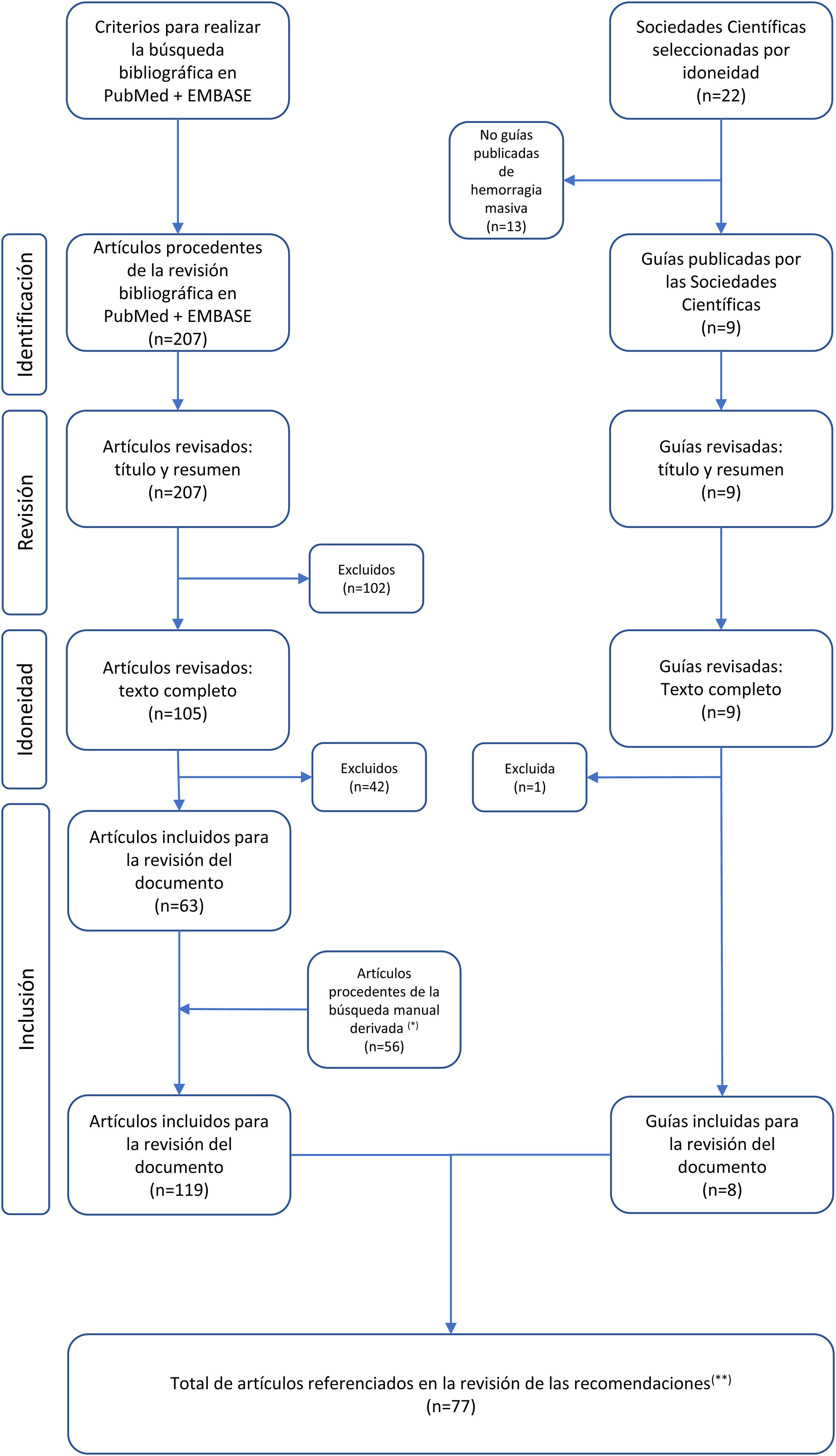
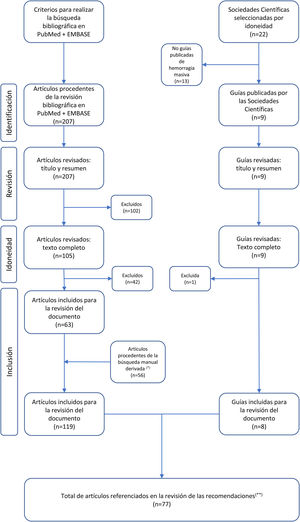
La revisión bibliográfica incluyó la selección de guías de práctica clínica, publicadas en revistas científicas, recomendaciones de Sociedades Científicas relacionadas con el manejo de la HM y una búsqueda en PubMed y EMBASE (enero-2014 hasta junio-2021; ver material suplementario y figura 1).
Diagrama de flujo de la selección de artículos incluidos en la revisión del documento.
(*) Búsqueda manual derivada: búsqueda de artículos incluidos para la revisión del documento basada en las citas bibliográficas existentes en los artículos y guías clínicas seleccionados. (**) Artículos referenciados en las justificaciones de las recomendaciones, sin incluir las referencias de la introducción ni de la metodología.
Tras protocolizar la estrategia de revisión bibliográfica y de las recomendaciones de la guía original (revisión por pares), se pusieron en común los resultados, consensuando las modificaciones pertinentes con la nueva evidencia disponible de las recomendaciones (detalles del protocolo de revisión en material suplementario).
ResultadosDe las 47 recomendaciones del documento inicial solo se mantuvo una sin modificación, considerándose necesario cambiar la redacción y/o el grado de recomendación y/o el nivel de evidencia en el resto. Se suprimieron siete recomendaciones, agrupando algunas de ellas y ampliando otras según la evidencia disponible. Se obtuvieron finalmente 41 en el documento actualizado, distribuidas en 14 apartados, con 61 afirmaciones (38 recomendaciones, dos con grado de evidencia A, y 23 sugerencias). En el material suplementario se aporta información de las diferencias entre los documentos (tablas 1MS y 2MS).
Recomendaciones y justificacionesDefinición y valoracionesRecomendación 1
En la evaluación de la extensión y/o gravedad de la hemorragia en el paciente quirúrgico se recomienda la exploración visual periódica del campo quirúrgico en busca de hemorragia excesiva microvascular, y en el paciente traumatizado el examen clínico analizando el mecanismo traumático, el patrón anatómico y la respuesta inicial a la reanimación. (1C)
En el paciente con riesgo de HM la monitorización del sangrado debe hacerse mediante el examen clínico y la cuantificación del mismo9. En el paciente traumático también se debe analizar el mecanismo de la lesión, el patrón anatómico y la respuesta inicial a la reanimación. Estas medidas pueden ayudar a predecir la necesidad de activación de los protocolos de transfusión masiva (PTM)4,10.
Recomendación 2
Para la identificación temprana de pacientes beneficiarios de una activación del protocolo de transfusión masiva en los pacientes traumatizados, se sugiere utilizar el Trauma Associated Severe Hemorrhage (TASH) score (puntuación de corte 15), preferentemente asociado a la disminución de la firmeza del coágulo en los test viscoelásticos en el caso de que estén disponibles. (2C)
La rápida identificación del paciente en riesgo de desarrollar una HM y recibir una transfusión masiva (TM) es crucial para poder activar los PTM precozmente y mejorar el pronóstico en estos pacientes11.
En el paciente politraumatizado se han descrito escalas como el «TASH score», que incluye parámetros clínicos (presión arterial y frecuencia cardiaca entre otros) y analíticos (hemoglobina, exceso de bases), y ha demostrado clasificar correctamente al 88,8% de los pacientes que requerirán una TM10
Los test viscoelásticos (TVE) también pueden ayudar a predecir la necesidad de activación del PTM en el paciente traumático12,13.
Recomendación 3
Para la identificación temprana de pacientes beneficiarios de una activación del protocolo de transfusión masiva en pacientes no traumatizados se sugiere utilizar la «intensidad de la reanimación» definida como la transfusión de al menos 4 unidades de concentrado de hematíes en 1 hora. (2C)
En el ámbito prehospitalario se sugiere utilizar el «Índice de shock», teniendo como punto de corte para la activación precoz del protocolo de transfusión masiva un resultado igual o superior a 1. (2C)
En pacientes no traumatizados se ha propuesto la intensidad de la resucitación como indicador de la severidad de la hemorragia, definida como la administración de 3-4 concentrados de hematíes (CH) por hora4.
El índice de shock (IS) (frecuencia cardiaca dividido por presión arterial sistólica), es la única escala de riesgo validada que utiliza exclusivamente variables clínicas, considerándose de gran utilidad en el ámbito prehospitalario. Un valor de IS superior o igual a 1 predice mortalidad temprana4,14.
Recomendación 4
Se recomienda que las instituciones elaboren protocolos de transfusión masiva coordinados de forma multidisciplinar, con algoritmos de tratamiento basados en la evidencia científica que incluyan criterios de activación y desactivación, y objetivos de transfusión, contemplando la transición a una reanimación guiada por datos de laboratorio o test viscoelásticos tan pronto como sea posible. Asimismo, se recomienda realizar campañas informativas y de entrenamiento a los equipos implicados y evaluar periódicamente su cumplimiento y su efectividad, en el marco de los programas de calidad y seguridad de las instituciones. (1B)
La instauración y aplicación de PTM multidisciplinares ha demostrado reducir la transfusión de componentes sanguíneos y la mortalidad en el paciente traumático15,16, recomendándose revisarlos regularmente dentro de los programas de calidad y seguridad4,17. Otras situaciones de HM, en las que se sospeche coagulopatía y el sangrado sea de difícil control, podrían beneficiarse también de estas medidas18, con una gestión de la HM más rápida, coordinada y eficiente5.
Para el desarrollo de los PTM, se recomienda la transición de un algoritmo basado en proporciones fijas de hemocomponentes a otro guiado por datos de laboratorio o TVE, permitiendo reducir el uso de componentes sanguíneos, la morbilidad de los pacientes y mejorar la coagulopatía10.
Recomendación 5
En situaciones de hemorragia masiva, se recomienda basar la valoración inicial en la historia clínica y la anamnesis (si es posible), y para evaluar la perfusión tisular y el grado de shock hipovolémico se recomienda monitorizar secuencialmente presión arterial, frecuencia cardíaca y lactato sérico o déficit de bases. (1C)
La monitorización dinámica del estado de perfusión tisular incluirá la presión arterial, frecuencia cardiaca, saturación de oxígeno y electrocardiografía, además de los signos y síntomas clínicos9. Se recomienda también la determinación seriada del lactato sérico y el déficit de bases3,4, que, aunque pueden no correlacionarse estrictamente con la gravedad de la agresión, sí que lo hacen con el grado de hipoperfusión e hipoxia tisular19.
Control de la temperaturaRecomendación 6
En los pacientes con hemorragia masiva, se recomienda la monitorización sistemática de la temperatura y la rápida aplicación de medidas que eviten la pérdida de calor y la hipotermia, manteniendo la temperatura central por encima de 35°C. (1B)
Entre las medidas para evitar la hipotermia, se sugiere retirar la ropa húmeda, tapar al paciente, aumentar la temperatura ambiente, usar mantas de aire o colchones de agua caliente, así como calentadores de infusión rápida para todos los fluidos que se administren durante una transfusión masiva y considerar los sistemas de calentamiento extracorpóreo en pacientes con hipotermia severa y alto riesgo de parada cardíaca. (2C)
El mantenimiento de la normotermia reduce la hemorragia y los requerimientos transfusionales3, debiendo ser una prioridad en los pacientes con HM4 porque la hipotermia (temperatura central inferior a 35°C) se asocia a acidosis, hipotensión y coagulopatía. Así, la monitorización sistemática de la temperatura central permite guiar la aplicación de las medidas más adecuadas para alcanzar la normotermia.
Las medidas necesarias frente a la hipotermia incluyen calentadores de fluidos, sistemas de calentamiento por aire o colchones de agua caliente4. Además, es importante realizar un adecuado control de la temperatura de los CH y otros hemocomponentes a administrar.
FluidoterapiaRecomendación 7
Se recomienda la terapia precoz con fluidos en el paciente con hemorragia grave e hipotensión, empleando preferentemente cristaloides isotónicos. (1A)
En pacientes con hemorragia grave por traumatismo, se recomienda el uso de soluciones cristaloideas balanceadas en lugar de soluciones salinas. (1B)
La corrección de la hipovolemia con fluidoterapia es la primera medida a tomar en una HM20 por la menor tolerabilidad a la hipovolemia que a la anemia.
Los cristaloides (tabla 3 MS, material suplementario) son los fluidos de elección por su eficacia clínica, moderados efectos adversos y bajo coste. No hay datos suficientes para sugerir que el uso de una solución coloidea mejore el pronóstico de los pacientes en shock hemorrágico19, habiéndose descrito efectos adversos como alergias (especialmente con gelatinas), alteraciones en la coagulación y de insuficiencia renal.
Respecto a las soluciones balanceadas, se ha descrito en pacientes politraumatizados una mejoría del estado ácido-base y menor hipercloremia a las 24 horas frente a una solución salina al 0,9%21, con una mejor relación coste-beneficio22. Aunque estudios más recientes publicados tras el cierre de la revisión realizada para la actualización de esta guía pudieran indicar que ambas soluciones podrían ser adecuadas en pacientes críticos23,24, los autores nos inclinamos por el uso preferente de las soluciones balanceadas frente al suero salino en el manejo de la HM del paciente politraumatizado. Si se utiliza suero salino, debe administrarse un máximo de 1-1,5 litros4,19.
Recomendación 8
Se recomienda evitar las soluciones cristaloideas hipotónicas tipo Ringer lactato en pacientes con traumatismo craneoencefálico grave. (1B)
Las soluciones hipotónicas, por su menor poder de expansión que las isotónicas e hipertónicas y aumentar el volumen de agua libre, deben evitarse en pacientes con traumatismo craneoencefálico (TCE) grave, pudiendo aumentar la mortalidad frente a la solución salina a 0,9%3,4,25,26.
Recomendación 9
Se sugiere evitar la administración de soluciones hipertónicas como líquido de reanimación en pacientes con traumatismo craneoencefálico grave. (2C)
La solución salina hipertónica representa un tratamiento de primera línea para reducir temporalmente la presión intracraneal elevada, pero no debe utilizarse como líquido de reanimación principal para el shock hemorrágico, porque no mejora la supervivencia ni el resultado cognitivo4.
Recomendación 10
Se recomienda restringir el uso de coloides sintéticos. (1C)
La administración de coloides sintéticos puede agravar la coagulopatía por su efecto negativo sobre la hemostasia3,4.
Se han utilizado por una supuesta mayor eficacia para restaurar el volumen intravascular, permitiendo una menor infusión de cristaloides27, por lo que se han propuesto cuando la combinación cristaloides-vasopresores no conseguía mantener la perfusión tisular básica, sin haber demostrado beneficio sobre la mortalidad28 ni determinado cuál debería ser de uso preferente.
Actualmente, con la retirada de los hidroxietilalmidones, el eventual uso de coloides sintéticos se reduce a las gelatinas.
Recomendación 11
Se recomienda evitar el empleo sistemático de la albúmina como fluido de reposición de la volemia en pacientes con hemorragia masiva. (1C)
Debido a la falta de datos sobre su efectividad en comparación con otros solutos, su elevado coste y potenciales riesgos, la albúmina no es un fluido de elección en la reanimación de la HM19. Aunque se sugiere su empleo como fluido de segunda línea en el paciente séptico tras la administración inicial de grandes cantidades de cristaloides29, esta recomendación no se puede extrapolar a la HM.
Un análisis de subgrupos del estudio SAFE30 sugiere un mayor riesgo de muerte con el uso de albúmina a 4% en pacientes con TCE, posiblemente debido a la hipo-osmolaridad de este preparado.
Recientemente se ha postulado que la albúmina podría tener un efecto protector sobre el glicocálix, con un cierto beneficio sobre la permeabilidad vascular31. Por último, su uso pudiera ser apropiado en la reanimación del sangrado en pacientes cirróticos, durante la cirugía hepática32, o la cirugía cardiaca33.
Recomendación 12
Se recomienda una estrategia restrictiva de reposición de volumen para alcanzar la tensión arterial objetivo hasta el control de la hemorragia. (1B)
Hasta que se pueda controlar el sangrado, parece lógico tolerar un cierto grado de hipotensión arterial, considerando particularidades de cada paciente (edad avanzada, antecedentes de hipertensión arterial y el objetivo del mantenimiento de la perfusión tisular). Además, la elevación excesiva de la tensión arterial puede contribuir a reanudar el sangrado19.
En la cirugía hepática se ha demostrado una reducción del sangrado y de las necesidades transfusionales con una estrategia restrictiva de reposición de volumen3,4,19.
Reanimación hipotensivaRecomendación 13
Se recomienda, en pacientes traumatizados sangrantes, hipotensos y sin traumatismo craneoencefálico, un objetivo de tensión arterial sistólica entre 80 y 90 mmHg. Esta medida debe ser transitoria hasta que el origen de la hemorragia haya sido controlado, sobre todo en pacientes ancianos o hipertensos. (1C)
En el paciente traumatizado el concepto de «Resucitación con Control de Daños» con una estrategia de reemplazo de volumen restrictiva e hipotensión permisiva ha demostrado ser beneficioso4,19,34,35.
No obstante, las cifras recomendadas de tensión arterial media (50-60 mmHg) y presión arterial sistólica (80-90 mmHg) son arbitrarias y podrían no ser seguras para todos los pacientes traumáticos, especialmente en pacientes con traumatismo contuso y penetrante36, debiendo considerarse cuidadosamente en el paciente anciano37 e hipertenso crónico38.
Recomendación 14
En pacientes traumatizados sangrantes, hipotensos y con traumatismo craneoencefálico, se recomienda un objetivo de tensión arterial sistólica de al menos 110 mmHg de manera transitoria hasta que el origen de la hemorragia haya sido controlado, sobre todo en escenarios particulares, como el paciente anciano, hipertenso, etc. (1C)
Las estrategias de reemplazo de volumen restrictivo e hipotensión permisiva están contraindicadas en los pacientes con TCE severo y lesiones medulares agudas, siendo esencial el mantenimiento de la presión de perfusión tisular y la autorregulación para asegurar la oxigenación4,38.
Recomendación 15
Se recomienda que el uso de norepinefrina de forma precoz sea una opción para mantener la tensión arterial en ausencia de respuesta adecuada a la fluidoterapia, idealmente a través de un acceso venoso central siempre que no suponga una demora en el inicio del tratamiento. (1C)
Los vasopresores pueden ser necesarios transitoriamente para mantener la perfusión tisular, siendo considerada la norepinefrina el agente de elección.
La comparación del reemplazo vascular más vasopresores frente a solo reemplazo vascular, demostró que el grupo de vasopresores recibió menos volumen39. Aunque la terapia precoz con vasopresores ha mostrado ser beneficiosa40, en estudios observacionales se ha objetivado mayor mortalidad en los pacientes traumáticos que los reciben. Por ello, se ha sugerido su empleo dentro de una estrategia de reposición de volumen cuando existe hipotensión refractaria al tratamiento4,19.
La administración de norepinefrina se realiza habitualmente mediante un acceso venoso central debido al riesgo de difusión subcutánea y necrosis, pero la administración venosa periférica es posible y eficaz.
Contención de dañosRecomendación 16
Se recomienda la aplicación del concepto de «cirugía de contención de daños» en pacientes traumatizados con lesiones anatómicas complejas o de difícil acceso con sangrado asociado de muy difícil control, que requieran un tiempo quirúrgico prolongado y/o se acompañen de acidosis y/o hipotermia. (1B)
La reanimación de control de daños se define como una estrategia de control rápido de la hemorragia y restauración del volumen intravascular. Incluye aspectos como la minimización de la pérdida de sangre, la reanimación hipotensiva, el tratamiento hemostático equilibrado con una alta proporción de hematíes:plasma:plaquetas (1:1:1 en su concepto original)41, la aplicación de PTM, la restricción de infusión de cristaloides y el uso eventual de complementos hemostáticos4,42,43.
Uno de los componentes fundamentales de la reanimación en pacientes específicos es la cirugía de control de daños, cuyos fundamentos son la realización de una laparotomía rápida para controlar el sangrado abdominal mediante el «empaquetamiento» visceral para comprimir las laceraciones de difícil hemostasia, junto a la restauración del flujo sanguíneo local allí donde fuera necesario y el control de la contaminación derivada de las vísceras abdominales4. Posteriormente, tras un mínimo de 48 horas, se debe realizar una segunda cirugía para retirar las compresas del «empaquetamiento», dejando para un tercer tiempo si es necesario, la reparación abdominal definitiva.
En pacientes politraumatizados con fracturas óseas graves se ha descrito el concepto de «control de daños ortopédicos»44, cuyo fundamento es también la estabilización inicial de las fracturas, dejando para un segundo tiempo la osteosíntesis definitiva de las mismas.
MonitorizaciónRecomendación 17
Se recomienda la utilización de variables dinámicas como variación de volumen sistólico (VVS) y variación de presión de pulso (VPP), frente a las estáticas como presión venosa central (PVP) o presión de oclusión pulmonar (PAOP) para guiar la administración de fluidos en los pacientes con hemorragia grave en ventilación mecánica controlada y ritmo sinusal que no responden a la terapia de reanimación inicial. (1B)
Se recomienda utilizar indicadores dinámicos frente a variables estáticas, porque permiten valorar la precarga para guiar la respuesta a los fluidos en pacientes con ventilación mecánica controlada y ritmo cardiaco sinusal. Las variables dinámicas más utilizadas y con mayor valor predictivo son la variación del volumen sistólico (VVS) y la variación de la presión del pulso (VPP)3, habiéndose recomendado también el uso de parámetros dinámicos de volumen (VVS y VPP), gap de CO2 y saturación venosa central de oxígeno3.
Recomendación 18
Se recomienda la determinación precoz y seriada de lactato y déficit de bases para estimar y monitorizar la gravedad del sangrado, el grado de hipoperfusión, la hipoxia tisular y la situación de shock. (1B)
Entre los datos de laboratorio más útiles para valorar la evolución del paciente con HM disponemos de la determinación precoz y seriada de lactato y déficit de bases, que se alteran precozmente y parecen ser un buen indicador pronóstico en pacientes con HM, estimando y monitorizando el grado de hipoperfusión e hipoxia tisular3,4,19.
Recomendación 19
En el paciente con hemorragia grave, se recomienda la monitorización precoz de la hemostasia para optimizar la administración de hemocomponentes y fármacos prohemostáticos, guiando mediante algoritmos un tratamiento individualizado basado preferentemente en los resultados de test viscoelásticos (1B), o en su defecto, de test de coagulación convencionales. (1C)
Para la monitorización de la coagulación, los TVE más utilizados son Rotem® (Instrumentation Laboratory, Bedford, MA, USA) y TEG® (Haemonetics Corporation, Boston, MA, USA). Las pruebas de coagulación convencionales deben incluir tiempo de protrombina (TP), tiempo de tromboplastina parcial activado (TTPa), nivel plasmático de fibrinógeno por método de Clauss y recuento de plaquetas. No hay evidencia suficiente para afirmar la superioridad de un sistema frente a otro42,45, pero los TVE aportan rapidez en la obtención de resultados e información adicional sobre la hiperfibrinólisis, la firmeza del coágulo y la hipofibrinogenemia4.
En escenarios concretos como la cirugía cardiaca y el trasplante hepático, los TVE han demostrado ser útiles para la reducción del sangrado y las necesidades de transfusión (1B en cirugía cardiaca)4,46; la International Society of Thrombosis and Haemostasis (ISTH) sugiere su uso para el trasplante hepático47 y la Sociedad Británica de Hematología sugiere su utilidad en cirugía cardiaca, hepática, traumatismo y hemorragia posparto como guía de la práctica transfusional13.
Recomendación 20
Se recomienda la monitorización seriada de la hemoglobina como base para la indicación de transfusión de hematíes, debiéndose considerar tanto parámetros clínicos como de laboratorio. (1C)
En la decisión de transfundir, además de parámetros clínicos, como la tensión arterial, frecuencia cardiaca o IS, y analíticos, como los niveles plasmáticos de lactato o déficit de bases, también influye la propia situación clínica del paciente, debiendo tener en cuenta si se trata de un paciente politraumatizado (fracturas o lesiones que presenta), quirúrgico o de cualquier otro escenario48,49.
Transfusión de concentrado de hematíesRecomendación 21
En el contexto de una hemorragia masiva se recomienda considerar la transfusión precoz de concentrados de hematíes, en una estrategia global restrictiva. (1B)
Se sugiere el empleo de hemocomponentes leucodeplecionados. (2B)
La transfusión de CH es generalmente necesaria cuando se produce una pérdida de volumen sanguíneo entre 30 y 40%. Además de considerar parámetros clínicos y analíticos, individualizando la situación del paciente, se evitará la transfusión de CH en base a determinaciones aisladas de la cifra de hemoglobina. Una estrategia restrictiva reduce la necesidad de transfusión de CH, si bien no tiene impacto significativo sobre la morbimortalidad comparada con una estrategia liberal50.
El uso de hemocomponentes que ha seguido un proceso de leucodepleción tiene como finalidad disminuir las complicaciones de tipo inmunitario asociadas con la transfusión de sangre alogénica.
Recomendación 22
Se recomienda la administración de hematíes para alcanzar un objetivo de Hb entre 7 y 9 g/dL. (1B)
Se sugiere considerar un objetivo transfusional de 9-10 g/dL en pacientes de riesgo con patologías asociadas como enfermedad cardiovascular crónica, síndrome coronario agudo, ictus, trombocitopenia o cáncer. (2C)
La concentración de hemoglobina usada generalmente para definir el grupo de transfusión restrictiva es de 7-8 g/dL, por lo que debería evitarse en la mayoría de los pacientes con hemoglobina superior a dicho rango. En determinados subgrupos de pacientes y contextos clínicos se sugiere alcanzar una concentración plasmática de hemoglobina superior a 9 g/dL (enfermedad cardiovascular crónica, síndrome coronario agudo, ictus, o pacientes de bajo peso y ancianos), aunque no existen suficientes datos para establecer recomendaciones sobre la estrategia transfusional óptima en estos subgrupos50,51.
Recomendación 23
Se recomienda manejar la hemorragia masiva durante la fase empírica inicial basada en el concepto de reanimación hemostática con una alta proporción (al menos 1:2) de plasma fresco en relación con los concentrados de hematíes en pacientes con hemorragia masiva secundaria a trauma grave, no pudiendo hacerse recomendaciones específicas en el paciente no traumático. (1C)
Se han sugerido beneficios en estrategias transfusionales con relaciones de administración de plasma/CH fijas y altas, especialmente en los pacientes politraumatizados, aunque no se ha conseguido demostrar que la relación 1:1:1 tenga un perfil riesgo-beneficio mejor que la 1:1:22,52–54.
Transfusión de plasmaRecomendación 24
En el seguimiento de la hemorragia masiva, se recomienda que la dosis de plasma fresco se fundamente en una «estrategia guiada por objetivos», basada en parámetros clínicos (sangrado microvascular, control de la hemorragia) y analíticos (evidencia de CT o R alargados en los test viscoelásticos o aumento de las ratios del tiempo de protrombina (TP) y/o del tiempo de tromboplastina parcial activado (TTPa) en los test convencionales). (1C)
La transfusión de plasma sigue siendo el estándar para prevenir y tratar la coagulopatía en la HM, a pesar de los inconvenientes conocidos de su administración o del tiempo de espera hasta su disponibilidad17.
Se ha descrito que con un protocolo prefijado de hemocomponentes, con dosis altas, los pacientes reciben mayor volumen de plasma y de plaquetas comparado con una estrategia guiada por objetivos2.
Transfusión de plaquetasRecomendación 25
Se recomienda la administración de concentrados de plaquetas para mantener un recuento por encima de 50×109/L en cualquier paciente con hemorragia activa. (1C)
Se sugiere la transfusión de plaquetas para mantener un recuento por encima de 100×109/L en pacientes con sangrado masivo y traumatismo craneoencefálico u ocular, o en aquéllos que vayan a requerir una intervención neuroquirúrgica o del polo posterior ocular, o en aquéllos con sangrado activo cuando la hemorragia no cesa con cifras superiores a 50×109/L. (2C)
Se sugiere valorar la trasfusión de concentrado de plaquetas para alcanzar un recuento de 50×109/L en aquellos pacientes que requieran un procedimiento invasivo mayor o en los pacientes politraumatizados aún sin sangrado. (2C)
Aunque no existe una evidencia científica sólida, parece haber un consenso en establecer una cifra mínima de 50×109plaq/L en pacientes con sangrado agudo4,7,19,55–57.
En los pacientes con TCE o sangrado ocular, se recomienda mantener el recuento plaquetario por encima de 100×109/L40,19,56, habiéndose extendido este umbral para aquellos en los que persista el sangrado4,19,56,57. No hay recomendaciones sólidas respecto a la transfusión de plaquetas para el control del sangrado en los pacientes con disfunción plaquetaria57.
En relación con la transfusión profiláctica, se ha sugerido la transfusión de plaquetas ante la necesidad de cirugía mayor o en los pacientes politraumatizados, si el recuento es inferior a 50×109/L40,19,58,59.
Recomendación 26
Se sugiere evitar la transfusión de plaquetas en la hemorragia intracraneal (espontánea o traumática) en pacientes antiagregados, salvo que vayan a requerir neurocirugía. (2C)
Esta recomendación se sustenta en el estudio PATCH60 en el que los resultados clínicos y la mortalidad a tres meses fueron peores en los pacientes transfundidos (ver recomendación 41)
Recomendación 27
Se sugiere una dosis inicial de 4 a 8 concentrados de plaquetas (o su equivalente: 1-2 pooles), o 1 unidad de aféresis, debiéndose ajustar la cadencia de administración en función de la persistencia de la hemorragia, las cifras alcanzadas con la dosis inicial, la respuesta a otras medidas para controlar la hemorragia y los resultados de los test viscoelásticos cuando estuvieran disponibles. (2C)
La dosis de plaquetas a transfundir ya se sugería en la versión anterior de esta guía. Si se dispone de donantes, 1 unidad de plaquetas de aféresis (que equivale a cuatro a seis concentrados de plaquetas) eleva el recuento de plaquetas en 30-50 x 109/L, disminuyendo la exposición a donantes múltiples4,58,59.
Concentrado de complejo protrombínicoRecomendación 28
En el contexto de una hemorragia masiva, se recomienda el empleo de concentrados de complejo protrombínico y vitamina K en pacientes en tratamiento con anticoagulantes orales tipo antivitamina K para la reversión rápida de su efecto. (1B)
En este contexto, se recomienda preferentemente la administración de concentrado de complejo protrombínico (CCP) para la reversión urgente del efecto anticoagulante de fármacos antivitamina-K3–5,9,17.
En relación con la administración de CCP, se recomienda el empleo de CCP de cuatro factores (tablas 4 MS y 5 MS, material suplementario)5,19,61–64. Aunque no se ha establecido una estrategia de dosificación óptima, se recomienda basar la dosis en el peso del paciente y en los valores de INR61.
Recomendación 29
En el contexto de la hemorragia masiva, en pacientes no tratados con anticoagulantes orales tipo antivitamina K, no se recomienda el empleo de concentrado de complejo protrombínico como primera opción para la corrección de la coagulopatía, pudiendo emplearse en pacientes seleccionados en función de la urgencia del tratamiento y la disponibilidad de plasma fresco. (1C)
No se han encontrado suficientes evidencias para recomendar el uso de CCP como hemostático de primera elección en la HM.
Sin embargo, en escenarios específicos como coagulopatía refractaria, cirugía cardiaca63,64, hepática y pacientes politraumatizados65 se ha sugerido el empleo de CCP fuera de ficha técnica, de acuerdo con el marco legal establecido3–5,9,17, en el contexto de un manejo multimodal de la HM.
Recomendación 30
Se sugiere el uso de concentrado de complejo protrombínico activado o de rFVIIa solo para los pacientes hemofílicos con inhibidores en el contexto de la hemorragia masiva. (2C)
El CCP activado (FEIBA) y el rFVIIa tienen indicaciones específicas en hemofilia congénita con inhibidor y hemofilia adquirida66,67.
Recomendación 31
Se sugiere utilizar con precaución los concentrados de complejo protrombínico en pacientes con hemorragia masiva que amenaza la vida o tienen que ser intervenidos de cirugía urgente no demorable y que presentan alto riesgo trombótico. (2C)
Si bien los CCP se consideran fármacos seguros, se ha comunicado una incidencia de complicaciones trombóticas en 2-4% de los tratados por HM, por lo que su empleo debe contemplar el balance riesgo/beneficio de manera individualizada en pacientes con hemorragia que presentan un alto riesgo trombótico.
FibrinógenoRecomendación 32
Se recomienda la determinación de fibrinógeno por el método de Clauss o mediante FIBTEM en el ROTEM® o el Functional Fibrinogen en el TEG® para finalidades diagnósticas o cuando se deban tomar decisiones del manejo clínico de pacientes en el contexto de una hemorragia masiva. (1C)
Esta recomendación, recogida en la versión previa de la guía7, sigue plenamente vigente4,9,13,68,69. En el caso de la cuantificación del fibrinógeno se debe utilizar el método de Clauss17.
Recomendación 33
En un paciente con sangrado activo, se recomienda la administración de concentrado de fibrinógeno si los niveles plasmáticos (funcional de Clauss) están por debajo de 1,5-2,0 g/L, o el A5 en el FIBTEM es inferior a 7-9 mm o, por equivalencia, la amplitud máxima MACFFes inferior a 10 mm. (1C)
En la fase inicial del sangrado masivo, sobre todo si es debido a un traumatismo grave, se recomienda la administración de concentrado de fibrinógeno junto a concentrado de hematíes como alternativa a la estrategia de reanimación hemostática, incluso sin necesidad de resultados de los TVE o de coagulación. (1C)
El umbral para la administración de fibrinógeno es controvertido. El nivel plasmático no debe ser inferior a 1,5 g/L30,4,13,19,45,68–70 correspondiendo a un A5-FIBTEM inferior a 7 mm, aunque se ha propuesto un umbral de 8-9 mm en algunos escenarios clínicos70. En el TEG®, por equivalencia, se correspondería con una amplitud máxima (MACFF) 10 mm.
Recomendación 34
Se sugiere una dosis inicial de 25-50 mg/kg de concentrado de fibrinógeno cuando no se alcance el umbral plasmático recomendado del mismo, y/o repetir una segunda dosis guiada por test viscoelásticos. (2C)
En el paciente traumático adulto con sangrado se sugiere una dosis inicial mínima de 3-4 g. (2C)
Se recomienda en contra del uso de plasma como fuente preferente para el aporte de fibrinógeno, pudiendo ser administrado en caso de no disponer de concentrado de fibrinógeno o de crioprecipitado. (1C)
Aunque en pacientes politraumatizados se recomienda una dosis inicial de 3-4 g continuando después con dosis guiadas por los resultados de los TVE4,19, parece idóneo calcular ésta en función del peso del paciente3,4,19,68 (tabla 6 MS).
Como alternativa, se podría utilizar crioprecipitado, en dosis de 4-6 mL/kg (aproximadamente 1U/5-10 kg)3,4,9,71.
Factor VIIaRecomendación 35
Se recomienda no utilizar el factor VIIa como medida rutinaria de primer nivel en el tratamiento de la hemorragia masiva. (1B)
Se sugiere que el factor VIIa sea considerado únicamente en aquellos pacientes en los cuales las medidas hemostáticas convencionales hayan resultado ineficaces. (2B)
El tratamiento de la HM con factor VIIa está fuera de indicación. Los estudios son escasos, con resultados equívocos y mayor incidencia de eventos trombóticos, especialmente arteriales3,4,9,17,19,72.
Sugerimos el uso de factor VIIa solo si todas las demás opciones para controlar la hemostasia han resultado ineficaces, una vez se ha optimizado el fibrinógeno, el recuento plaquetario el pH y la temperatura4,68,72 (tabla 7 MS).
AntifibrinolíticosRecomendación 36
Se recomienda la administración precoz (en las 3 primeras horas) de ácido tranexámico en pacientes con hemorragia masiva secundaria a trauma y en pacientes con TCE. (1A)
Se sugiere el uso de ácido tranexámico en la hemorragia perioperatoria grave, preferentemente basado en los resultados obtenidos con los test viscoelásticos. (2B)
La recomendación de uso de TXA en el politraumatizado se basa en el estudio CRASH-273 y en el paciente con TCE en los resultados del CRASH-3. En todo caso, hay que recordar que la administración «no precoz» no aporta beneficios y aumenta las complicaciones74. La dosis recomendada es 1 g administrado en 10’ más una perfusión continua de 1 g durante las siguientes ocho horas.
En el contexto perioperatorio se sugiere la administración de TXA en el sangrado activo, sin estudios aleatorizados que pudieran aportar suficiente evidencia. Su administración debería basarse en la documentación de hiperfibrinólisis. Una excepción es la cirugía cardiaca donde se recomienda su uso profiláctico con un alto nivel de evidencia (1A)33.
Otras medidasRecomendación 37
Se sugiere valorar la administración de desmopresina (0,3 μg/kg) en pacientes sangrantes con enfermedad de Von Willebrand. (2C)
Se sugiere valorar la administración de desmopresina (0,3 μg/kg) en pacientes sangrantes urémicos, tomadores de ácido acetilsalicílico o con sangrado crítico y disfunción plaquetaria documentada. (2C)
La desmopresina (DDAVP) es eficaz en el tratamiento y la prevención de hemorragias leves/moderadas en pacientes con defectos congénitos o adquiridos de la hemostasia primaria3,4,9.
Recomendación 38
Se recomienda el uso de hemostáticos tópicos en combinación con las medidas convencionales asociadas a diferentes procedimientos quirúrgicos en el contexto de la hemorragia masiva. (1B)
Los hemostáticos tópicos son eficaces en casos en los que es posible el acceso directo al punto sangrante4,7,9.
Recomendación 39
Se recomienda la valoración de medidas de control mecánico como la angioembolización. (1B)
Se sugiere la utilización de procedimientos endovasculares (por ejemplo, REBOA) en el tratamiento de la hemorragia masiva en pacientes seleccionados, siempre que estén disponibles. (2C)
La angioembolización es eficaz en pacientes seleccionados (hemorragia gastrointestinal alta no varicosa o baja, o complicaciones hemorrágicas arteriales de la pancreatitis), como alternativa a la cirugía abierta precozmente3, o en pacientes con fractura pélvica4.
El uso de balón aórtico oclusivo puede considerarse en el politraumatismo grave en circunstancias extremas, para ganar tiempo hasta el control apropiado de la hemorragia4, en pacientes con ruptura de aneurisma aórtico abdominal y en hemorragia gastrointestinal o periparto graves41.
Recomendación 40
Se recomienda monitorizar los niveles plasmáticos de calcio en el paciente sangrante (1C), sobre todo si requiere transfusión masiva. (1B)
Se recomienda mantener los niveles plasmáticos de calcio en el rango de la normalidad, administrando calcio en caso de hipocalcemia (Ca iónico<3,6 mg/dL, o calcio sérico corregido<7,5 mg/dL). (1B)
El control de la calcemia es relevante sobre todo en las situaciones en que se administran un número elevado de hemocomponentes75–77.
Recomendación 41
En una situación de hemorragia grave o masiva, se recomienda analizar si el paciente está bajo tratamiento con fármacos antiagregantes o anticoagulantes para el empleo de medidas terapéuticas específicas destinadas a la reversión de dicho tratamiento, valorando en cada caso el beneficio de su neutralización frente al riesgo trombótico. (1B)
Se recomienda el uso de concentrado de complejo protrombínico más vitamina-k en los pacientes anticoagulados con fármacos con acción antivitamina-k. (1B)
Se sugiere la transfusión precoz de plaquetas en los pacientes con hemorragia claramente relacionada con antiagregantes plaquetarios, preferentemente tras haber monitorizado la función plaquetaria. (2C)
Se sugiere la administración de idarucizumab en los pacientes en tratamiento con dabigatrán en lugar de hemostáticos no específicos como los concentrados de complejo protrombínico. (2A)
Se sugiere la administración de andexanet alfa o concentrado de complejo protrombínico en los pacientes que reciben inhibidores orales del factor-Xa («xabanes») que presentan una hemorragia potencialmente mortal o no controlada. (2C)
La administración de plaquetas puede considerarse la mejor opción en los pacientes con sangrado claramente relacionado con fármacos antiagregantes3,4. Su eficacia depende de factores como el propio fármaco, el tiempo desde la última toma, la etiología y lugar anatómico del sangrado, y el propio criterio de eficacia78. La dosis es igualmente controvertida, sugiriéndose 0,7x1011 plaquetas/10 kg (equivalente a un concentrado/10 kg aproximadamente, o 2 pooles en un paciente de 70-80 kg) en los casos relacionados con ácido acetilsalicílico, hasta el doble en el caso de clopidogrel o incluso más si se trata de prasugrel3,78.
En la hemorragia cerebral, los resultados no fueron concluyentes en una revisión sistemática por las limitaciones metodológicas de los estudios publicados58,79,80.
En los pacientes en tratamiento con fármacos anticoagulantes, la recomendación es el empleo de antídotos específicos3,4 (tabla 8 MS). El uso de idarucizumab, para la reversión específica de la anticoagulación por dabigatrán no parece estar asociado a una reducción evidente en la mortalidad81. Las dosis recomendadas son 5 g en dos dosis endovenosas de 2,5 g en 15’. El uso de andexanet-alfa fue aprobado para revertir la anticoagulación en pacientes tratados con apixabán y rivaroxabán.
DiscusiónEl manejo de la HM es extremadamente complejo, e incluye el empleo y la aplicación de múltiples herramientas y estrategias, recogidas en guías clínicas, documentos de consenso y PTM, con el objetivo fundamental de mejorar la supervivencia de los pacientes.
El presente documento multidisciplinar, avalado por la SEDAR, la SEMICYUC y la SETH, supone una puesta al día de las recomendaciones existentes en el documento original HEMOMAS7. Como en la edición previa, se han omitido escenarios específicos como obstetricia, pediatría y hemorragia digestiva, que requieren la aplicación de medidas particulares y cuya inclusión hubiera desvirtuado el objetivo de actualización del documento.
Para su redacción se decidió una estrategia basada en la revisión de artículos publicados desde la anterior edición. Esta metodología permite conseguir el objetivo de puesta al día de las recomendaciones previas sin modificar la estructura fundamental del documento original.
Con relación al documento previo editado en 2016, se ha disminuido el número final de recomendaciones a 41, que contienen un total de 61 afirmaciones, de las cuales 38 son recomendaciones y 23 sugerencias. Las dos únicas recomendaciones que alcanzan el máximo nivel de evidencia hacen referencia al empleo precoz de cristaloides isotónicos y al ácido tranexámico en pacientes con HM secundaria a trauma. La actualización del documento ha supuesto modificaciones en el nivel de recomendación o de evidencia y en la redacción de varias afirmaciones. En la tabla 2MS se recogen todas estas modificaciones.
El documento resalta la importancia adquirida por la cirugía de contención de daños, la transfusión de hemoderivados basada en apropiadas tasas transfusionales de CH/plasma/plaquetas, la terapia prohemostática dirigida por TVE o pruebas convencionales de coagulación que permite una mejor caracterización de la coagulopatía y una aproximación individualizada, y el manejo específico en el paciente antiagregado o anticoagulado sangrante.
ConclusionesLa HM es una entidad con una elevada mortalidad asociada. La actualización periódica de las recomendaciones para su tratamiento multidisciplinar es esencial para diagnosticar precozmente tanto a los pacientes con HM como a aquellos con elevado riesgo de desarrollarla, poniendo en marcha las estrategias que permitan controlar el sangrado, reponer los hemocomponentes perdidos y evitar la coagulopatía asociada.
FinanciaciónPara la realización de este documento se ha contado con financiación procedente de una beca sin restricciones concedida por CSL-Behring.
Conflcito de intersesNinguno.
Contribución de los autoresJuan V. Llau: Coordinación general, revisión de las recomendaciones, redacción del manuscrito, revisión y aprobación del manuscrito.
César Aldecoa, Emilia Guasch, Pascual Marco, Pilar Marcos-Neira, Pilar Paniagua, José A. Páramo, Manuel Quintana, Francisco Javier Rodríguez-Martorell y Ainhoa Serrano: revisión de las recomendaciones, redacción del manuscrito, revisión y aprobación del manuscrito.
Los autores quieren agradecer específicamente a Fernando Rico-Vilademoros por el soporte metodológico, Isabel San Andrés por la realización de la búsqueda bibliográfica y a Ampersand Consulting por el trabajo de logística en la preparación del manuscrito.
En los años transcurridos desde la publicación del primer documento, algunos de los autores originales han dejado la práctica asistencial. Es necesario reconocer su generosidad al haber dejado paso a otros colegas que se han incorporado al panel de expertos de este documento, siendo todos conscientes de que no hubiera sido posible sin la publicación de la primera edición del HEMOMAS.
Este artículo se publica simultáneamente, en el marco del correspondiente acuerdo de publicación y derechos de autor, en: Medicina Intensiva (https://doi.org/10.1016/j.medin.2023.03.007) y en Revista Española de Anestesiología y Reanimación (https://doi.org/10.1016/j.redar.2023.05.001).