Determinar el papel de los niveles plasmáticos de procalcitonina (PCT) en el diagnóstico de neumonía asociada a ventilación mecánica.
Diseño Revisión sistemática y metaanálisis de los trabajos originales que evalúan el papel de PCT en el diagnóstico de neumonía asociada a ventilación mecánica. La búsqueda de trabajos se llevó a cabo en Medline, Embase, Colaboración Cochrane y MEDION y tras revisión de las referencias de los artículos obtenidos. Se extrajeron datos que permitieron el cálculo de la sensibilidad, la especificidad, las razones de verosimilitud y la odds ratio diagnóstica.
IntervenciónMetarregresión para determinar si la exposición a tratamiento antibiótico previo, el tiempo de desarrollo de neumonía y el tipo de paciente crítico tienen impacto en el rendimiento diagnóstico de la procalcitonina.
ResultadosSe incluyeron 7 estudios (373 pacientes, 434 episodios). No encontramos sesgos de publicación ni efecto umbral. Las cifras elevadas de PCT plasmática se asocian a un mayor riesgo de padecer neumonía (OR 8,39; IC 95% 5,4-12,6). Los datos agrupados de sensibilidad, especificidad, razón de verosimilitud positiva y negativa y odds ratio diagnóstica encontrados son, respectivamente, 76% (69-82), 79% (74-84), 4,35 (2,48-7,62), 0,26 (0,15-0,46) y 17,9 (10,1-31,7). El rendimiento diagnóstico se ve modificado por la exposición previa a antibióticos (rORD 0,11, 0,02-0,069), no así por el tipo de paciente crítico o el tiempo de desarrollo de neumonía.
ConclusionesNuestros resultados muestran que la PCT aporta información adicional respecto al riesgo de sufrir neumonía asociada a ventilación mecánica. Su inclusión en los algoritmos diagnósticos podría mejorar la capacidad de los mismos.
To determine the role of plasma procalcitonin (PCT) levels in diagnosing ventilator-associated pneumonia.
DesignA systematic review of publications prospectively assessing the diagnostic role of PCT in ventilator-associated pneumonia was carried out. The search was performed using Medline, Embase, the Cochrane Collaboration and MEDION, with reviewing of the references of retrieved articles. We extracted data that allowed the calculation of sensitivity, specificity, likelihood ratios and diagnostic odds ratio.
Intervention Metaregression was performed to determine whether exposure to previous antibiotic treatment, the time to occurrence of ventilator-associated pneumonia and the type of patients had an impact upon the diagnostic performance of procalcitonin.
ResultsSeven studies were considered (373 patients, 434 episodes). We found no publication bias or threshold effect. High plasma PCT levels were associated to an increased risk of suffering ventilator-associated pneumonia (OR: 8.39; 95% CI: 5.4-12.6). The pooled data on sensitivity, specificity, positive and negative likelihood ratio, and diagnostic odds ratio found were 76% (69-82), 79% (74-84), 4.35 (2.48-7.62), 0.26 (0.15-0.46) and 17.9 (10.1-31.7), respectively. Diagnostic yield was modified by prior exposure to antibiotics (rDOR 0.11, 0.02-0.069), but not by the type of critically ill patient or the time to occurrence of ventilator-associated pneumonia.
ConclusionsOur results suggest that PCT provides additional information on the risk of VAP. Inclusion of PCT in diagnostic algorithms could improve their effectiveness.
La neumonía asociada a ventilación mecánica (NAVM) es un grave problema en los pacientes críticos, con una elevada incidencia a pesar de los grandes esfuerzos para prevenirla, siendo considerada uno de los principales indicadores de calidad asistencial, al ser responsable de hasta un 25% de todos los episodios de infección nosocomial que ocurren dentro de los Servicios de Medicina Intensiva (SMI)1. No es menos importante la elevada probabilidad de recurrencia, un 25%, especialmente asociada al desarrollo de shock séptico o de distrés respiratorio del adulto2, y su impacto en la mortalidad. De hecho, se ha cifrado en torno a un 35% el riesgo de muerte, o mayor aún si se asocia, entre otros factores, a tratamiento inapropiado, desarrollo de sepsis grave o bacteriemia, tratarse de un episodio tardío o provocar fracaso respiratorio3.
El diagnóstico de NAVM presenta problemas aún no resueltos, lo que dificulta el tratamiento antibiótico precoz y adecuado para reducir los episodios de riesgo vital en los SMI. Es un diagnóstico fundamentalmente clínico, que aúna criterios radiológicos (aparición de nuevos infiltrados o progresión de los ya existentes), de deterioro respiratorio (PO2/FiO2) y de respuesta inflamatoria local (broncorrea purulenta) y sistémica (fiebre/hipotermia, leucopenia/leucocitosis)4, y que requiere confirmación microbiológica para un correcto diagnóstico, que puede demorarse entre 3 y 5 días. Desde el punto de vista microbiológico la tinción de Gram de las secreciones respiratorias y los cultivos rápidos anticipativos pueden facilitar tanto la aproximación diagnóstica como terapéutica, acortando los tiempos de respuesta5.
La procalcitonina (PCT) es una proteína soluble compuesta por 116 aminoácidos, cuya secuencia es idéntica a la prohormona de calcitonina que se produce, en condiciones normales, en las células C del tiroides tras fenómenos de proteolisis interna de PCT, y cuyos niveles circulantes basales son muy bajos, inferiores a 0,05ng/ml6. Situaciones de sepsis, infecciones bacterianas o reacciones inflamatorias graves aumentan la expresión del gen CALC-1, favoreciendo la producción de PCT en todos los tejidos parenquimatosos (incluidos pulmón, hígado, riñón, adipocitos y músculo), así como en todas las células diferenciadas del organismo. Aumenta rápidamente, 2-3h tras el estímulo7, permanece estable tanto in vivo como in vitro, y la determinación de laboratorio, basada en métodos de inmunoanálisis, permite establecer de manera fiable los valores plasmáticos.
Es conocido su uso en el diagnóstico de sepsis, su capacidad diferenciadora de infección bacteriana respecto a otras causas de respuesta inflamatoria sistémica, su utilidad como marcador de severidad y sus implicaciones pronóstico en la evaluación del impacto del tratamiento antibiótico y en determinadas infecciones orgánicas8–10. El papel de la PCT en el diagnóstico de NAVM ha sido objeto de estudio en un número reducido de trabajos, con resultados dispares11. El uso conjunto de criterios clínicos, datos microbiológicos preliminares y niveles plasmáticos de PCT podría facilitar el diagnóstico temprano y el tratamiento precoz, reduciendo el impacto de los episodios de NAVM.
El objetivo del presente trabajo es determinar la utilidad de los niveles plasmáticos de PCT en el diagnóstico de NAVM e identificar posibles factores que puedan modificar dicho rendimiento diagnóstico.
Pacientes y métodosRevisión sistemática y metaanálisis realizado de acuerdo con las guías publicadas al respecto en pruebas diagnósticas12,13, con el objetivo de determinar la utilidad real de los niveles plasmáticos de PCT en el diagnóstico de NAVM en pacientes críticos adultos.
Estrategia de búsqueda y selección de artículosRevisión exhaustiva de la literatura tanto de las bases bibliográficas electrónicas PubMed y Embase, como de bases de datos específicas de estudios de diagnóstico como MEDION, y de la Colaboración Cochrane, empleando como palabras clave: «procalcitonina», «procalcitonina plasmática», «biomarcadores», «diagnóstico», «neumonía nosocomial», «neumonía asociada a ventilación mecánica», «sensibilidad y especificidad» y «pacientes críticos», utilizando filtros para la detección de estudios en humanos, en edad adulta, sin restricción idiomática, eliminando revisiones sistemáticas y artículos de revisión, centrándonos principalmente en estudios prospectivos, estudios clínicos y ensayos clínicos de los últimos 20 años. Ampliamos la búsqueda con la revisión manual de las referencias de los artículos más relevantes.
Estrategia de búsqueda: («procalcitonin pneumonia»[tw] OR «procalcitonin»[MeSH term] OR «biomarkers» [MeSH term]) AND («diagnosis»[MeSH term] OR «diagnosis»[tw] OR «diagnos*»[tw] OR «Sensitivity»[tw] OR «Specificity»[tw] OR «Sensitivity and specificity»[MeSH term]) AND («nosocomial pneumonia»[MeSH term] OR «ventilator-associated pneumonia» [MeSH term] OR «ventilator-associated pneumonia»[tw] OR «VAP»[tw]) AND («Critical care»[tw]) OR «critical illness»[tw]).
Dos autores, de manera independiente, determinaron los artículos incluidos en la revisión sistemática, siendo resuelta cualquier discordancia por un tercer revisor. Los estudios recopilados debían recoger, de manera prospectiva, niveles plasmáticos de PCT y su relación con el desarrollo de NAVM o datos de rendimiento diagnóstico que permitieran reconstruir de manera individual la tabla 2×2 (valores de PCT frente a diagnóstico de NAVM). El grado de concordancia entre ambos revisores fue determinado mediante el estadístico K de Cohen.
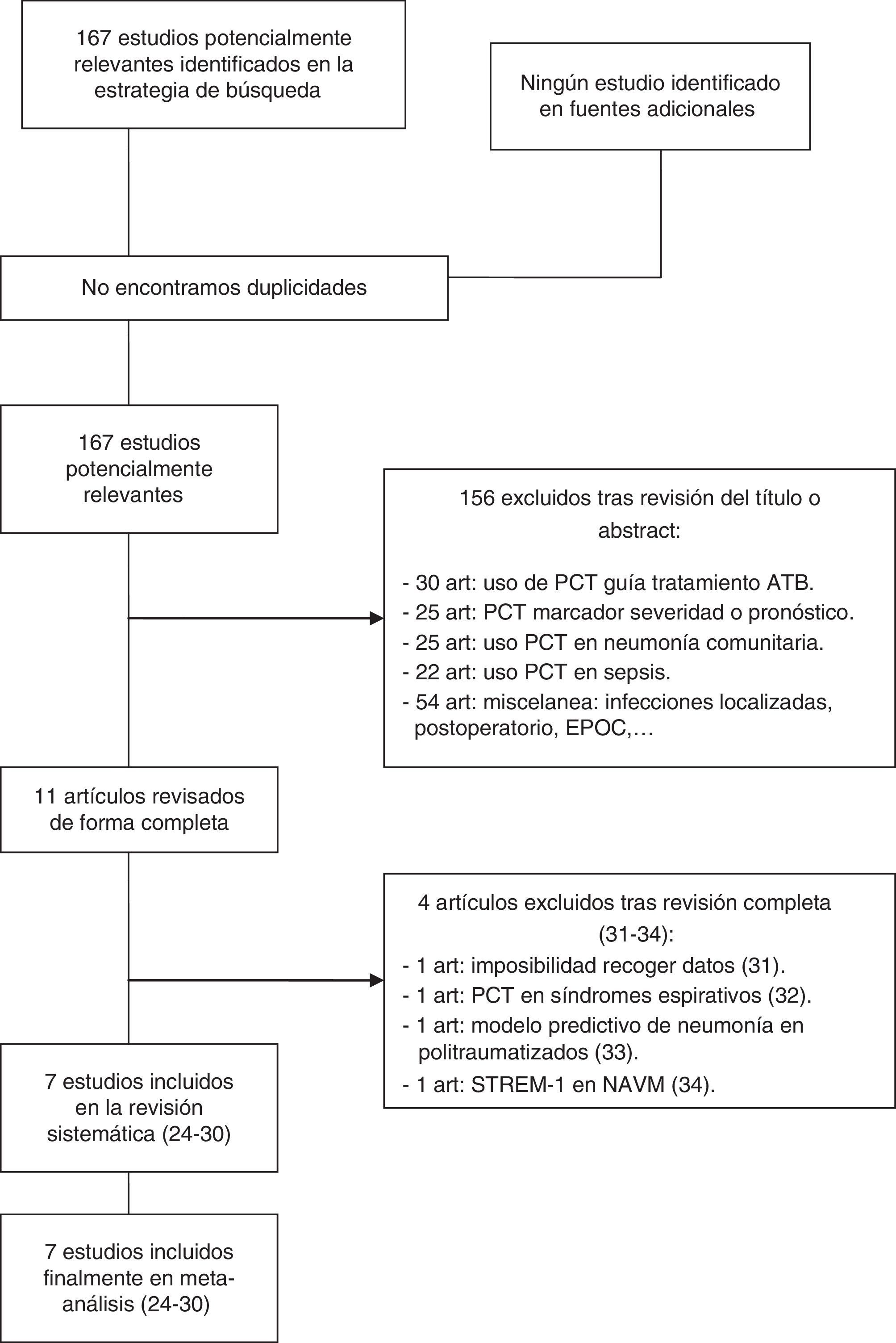
El flujo de estudios derivado del análisis bibliográfico queda representado siguiendo las recomendaciones de la declaración PRISMA14, así como el análisis de la calidad metodológica de los estudios incluidos mediante el cuestionario Quality Assessment of Diagnostic Accuracy Studies (QUADAS-2)15. Se siguieron los criterios de la iniciativa STARD tanto para la valoración de los estudios incluidos en el presente trabajo como para la confección y redacción del manuscrito16.
Datos recopiladosSe recogieron como datos a analizar de los estudios elegidos: el tipo de estudio, el tamaño muestral (número de pacientes y de episodios de NAVM), el tipo de paciente crítico incluido, los criterios de inclusión/exclusión, así como los criterios diagnósticos de neumonía y la prueba de referencia, la presencia de antibioterapia previa, el momento de aparición de la neumonía (precoz/tardía), el método de análisis de los niveles de PCT, los puntos de corte, el promedio de los valores de PCT en pacientes con o sin NAVM, la mortalidad de las series y los ítems que permitían la valoración de la calidad metodológica (QUADAS-2).
Análisis estadísticoEl tratamiento de los datos se llevó a cabo empleando como programas estadísticos Meta-DiSc 1.4 (Unidad de Bioestadística Clínica del Hospital Ramón y Cajal de Madrid, España)17 y EPIDAT 3.1 (programa de análisis epidemiológico de la Junta de Galicia, España)18.
Como primer paso, y debido a que los distintos trabajos usaban diferentes puntos de corte para la PCT plasmática, se determinó la presencia o no de «efecto umbral» mediante el análisis de la relación entre la sensibilidad y la especificidad de los estudios y el cálculo del coeficiente de correlación de Spearman (en caso de existir el citado efecto se pondría de manifiesto una correlación inversa significativa entre la sensibilidad y la especificidad), así como la representación gráfica del plano ROC entre la sensibilidad y 1-especificidad19. La ausencia de efecto umbral permitiría, como segundo paso, el cálculo ponderado de la sensibilidad, la especificidad, la razón de verosimilitud positiva y negativa (cocientes de probabilidad o likelihood ratios) (LR+/LR-) y la odds ratio diagnóstica (ORD), empleando para su cálculo el modelo de efectos aleatorios de DerSimonian-Laird junto con el modelo propuesto por Moses et al.20.
En caso contrario, es decir, si se determinase la existencia de efecto umbral, el promedio de índices no sería posible y se mostraría la curva sROC21 como resumen del rendimiento diagnóstico de PCT en NAVM, así como el cálculo del índice Q*, definido como el punto en el que la sensibilidad y la especificidad son iguales.
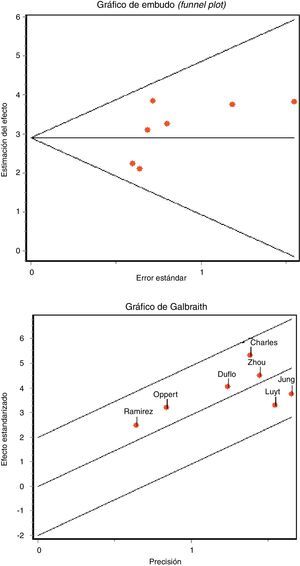
El estudio de la heterogeneidad de los trabajos, aparte del análisis del grado de homogeneidad metodológica, se evaluó mediante el estadístico Q (test Chi2) para determinar si la diferencia encontrada entre estudios es mayor que la esperada por el azar, considerando significativa una Chi2 con una p<0,10, y el índice de inconsistencia (I2)22 en un intento de cuantificar dicha heterogeneidad y considerándola apreciable para valores de I2>50%. Todo ello se complementó con el gráfico de Galbraith, que representa una medida del efecto (OR estandarizada) frente a otra de precisión. El impacto de determinados cofactores, tales como el tipo de pacientes, la calidad metodológica, la presencia de tratamiento antibiótico y el desarrollo de neumonías precoces o tardías, en el rendimiento diagnóstico y en la heterogeneidad de los estudios, se evaluó mediante técnicas de metarregresión o análisis de subgrupos en caso necesario21.
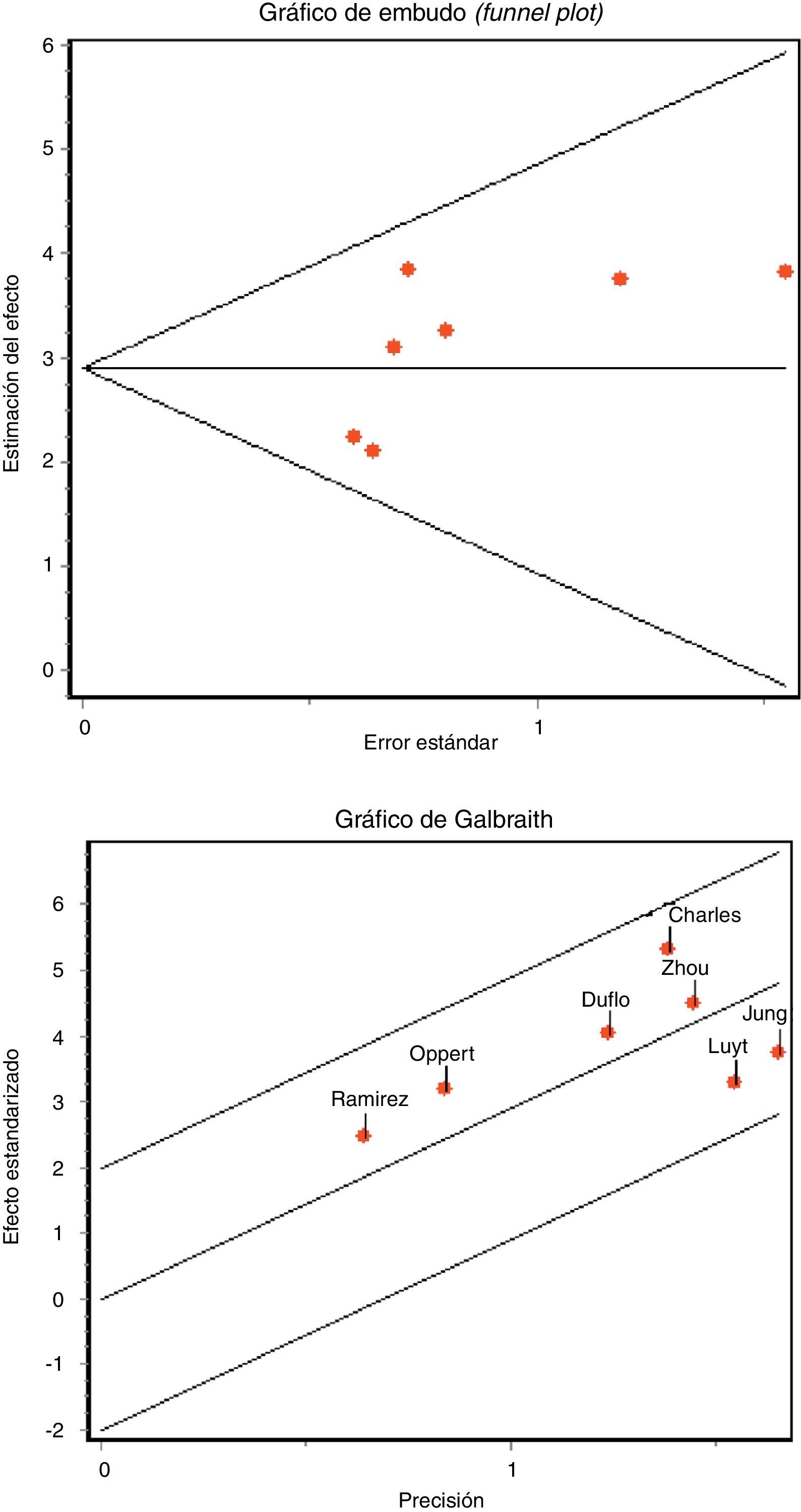
La detección de un posible sesgo de publicación se evaluó mediante el gráfico de embudo (funnel plot) y las pruebas regresión de Begg y de Egger23.
ResultadosLa búsqueda bibliográfica inicial seleccionó 1.700 artículos, que se redujeron a 167 publicaciones al considerar solo aquellos trabajos realizados en las 2 últimas décadas, en pacientes críticos adultos y a través de estudios clínicos prospectivos. Los trabajos fueron evaluados pormenorizadamente hasta reducir la cifra a 11 artículos, de los que se escogieron los 7 que finalmente quedaron incluidos en el metaanálisis24–30. De los 4 trabajos excluidos, 2 de ellos se rechazaron por la imposibilidad de recoger resultados válidos para su análisis, un tercero por evaluar la PCT en el diagnóstico diferencial de neumonía frente a neumonitis aspirativa y el último por analizar el papel de la PCT como variable de riesgo en el desarrollo de NAVM en politraumatizados dentro de modelos multivariantes, y no como una herramienta de diagnóstico31–34 (fig. 1).
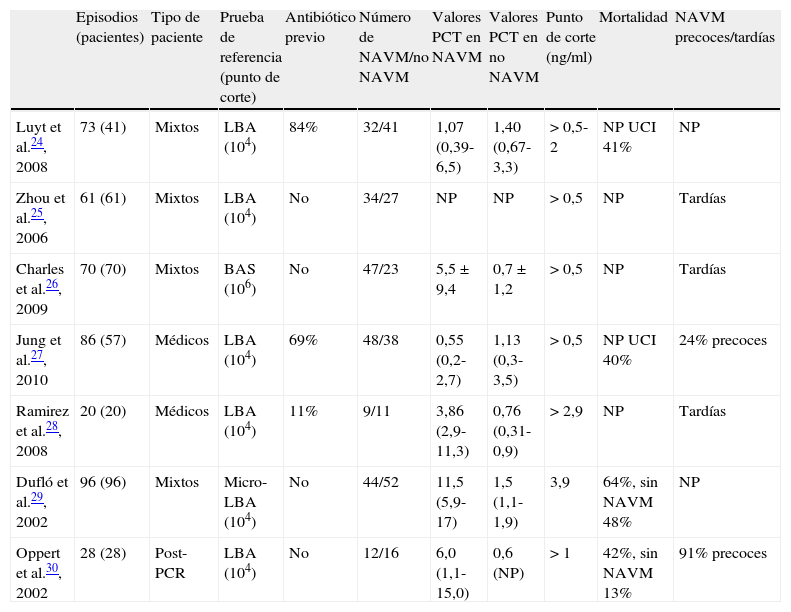
Características de los trabajos incluidosSe analizaron 7 trabajos, englobando un total de 373 pacientes y 434 episodios de sospecha de NAVM, de series de enfermos medicoquirúrgicos o médicos, ingresados todos ellos en SMI. Tan solo un estudio estuvo formado por pacientes ingresados en UCI tras sufrir un paro cardíaco. En todos los estudios los pacientes se incluyeron de manera consecutiva, necesitando como criterios de inclusión recibir al menos 48h de ventilación mecánica (en un trabajo 7 días y en otro más de 72h) y presentar signos radiológicos, clínicos y analíticos compatibles con neumonía. Si cumplían los criterios de inclusión se extraía una muestra sanguínea para la determinación de PCT, y la confirmación diagnóstica se determinaba por criterios microbiológicos (lavado broncoalveolar en 6 estudios y aspirado traqueal en otro). La tabla 1 resume las principales características de los estudios mencionados.
Estudios incluidos en la revisión sistemática
| Episodios (pacientes) | Tipo de paciente | Prueba de referencia (punto de corte) | Antibiótico previo | Número de NAVM/no NAVM | Valores PCT en NAVM | Valores PCT en no NAVM | Punto de corte (ng/ml) | Mortalidad | NAVM precoces/tardías | |
| Luyt et al.24, 2008 | 73 (41) | Mixtos | LBA (104) | 84% | 32/41 | 1,07 (0,39-6,5) | 1,40 (0,67-3,3) | >0,5-2 | NP UCI 41% | NP |
| Zhou et al.25, 2006 | 61 (61) | Mixtos | LBA (104) | No | 34/27 | NP | NP | >0,5 | NP | Tardías |
| Charles et al.26, 2009 | 70 (70) | Mixtos | BAS (106) | No | 47/23 | 5,5±9,4 | 0,7±1,2 | >0,5 | NP | Tardías |
| Jung et al.27, 2010 | 86 (57) | Médicos | LBA (104) | 69% | 48/38 | 0,55 (0,2-2,7) | 1,13 (0,3-3,5) | >0,5 | NP UCI 40% | 24% precoces |
| Ramirez et al.28, 2008 | 20 (20) | Médicos | LBA (104) | 11% | 9/11 | 3,86 (2,9-11,3) | 0,76 (0,31-0,9) | >2,9 | NP | Tardías |
| Dufló et al.29, 2002 | 96 (96) | Mixtos | Micro-LBA (104) | No | 44/52 | 11,5 (5,9-17) | 1,5 (1,1-1,9) | 3,9 | 64%, sin NAVM 48% | NP |
| Oppert et al.30, 2002 | 28 (28) | Post-PCR | LBA (104) | No | 12/16 | 6,0 (1,1-15,0) | 0,6 (NP) | >1 | 42%, sin NAVM 13% | 91% precoces |
BAS: aspirado traqueal; LBA: lavado bronquioalveolar; NAVM: neumonía asociada a ventilación mecánica; NP: datos no publicados; PCR: paro cardiorrespiratorio; PCT: procalcitonina; UCI: Unidad de Cuidados Intensivos.
En todos los estudios se realizaron determinaciones cuantitativas de PCT en sangre mediante técnicas de inmunoanálisis, empleando tecnología time-resolved amplified cryptate emission technology –TRACE– con un analizador Kryptor® (Brahms Diagnostica, Berlín, Alemania).
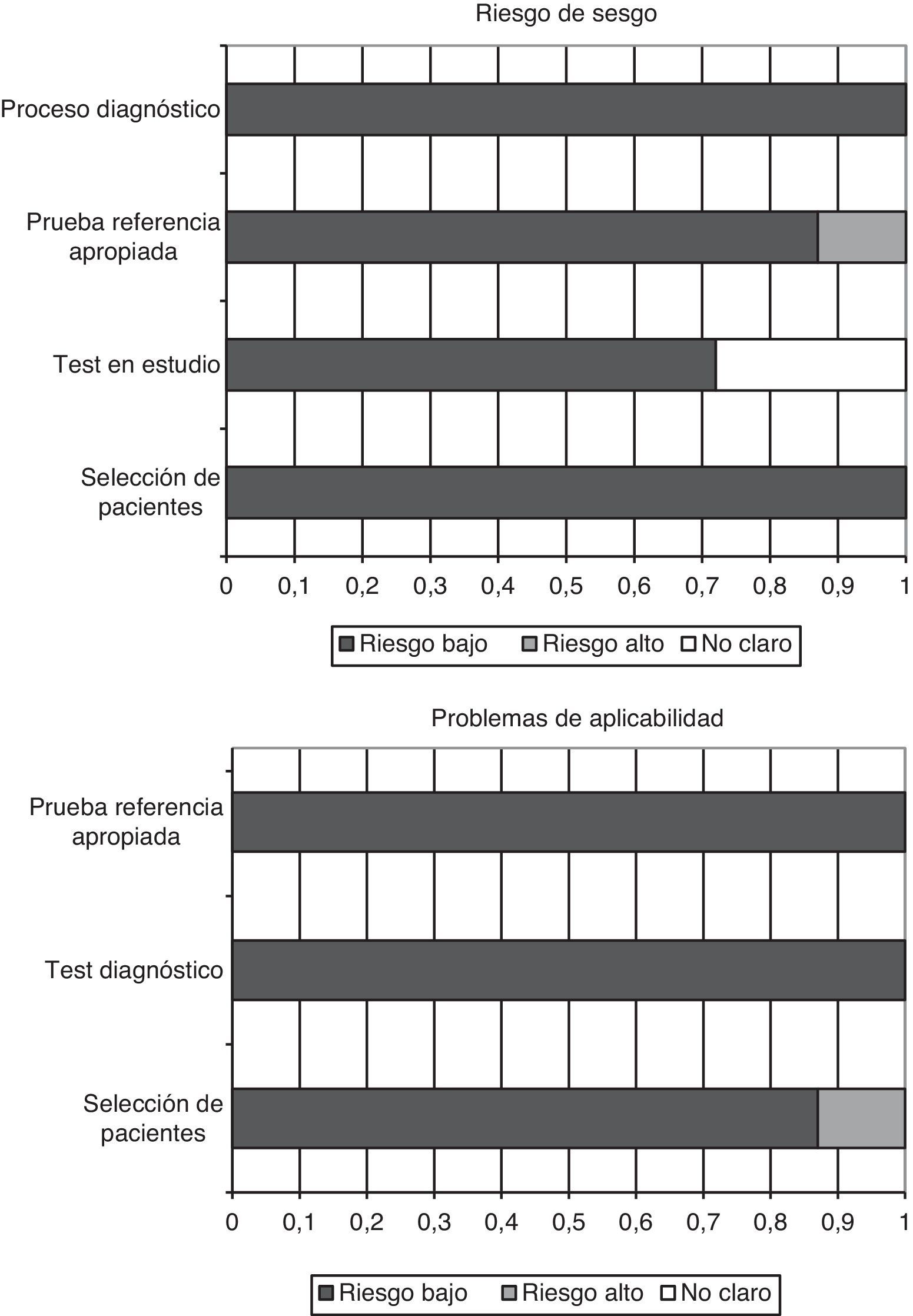
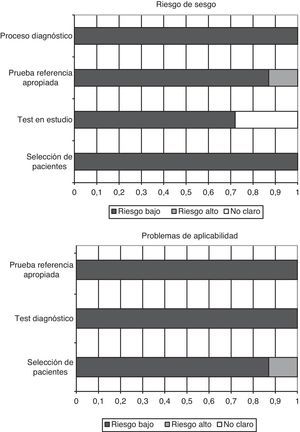
Calidad de los estudios y sesgo de publicaciónEl cuestionario QUADAS-2, diseñado para evaluar la calidad metodológica de los estudios de tests diagnósticos, incluye 4 dominios que analizan a los pacientes incluidos en los trabajos, el test diagnóstico a evaluar, la prueba de referencia y el flujo de pacientes dentro del estudio y el momento del diagnóstico final (flow and timing). Cada aspecto evaluado es clasificado como bajo riesgo de sesgo, alto riesgo, o sesgo no aclarado (si no hay datos suficientes en la publicación para contestar la pregunta correspondiente).
En los trabajos incluidos en la presente revisión, todos los pacientes fueron incorporados de manera consecutiva, se evitaron los diseños de casos-controles y no se produjeron exclusiones inapropiadas. En todos los estudios las cifras «umbrales» (puntos de corte de PCT) fueron especificados previamente, y en 5 de los 7 trabajos el test a estudio fue evaluado desconociendo el resultado del test de referencia (en los otros 2 trabajos no consta que fuera así). En el 100% de los estudios la prueba de referencia fue interpretada independientemente de los niveles de PCT, y en 6 de 7 trabajos, los autores pensamos que la prueba de referencia clasifica correctamente a los enfermos. El intervalo entre la realización del test diagnóstico y el de referencia es apropiado, todos los pacientes fueron sometidos a la prueba de referencia e incluidos en los análisis posteriores.
Además, en más de un 85% (6 de 7) de los trabajos, el espectro de los pacientes fue representativo de los que recibirían la prueba en la práctica habitual, se describieron con claridad los criterios de selección, se aplicaron tanto el test a estudio como el de referencia a toda la población (evitando sesgos de verificación diferencial y de verificación parcial respectivamente), ambas pruebas, tanto la determinación de PCT en sangre como la prueba de referencia son reproducibles, disponiendo de la misma información clínica para interpretar el test que la que se tiene en la práctica diaria. En la figura 2 se resumen gráficamente los riesgos de sesgos en cada uno de los 4 dominios, así como los problemas de aplicación que podemos encontrarnos a raíz de los resultados obtenidos.
La concordancia entre los 2 investigadores a la hora de analizar la calidad metodológica fue elevada, con un índice kappa 0,86 (IC 95% 0,66-1,04). No encontramos datos que evidencien la existencia de sesgo de publicación gráficamente (fig. 3 A), ni aplicando el estadístico de Begg (Z: 1.501, p=0,133) ni el de Egger (t: 1.657, gl 5, p=0,158).
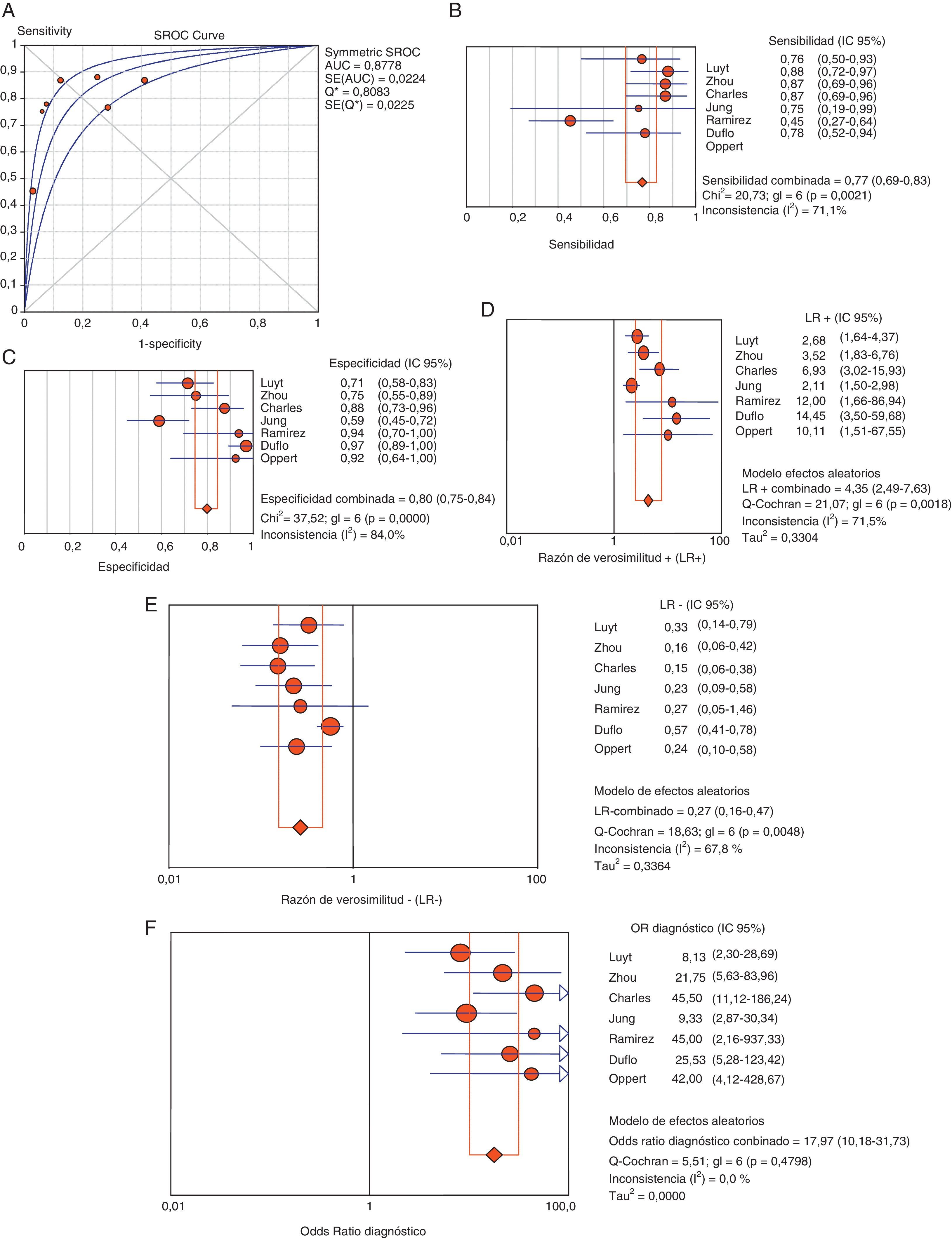
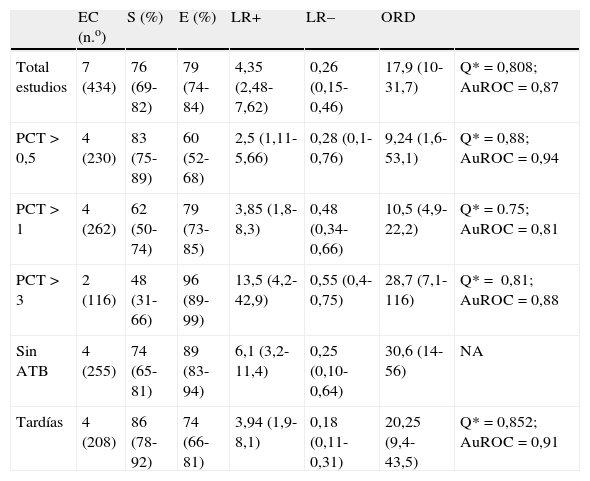
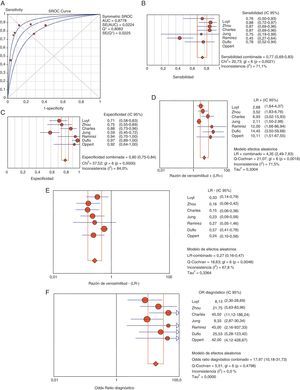
Utilidad de la procalcitonina como diagnóstico de neumonía asociada a ventilación mecánicaLos pacientes con clínica evidente y cifras elevadas de PCT plasmática presentan un mayor riesgo elevado de sufrir NAVM (69 frente a 8,8%, OR 8,39, IC 95% 5,4-12,6). El coeficiente de correlación de Spearman entre sensibilidad y especificidad, de 0,667 (p=0,102), no fue indicativo de efecto umbral, permitiendo el cálculo del promedio de los distintos índices diagnósticos. Así, encontramos, respectivamente, valores de sensibilidad del 76,7% (IC 95% 69-82), de especificidad del 79,9% (IC 95% 74-84), de LR+ de 4,35 (IC 95% 2,48-7,62), de LR- de 0,26 (IC 95% 0,15-0,46) y ORD de 17,9 (IC 95% 10,1-31,7) (fig. 4).
Área bajo la curva (A) para el diagnóstico de NAVM. Resumen de los valores de sensibilidad (B), especificidad (C), razón de verosimilitud positiva (LR+) (D) y negativa (LR−) (E) y odds ratio diagnóstica (F) de PCT plasmática en NAVM.
AUC: área bajo la curva. SE: error estándar. Q*: punto Q* como dato de rendimiento global del test.
No apreciamos heterogeneidad empleando el estadístico Q (Chi2 5,50, p=0,48) ni gráficamente (fig. 3 B). La representación gráfica de los valores agrupados de los distintos índices diagnósticos muestra cierta inconsistencia, a excepción de la ORD, lo que nos llevó al análisis de subgrupos. Analizamos la rentabilidad diagnóstica en función de diferentes puntos de corte de PCT plasmática y en pacientes sin exposición a tratamiento antibiótico y en situaciones de NAVM tardías. En la tabla 2 quedan recogidos los resultados obtenidos.
Resultados agrupados de los diferentes índices diagnósticos
| EC (n.o) | S (%) | E (%) | LR+ | LR– | ORD | ||
| Total estudios | 7 (434) | 76 (69-82) | 79 (74-84) | 4,35 (2,48-7,62) | 0,26 (0,15-0,46) | 17,9 (10-31,7) | Q*=0,808; AuROC=0,87 |
| PCT>0,5 | 4 (230) | 83 (75-89) | 60 (52-68) | 2,5 (1,11-5,66) | 0,28 (0,1-0,76) | 9,24 (1,6-53,1) | Q*=0,88; AuROC=0,94 |
| PCT>1 | 4 (262) | 62 (50-74) | 79 (73-85) | 3,85 (1,8-8,3) | 0,48 (0,34-0,66) | 10,5 (4,9-22,2) | Q*=0.75; AuROC=0,81 |
| PCT>3 | 2 (116) | 48 (31-66) | 96 (89-99) | 13,5 (4,2-42,9) | 0,55 (0,4-0,75) | 28,7 (7,1-116) | Q*= 0,81; AuROC=0,88 |
| Sin ATB | 4 (255) | 74 (65-81) | 89 (83-94) | 6,1 (3,2-11,4) | 0,25 (0,10-0,64) | 30,6 (14-56) | NA |
| Tardías | 4 (208) | 86 (78-92) | 74 (66-81) | 3,94 (1,9-8,1) | 0,18 (0,11-0,31) | 20,25 (9,4-43,5) | Q*=0,852; AuROC=0,91 |
ATB: antibioterapia; AuROC: área bajo la curva ROC; E: especificidad; EC: estudios clínicos; LR+: razón de verosimilitud positiva; LR–: razón de verosimilitud negativa; n.o: número de pacientes; NA: no aplicable; ORD: odds ratio diagnóstica; PCT: procalcitonina; S: sensibilidad.
Creando un modelo de regresión (metarregresión) podemos analizar el impacto de determinados cofactores, incluidos en el modelo como variables independientes, en la validez diagnóstica (ORD), que en el modelo es la variable dependiente. La transformación exponencial de los coeficientes de cada variable independiente indican el cambio en el rendimiento diagnóstico de la prueba y el resultado se muestra como ODR relativa (rODR). En nuestro trabajo el rendimiento diagnóstico de la PCT plasmática se ve modificada por la exposición previa a antibióticos (rORD 0,11; IC 95% 0,02-0,069), que se ve disminuido por este hecho, y no así por el tipo de pacientes críticos (rORD 1,08, IC 95% 0,25-4,74), por la calidad metodológica de los estudios (rORD 1,04; IC 0,59-1,83) ni por el tiempo de desarrollo de la NAVM (rORD 2,91; IC 95% 0,37-2,28). Estos resultados confirman los mostrados en la tabla 2 y tiene una intención más explicativa y generadora de hipótesis que de mostrar algún tipo de evidencia estadística17,21.
DiscusiónEl diagnóstico rápido y preciso de la NAVM continúa siendo un reto no completamente resuelto, tal y como refieren Rea-Neto et al.35 en una reciente revisión sistemática donde concluyen apreciar una marcada variabilidad interobservador en el uso de las escalas clínicas, con un grado de exactitud diagnóstica que no mejora con datos microbiológicos; toman como base para estas aseveraciones estudios que tienen como referencia pruebas anatomopatológicas, y consideran los cultivos microbiológicos cuantitativos el equivalente diagnóstico a utilizar en la práctica clínica36. Este hecho, aun siendo minoritario en nuestro medio, donde predomina el uso de cultivos cualitativos, debería ser evaluado con vistas a su incorporación en la práctica habitual de nuestras unidades5,37. Los hemocultivos presentan una baja rentabilidad, en torno al 25%5, siendo prometedores los resultados de pruebas citológicas y el uso de biomarcadores11, considerando claro el uso de la PCT como marcador pronóstico y como guía de tratamiento, quedando por determinar su uso diagnóstico en infecciones localizadas.
Siguiendo las recomendaciones GRADE38, las pruebas diagnósticas solo son útiles si mejoran el desenlace de los pacientes. La exactitud de dichas pruebas es, tan solo, un indicador indirecto de dicha relevancia clínica. Deducir que una mayor precisión diagnóstica equivale a mejores resultados clínicos lleva implícita la existencia de un tratamiento eficaz para los episodios de NAVM.
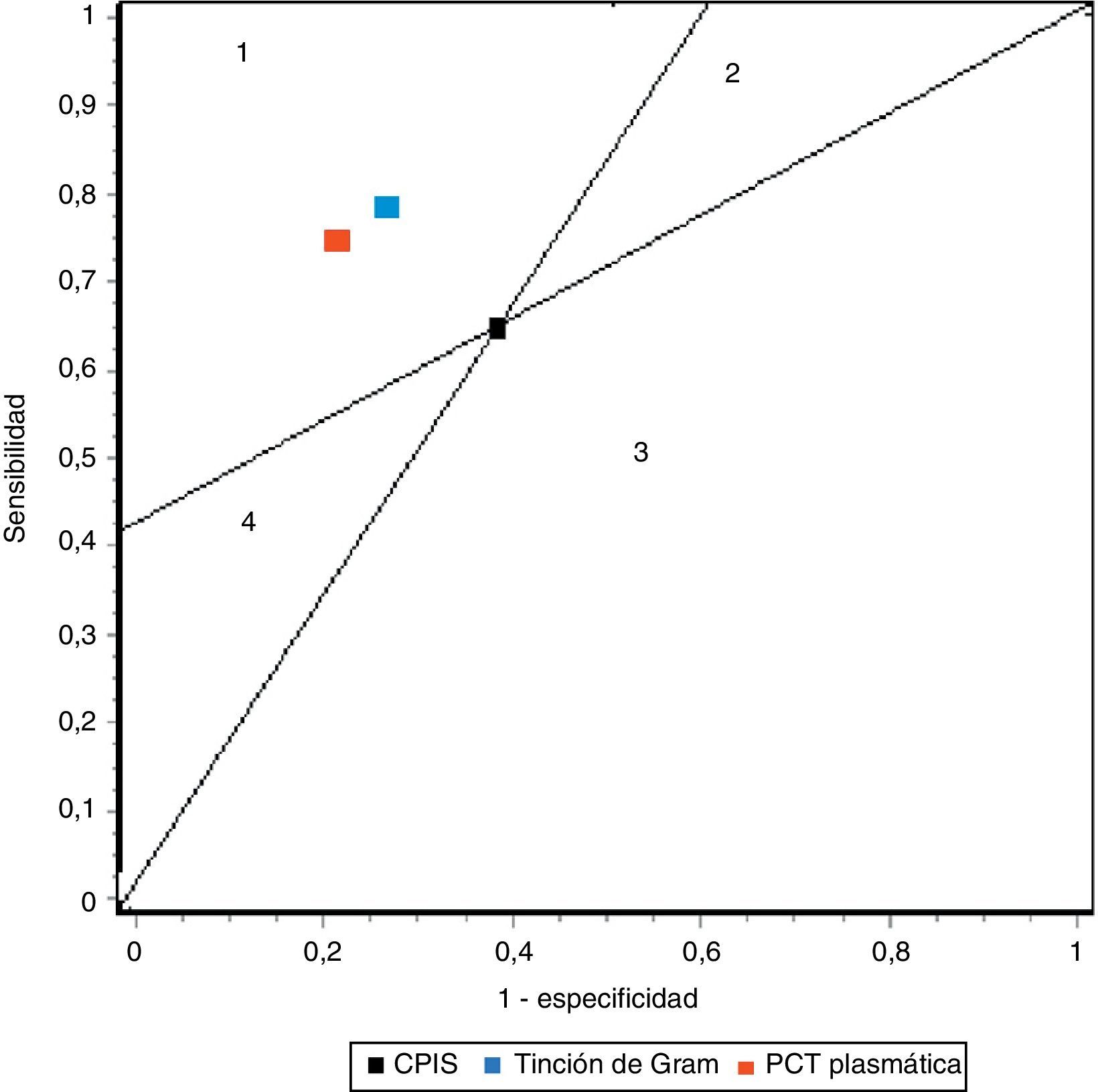
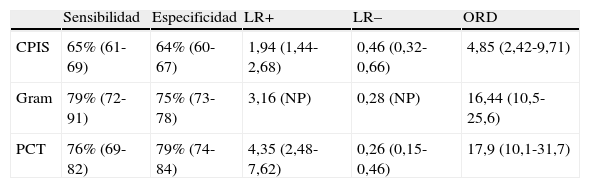
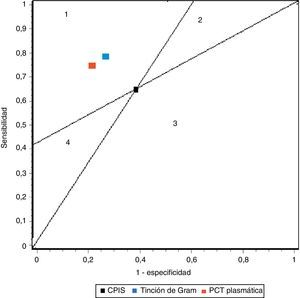
En nuestro trabajo encontramos un adecuado comportamiento diagnóstico de los niveles de PCT en la NAVM en cuanto a cifras de sensibilidad, especificidad y ORD. Todo paciente con clínica evidente incrementa 17 veces el riesgo de padecer NAVM si los niveles plasmáticos de PCT están elevados frente a otro paciente cuyos valores son normales o bajos. Estos resultados mejoran los determinados por Shan et al.39 en un reciente metaanálisis del papel de la escala de Pugin (Clinical Pulmonary Infection Score) y son equiparables a los publicados por O’Horo et al.40 en otro reciente trabajo que evalúa el papel de la tinción de Gram en secreciones bronquiales, todos ellos en el diagnóstico de NAVM, resumidos en la tabla 3. La figura 5 recoge gráficamente la comparativa entre las pruebas diagnósticas en función de los resultados obtenidos en los metaanálisis referidos.
Resumen de los resultados de los metaanálisis de pruebas diagnósticas en neumonía asociada a ventilación mecánica
| Sensibilidad | Especificidad | LR+ | LR– | ORD | |
| CPIS | 65% (61-69) | 64% (60-67) | 1,94 (1,44-2,68) | 0,46 (0,32-0,66) | 4,85 (2,42-9,71) |
| Gram | 79% (72-91) | 75% (73-78) | 3,16 (NP) | 0,28 (NP) | 16,44 (10,5-25,6) |
| PCT | 76% (69-82) | 79% (74-84) | 4,35 (2,48-7,62) | 0,26 (0,15-0,46) | 17,9 (10,1-31,7) |
CPIS: Clinical Pulmonary Infection Score; LR+: razón de verosimilitud positiva; LR−: razón de verosimilitud negativa; NP: datos no publicados; ORD: odds ratio diagnóstica; PCT: procalcitonina.
Representación de sensibilidad y especificidad de CPIS, PCT y tinción de Gram. Las líneas trazadas desde coordenadas (0,0) y (1,1) crean 4 espacios que permiten comparar pruebas entre sí. Área 1: mejor rendimiento; área 2: mejor solo si resultado negativo; área 3: siempre peor; área 4: mejor solo para resultados positivos.
Aunque las pruebas estadísticas no detecten el efecto umbral, existe variación diagnóstica en función del punto de corte de la PCT plasmática. Al tratarse de pacientes con sospecha de NAVM, y, por tanto, con probabilidades pretest relativamente altas (≥40%), el uso de puntos de corte bajos (PCT<0,5) se asocia a un número no despreciable de falsos positivos y, por tanto, de riesgo de sobretratamiento, toxicidad y desarrollo de resistencias, balanceado por una mayor proporción de verdaderos positivos que disminuyen el riesgo de mala evolución o recurrencias. Puntos de corte elevados (PCT>3), siempre en situación de alta probabilidad pretest, conllevan una mayor proporción de falsos negativos y el riesgo de diagnósticos tardíos, complicaciones sépticas y peores resultados.
El rendimiento diagnóstico de los niveles plasmáticos de PCT es mayor en pacientes sin presión antibiótica previa, quedando pendiente de determinar su utilidad real en neumonías precoces, aunque la rentabilidad en pacientes con estancias prolongadas no parece disminuir, a tenor de lo encontrado en neumonías tardías. No encontramos evidencia de sesgo de publicación que pueda contaminar los resultados obtenidos, aunque sí cierta heterogeneidad, en relación con el tipo de paciente crítico englobado.
Es bien sabido que niveles elevados de PCT plasmática no son específicos de infección orgánica y podrían deberse a infecciones en otras localizaciones. El hecho de tratarse de estudios de pacientes con alta sospecha de infección respiratoria y niveles promedio de PCT sensiblemente menores a los publicados en otros contextos del paciente crítico, aun sin descartarlo, lo hacen menos probable.
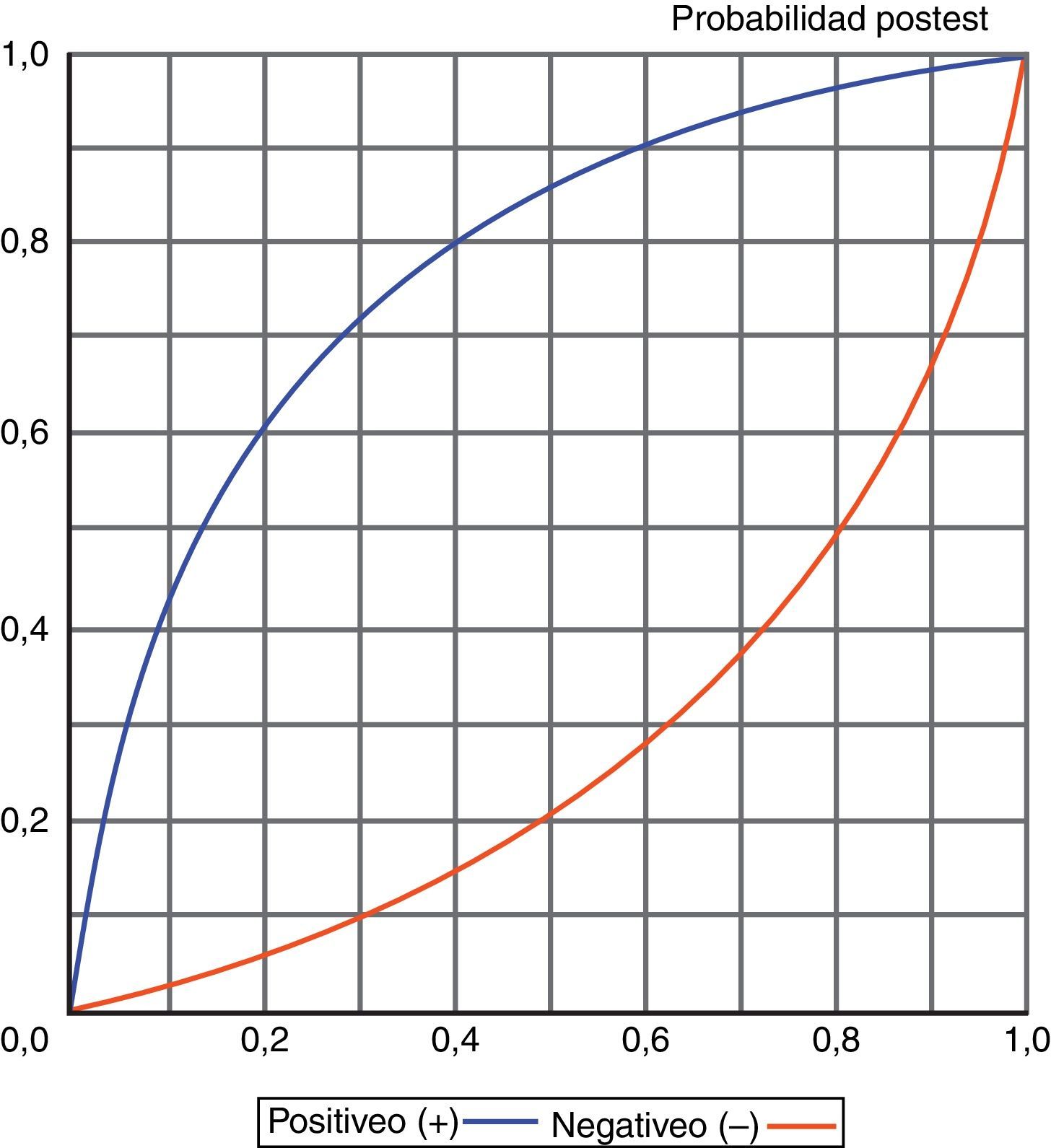
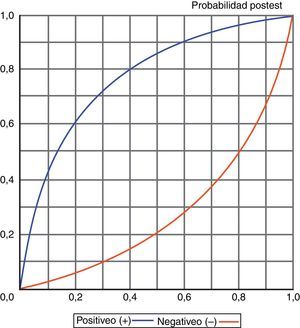
El conocimiento de los valores obtenidos para los distintos índices diagnósticos, y especialmente de las razones de verosimilitud (LR+/LR-), también permite, a través de un enfoque probabilístico, conocer la probabilidad de sufrir o no un episodio de NAVM en función de que el test sea positivo o negativo, tal y como se muestra en la figura 6.
No obstante, la utilidad real de la PCT plasmática en la NAVM debería determinarse tras su incorporación en los algoritmos diagnósticos y tras evaluar su impacto en el tratamiento en el paciente crítico y, sobre todo, en sus resultados.
Dentro de las limitaciones del trabajo encontramos un escaso número de estudios publicados, lo que trae consigo un número relativamente pequeño de pacientes seleccionados y, por otro lado, hace que los tests estadísticos sean poco consistentes. Este hecho impide conocer con certeza el impacto real de factores tales como la toma previa de antibióticos, el papel de la PCT en neumonías precoces o tardías, o el punto de corte ideal. En segundo lugar, la valoración del sesgo de publicación no está completamente estandarizada en el contexto de metaanálisis de pruebas diagnósticas, aunque parece demostrada la relación entre niveles elevados de PCT y el riesgo de padecer NAVM en pacientes con clínica compatible, lo que hace improbable la existencia de estudios significativos no publicados que pudieran cambiar el sentido de la asociación. Por último, el tipo de pacientes incluidos no engloba todo el espectro de pacientes críticos y pone en duda la capacidad de generalizar los resultados.
En conclusión, asumiendo que el diagnóstico rápido de los episodios de NAVM debe hacerse con la suma de datos clínicos, radiológicos y de laboratorio, junto con información microbiológica anticipatoria (por ejemplo, tinción de Gram), los niveles plasmáticos de PCT aportan información a tiempo real que permiten establecer la posibilidad de sufrir NAVM e iniciar tratamiento antibiótico empírico que pueda paliar su impacto en el pronóstico de los pacientes críticos. Estos niveles de PCT son un complemento adicional al uso, ya conocido, de guía de antibioterapia y marcador pronóstico. Es necesario aclarar la utilidad real de estos valores en neumonías precoces, el impacto que pueda tener en el rendimiento diagnóstico el uso previo de antimicrobianos y diferentes terapias inmunomoduladoras, así como su comportamiento en los diferentes tipos de pacientes críticos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.