La inmunoterapia con células T modificadas con receptor quimérico antígeno-específico (chimeric antigen receptor conocida como [CAR-T]) está emergiendo como un tratamiento prometedor para enfermedades hematológicas. Así, las CAR-T dirigidas contra el complejo de diferenciación 19 han demostrado gran eficacia antitumoral contra neoplasias de células B resistentes a terapias convencionales. Sin embargo, la activación dirigida de la respuesta inmunitaria desata en ciertos casos complicaciones específicas graves y potencialmente mortales. Entre ellas cabe destacar el síndrome de liberación de citoquinas y el síndrome de toxicidad neurológica asociado a la terapia con células inmunoefectoras (Immune-effector cell associated neurotoxicity syndrome conocido como ICANS), siendo este último el objetivo de nuestra revisión. Aunque los mecanismos fisiopatológicos que conducen al ICANS son poco conocidos, existen factores clínicos y biológicos que aumentan el riesgo de desarrollo de neurotoxicidad asociada a la terapia CAR-T. El tratamiento se basa en medidas de monitorización y soporte, tratamiento con anticonvulsivantes, corticosteroides e ingreso en los servicios de medicina intensiva de forma precoz. Este artículo proporciona una revisión exhaustiva de la literatura disponible sobre el ICANS desde una perspectiva multidisciplinar, incluyendo recomendaciones de intensivistas, neurólogos y hematólogos formados en el cuidado de adultos críticamente enfermos.
Immunotherapy with chimeric antigen-specific receptor modified T cells, known as CAR-T, is emerging as a promising approach to hematological malignancies. In this regard, CAR-T against human cluster of differentiation (CD) 19 has demonstrated antitumor efficacy in application to B cell neoplasms resistant to conventional therapy. However, activation of the immune system induces severe and specific complications which can prove life-threatening. These include cytokine release syndrome and immune effector cell-associated neurotoxicity syndrome (known as ICANS) - the latter being the subject of the present review. Although the physiopathological mechanisms underlying ICANS are not well known, a number of clinical and biological factors increase the risk of developing neurotoxicity associated to CAR-T therapy. Treatment is based on close monitoring, measures of support, anticonvulsivants, corticosteroids, and early admission to intensive care. The present study offers a comprehensive review of the available literature from a multidisciplinary perspective, including recommendations from intensivists, neurologists and hematologists dedicated to the care of critically ill adults.
El cáncer es una de las principales causas de muerte en el mundo1. Solo en España se diagnostican más de 200.000 casos nuevos al año, de los cuales más del 10% son de origen hematológico2. En las últimas décadas el desarrollo de terapias específicas contra el cáncer, como la inmunoterapia, ha hecho posible que un grupo de pacientes con enfermedad oncohematológica avanzada puedan sobrevivir3,4. Sin embargo, estas terapias no están exentas de toxicidades que pueden poner en peligro la vida del paciente5. Estas emergencias oncohematológicas, que son cada vez más frecuentes, se han visto reflejadas en un mayor número de pacientes que requieren ingreso y manejo en los servicios de medicina intensiva (SMI)3,6,7.
Recientemente la inmunoterapia con células T modificadas genéticamente para expresar un receptor quimérico antígeno-específico (CAR-T) ha demostrado una notable eficacia clínica contra las neoplasias linfoides B en fases avanzadas8,9. Los CAR son receptores sintéticos constituidos por un dominio de activación de la célula T (cadena zeta del CD3), acompañado de un dominio de coestimulación (CD28 o 4-1BB), un dominio transmembrana y un dominio extracelular de unión al antígeno (un fragmento de anticuerpo, parte de la región variable de las inmunoglobulinas, en forma de cadena simple)8,10. Este último dominio es el que confiere a las células T la especificidad antigénica. El proceso para redirigir el sistema inmune contra las células tumorales se fundamenta en extraer los linfocitos T del propio del paciente, y modificarlos con un gen que codifica el CAR mediante transducción retroviral o lentiviral. Los linfocitos T modificados genéticamente son expandidos y posteriormente infundidos como tratamiento inmune8,10.
Actualmente existen 3 indicaciones aprobadas en adultos. La primera es para la leucemia linfoblástica aguda B (LLA-B) refractaria, en recaída postrasplante o en segunda o posterior recaída en pacientes con edad inferior a 25 años; la segunda es para el linfoma difuso de células B grandes (LDCBG) en recaída o refractario tras 2 o más líneas de tratamiento sistémico, y la tercera es para el linfoma B primario mediastínico de células grandes, después de 2 o más líneas de tratamiento sistémico11–18.
Desde los primeros ensayos clínicos con las células CAR-T anti-CD19, su alta tasa de efectividad se acompaña de toxicidades importantes y más graves que las descritas en otras terapias celulares. El efecto adverso más común es el síndrome de liberación de citoquinas (SLC), el cual se manifiesta con fiebre, hipotensión y/o hipoxemia18–20. La segunda complicación más común es la neurotoxicidad, a pesar de que inicialmente se consideraba parte del SLC.
Con el objetivo de clasificar y tratar con mayor precisión los diferentes síntomas y signos neurológicos que presentan los pacientes tratados con CAR-T, desde el 2018 la Sociedad Americana de Hematología y Trasplante de médula ósea (American Society for Blood and Marrow Transplantation [ASBMT]) reconoce la neurotoxicidad como una entidad clínica separada llamada síndrome de neurotoxicidad asociado a células inmunoefectoras (immune effector cell-associated neurotoxicity syndrome [ICANS])20.
Detectar precozmente los síntomas y signos de ICANS, el inicio precoz del tratamiento específico de sus complicaciones y valorar el ingreso en los SMI son las recomendaciones estándar para el cuidado de estos enfermos19,21,22. Por ello, la valoración inicial y seguimiento del paciente sometido a terapia con células CAR-T por un equipo multidisciplinar es fundamental3,23.
MétodosSe realizó una búsqueda en la base de datos Medline (Pubmed) de artículos relevantes utilizando como términos principales: Immune effector cell associated neurotoxicity syndrome o CAR t-cell therapy. Los términos de búsqueda adicionales fueron: hematologic malignancies o intensive care o critical care o critical illness. Las referencias de los artículos seleccionados se utilizaron a su vez para identificar estudios adicionales. Todos los artículos fueron seleccionados y aceptados en consenso por los 4 autores.
Factores de riesgo y fisiopatología para el desarrollo de síndrome de neurotoxicidad asociado a células inmunoefectorasSe define ICANS como una alteración clínica del sistema nervioso central (SNC) después de cualquier terapia inmune que resulte en la activación o compromiso de células T endógenas o infundidas y/u otras células efectoras inmunes20. El ICANS suele ocurrir una vez terminadas las manifestaciones del SLC y se caracteriza por diversos síntomas neurológicos de intensidad variable, entre los que destacan: confusión, alteración del lenguaje, disartria, alteración del humor, delirium, crisis convulsivas, alteraciones del nivel de consciencia e incluso edema cerebral y muerte20.
La fisiopatología del ICANS es poco conocida a día de hoy, ya que existen pocos biomarcadores disponibles y su presentación clínica es inespecífica24,25. Estas particularidades son típicas de las entidades sindrómicas (por ejemplo síndrome de distrés respiratorio del adulto o la sepsis) que se tratan en los SMI. Los criterios clínicos y factores de riesgo asociados al desarrollo y severidad del ICANS son: la edad (pacientes más jóvenes), el diagnóstico de LLA-B, la alta carga tumoral al momento de la infusión, las dosis altas de CAR-T y una rápida expansión de células T tras la infusión24,26. Además, se ha descrito que el ICANS grave habitualmente está precedido por SLC26,27, y existe una relación directa entre la gravedad de este y la del ICANS. Por otro lado, datos analíticos de coagulación intravascular diseminada, elevación de proteína C reactiva y ferritina, y también una gran elevación de citoquinas proinflamatorias, incluyendo interleucina 6 (IL-6), interferón gamma (IFN-γ) y factor de necrosis tumoral alfa (TNF-α) se han asociado con ICANS grave24,26,28. Todos estos datos, en conjunto, sugieren el desarrollo de un síndrome de tipo inflamatorio con fuga capilar tras la infusión de las células CAR-T.
Desde el punto de vista fisiopatológico se han descrito como posibles desencadenantes de ICANS: la activación endotelial difusa mediada por una alta concentración de citoquinas en sangre periférica (IL-6 e IFN-γ), lo que provocaría también una alteración de la barrera hematoencefálica (BHE), objetivada por la detección de altos niveles de proteínas y pleocitosis en el líquido cefalorraquídeo (LCR)24–26,29. Estudios in vitro han demostrado que los pericitos del endotelio vascular cerebral son sensibles a la estimulación por citoquinas proinflamatorias, lo que provocaría el aumento de la permeabilidad de la BHE26. Adicionalmente, la producción local de citoquinas en el SNC, con incrementos notables de IL-8, IL-10 y la proteína quimiotáctica de monocitos (MCP-1) en el LCR, es otro mecanismo postulado para la aparición de ICANS grave24,29. Santomasso et al.24 han descrito que durante la neurotoxicidad grave hay una elevación de IL-1 e IL-6 en el LCR, lo que sugiere una hiperproducción dentro del mismo SNC. Por último, las manifestaciones de ICANS han sido descritas en CAR-T dirigidas contra CD19, pero la neurotoxicidad no es exclusiva de esta diana. De hecho, mediante un modelo in vivo de neurotoxicidad en macacos infundiendo CAR-T dirigidas contra CD20 se ha logrado confirmar que, junto con los elevados niveles de citoquinas proinflamatorias, la infiltración difusa del parénquima cerebral por células T ocasiona encefalitis y los síntomas de neurotoxicidad25.
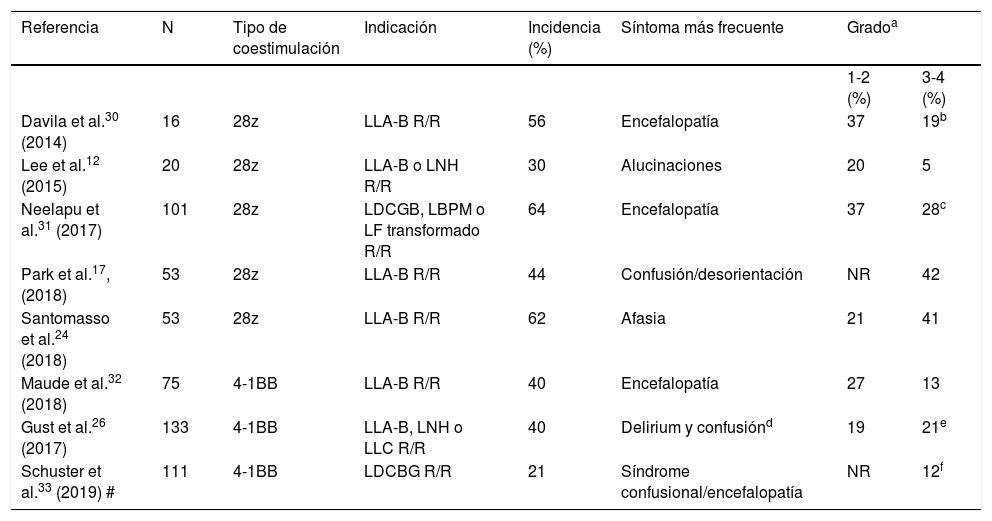
Espectro clínico y diagnóstico del síndrome de neurotoxicidad asociado a células inmunoefectorasLa incidencia de la neurotoxicidad asociada a las terapias con células CAR-T se estima entre un 21-64% de pacientes infundidos12,17,24,26,30–33 (tabla 1), entre los cuales un tercio pueden requerir medidas de soporte e ingreso en los SMI30,34,35. La mediana de tiempo de aparición del primer síntoma neurológico después de la infusión de células CAR-T es de 6 días (rango 1-34 días), y suele desarrollarse al mismo tiempo o justo después de que los síntomas del SLC se hayan resuelto20,27,36. La duración de los síntomas oscila entre 2 a 9 días, y típicamente se resuelven dentro de las 3-4 primeras semanas después de la infusión20,26,27,31,33.
Incidencia y características clínicas de neurotoxicidad por terapia con células T-CAR
| Referencia | N | Tipo de coestimulación | Indicación | Incidencia (%) | Síntoma más frecuente | Gradoa | |
|---|---|---|---|---|---|---|---|
| 1-2 (%) | 3-4 (%) | ||||||
| Davila et al.30 (2014) | 16 | 28z | LLA-B R/R | 56 | Encefalopatía | 37 | 19b |
| Lee et al.12 (2015) | 20 | 28z | LLA-B o LNH R/R | 30 | Alucinaciones | 20 | 5 |
| Neelapu et al.31 (2017) | 101 | 28z | LDCGB, LBPM o LF transformado R/R | 64 | Encefalopatía | 37 | 28c |
| Park et al.17, (2018) | 53 | 28z | LLA-B R/R | 44 | Confusión/desorientación | NR | 42 |
| Santomasso et al.24 (2018) | 53 | 28z | LLA-B R/R | 62 | Afasia | 21 | 41 |
| Maude et al.32 (2018) | 75 | 4-1BB | LLA-B R/R | 40 | Encefalopatía | 27 | 13 |
| Gust et al.26 (2017) | 133 | 4-1BB | LLA-B, LNH o LLC R/R | 40 | Delirium y confusiónd | 19 | 21e |
| Schuster et al.33 (2019) # | 111 | 4-1BB | LDCBG R/R | 21 | Síndrome confusional/encefalopatía | NR | 12f |
LBPM: linfoma B primario mediastínico; LDCGB: linfoma difuso de células grandes B; LF: linfoma folicular; LLA-B: leucemia linfoblástica aguda B; LNH: linfoma no Hodgkin; LLC: leucemia linfocítica crónica; NR: no reportado; R/R: recaído o refractario.
La expresión clínica de la neurotoxicidad es muy amplia20. Algunos síntomas neurológicos que pueden aparecer son poco específicos, como la cefalea, el temblor, las mioclonías, la asterixis o las alucinaciones. Son síntomas que también pueden presentarse en el SLC sin toxicidad neurológica asociada, y por eso se han excluido de la definición de ICANS. La frecuencia y severidad de los síntomas pueden estar relacionadas con la estructura del receptor. En ese sentido, pacientes que recibieron productos cuyo CAR-T incluía en su construcción el dominio coestimulador CD28 presentaron ICANS grave en alrededor del 40% de los casos, mientras que solo 13-21% de los eventos fueron graves en aquellos con el dominio coestimulador 4-1BB20(tabla 1).
La encefalopatía y la afasia son los síntomas más frecuentes y específicos que caracterizan el ICANS20,27,30–32. Neelapu et al.31 y Rubin et al.27 describieron que la encefalopatía fue el signo más común en los pacientes con neurotoxicidad grave. En contraste, Santomasso et al.24 estudiaron 53 pacientes con LLA-B refractaria tratados con CAR-T, en los que la afasia de expresión (34%), especialmente para nominación de objetos, fue el síntoma más característico de neurotoxicidad. La afasia se desarrolló en el 95% de los pacientes con neurotoxicidad grave24. La afasia de expresión empieza como una alteración para nominar objetos, parafasias, lenguaje vacilante y puede progresar a una afasia global y/o mutismo, caracterizada por una dificultad completa para la expresión y la nominación. Los síntomas pueden evolucionar a convulsiones, estupor y coma. Los pacientes con afasia global pueden aparentar estar despiertos, pero están mutistas y acinéticos20. Davila et al.30 observaron que algunos de los pacientes estudiados desarrollaron una progresión gradual de la confusión hasta presentar una afasia, y 3 de sus 9 pacientes con neurotoxicidad requirieron intubación y ventilación mecánica invasiva (VMI).
El edema cerebral difuso ha sido descrito como una de las complicaciones más graves de la terapia CAR-T14,20,26,30,37. Esta complicación puede tener un inicio fulminante y pocos signos clínicos premonitorios20. En una de las primeras series publicadas de pacientes LLA-B que recibieron terapia CAR-T experimental se observaron 5 casos de edema cerebral y muerte38. Además, Gust et al.26 describieron 4 muertes, 2 de las cuales fueron por edema cerebral difuso en pacientes tratados con un CAR-T 19 (4-1BB).
Las convulsiones son de frecuencia variable y suceden a menudo después de haber presentado afasia20. Suelen ser tónico-clónicas generalizadas, pero también pueden aparecer crisis comiciales no convulsivas, que se han descrito hasta en el 10% de los casos tratados con terapia CAR-T20,24. Gust et al.26 documentaron una incidencia de crisis comiciales del 8% (4/53 pacientes) asociada a la terapia CAR-T anti-CD19 coestimuladas con 4-1BB y solo ocurrieron en pacientes con antecedentes de convulsiones o en casos de neurotoxicidad grave.
Niveles de gravedad del síndrome de neurotoxicidad asociado a células inmunoefectorasEl ICANS es un abanico de manifestaciones clínicas que abarcan desde trastornos relativamente leves (grado 1) hasta manifestaciones clínicas muy graves y potencialmente fatales (grado 4), que requieren de un reconocimiento precoz y de una pronta intervención20.
Para la nueva clasificación de ICANS propuesta por la ASBMT se descartaron varios signos y síntomas neurológicos poco específicos, como la cefalea o la confusión. Se debe realizar siempre el diagnóstico diferencial de los síntomas neurológicos en estos pacientes39 (tabla 2). La hemorragia intracraneal y las infecciones del SNC se han excluido de la definición del ICANS20.
Diagnóstico diferencial del ICANS
| Alteraciones vasculares del sistema nervioso central (SNC) | Infarto cerebralHemorragia intracraneal (hemorragia subaracnoidea y/o intraparenquimatosa)a |
| Infecciones del SNCb | Meningitis y/o encefalitis: bacterianas, víricas, fúngicas o por parásitos (toxoplasmosis) |
| Metabólicas | Diselectrolitemias: hipo o hipernatremia, hipo o hipercalcemia, hipo o hipermagnesemiaHipoxemia o hipercapniaDéficit de tiamina y cianocobalaminaHipoglicemia |
| Tóxico-farmacológicas | Hipnóticos sedantes y opioidesNeurolépticos y anticolinérgicosAntibióticos (por ejemplo betalactámicos, quinolonas)Inmunosupresores (ciclosporina) |
| Alteraciones del sistema nervioso periférico (SNP) | Polineuropatía axonal secundaria a quimioterápicos |
Para la correcta evaluación del ICANS en primer lugar se debe identificar el grado de encefalopatía del paciente mediante un sistema de puntuación (score) denominado Escala de encefalopatía asociada a células inmuno-efectoras (ICE, por sus siglas en inglés: immune effector cell-associated encephalopathy) (tabla 3). La escala ICE se puntúa del 1 a1 10, donde 10 es ausencia de alteración y 0 corresponde a una disminución severa del nivel de conciencia20. A diferencia la escala CARTOX-1022, más antigua, la actual escala ICE incluye un elemento más (la respuesta a órdenes) para evaluar la afasia, observada frecuentemente en pacientes que desarrollan una toxicidad neurológica grave24.
Encefalopatía asociada a células inmunoefectoras (escala ICE)
| Puntuación | ||
|---|---|---|
| Orientacióna | Año, mes, ciudad, lugar | 4 |
| Nominacióna | Nombra 3 objetos (ejemplo: reloj, bolígrafo, botón) | 3 |
| Atencióna | Contar para atrás desde 100 de 10 en 10 | 1 |
| Escrituraa | Habilidad para escribir una frase sencillab | 1 |
| Respuesta a órdenesc | Obedece órdenes (ejemplo: cierre los ojos y saque la lengua o muéstreme 2 dedos) | 1 |
ICE: Immune effector Cell-associated Encephalopathy; CARTOX: CAR-T cell-therapy-associated TOXicity.
La escala ICE incluye la respuesta de órdenes verbales, ítem no presente en la escala CARTOX-10, permitiendo una mejor valoración del lenguaje55.
La escala ICE es una herramienta sencilla y rápida para obtener una valoración inicial y detectar rápidamente cambios neurológicos sutiles. Sin embargo, en el paciente intubado en sedación farmacológica y con ventilación mecánica invasiva la escala ICE no permite la correcta evaluación de la encefalopatía. Sabemos que las estrategias de sedación habituales no ofrecen ninguna ventaja en relación con estrategias sin sedación40, ya que hay que minimizar e individualizar el uso de estas sustancias (en particular las benzodiacepinas)41–43. Por otro lado, varias herramientas podrían ser útiles en la valoración del paciente en este escenario. Una de ellas sería la herramienta CAM-ICU 44 o el ICDSC45. Ambas son útiles para la valoración de la confusión y delirium en el paciente crítico, pero no están validadas en este contexto. Por todo ello, es importante que junto con el neurólogo se exploren cada uno de los signos y síntomas de forma individual.
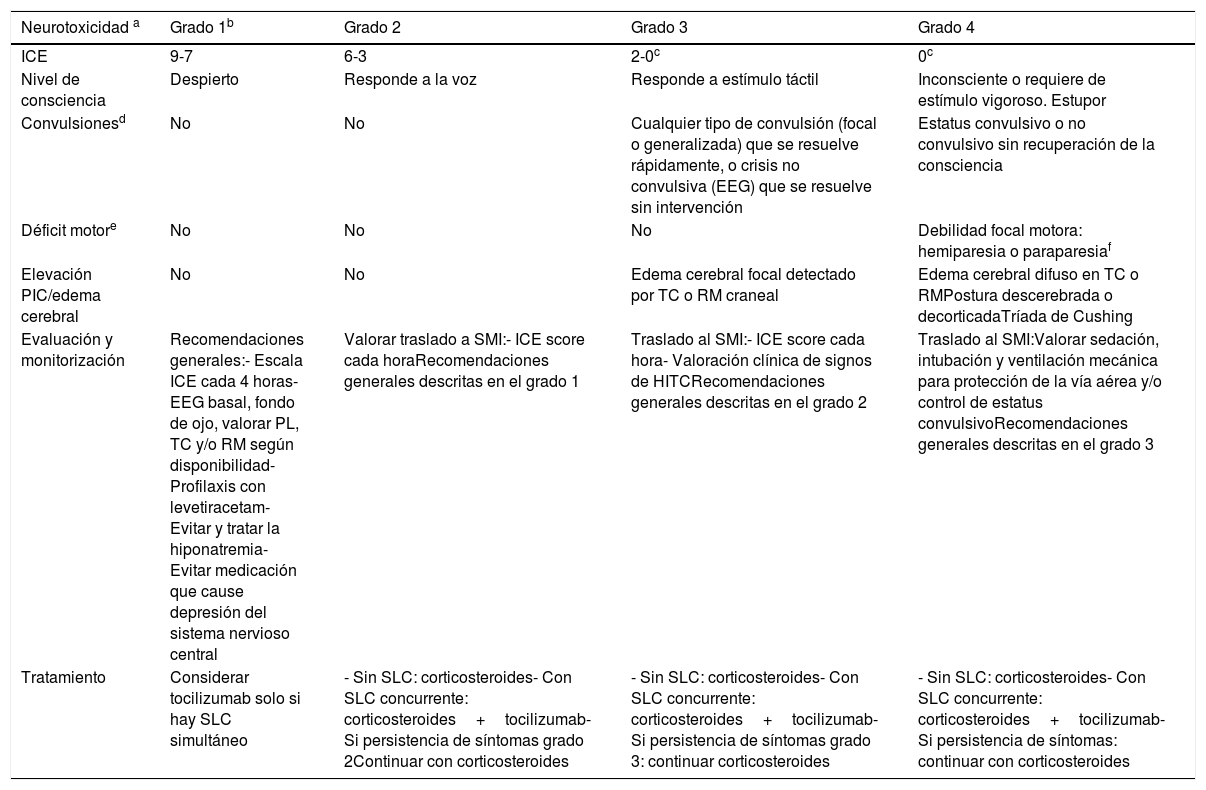
Una vez evaluada la encefalopatía se valoran 4 elementos más: el nivel de consciencia, los síntomas motores, las convulsiones y los signos de elevación de la presión cerebral y/o edema cerebral. La clasificación de gravedad del ICANS se realiza teniendo en cuenta todas las variables descritas, agrupadas según el consenso de la ASBMT20. La tabla 4 describe con detalle la escala de gravedad del ICANS.
Niveles de gravedad del ICANS según el consenso de expertos de la ASBMT
| Neurotoxicidad a | Grado 1b | Grado 2 | Grado 3 | Grado 4 |
|---|---|---|---|---|
| ICE | 9-7 | 6-3 | 2-0c | 0c |
| Nivel de consciencia | Despierto | Responde a la voz | Responde a estímulo táctil | Inconsciente o requiere de estímulo vigoroso. Estupor |
| Convulsionesd | No | No | Cualquier tipo de convulsión (focal o generalizada) que se resuelve rápidamente, o crisis no convulsiva (EEG) que se resuelve sin intervención | Estatus convulsivo o no convulsivo sin recuperación de la consciencia |
| Déficit motore | No | No | No | Debilidad focal motora: hemiparesia o paraparesiaf |
| Elevación PIC/edema cerebral | No | No | Edema cerebral focal detectado por TC o RM craneal | Edema cerebral difuso en TC o RMPostura descerebrada o decorticadaTríada de Cushing |
| Evaluación y monitorización | Recomendaciones generales:- Escala ICE cada 4 horas- EEG basal, fondo de ojo, valorar PL, TC y/o RM según disponibilidad- Profilaxis con levetiracetam- Evitar y tratar la hiponatremia- Evitar medicación que cause depresión del sistema nervioso central | Valorar traslado a SMI:- ICE score cada horaRecomendaciones generales descritas en el grado 1 | Traslado al SMI:- ICE score cada hora- Valoración clínica de signos de HITCRecomendaciones generales descritas en el grado 2 | Traslado al SMI:Valorar sedación, intubación y ventilación mecánica para protección de la vía aérea y/o control de estatus convulsivoRecomendaciones generales descritas en el grado 3 |
| Tratamiento | Considerar tocilizumab solo si hay SLC simultáneo | - Sin SLC: corticosteroides- Con SLC concurrente: corticosteroides+tocilizumab-Si persistencia de síntomas grado 2Continuar con corticosteroides | - Sin SLC: corticosteroides- Con SLC concurrente: corticosteroides+tocilizumab-Si persistencia de síntomas grado 3: continuar corticosteroides | - Sin SLC: corticosteroides- Con SLC concurrente: corticosteroides+tocilizumab- Si persistencia de síntomas: continuar con corticosteroides |
ASBMT: Sociedad Americana de Hematología y Trasplante de Médula Ósea (American Society for Blood and Marrow Transplantation); EEG: electroencefalograma; ICANS: síndrome de neurotoxicidad asociada a células inmunoefectoras (Immune-effector Cell-associated Neurotoxicity Syndrome); ICE: escala de valoración de encefalopatía (Immune effector Cell-associated Encephalopathy, ICE score); PIC: presión intracraneal; PL: punción lumbar; RM: resonancia magnética; SMI: servicio de medicina intensiva; SLC: síndrome de liberación de citoquinas; TC: tomografía computarizada.
La neurotoxicidad será graduada según la sintomatología de mayor gravedad, no atribuible a otra causa.
Un paciente con ICE 0 puede ser clasificado como grado 3, si el paciente está despierto, pero con afasia global. Sin embargo, se debe clasificar como grado 4 si el paciente está inconsciente.
Las pruebas complementarias van fundamentalmente dirigidas a realizar el diagnóstico diferencial del ICANS (tabla 2).
NeuroimagenLas pruebas de neuroimagen, entre las que se incluyen la tomografía computarizada (TC) y la resonancia magnética (RM), son necesarias en los pacientes con neurotoxicidad para poder confirmar o descartar el edema cerebral difuso, que es la complicación más grave del ICANS14,26,37. El estado clínico del paciente a menudo determina la elección de la modalidad de la neuroimagen. La RM es preferible a la TC, aunque en los grados leves no suelen observarse cambios relevantes ni en la TC ni en la RM13,14,20,26,30,46. Estos métodos diagnósticos sirven también para descartar eventos cerebrovasculares que son más frecuentes y no corresponden al ICANS27,47,48.
ElectroencefalogramaLas crisis comiciales y el estatus epiléptico son manifestaciones graves de neurotoxicidad. El patrón electroencefalográfico más común es la actividad delta rítmica intermitente frontal y la actividad lenta presentes en el edema cerebral difuso49. Sin embargo, una actividad delta rítmica intermitente frontal o un patrón de lentificación del trazo con ondas de bajo voltaje pueden estar presentes en otras entidades, como encefalopatías tóxico-metabólicas, infecciones del SNC o sedación con fármacos depresores del SNC50. Rubin et al.27 estudiaron 36 pacientes con neurotoxicidad por CAR-T a los que se les realizó un electroencefalograma (EEG); el 77% de los pacientes presentaba un ritmo lento theta-delta, 2 pacientes presentaron una actividad lenta asincrónica generalizada y un 33% presentaron un patrón de la desaceleración focal. El EEG continuo puede revelar episodios periódicos de descargas, que se han visto correlacionadas con los periodos de empeoramiento de ICANS51. Sin embargo, el EEG continuo se trata de una herramienta de difícil disposición en muchos centros.
Presión intracraneal y estudio de líquido cefalorraquídeoEs recomendable realizar una punción lumbar, siempre que la situación clínica del paciente lo permita, incluyendo bioquímica, citología y estudio microbiológico del LCR (vírico y bacteriano). En el LCR el recuento celular y las proteínas pueden estar aumentadas. Las células CAR-T pueden encontrarse en el LCR tanto en pacientes con neurotoxicidad como en los pacientes sin síntomas neurológicos26,29.
El consenso del ASBMT recomienda realizar una punción lumbar valorando la presión de apertura y la valoración de papiledema, en pacientes estables clínica y analíticamente. Sin embargo, en los pacientes críticos estas medidas pueden ser difíciles realizar en la práctica habitual, ya que la presión de apertura puede variar con la edad, la posición, la presión arterial, la VMI y la sedación farmacológica52. La monitorización de los signos de hipertensión intracraneal por doppler transcraneal puede ser útil34,53,54. Sin embargo, no se ha podido relacionar la gravedad del ICANS con un aumento de las velocidades del flujo por Doppler27.
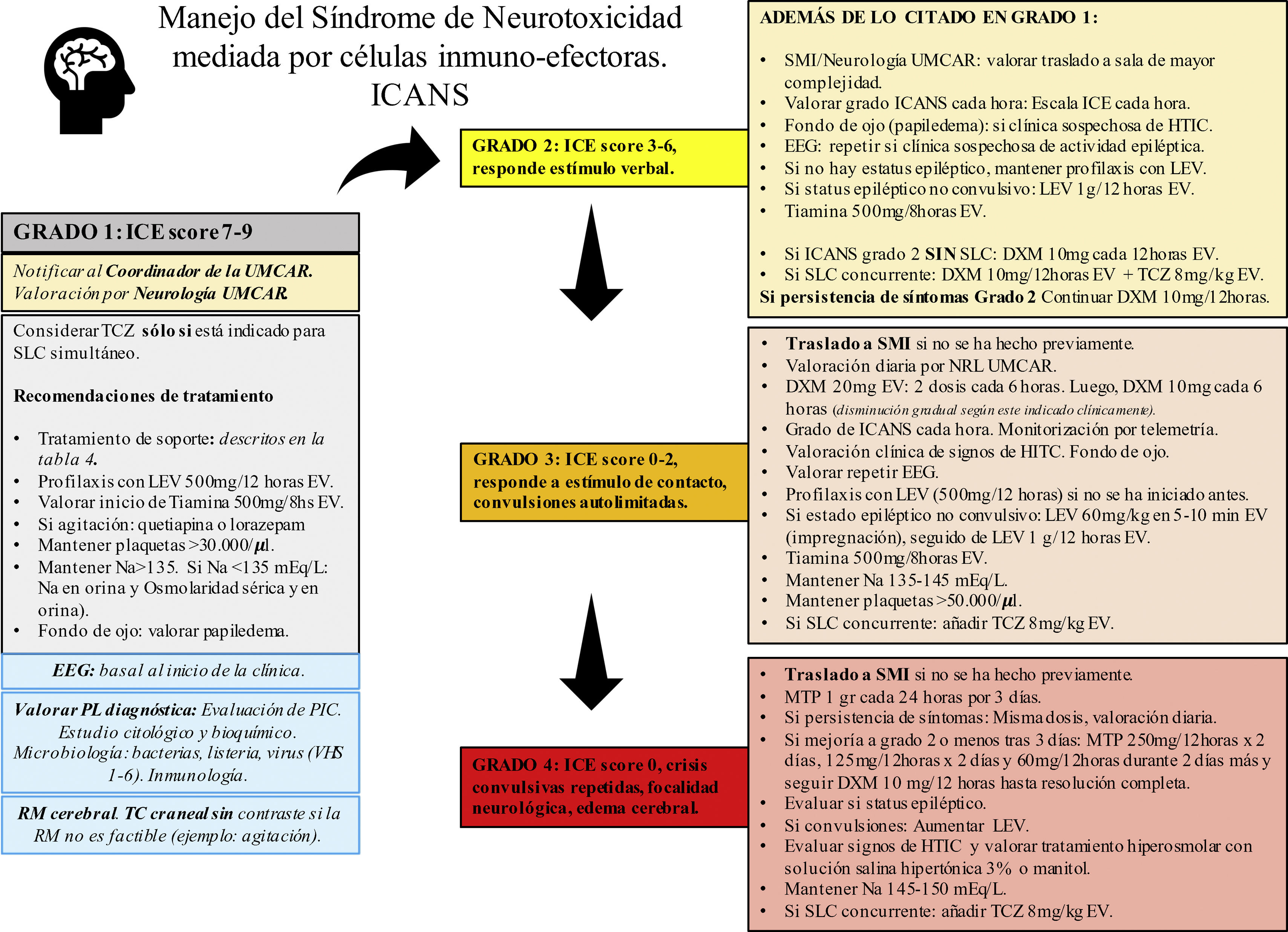
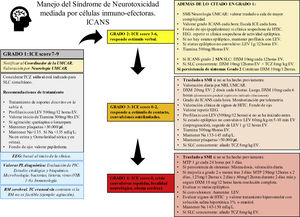
Manejo del síndrome de neurotoxicidad asociado a células inmunoefectorasNo existe tratamiento específico para el ICANS20. Por regla general son necesarias la vigilancia estricta y la evaluación frecuente del paciente por un equipo multidisciplinar, que incluya hematólogos/oncólogos, neurólogos e intensivistas19,34. El manejo de la neurotoxicidad depende del grado ICANS en el que se encuentra el paciente (fig. 1).
Recomendaciones de manejo basada en ASBMT.
ASBMT: Sociedad Americana de Hematología y Trasplante de Médula Ósea; DXM: dexametasona; EEG: electroencefalograma; HTIC: hipertensión intracraneana. ICANS: síndrome de neurotoxicidad asociada a células inmunoefectoras; ICE score: Escala de valoración de encefalopatía por células inmuno-efectoras; LEV: levetiracetam; MTP: metilprednisolona; Na: sodio mEq/L; NLG: neurólogo; PL: punción lumbar; RM: resonancia magnética; SLC: síndrome de liberación de citoquinas; SMI: servicio de medicina intensiva; TC: tomografía computarizada; TCZ: tocilizumab; UMCAR: unidad multidisciplinar CAR.
Los corticosteroides son la base del tratamiento del ICANS. Los pacientes con grado 1-3 de ICANS son tratados usualmente con dexametasona, mientras que los pacientes con grado 4 de ICANS se recomienda optar por dosis altas de metilprednisolona20,26,34,55,56 (fig. 1). Ante el efecto linfocítico y antiinflamatorio de los corticoides existe incertidumbre en relación con la noción de si estos fármacos disminuyen o no la efectividad de los CAR-T. Sin embargo, datos recientes sugieren que la administración precoz y/o los ciclos cortos de esteroides se asocian con la resolución de las toxicidades neurológicas sin alterar la respuesta antitumoral57,58. En todo caso, los corticoides deben mantenerse hasta que la neurotoxicidad mejore o desaparezca por completo. La dosis y ciclos utilizados en nuestro centro están explicados de forma detallada en la figura 1. Los pacientes deben controlarse estrechamente para detectar la recurrencia de los síntomas de neurotoxicidad durante la reducción de dosis de los corticosteroides.
Antirreceptores de interleucinasEl tocilizumab, un anticuerpo monoclonal humanizado dirigido contra el receptor de la IL-6, no está indicado para el tratamiento del ICANS20. Se recomienda exclusivamente para pacientes con manifestaciones clínicas simultáneas de ICANS y SLC20,36. Una de las razones por la que el ICANS no responde al tocilizumab es que este fármaco no alcanza niveles significativos en el LCR59. Además, algunos autores describen que bloquear el receptor de IL-6 con el tocilizumab puede producir un aumento de IL-6 en el LCR empeorando la neurotoxicidad60,61. Norelli et al., en un modelo con ratones, observaron que al bloquear el receptor de IL-6 con tocilizumab se prevenía el SLC. Por el contrario, el tocilizumab no logró evitar el desarrollo de neurotoxicidad. Los mismos autores observaron que la administración de un antagonista del receptor de IL-1 (anakinra) se asociaba a la mejoría tanto del SLC como de la neurotoxicidad28. Actualmente está en desarrollo un ensayo clínico fase ii para evaluar la potencial utilidad de la anakinra para prevenir el ICANS en pacientes con LDCBG receptores de terapia con CAR-T (NCT04205838).
AnticonvulsivantesEl rol de los anticonvulsivantes en profilaxis para los pacientes en terapia CAR-T es controvertido10. Algunos centros inician la profilaxis anticonvulsivante el mismo día de la infusión de células CAR-T, especialmente si se infunden CAR-T con dominio de coestimulación CD 28. En otros se pauta la profilaxis cuando se inician síntomas de neurotoxicidad21,34,55. En nuestro centro se recomienda iniciar la profilaxis anticonvulsivante ante cualquier signo de toxicidad neurológica y mantenerlo al menos hasta el día +14, y se consensúa su retirada con el equipo de neurología de forma lenta y en función de las características de cada paciente (fig. 1). Cualquier tipo de crisis comicial o estatus epiléptico debe ser manejado con benzodiacepinas y fármacos antiepilépticos, siguiendo las guías de cada centro23,34,47.
Terapia hiperosmolarLos pacientes con edema cerebral difuso deben recibir corticosteroides a dosis altas, asociado a medidas para disminuir la presión intracraneal con manitol y/o solución salina hipertónica34. La utilización de medidas neuroquirúrgicas, como el drenaje ventricular externo y la craniectomía descompresiva son infrecuentes, pero están descritas en la literatura55. No hay evidencia de que la monitorización neurológica invasiva sea útil. Es probable que el mejor método para prevenir el edema cerebral sea detectar y tratar precozmente el ICANS, ya que una vez establecido puede ser letal10.
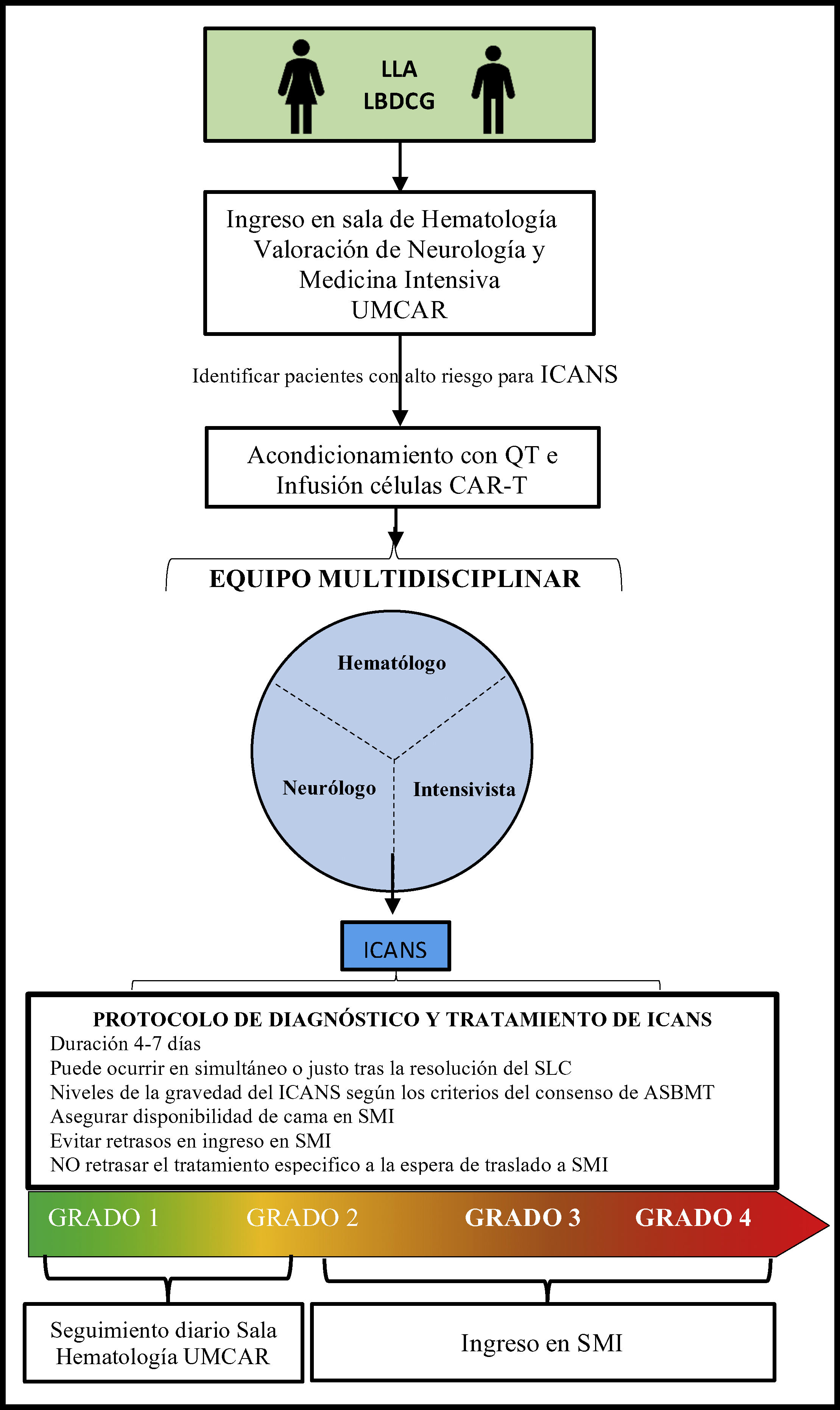
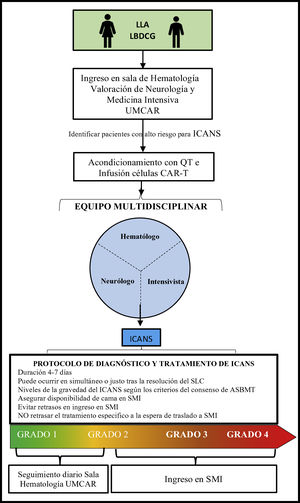
Consideraciones específicas para el manejo de pacientes con terapia con células T modificadas con receptor quimérico antígeno-específico en medicina intensivaLos pacientes con cáncer que requieren ingreso en los SMI generalmente son pacientes con elevada morbimortalidad6,62. Los intensivistas debemos ser conscientes de que los pacientes tratados con células CAR-T pueden potencialmente necesitar sedación, intubación y VMI para la protección de las vías respiratorias y control ventilatorio y de la oxigenación, sobre todo en casos de ICANS grado 3 o 456. En nuestra experiencia una visita conjunta y diaria con los intensivistas y otros especialistas permite un abordaje clínico y toma de decisiones de forma óptima y precoz (fig. 2). Así mismo, el manejo de una complicación grave o en una situación de fallo multiorgánico debe ser dirigido por el intensivista, habida cuenta de que este tipo de complicaciones ponen en peligro la vida de los pacientes63.
Proceso de ingreso y seguimiento para pacientes en terapia con células CAR-T.
ASBMT: Sociedad Americana de Hematología y Trasplante de Médula Ósea; CAR: receptor quimérico de antígeno específico; ICANS: Síndrome de neurotoxicidad asociada a células inmuno-efectoras; LDCBG: linfoma difuso de células B grandes; LLA-B: leucemia linfoblástica aguda B; QT: quimioterapia; SLC: síndrome de liberación de citoquinas; SMI: servicio de medicina intensiva; UMCAR: unidad multidisciplinar.
Con el objetivo de garantizar una asistencia segura y de calidad es altamente recomendable contar con la disponibilidad de camas en los SMI64 o, en su defecto, evitar el retraso del inicio de las medidas de soporte y tratamiento específico necesarios que deben empezar en la sala convencional de hematología a la espera de traslado lo más rápido posible al SMI. Ello da lugar a mejores tasas de supervivencia en estos pacientes62,65,66.
Una vez los pacientes estén ingresados en el SMI, además de seguir las recomendaciones específicas del manejo del ICANS, seguirán estando sometidos al manejo terapéutico habitual de cualquier paciente crítico en fallo multiorgánico, con la colaboración estrecha de hematólogos y neurólogos.
ConclusionesEl aumento de la incidencia de cáncer, y también de su supervivencia, se ha acompañado de la irrupción de nuevas terapias biológicas, algunas de ellas causantes de complicaciones graves y específicas. Estas complicaciones secundarias al uso de terapias biológicas se generan por mecanismos fisiopatológicos poco conocidos. Todo ello hace de estos pacientes un subgrupo especialmente vulnerable. Un equipo experto y multidisciplinar conformado por hematólogos/oncólogos, neurólogos e intensivistas en estrecha colaboración, tanto clínica como de investigación, son la única garantía para una asistencia de excelencia.
Conflicto de interesesNinguno con relación al tema tratado.
Al Dr. Javier Briones Meijide, del Servicio de Hematología Clínica, Hospital de la Santa Creu i Sant Pau, y al Dr. Luís Querol Gutiérrez, del Servicio de Neurología, Hospital de la Santa Creu i Sant Pau.