INTRODUCCIÓN
En la práctica clínica pediátrica existen procedimientos diagnóstico-terapéuticos cuya aplicación, además de dolorosa, suele ser repetitiva, generando en los pacientes ansiedad, miedo y rechazo de los mismos. Su realización en la planta de hospitalización es más traumática, al utilizarse menos analgésicos y/o sedantes. La necesidad de monitorización y la prevención de posibles complicaciones conllevan la ocupación de quirófanos y salas de reanimación para ofrecer una asistencia de calidad.
La unidad de medicina intensiva pediátrica (UMIP) puede aportar su experiencia en sedoanalgesia (SA), y sus medios de monitorización y reanimación durante la realización de estos procedimientos invasivos (PI).
PACIENTES Y MÉTODOS
Durante un período de 3 años (enero 2002 - enero 2005) se recogieron, de forma prospectiva, una serie de variables demográficas y clínicas en los pacientes que ingresaron en la UMIP para realización de PI.
El objetivo de nuestro estudio fue describir nuestra experiencia en la realización de SA para PI electivos en pacientes pediátricos, valorando especialmente la seguridad del procedimiento y el grado de comfort del paciente.
A los pacientes se les realizó una monitorización neurológica, hemodinámica y respiratoria (nivel de conciencia, frecuencia cardíaca, tensión arterial, frecuencia respiratoria y saturación arterial de oxígeno [SaO2]) previa al PI, durante y tras el mismo.
Se registraron datos de filiación, sexo, edad, peso, enfermedad actual, procedimiento, tiempo hasta SA, duración de los PI, tiempo de estancia en la UMIP y complicaciones.
Los fármacos administrados fueron: a) fentanilo (1-2 mcg/kg con una dosis máxima de 100 mcg para la primera dosis y de 50 mcg para las siguientes); b) propofol (1-2 mg/kg con dosis máxima de 100 mg para la primera dosis y de 50 mg para las siguientes); c) si el paciente no disponía de vía central, se añadía lidocaína al 1% al propofol, para evitar el efecto irritativo local sobre las venas periféricas; d) anestésico local o midazolam en dosis de 0,05-0,1 mg/kg si se consideraba oportuno.
El grado de SA se valoró: a) por la escala de Ramsay modificada1,2 (tabla 1) considerando una SA óptima si se conseguía un grado III o IV y b) por el grado de amnesia del PI.
Definiciones
1. Tiempo de inducción: desde la administración de la SA hasta la pérdida de conciencia.
2. Tiempo hasta la SA: desde el inicio de la administración de la SA al inicio del PI.
3. Duración del PI: tiempo de realización de la técnica diagnóstico-terapéutica.
4. Tiempo de recuperación: comprendido entre la finalización del PI y la recuperación de la conciencia.
5. Tiempo de estancia en la UMIP: período que permanece el paciente ingresado en la UMIP.
6. Hipoxemia: desaturación mantenida por debajo de una SaO2 del 93%.
7. Apnea: ausencia de movimientos respiratorios y desaturación por debajo de una SaO2 del 93%, que precisa la apertura de la vía aérea y la ventilación manual con una bolsa-mascarilla.
8. Hipotensión: descenso mayor a un 20% de la presión arterial sistólica basal.
Se solicitó el consentimiento informado a los familiares y se comprobó: a) la ausencia de alergias a los fármacos a administrar; b) el ayuno durante las 8 horas previas al PI y c) el cumplimiento de los criterios de alta (paciente alerta y orientado con constantes vitales estables y acompañamiento hasta su lugar de origen por personal sanitario).
Análisis estadístico
Los resultados de las variables cuantitativas se expresan como media y desviación estándar y se comparan a través de la prueba de la «t» de Student (muestras independientes o pareadas) y las variables cualitativas son expresadas en porcentajes y comparadas a través de la prueba de la ji cuadrado, para un nivel de significación de α = 0,05.
RESULTADOS
Se realizaron 500 SA para 634 PI (tabla 2) en un total de 110 niños (52,8% niños y 47,2% niñas). La edad y peso medio de los mismos fue de 7,01 ± 3,6 años (rango: 1 mes-14 años; mediana: 7 años) y 28,7 ± 12 kg respectivamente. El número medio de SA por paciente fue de 4,64 ± 6,37 (rango: 1-36; mediana: 2). En 131 pacientes (26,2%) se realizó más de un PI durante la SA.
Respecto a la patología previa, el 91,5% de los pacientes presentaba una patología onco-hematológica, el 4,5% fueron otros pacientes oncológicos y el 4% restante se incluyó en el grupo de otras causas (cardiológicas, infecciosas, respiratorias, etc.).
Los PI realizados con mayor frecuencia fueron la punción lumbar y el tratamiento quimioterápico intratecal (48,5%), seguido del aspirado/biopsia de médula ósea (45,7%). El 5,8% restante lo forma un grupo de procedimientos variados: biopsias extramedulares, ecografía transesofágica, fibrobroncoscopia, canalización de vías centrales, etc.
La SA con fentanilo y propofol fue precedida de la administración de midazolam intravenoso en el 12,6% de los casos y de anestesia local en el 19,6% de los mismos.
La dosis media de fentanilo inicial fue de 1,04 ± 0,2 mcg/kg y la de propofol de 1,5 ± 0,34 mg/kg. El 31% de las SA precisó una segunda dosis de fentanilo de 0,8 ± 0,2 mcg/kg y el 74,8% una segunda dosis de propofol de 0,9 ± 0,4 mg/kg. En un 4,4% de las SA fue necesaria una tercera dosis de fentanilo de 0,7 ± 0,3 mcg/kg y en el 29,6% una tercera dosis de propofol de 0,9 ± 0,5 mg/kg. Las dosis medias totales de fentanilo y propofol fueron de 1,33 ± 0,54 mcg/kg y 2,54 ± 1,01 mg/kg respectivamente (tabla 3).
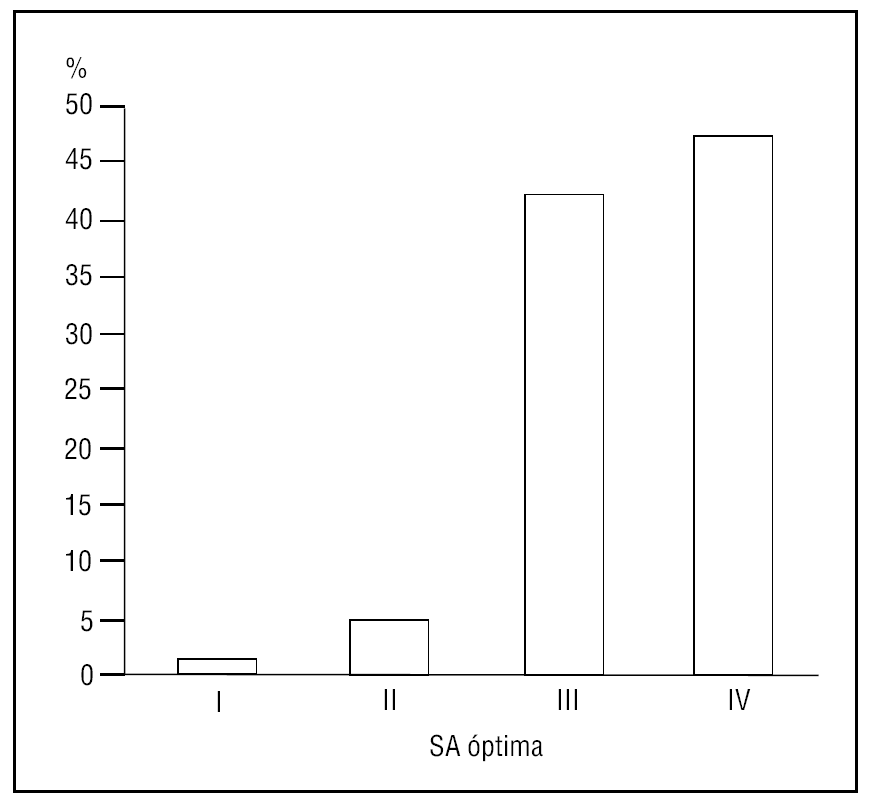
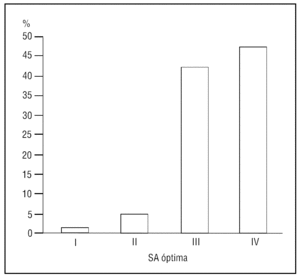
El grado de SA conseguida en el 93,6% de los casos fue superior o igual al grado III (fig. 1), recordando el procedimiento sólo un 3,2% de los pacientes.
Figura 1. Grado de sedoanalgesia (escala de Ramsay modificada). SA: sedoanalgesia.Adaptada de: Ramsay M, et al1 y Hansen J, et al2.
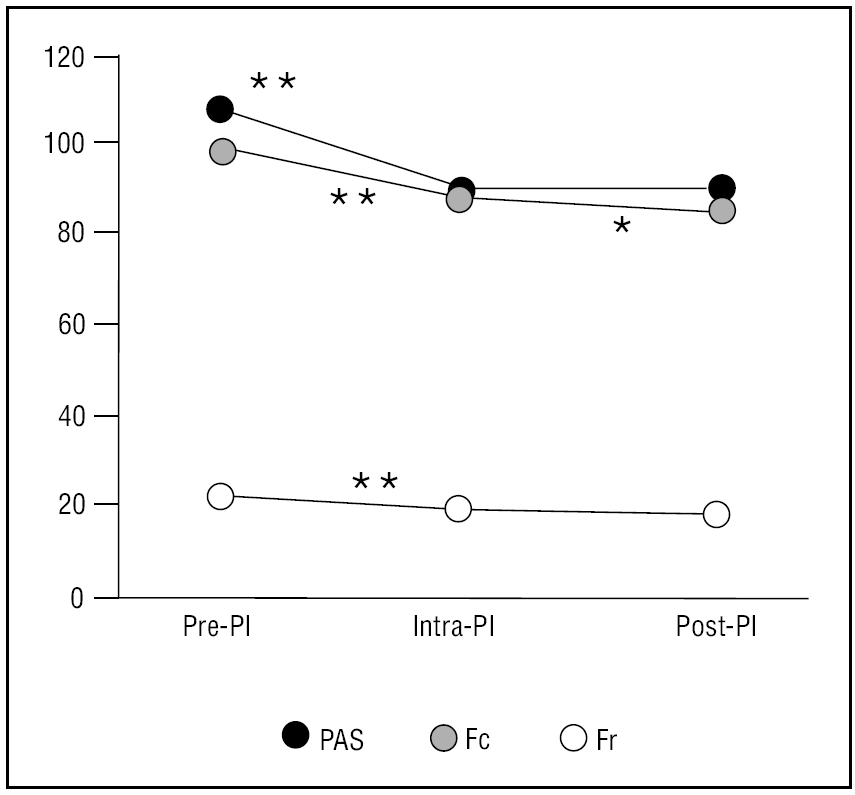
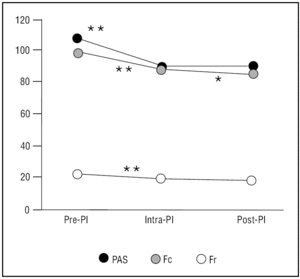
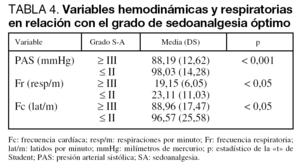
La SA produjo un descenso significativo de los valores basales de la presión arterial sistólica (PAS) (107 ± 13,37 mmHg frente a 88 ± 12,65 mmHg; p < 0,001; intervalo de confianza [IC] al 95%: 18,03 - 20,36), de la frecuencia cardíaca (97,51 ± 21,45 frente a 89,16 ± 17,61; p < 0,001; IC al 95%: 7,05-9,64), y de la frecuencia respiratoria (21,76 ± 7,59 frente a 19,25 ± 6,30; p < 0,01; IC al 95% 1,77-3,24) que se presentan en la figura 2. Igualmente existieron diferencias significativas en la presión arterial, la frecuencia cardíaca y la frecuencia respiratoria entre los pacientes con SA óptima y aquellos con un menor grado de SA (tabla 4).
Figura 2. Evolución de las variables monitorizadas. Fc: frecuencia cardíaca en latidos por minuto; Fr: frecuencia respiratoria en respiraciones por minuto; ns: no significación estadística; PAS: presión arterial sistólica en mmHg; PI: procedimiento invasivo.
Los períodos de tiempo más significativos durante la realización de los PI se muestran en la tabla 5, destacando que el tiempo medio hasta la SA óptima fue de 4,62 ± 3,69 minutos y el tiempo de estancia en la UMIP fue de 41,8 ± 19 minutos. La duración de los procedimientos por término medio fue de 11,47 ± 10,47 minutos.
Treinta y tres pacientes (6,6%) presentaron complicaciones durante la realización de los procedimientos. La más frecuente fue la apnea y desaturación arterial (3,6%), seguida de la hipotensión (2,6%) y la bradicardia (0,4%), resolviéndose las mismas con la apertura de la vía aérea, ventilación manual y/o expansión de volumen.
DISCUSIÓN
El dolor en el niño es frecuentemente infravalorado. Los PI, diagnósticos o terapéuticos, provocan ansiedad y miedo, predisponiéndole negativamente y dificultando la correcta realización de los mismos. Estos PI pueden producir en algunos niños un impacto psicológico más negativo incluso que la propia enfermedad de base, como citan diversos autores3,4 por lo que es prioritaria una correcta SA para conseguir el alivio del dolor y garantizar la realización de la técnica.
En los últimos 15 años se han creado unidades de sedación pediátrica y se ha fomentado la realización de la SA fuera del quirófano por pediatras, oncólogos e intensivistas3,5-9, principalmente, ya que muchos de estos PI (sobre todo en pacientes onco-hematológicos) se realizan de forma repetitiva en períodos de tiempo cortos para: a) valoración de la respuesta al tratamiento quimioterápico o al trasplante de médula ósea; b) diagnóstico de recidivas; c) administración intratecal de quimioterapia o d) canalización de catéteres venosos centrales permanentes.
Siguiendo esta tendencia y debido a los problemas que planteaba la necesidad de utilizar los quirófanos para la monitorización y reanimación de los pacientes durante estas técnicas, en enero de 2001 se empezó a realizar en nuestra UMIP la SA de PI en pacientes onco-hematológicos. Con los resultados preliminares (alrededor de 50 PI) se diseñó un estudio prospectivo descriptivo de la población a la que se asistía, sus características clínicas, los PI realizados y las complicaciones presentadas.
El protocolo se realizó utilizando la combinación de fentanilo y propofol administrados por vía intravenosa, por ser fármacos habitualmente utilizados en la UMIP, por su rapidez de acción (fentanilo: 2-3 minutos; propofol: 15-45 segundos) y rápida reversión de sus efectos (fentanilo: 45-60 minutos propofol 5-10 minutos)3,4,10. Sin embargo, existen múltiples protocolos para realizar la SA de PI en pediatría utilizando asociaciones de ketamina-midazolam, fentanilo-midazolam, midazolam-meperidina, propofol-remifentanilo, propofol solo, etc.11-17. Es más, nuestro protocolo permitió la premedicación con midazolam intravenoso (0,05-0,1 mg/kg [12%] y con anestésico local (19,6%) en casos de pacientes que presentaban irritabilidad, ansiedad o rechazo del PI o bien cuando esto era especialmente traumático. El objetivo final, más que utilizar una asociación u otra de fármacos era conseguir la SA adecuada.
Existen pocos estudios prospectivos de SA pediátrica con un volumen importante de pacientes16,18, por ello consideramos la cifra de 500 SA y 634 PI de nuestro trabajo como significativa, respecto a recientes estudios3,10,15,19 con series menores y principalmente restrospectivos. La corta edad de los pacientes (7 años), así como la reiteración de los PI (4 SA por paciente, con un rango máximo de 36 SA en un paciente) justificarían la protocolización de la SA.
La patología más frecuente fue la onco-hematológica, porque el protocolo surgió a partir de la iniciativa de Hematología; sin embargo, actualmente se utiliza a petición de oncología-radiología (biopsia percutánea), otorrinolaringología-neumología (fibrobroncoscopia), cardiología (ecocardiografía transesofágica, cardioversión eléctrica, pericardiocentesis), pediatría-cirugía (canalización de vías centrales, curas de grandes quemados, administración intratecal de baclofen).
La dosis media de propofol fue de 2,54 mg/kg, utilizando la administración en bolo intravenoso, en comparación con los estudios de Godambe y Wheeler3,15 de 4,25 mg/kg y 4,23 mg/kg respectivamente como dosis media total de los bolos intravenosos y de 8 mg/kg por hora y 10 mg/kg por hora para la perfusión continua. La dosis media del fentanilo fue de 1,33 mcg/kg similar a los 1,3 mcg/kg del estudio de Wheeler3, al igual que la necesidad de un segundo bolo que en nuestro estudio fue de un 31% respecto al 32% del trabajo anteriormente citado.
En los lactantes la valoración de la SA y, sobre todo, el grado de amnesia del PI es más complicado. Los lactantes menores de 1 año representaron menos del 1% de los PI, no incluyéndose en la valoración de la amnesia del PI por la dificultad para comunicarnos con ellos y por su mayor grado de desconfianza en nosotros. A pesar de esto, en la serie global más del 95% de los pacientes no recordaron el PI. En algunos pacientes no se consiguió el grado de SA óptimo (mayor al grado II), por presentar complicaciones (hipotensión, bradicardia, apnea), o porque la situación clínica del paciente no permitía una SA profunda. Este hecho se constata también en los estudios de Vardi et al10 y de Pitetti et al18, en el que el grado de SA adecuado se consiguió en el 97-98% de los casos, aunque el último incluyó a pacientes del área de Urgencias que precisaron PI, con una edad máxima de 21 años, superior a los 14 años de edad máxima de nuestro estudio.
El tiempo medio hasta la SA adecuada fue de 4,6 minutos, con un tiempo de inducción de 2,06 minutos, algo mayor que el referido por otros autores, que oscila entre 1-1,5 minutos10,16; sin embargo, estos autores pautan bolos de propofol entre 2 y 3 mg/kg administrados en 1 minuto, respecto a la dosis media inicial de nuestro trabajo que fue de 1,5 mg/kg. El tiempo de realización de la técnica es variable y no homogéneo según los estudios, ya que depende de los PI incluidos, la laboriosidad de los mismos, la realización de más de un PI durante la misma SA y el protocolo de SA utilizado3,10,16,20. En nuestro trabajo primaron los procedimientos onco-hematológicos, con un tiempo medio para la realización de la técnica de 11,47 minutos, realizándose más de un PI durante la SA en un 26% de los casos.
El tiempo de recuperación de los pacientes fue de aproximadamente 22 minutos, superior a los 11 minutos citados en el trabajo de Evan et al14, en el que utilizó solamente ketamina. El tiempo de recuperación referido en nuestro trabajo fue muy similar a los publicados por otros autores como Pershad et al15, Vardi et al10 y Hertzog et al16 que lo sitúan entre los 23 y 27 minutos. Sin embargo, el tiempo de estancia en la unidad de medicina intensiva (41 minutos) fue menor respecto a los dos últimos estudios referidos (69 y 80 minutos respectivamente)10,16 y al estudio retrospectivo de Wheeler el al3, que fue de 108 minutos. Tal vez este hecho se deba a la menor dosis SA y a la no utilización de la perfusión continua de profofol en los pacientes de nuestro estudio.
También se evaluó la repercusión de la correcta SA sobre los parámetros cardiorrespiratorios. Se observó que la SA óptima se asocia a valores significativamente menores en la frecuencia cardíaca y respiratoria y en la presión arterial, sin repercusión clínica. Así mismo, existieron diferencias significativas entre los valores basales de estas variables y los registrados durante la realización de los PI; sin embargo, estas diferencias no tuvieron significación clínica.
La efectividad del protocolo se constata al ver que la mayoría de los pacientes tuvieron un grado de SA óptimo y no recordaban el PI, hechos estos de capital importancia en los pacientes pediátricos. Éstos, al no recordar el PI, tienen una mayor confianza y una mejor predisposición a los siguientes PI, no considerándolos como una experiencia traumática.
La incidencia de complicaciones varía, según los estudios, entre un 2 y un 9% para las desaturaciones arteriales y apneas3,9,15,16, un 3-31% para los episodios de hipotensión/bradicardia3,16 y un amplio rango para otras complicaciones (agitación, convulsiones-mioclonías, nistagmo, vómitos, hipertensión arterial, rash cutáneo, etc.)9,11,14,21. En nuestro trabajo, las complicaciones más destacables (hipotensión, bradicardia y apnea) presentaron una incidencia de un 6,5%, siendo rápidamente diagnosticadas y tratadas con medidas de reanimación básicas (apertura de vía aérea, ventilación, expansión). Este hecho refleja la seguridad del protocolo de SA para PI en los pacientes pediátricos, que se une a la efectividad del mismo anteriormente expuesta.
En este punto podríamos citar la controversia en el uso del propofol en niños en relación al «síndrome de infusión del propofol» caracterizado por acidosis láctica, hiperlipemia, convulsiones, bradiarritmias, parada cardiorrespiratoria y, en los casos extremos, fallecimiento de los pacientes3,10,11,22-24. Sin embargo, la experiencia a nivel pediátrico considera al propofol como agente ideal para la sedación de corta duración por su seguridad y efectividad respecto a otros fármacos3,10,16, siempre que la SA se realice en condiciones adecuadas de monitorización y reanimación, evitando la infusión continua prolongada, sobre todo en menores de 3 años24.
Por último, destacar que la protocolización de la SA se puede incluir en la tendencia actual de las unidades de medicina intensiva para optimizar los recursos hospitalarios y ampliar la cartera de servicios de las mismas. En nuestra UMIP, además de la SA, se colabora en la canalización de vías centrales de enfermos de hospitalización, colocación de sondas transpilóricas, evaluación de respuesta a la administración intratecal de baclofeno y se plantea en un futuro próximo la monitorización tras estimulación alergénica (pruebas de hipersenbilidad).
Como resumen del trabajo consideramos que nuestro protocolo de SA para PI proporciona a los pacientes pediátricos: a) el alivio del dolor y la ansiedad del PI; b) una mejor tolerancia de la exploración; c) seguridad ante las posibles complicaciones y d) un adecuado grado de amnesia del PI.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dr. J.M. López Álvarez.
C/ Francisco Gourié, 28, 5.º E.
35002 Las Palmas. Gran Canaria.
Correo electrónico: jmloal@hotmail.com
Manuscrito aceptado el 8-II-2007.