La esclerosis múltiple (EM) es una enfermedad inflamatoria desmielinizante crónica del sistema nervioso central que afecta a adultos jóvenes1. El desarrollo de edema pulmonar y disfunción miocárdica tras un brote de EM es una entidad rara en la que el sistema simpático desempeña un papel fundamental2,3. Presentamos un caso de una mujer que ingresa en UCI por insuficiencia respiratoria por edema pulmonar y shock cardiogénico tras brote de EM.
Mujer de 34 años, diagnosticada hace once años de síndrome desmielinizante aislado al presentar alteraciones sensitivas y en la resonancia magnética (IRM) cerebral y de médula cervical lesiones desmielinizantes (periventriculares, yuxtacorticales, cerebelo derecho y C2-C4). Tras ciclo de corticoides experimentó mejoría clínica; y desde entonces está asintomática.
Consultó por cefalea brusca que interfiere en el descanso nocturno. Las tres semanas previas presentó vértigo, inestabilidad de la marcha, parestesias faciales y síntomas autonómicos. De forma aguda presentó disnea con insuficiencia respiratoria hipoxémica e inestabilidad hemodinámica. En la auscultación pulmonar presentaba crepitantes húmedos bilaterales. Desde el punto de vista neurológico, se mostraba bradipsíquica y bradilálica, nistagmo horizonto-rotatorio con movimientos sacádicos oculares, parálisis e hiperestesia facial izquierda, reflejos osteotendinosos vivos y simétricos y reflejo cutaneoplantar de extensor izquierdo.
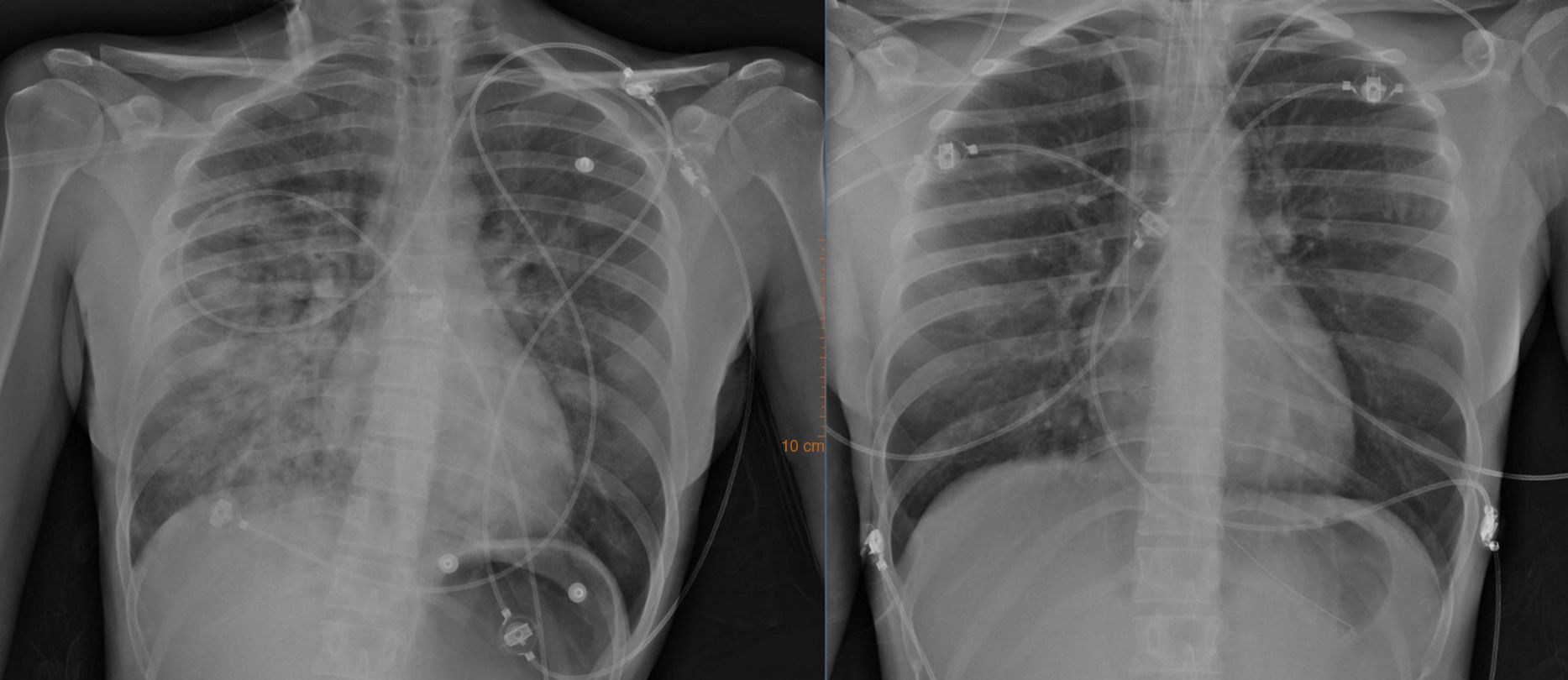
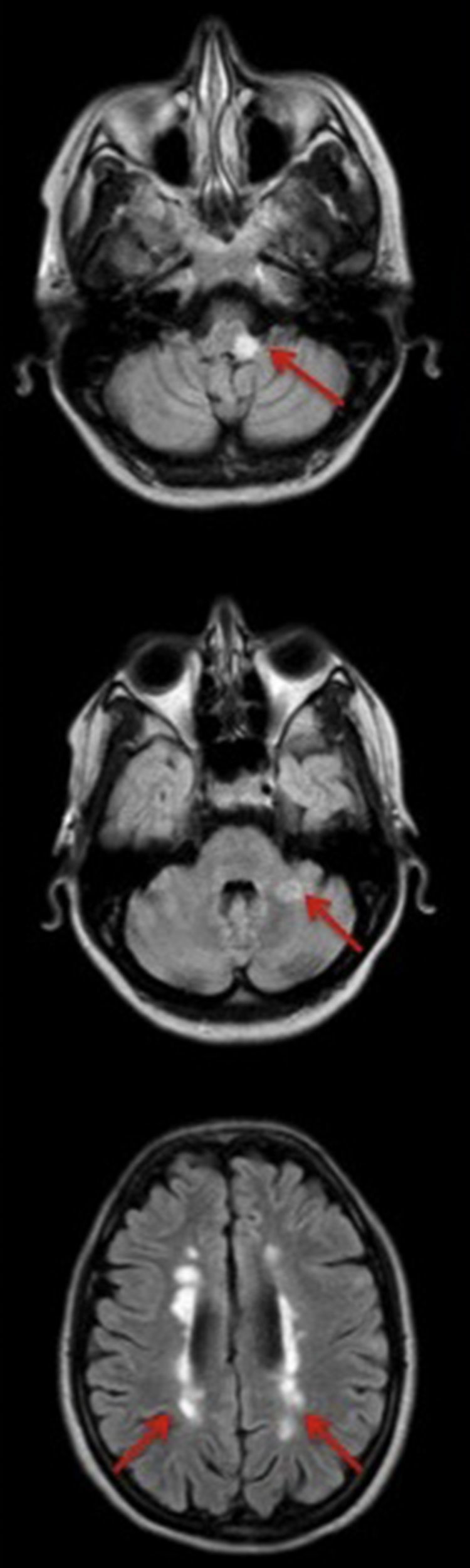
Las pruebas de laboratorio mostraron leucocitosis con neutrofilia, aumento de proteína C reactiva (24mg/dl) y elevación troponina T (322ng/L; normal: 0-14ng/L). La radiografía de tórax reveló un infiltrado pulmonar bilateral asimétrico, más llamativo en hemitórax derecho (fig. 1, izquierda). En el electrocardiograma presentaba taquicardia sinusal con descenso del segmento ST en cara inferior y anterolateral. La tomografía computarizada de cráneo mostró atrofia frontal y el estudio bioquímico y microbiológico del líquido cefalorraquídeo fueron normales. Finalmente, se trasladó a UCI y se procedió a intubación orotraqueal con inicio de ventilación mecánica, soporte inotrópico y monitorización hemodinámica. La ecocardiografía transtorácica mostró una disfunción severa del ventrículo izquierdo con hipocontractilidad global y fracción de eyección del 15%. La ventriculografía confirmó los hallazgos ecocardiográficos. Serología, marcadores de autoinmunidad y estudio de hipercoagulabilidad fueron normales. La IRM cerebral y de médula cervical mostraron lesiones hipointensas en T1 e hiperintensas en TR largo en situación postero-lateral izquierda de protuberancia-bulbo, pedúnculo cerebeloso izquierdo y periventriculares bilaterales que realzaban con gadolinio, compatibles con lesiones desmielinizantes agudas (fig. 2). Al tratarse del segundo brote clínico y presentar más de dos lesiones diseminadas en espacio y tiempo se confirmó el diagnóstico de EM (criterios de McDonald). Se inició tratamiento con pulsos de corticoides (metilprednisolona 500mg/24h, 3 días por vía intravenosa) y posteriormente por vía oral en pauta descendente con remisión del cuadro neurológico. A las 36 horas se suspendieron fármacos inotrópicos y se extubó. A las 48 horas, la radiografía de tórax era normal (fig. 1 derecha) y una ecocardiografía de control reveló una mejoría de la función sistólica y la fracción de eyección, con recuperación completa al décimo día. Un mes más tarde fue dada de alta.
Se han reportado varios casos de shock cardiogénico por disfunción ventricular severa en EM, la mayoría tras un brote, aunque también se han dado casos fuera de este1. De cualquier modo, es una complicación inusual de la EM1,2,4. También se han dado casos de disfunción ventricular tras tratamiento con mitoxantrona que induce la formación de quelantes de hierro que promueven la producción de intermedios reactivos de oxígeno que dañan el tejido miocárdico5.
Varios investigadores han estudiado la relación entre EM y disfunción ventricular izquierda, proponiendo varias teorías al respecto. A día de hoy se desconoce el mecanismo fisiopatológico responsable. La primera hipótesis es la etiología autoinmune, habiéndose demostrado en animales que determinadas infecciones virales podrían inducir autoinmunidad con desarrollo de miocarditis y deterioro de la función miocárdica en EM1,2. Una segunda hipótesis, apoyada por Beer et al. se basa en una reducción en los fosfatos cardíacos de alta energía en pacientes con EM comparado con voluntarios sanos3. La tercera hipótesis afirma que el deterioro de la función ventricular en pacientes con mayor deterioro neurológico podría estar relacionado con la disfunción autonómica4. En este sentido, Zieber et al. describieron una disminución de la fracción de eyección del ventrículo izquierdo por ecocardiografía en pacientes con mayor deterioro neurológico5,6. No obstante, faltan evidencias que apoyen cualquiera de estas teorías y son necesarios más estudios para establecer el mecanismo subyacente1,4.
En nuestro caso, la localización en la IRM cerebral de una placa desmielinizante en protuberancia-bulbo, cerca del núcleo del tracto solitario y otros núcleos nerviosos implicados en el control autonómico, podría explicar la disfunción autonómica aguda responsable de la descarga catecolaminérgica que precipitó el cuadro clínico. El exceso de catecolaminas puede producir disfunción ventricular aguda y reversible por tres mecanismos: vasoespasmo multivaso, disfunción microvascular y daño directo de las catecolaminas a nivel miocárdico, como ocurre en el feocromocitoma7. La otra peculiaridad del caso es el infiltrado pulmonar asimétrico que corresponde a edema pulmonar neurogénico (EPN) una entidad bien documentada producida por un insulto neurológico agudo y debida a la vasoconstricción no uniforme del lecho capilar pulmonar2.
La asociación de disfunción ventricular izquierda y EPN raramente se ha descrito tras un brote de EM, sobre todo simultáneamente. Uriel et al. describieron un caso de disfunción ventricular, sin EPN, en una mujer de 21 años con EM1. Makaryus et al. reportaron un caso de EPN y disfunción ventricular en una mujer de 31 años tras brote de EM pero sin lesiones desmielinizantes a nivel de protuberancia-bulbo2. Padley et al. comunicaron un caso similar en un varón que presentaba en la RM craneal lesiones desmielinizantes y una gran placa bulbar8. Simon et al. presentaron un caso de EPN recidivante en un paciente diagnosticado de EM que presentaba una nueva lesión bulbar9. Gentiloni et al. comunicaron un caso similar al descrito en el que el EPN fue el síntoma de comienzo de un primer brote desmielinizante10.
En conclusión, se presenta una entidad poco frecuente en el espectro clínico de la EM en la que se aportan evidencias clínico-radiológicas firmes de la relación de causalidad directa entre la lesión neurológica aguda y las manifestaciones cardiopulmonares.
FinanciaciónEl artículo no tiene ningún tipo de soporte financiero.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.