INTRODUCCION
La neumonía asociada con ventilación mecánica (NAV) es una de las principales complicaciones infecciosas que se diagnostican en los pacientes ingresados en servicios de medicina intensiva (UCI). Tradicionalmente, esta complicación se ha asociado con una importante morbilidad y mortalidad, motivo por el que, en los últimos años, han sido numerosos los estudios realizados para conocer mejor su epidemiología, fisiopatogenia, etiología y factores pronóstico, así como para valorar distintas medidas profilácticas y/o estrategias terapéuticas.
El diagnóstico de la NAV puede ser difícil y la identificación de los agentes etiológicos mediante diferentes procedimientos continúa siendo un aspecto extraordinariamente controvertido. La ausencia de una metodología universalmente aceptada, la carencia de un patrón de referencia inequívoco con el que comparar los resultados y la variabilidad de las técnicas utilizadas para obtener muestras respiratorias han motivado la publicación de cientos de artículos sobre este tema en los últimos veinte años. A pesar de todo ello, persisten lagunas importantes en el manejo de estas técnicas diagnósticas y las bases científicas de algunas de las recomendaciones sugeridas no han sido nunca establecidas adecuadamente.
Con intención de superar estas limitaciones distintas sociedades científicas han propuesto criterios diagnósticos, basados en la realización de procedimientos invasivos, que son difíciles de aplicar de forma rutinaria en la mayoría de UCI1,2. Un estudio epidemiológico realizado en nuestro país (ENVIN-UCI), que estudia de forma periódica las NAV, ha demostrado que sólo en una tercera parte de estas infecciones se han utilizado técnicas invasivas para la obtención de muestras respiratorias3, a pesar de las recomendaciones realizadas por diferentes sociedades científicas españolas4,5. Asimismo, y una vez conocidos los resultados de las diversas exploraciones y la evolución al tratamiento continúa existiendo una gran diversidad en los criterios que se utilizan para la clasificación definitiva de NAV.
El Área de Trabajo de Tuberculosis e Infecciones Respiratorias de la Sociedad Española de Patología del Aparato Respiratorio (SEPAR), el Grupo de Estudio de Infección Hospitalaria de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y el Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) han elaborado unas recomendaciones para homogeneizar los criterios de sospecha de las NAV, las técnicas para la obtención de muestras respiratorias, así como los procesamientos microbiológicos y los criterios de diagnóstico definitivo, en el marco de los pacientes ventilados en las UCI multidisciplinarias o de especialidad (quemados, neumológicas, quirúrgicas) de nuestro país. El objetivo de dichas recomendaciones ha sido definir unos criterios mínimos, basados en evidencias científicas y en la opinión de expertos, de fácil aplicación para la mayoría de médicos que atienden a pacientes críticos con ventilación mecánica en nuestro país.
Se debe resaltar, no obstante, que el contenido de este documento debe ser considerado como recomendaciones realizadas por expertos de dichas sociedades científicas, y que no son el resultado de "reuniones de consenso", organizadas por las sociedades a las que pertenecen. Estas recomendaciones están abiertas a aportaciones constructivas de diferentes profesionales, que permitirán su perfeccionamiento en el tiempo.
METODOLOGIA
Se ha formado un equipo de trabajo (task force) formado por expertos en patología infecciosa del paciente crítico pertenecientes a las tres sociedades científicas promotoras del proyecto. Se han incluido los siguientes cinco temas relacionados con el manejo diagnóstico de las NAV: a) criterios clínicos y radiológicos de sospecha; b) metodología de obtención de muestras respiratorias; c) metodología para el procesamiento de las muestras respiratorias en el servicio de microbiología; d) puntos de corte con valor diagnóstico para cada muestra, y e) criterios definitivos de NAV.
A partir de una propuesta inicial, basada en una revisión de la bibliografía, se han elaborado diversos borradores que fueron mejorados después de su debate por los miembros de la task force hasta llegar al documento final. En este proceso, cuando ha sido necesario, se ha solicitado asesoramiento de otras personas expertas. El criterio general ha sido la elaboración de unas normas de mínimos, en cada uno de los apartados, que permitan su utilización de forma rutinaria por todos los profesionales que atienden a pacientes con ventilación mecánica, al margen del nivel asistencial del hospital en que realizan su trabajo. Este documento incluye el grado de acuerdo de los participantes en la reunión final en cada una de la recomendaciones, aunque en algunas de ellas se abstuvieron aquellos que carecían de experiencia personal.
Las recomendaciones, que se proponen a continuación, se han clasificado, atendiendo a criterios de calidad de la evidencia6, en los siguientes niveles:
1. Recomendaciones basadas de forma directa en evidencias científicas.
2. Recomendaciones basadas en evidencias científicas complementadas con opiniones de expertos.
3. Recomendaciones sólo basadas en opiniones de expertos.
4. No existen evidencias científicas ni opinión de expertos.
Estas recomendaciones no hacen referencia a niños, dado que la población pediátrica tiene características específicas que requieren su discusión en un documento independiente.
CRITERIOS DE SOSPECHA CLINICA Y RADIOLOGICA
De forma tradicional los criterios de sospecha de NAV se han basado en la combinación de signos clínicos y radiológicos. Los criterios clínicos que se han utilizado de forma preferente incluyen la combinación de fiebre, leucocitosis, estertores crepitantes y expectoración purulenta. En los últimos años se han presentado evidencias que demuestran la escasa sensibilidad y especificidad de los criterios clínicos en el diagnóstico de NAV7-14, aunque los estudios realizados difieren metodológicamente entre ellos. Ninguno de estos signos por separado (sensibilidad 98-100%, especificidad 3,4-20%) ni la combinación de todos ellos (sensibilidad 20-25%, especificidad 80-95%) permite asegurar un diagnóstico de NAV. Sin embargo, aunque la presencia de expectoración purulenta en los pacientes ventilados puede ser debida a causas diferentes a la neumonía, la ausencia de este signo clínico hace muy improbable la existencia de una neumonía.
Los datos de sospecha de NAV basados en la radiología fueron definidos por el Center Diseases Control (CDC) como la presencia de nuevos y permanentes infiltrados radiológicos o progresión de infiltrados previos15. En los pacientes críticos los infiltrados radiológicos pueden estar originados por otras causas, infecciosas o no, en especial atelectasias, edema de pulmón, derrame pleural, síndrome de distrés respiratorio del adulto, hemorragia alveolar o infartos pulmonares16. En otros pacientes existen signos clínicos de neumonía y no hay evidencia de infiltrados pulmonares. Ello es posible por la presencia de bronquiolitis purulenta (que se acompaña de elevados recuentos de colonias de bacterias y que precede a la aparición de la neumonía radiológica)17, o por la baja calidad de las radiografías anteroposteriores realizadas con aparatos portátiles (se ha demostrado que un 26% de las opacidades alveolares indentificadas en los campos inferiores, mediante tomografía computarizada, no se veían en las radiografías de tórax)18.
Cuando se comparan las imágenes radiológicas con hallazgos histológicos19,20 o con resultados de exploraciones broncoscópicas21,22 en pacientes con NAV se observa una sensibilidad del 58-83% para el broncograma aéreo y del 50-78% para la aparición de un nuevo infiltrado o el empeoramiento de uno previo. Debe tenerse en cuenta, asimismo, la subjetividad de los informes radiológicos que pueden variar significativamente entre dos o más observadores7.
Se proponen como criterios de sospecha clínica de NAV: la presencia de dos de tres criterios mayores (fiebre, secreciones purulentas, infiltrado pulmonar) y uno de los criterios menores (leucocitosis, leucopenia, hipoxemia, leucocitos inmaduros, aumento de las necesidades de oxígeno, inestabilidad hemodinámica) (tabla 1). El interés y novedad de esta propuesta se basa en aceptar la sospecha de NAV y el inicio de la metodología necesaria para lograr un diagnóstico etiológico de certeza, en pacientes sin evidencia de infiltrados radiológicos. (grado de evidencia III; acuerdo entre los expertos, 21 de 22 [95,4%]).
METODOLOGIA DE OBTENCION DE MUESTRAS RESPIRATORIAS
Métodos no invasivos
Aspirados traqueales. Es el método más sencillo de obtener secreciones respiratorias en el paciente ventilado, aunque la técnica no está sistematizada. No se necesita personal especializado y sólo se precisa un colector de esputo para recoger la muestra. La única complicación de este método es la desaturación de O2 que puede aparecer durante la aspiración de secreciones a través del tubo endotraqueal.
Los cultivos cualitativos del aspirado traqueal (AT) tienen una alta sensibilidad, ya que suelen identificar los organismos que se recuperan mediante técnicas invasivas, pero su valor predictivo positivo es sólo moderado.
Los cultivos cuantitativos tienen unos márgenes de sensibilidad y especificidad muy amplios, oscilando entre un 38 y un 100%, y un 14 y 100%, respectivamente, de acuerdo a 6 estudios con un total de 284 episodios analizados23-28. Los valores más bajos de sensibilidad se han obtenido en un estudio con un punto de corte en >105 ufc/ml24 y los valores más bajos de especificidad se han obtenido cuando se compara con resultados de necropsias25,26.
Recientemente, se ha analizado de forma comparativa el impacto, en la evolución de pacientes con NAV, de la utilización de aspirados traqueales para obtener muestras respiratorias. Los resultados no son concordantes y han variado según la utilización o no de procedimientos cuantitativos en el análisis microbiológico de las muestras respiratorias29,30.
Métodos invasivos con técnicas broncoscópicas
Cepillado bronquial mediante catéter telescopado. Se trata de un procedimiento sencillo pero delicado y es imprescindible su correcta ejecución para poder interpretar adecuadamente los resultados. La realización de la técnica se describe en la tabla 2.
La sensibilidad de la técnica en el diagnóstico de la NAV oscila, según los resultados de 18 estudios9,10,13,14,23,25,31-42 que incluyen 929 pacientes, entre un 33 y un 100%, con una media del 67 (20)%. La especificidad varía entre un 50 y un 100%, con una media del 90 (14)%. En general, se admite que la probabilidad de que un resultado positivo demuestre la existencia de una neumonía es muy alta, con una razón de probabilidad media de 6,7.
El procedimiento es seguro y rápido y la mayor parte de las complicaciones están relacionadas con el uso del fibrobroncoscopio (FB). No obstante, se pueden producir hemorragias bronquiales, especialmente en pacientes con alteraciones de la coagulación.
Lavado broncoalveolar (LBA). Permite recoger material alveolar mediante la instilación y aspiración secuencial de varias alícuotas de suero salino estéril a través del FB enclavado en la vía aérea del segmento pulmonar radiológicamente afectado. El procedimiento no está estandarizado y la cantidad de líquido que se debe instilar no está establecida, pero se considera que no debe ser inferior a 60 ml si se quieren recoger secreciones pulmonares periféricas. Existen otros métodos para realizar LBA mediante la utilización de catéteres protegidos para evitar la contaminación que puede suponer aspirar el líquido a través del canal hueco del FB. La utilización de estos dispositivos adicionales encarece significativamente el procedimiento. El volumen aspirado tras la instilación de la primera alícuota suele ser escaso y habitualmente contiene células escamosas y ciliadas en número significativo, por lo que debe rechazarse para un estudio microbiológico.
La sensibilidad del LBA varía según los estudios entre el 42 y el 93%, con una media del 73 (18)%. En cuanto a la especificidad, ésta oscila entre el 45 y el 100%, con una media del 82 (19)%, calculada sobre 957 pacientes incluidos en 23 estudios9,14,23-26,32,38,43-57. La razón de probabilidad media de un resultado positivo es de 4.
En general, el LBA es bien tolerado. Los efectos adversos más frecuentemente observados están en relación con el intercambio de gases. Las alteraciones en la oxigenación arterial no suelen aparecer de forma inmediata y pueden transcurrir varias horas hasta la recuperación total.
Organismos intracelulares. La investigación de microorganismos intracelulares (OIC) puede ser un método útil y rápido de establecer el diagnóstico de NAV. Además, la presencia de OIC puede ser de gran ayuda a la hora de seleccionar el régimen antibiótico inicial. Los umbrales diagnósticos empleados han oscilado entre un 2 y un 25%. Sin embargo, en general se acepta que la presencia de un 5% o más de OIC en la tinción directa del espécimen de LBA es altamente sugestivo de la existencia de neumonía. La sensibilidad oscila entre un 37 y un 100%, con una media del 69 (20)%. La especificidad varía entre el 89 y el 100%, con una media del 98 (15)%25,32,38,47,52,53. La razón de probabilidad de un resultado positivo es de 35.
Técnicas ciegas. Las técnicas ciegas o no broncoscópicas son menos invasivas, y no precisan de personal entrenado, lo que las convierte en procedimientos más baratos, con menor probabilidad de contaminación porque no han de pasar por el canal hueco del FB, y de menor riesgo. Además, pueden emplearse en pacientes intubados con tubos de pequeño calibre. Están indicadas en los enfermos en los que la realización de la broncoscopia no es posible ya sea por no disponer de la técnica o por la presencia de contraindicaciones. Su principal limitación es la imposibilidad de seleccionar el segmento pulmonar afectado radiológicamente, lo cual es especialmente importante cuando los infiltrados radiológicos están localizados en los lóbulos superiores o en el pulmón izquierdo.
Existen tres métodos ciegos diferentes:
1. Aspirado bro nquial ciego (ABC). Para recoger muestras bronquiales se han empleado cuatro tipos de catéteres diferentes. Cualquiera que sea el tipo que se utilice, el procedimiento consiste en enclavar el catéter en un bronquio distal y aspirar, al menos, 1-2 ml de secreciones bronquiales sin instilar suero u otra solución estéril. La sensibilidad del ABC varía según los estudios entre el 74 y el 97%, con una media del 84,6 (8,8)%. En cuanto a la especificidad oscila entre el 74 y el 100%, con una media calculada sobre 251 episodios procedentes de 5 estudios del 90,8 (12,7)%9,58-61. La razón de probabilidad media de un resultado positivo es de 9.
2. Minilavado broncoalveolar (mini-LBA). Para realizar este procedimiento se han empleado diferentes catéteres, como catéteres telescopados protegidos (CombicathE), catéteres Swan-GanzE, otros catéteres no protegidos o, más recientemente, catéteres que pueden dirigirse a uno u otro pulmón según donde esté ubicado el infiltrado radiológico (catéter de Ballard). La cantidad de líquido instilado tampoco está estandarizada y varía entre 20 y 150 ml. La sensibilidad de la técnica en el diagnóstico de la NAV oscila, según los resultados de 7 estudios que incluyen 280 pacientes, entre el 63 y el 100%, con una media del 79,7 (12,4)%. La especificidad varía entre el 66 y el 96%, con una media del 82 (12,7)%9,46,62-66. La razón de probabilidad media de un resultado positivo es de 4,4.
3. Catéter telescopado no broncoscópico. La mayor parte de los estudios emplean un catéter telescopado estándar, aunque también se ha empleado un dispositivo especial (AccucathE) que presenta un balón en su extremo distal para evitar la contaminación proximal. En su conjunto la sensibilidad del catéter telescopado ciego oscila entre un 58 y un 86%, con una media del 72,8 (10)%. Su especificidad varía de un 71,4 a un 100%, con una media calculada sobre 147 episodios procedentes de 5 estudios del 86,6 (10,5)%35,50,61,67,68. La razón de probabilidad media de un resultado positivo es de 5,4.
En general, estas técnicas ciegas han presentado resultados similares a las técnicas broncoscópicas, con niveles de concordancia, cuando se comparan con el cepillado bronquial con catéter telescopado realizado con FB, que oscilan entre un 73 y un 100%. Los niveles más altos de concordancia se obtienen en las afecciones bilaterales difusas y cuando la afección radiológica está ubicada preferentemente en los lóbulos inferiores.
Aunque no están claramente descritas, las complicaciones de las técnicas ciegas son semejantes a los procedimientos guiados, salvo las directamente implicadas con el uso del endoscopio. Se han descrito casos aislados de hemorragia leve y neumotórax.
Las recomendaciones para la obtención de muestras respiratorias son las siguientes:
1. La utilización de aspirados traqueales cualitativos no debe ser una técnica rutinaria en el diagnóstico de la NAV. Dada su sencillez y bajo coste, sólo estaría justificado su empleo en unidades con imposibilidad de realizar otras técnicas diagnósticas (grado de evidencia I; acuerdo entre los expertos, 21 de 22 [95,4%]).
2. Dado que no está establecida de forma inequívoca la superioridad de alguna de las diferentes técnicas cuantitativas, invasivas (CTT, LBA) o no invasivas (BAS), ciegas o no ciegas, el método diagnóstico a utilizar dependerá de la situación del paciente, las preferencias y experiencia del médico, y las posibilidades de que se disponga (grado de evidencia II; acuerdo entre los expertos, 21 de 21 [100%]).
3. Si se opta por la realización de técnicas invasivas, en el caso de infiltrados localizados la técnica de elección es el CTT, y en el caso de infiltrados difusos y/o sospecha de patógenos oportunistas la técnica de elección es el LBA (grado de evidencia II; acuerdo entre los expertos, 22 de 22 [100%]).
4. La detección de OIC debe realizarse en todos los casos en que se obtengan muestras por LBA (grado de evidencia II; acuerdo entre los expertos, 19 de 19 [100%]).
Parámetros ventilatorios durante la realización de broncofibroscopias para la obtención de muestras respiratorias. Se pueden establecer las siguientes recomendaciones:
1. El calibre del tubo endotraqueal debe ser, al menos, 1,5 mm mayor que el diámetro externo del fibrobroncoscopio (FB) con objeto de asegurar una adecuada ventilación y evitar daños en el endoscopio. Se considera que en torno a los 40 mm2 es la mínima área de la vía aérea que debe permanecer libre una vez colocado el FB, por lo que si se utiliza un endoscopio estándar de 5 mm de diámetro externo se recomienda que el tubo traqueal tenga, al menos, 8 mm de diámetro interno (grado de evidencia III; acuerdo entre los expertos, 18 de 18 [100%]).
2. El paciente debe ser sedado (midazolam, 0,1-0,2 mg/kg, o propofol, 1,5 mg/kg) y tratado con relajantes musculares de acción corta (atracurium, 0,8 mg/kg) con objeto de reducir el riesgo de barotrauma y evitar la tos durante el procedimiento (grado de evidencia III; acuerdo entre los expertos, 19 de 19 [100%]).
3. Antes de iniciar la exploración, el paciente debe ventilarse con los siguientes parámetros: ventilación controlada, FiO2 1, y flujo inspiratorio máximo inferior a 60 l/min. La alarma de presión debe situarse a un nivel inferior a 60 cmH2O pero permitiendo una ventilación adecuada, y debe retirarse la PEEP. Se colocará un adaptador al extremo proximal del tubo traqueal de tal forma que permita la introducción del FB evitando fugas aéreas. Se debe monitorizar el volumen corriente mediante el control continuo del volumen corriente espiratorio y se calcula la auto-PEEP. El objetivo es mantener volúmenes espiratorios similares a los que se tenían antes de introducir el FB y evitar niveles excesivos de auto-PEEP (grado de evidencia III; acuerdo entre los expertos, 18 de 19 [94,7%]).
Selección de la zona a explorar con las técnicas fibroscópicas. Establecemos las recomendaciones siguientes:
1. La zona pulmonar de la que se van a obtener las muestras se selecciona en función de la localización del infiltrado radiológico y/o por visualización directa de un subsegmento del que proceden las secreciones purulentas. En los casos en los que no se cumpla ninguno de los criterios anteriores las muestras se obtendrán del lóbulo inferior derecho (grado de evidencia III; acuerdo entre los expertos, 21 de 21 [100%]).
Técnicas diagnósticas en caso de mala respuesta al tratamiento inicial. Si el paciente no tiene una adecuada respuesta al tratamiento por persistencia o aumento de fiebre, leucocitosis, insuficiencia respiratoria o aumento de los infiltrados radiológicos se puede realizar una segunda toma de muestras respiratorias, a través del FB. Se ha sugerido que la toma de muestras seriadas con el catéter telescopado broncoscópico puede proporcionar una explicación microbiológica a la falta de respuesta clínica al tratamiento antibiótico pautado mediante la identificación de organismos no cubiertos. Sin embargo, la influencia que esta información pueda tener sobre la supervivencia es todavía incierta.
En el caso de persistir una mala evolución clínica, en ausencia de un diagnóstico etiológico de seguridad se puede proceder a la obtención de muestras de tejido pulmonar mediante biopsia con minitoracotomía.
En caso de mala respuesta clínica, antes de cualquier cambio antibiótico y revaluados otros posibles focos de infección (TC toracoabdominal y senos) o causas que justificaran una falta de respuesta al tratamiento (empiema, etc.), se procederá a una nueva toma de muestras, utilizando técnicas endoscópicas (grado de evidencia III; acuerdo entre los expertos, 22 de 22 [100%]).
METODOLOGIA PARA EL PROCESAMIENTO DE LAS MUESTRAS RESPIRATORIAS EN EL SERVICIO DE MICROBIOLOGIA
Se describen las diferentes fases del proceso de análisis de una muestra respiratoria:
1. Toma de muestras. Se debe evitar la contaminación de las muestras durante la fase de recogida. En todos los casos se realizará en condiciones de esterilidad por parte del personal que realiza la técnica y del material que se utiliza. Las muestras deben ser representativas del lugar de la infección por lo que se utilizarán preferentemente aquellas técnicas que permitan obtener muestras de calidad. Cuando la muestra respiratoria es escasa, en el caso de aspirados traqueales, puede utilizarse una solución salina para fluidificar las secreciones. En los casos en los que se obtengan muestras con varias técnicas se realizará, en primer lugar, el aspirado traqueal, en segundo lugar el cepillado bronquial con catéter telescopado y, finalmente, el lavado alveolar. Una vez tomadas, las muestras serán identificadas en los medios de transporte y en los impresos del laboratorio, especificando el método que se ha seguido para su obtención. Las muestras potencialmente peligrosas deberán ser adecuadamente identificadas.
2. Transporte de muestras. El transporte al laboratorio de microbiología debe realizarse de forma rápida, y no debe demorarse la llegada de la muestra respiratoria en más de una hora. En los casos en que no sea posible deben guardarse a temperatura inferior a 4 °C. Para las muestras obtenidas mediante aspirado traqueal y LBA se utilizarán contenedores estériles de boca ancha y tapón de rosca. Para las muestras obtenidas por CTT o biopsias pulmonares se utilizarán tubos estériles con 1 ml de solución fisiológica.
3. Calidad de las muestras. La mayoría de los artículos de la bibliografía no proporcionan información sobre la calidad de las muestras que obtienen. El primer paso del procesamiento consiste en evaluar la posible contaminación con bacterias del tracto respiratorio superior. Para las muestras obtenidas mediante aspiración traqueal se utilizan los criterios de Murray/Washington (tabla 3), no debiéndose procesar aquellas muestras con nivel de calidad 0 o 1. Para las muestras respiratorias broncoscópicas o ciegas se admite que la presencia de más de un 1% de células epiteliales escamosas demuestra la existencia de una contaminación orofaríngea significativa y será muy difícil poder interpretar correctamente los resultados. Además, estos especímenes no deben presentar menos de un 10% de neutrófilos.
4. Procesamiento de las muestras. Se realizará una tinción directa de las muestras evaluables (OIC y/o Gram), lo que puede ayudar a establecer el tratamiento antibiótico empírico inicial, siempre considerando que algunos gérmenes frecuentemente se asocian a tinciones directas negativas. Seguidamente, se sembrarán en los medios de cultivo siguientes:
Obligados: agar sangre, agar chocolate, MacConkey (BGN) y BHI (anaerobio).
Optativos: medios específicos para Mycobacteria, hongos y Legionella (BCYE). Tinción específica para P. carinnii.
Las recomendaciones son éstas:
1. No procesar las muestras respiratorias obtenidas por aspiración traqueal cuando utilizando los criterios de Murray/Washington se detecte un nivel de calidad 0 o 1 (grado de evidencia II; acuerdo entre los expertos, 21 de 21 [100%]).
2. La presencia de más de un 1% de células escamosas en las muestras respiratorias obtenidas con métodos broncoscópicos significa contaminación. La presencia de menos de un 10% de neutrófilos obliga a buscar otro diagnótico alternativo (excepto en pacientes neutropénicos) (grado de evidencia III; acuerdo entre los expertos, 20 de 21 [95,2%]).
PUNTOS DE CORTE PARA CADA MUESTRA RESPIRATORIA
Las vías aéreas se colonizan muy rápidamente en pacientes intubados. Por tanto, las decisiones basadas en técnicas cualitativas son inespecíficas y, casi siempre, implican un número significativo de diagnósticos falsos, lo que conlleva el uso innecesario de antibióticos, la posible selección de gérmenes resistentes y el retraso en el diagnóstico y el tratamiento del verdadero problema del paciente. Así pues, los cultivos cuantitativos en muestras de calidad son imprescindibles para poder comprender el significado de los patógenos aislados.
1. Catéter telescopado. El volumen de secreciones respiratorias que se recogen con este dispositivo es aproximadamente de 0,01 a 0,001 ml. Después de obtener la muestra, el cepillo se coloca en 1 ml de suero fisiológico estéril, consiguiéndose de esta forma una solución de secreciones respiratorias diluidas entre 100 y 1.000 veces. Posteriormente se realizará un cultivo cuantitativo de esta solución y un crecimiento de 103 ufc/ml se corresponderá a una concentración inicial de 105 a 106 organismos por mililitro de la secreción respiratoria original. La concentración de organismos necesaria para ocasionar una neumonía depende de la virulencia de la bacteria y la competencia de las defensas del huésped. Sin embargo, cuando la neumonía es clínicamente manifiesta, de forma habitual las secreciones respiratorias contienen al menos 104 ufc por gramo de tejido y 105 o más bacterias por mililitro de exudado.
2. Lavado broncoalveolar. En el caso del LBA, el volumen de secreciones respiratorias recuperadas se estima en algo más de 1 ml diluido en el líquido que se aspira (entre 10 y 100 ml), lo que viene a suponer un factor de dilución de 1/10-1/100 de las secreciones respiratorias originales. Los puntos de corte han variado entre 103 y 105 ufc/ml. No obstante, el umbral diagnóstico generalmente aceptado es el de 104 ufc/ml de, al menos, uno de los microorganismos aislados en el cultivo.
3. Técnicas ciegas. En el caso del ABC y mini-LBA se han considerado como significativas concentraciones entre 103 y 104 ufc/ml. Para el catéter telescopado no broncoscópico se acepta el mismo punto de corte que para el procedimiento guiado.
4. Aspirado endotraqueal. El umbral diagnóstico mayoritariamente aceptado en muestra de AT es de 106 ufc/ml. Algunos autores han recomendado un valor de 105 ufc/ml como mejor punto de corte para esta muestra.
Factores a considerar en la interpretación de los cultivos cuantitativos de muestras respiratorias
A pesar de establecer estos umbrales diagnósticos para cada una de las muestras respiratorias, la carga bacteriana debe interpretarse en el contexto clínico específico de cada paciente. La proliferación bacteriana en las vías aéreas de los pacientes ventilados es un proceso muy dinámico que va desde la colonización asintomática a la neumonía clínicamente manifiesta. En presencia de recuentos bacterianos bajos, la probabilidad de existencia de una neumonía es menor, y viceversa. En general, los puntos de corte mencionados sirven para seleccionar pacientes con una mayor probabilidad de tener una neumonía. No obstante, el análisis de los recuentos bacterianos requiere tener en cuenta la existencia de factores que puedan influir en la concentraci&oac ute;n de microorganismos en las muestras respiratorias:
1. Tiempo de evolución de la neumonía. Un recuento bajo de microorganismos puede representar un estadio evolutivo precoz de la infección respiratoria.
2. Antibioterapia previa. La exposición previa a antibióticos es la variable más importante y la que más a menudo reduce la concentración bacteriana en las muestras respiratorias, particularmente en pacientes que han iniciado un tratamiento antibiótico en las 24 h previas a la recogida de muestras. Si los pacientes están recibiendo antibióticos por una infección previa, la sensibilidad y especificidad de las técnicas diagnósticas se ven menos afectadas porque se asume que los organismos responsables del episodio neumónico actual son resistentes al tratamiento que el paciente estaba recibiendo. Con algunos patógenos (H. influenzae, S. pneumoniae) el efecto de los antibióticos es particularmente rápido, y una sola dosis puede esterilizar la muestra. Con gramnegativos no fermentadores este efecto es menos notable.
3. Existen subgrupos de pacientes con recuentos bacterianos relativamente altos pero sin los cambios inflamatorios que definen la existencia de una neumonía, como ocurre con frecuencia en pacientes con enfermedad pulmonar obstructiva crónica.
4. Variabilidad de las técnicas. Aunque la reproducibilidad cualitativa es alta, se puede observar una variabilidad en el recuento bacteriano que suponga un cambio en la categoría diagnóstica (por encima o por debajo del punto de corte) de un 25-30%, tanto en LBA como en catéter telescopado.
5. Factor dilucional. Cambios en el volumen en el que se introduce el cepillo del catéter telescopado universalmente admitido de 1 ml pueden producir variaciones dilucionales de la muestra respiratoria recogida e influir en el recuento de colonias. En el caso del LBA el problema es mayor debido a la falta de estandarización de la técnica, en la que se usan distintos volúmenes según los autores. Se desconoce el efecto del volumen de líquido instilado y del porcentaje recuperado sobre el recuento bacteriano. En general, recuperaciones inferiores al 10% de lo instilado no infrecuentes en pacientes con EPOC graves probablemente no son representativas del tracto respiratorio inferior y deberían rechazarse. En pacientes en los que se sospecha una escasa recuperación de líquido de LBA será preferible la realización de otras técnicas diagnósticas. En el caso de los AT, también se desconoce la influencia del volumen de secreciones recogido, y de la frecuencia de aspiraciones previas en los recuentos microbiológicos.
6. Otros aspectos técnicos. Los errores en la toma de muestras o los retrasos en el envío de las mismas al laboratorio de microbiología pueden ser la causa de descensos significativos en los recuentos bacterianos, o de sobrecrecimientos inespecíficos.
Podemos establecer las recomendaciones siguientes:
1. Abandonar los conceptos de "cultivo positivo" o "cultivo negativo" y solicitar al laboratorio de microbiología el recuento exacto aunque sea menor que los umbrales diagnósticos clásicos (grado de evidencia II; acuerdo entre los expertos, 22 de 22 [100%]).
2. Interpretar los resultados cuantitativos de acuerdo con las características del paciente (enfermedad de base, comorbilidades), el tiempo de evolución de la neumonía y la utilización de antibióticos previos (grado de evidencia II; acuerdo entre los expertos, 22 de 22 [100%]).
CRITERIOS DEFINITIVOS DE NEUMONIA NOSOCOMIAL
Los criterios clínicos de sospecha de una NAV son el desencadenante de una serie de actuaciones (obtención de muestras respiratorias, inicio de tratamiento con antibióticos, exploraciones complementarias) que conducen, en la mayoría de casos, al diagnóstico definitivo de una neumonía o a otro diagnóstico alternativo. El patrón de referencia que permite definir una NAV con seguridad se basa en la asociación de criterios histológicos (acumulación de leucocitos polimorfonucleares en el tejido pulmonar), y microbiológicos (crecimiento de mas 104 ufc por gramo de tejido pulmonar), lo que es prácticamente imposible conseguir en la rutina diaria. Sin embargo, es necesario identificar unos criterios mínimos que permitan establecer el diagnótico definitivo de NAV para incluirse en las historias clínicas de los enfermos.
El diagnóstico definitivo de la NAV se puede realizar si el paciente en el que se sospechó la presencia de esta afección cumple uno de los siguientes criterios durante el período de tratamiento de la infección:
Criterios radiológicos
La aparición de una imagen cavitada en una radiografía o en una TC torácica en una zona en la que previamente existía un infiltrado o una condensación.
Criterios microbiológicos
El aislamiento de un microorganismo patógeno (MP) en alguna de las siguientes muestras o combinaciones de muestras:
1. Aislamiento en el aspirado traqueal (> 106 ufc) del mismo MP que el aislado en uno o más hemocultivos o en líquido pleural, en ausencia de otro foco de infección.
2. Aislamiento de uno o más MP en muestras procedentes de las vías respiratorias inferiores, con los siguientes puntos de corte para cada una de ellas: AT > 106 ufc/ml; CTT > 103 ufc/ml; LBA > 104 ufc/ml.
3. Identificación de Legionella pneumophila en cualquiera de las muestras respiratorias mediante técnicas de cultivo o de inmunología; serología en orina positiva; incremento de la serología plasmática en más de cuatro diluciones en muestras obtenidas con diferencia de tres o más semanas.
4. Aislamiento de MP en muestras procedentes de biopsia pulmonar o de necropsias, con punto de corte de > 104 ufc por gramo de tejido pulmonar.
Criterio terapéutico
Respuesta favorable al tratamiento antibiótico que se administra por lo menos durante 7 días. Exclusión de otras causas que se asocien con los signos clínicos de sospecha de neumonía.
Criterios histológicos
Presencia de acumulaciones de leucocitos polimorfonucleares en los alvéolos y bronquios terminales en muestras procedentes de biopsias pulmonares o de necropsia (exudación purulenta, zonas hepatizadas, cavitaciones).
Se pueden establecer las recomendaciones siguientes:
1. La presencia de criterios de sospecha y uno solo de los criterios radiológicos, microbiológicos, terapéuticos o histológicos anteriores permiten realizar un diagnóstico definitivo de NAV. En caso contrario, debe expresarse como diagnóstico de sospecha de NAV (grado de evidencia III; acuerdo entre los expertos, 20 de 22 [90,9%]).
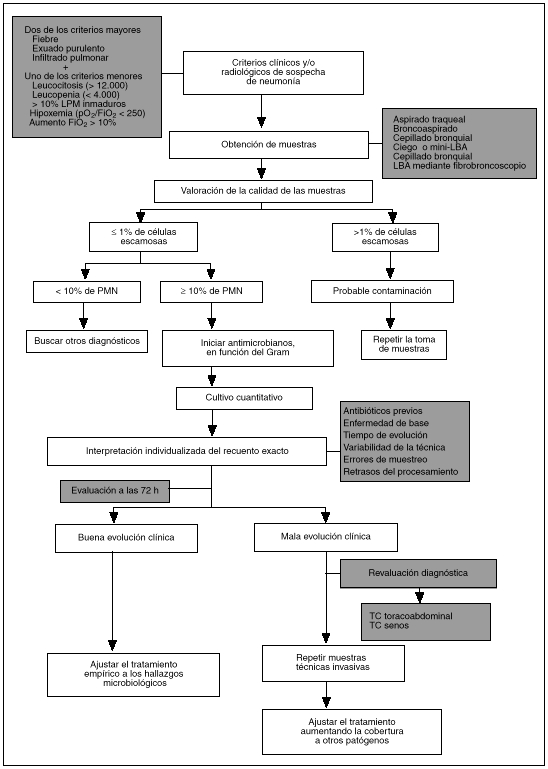
ALGORITMO DE ACTUACION ANTE LA SOSPECHA DE UNA NAV (fig. 1)
Fig. 1. Algoritmo de actuación ante la sospecha de neumonía relacionada con ventilación mecánica.
1. Una vez establecida la sospecha clínica, y antes de administrar antibióticos, se obtendrán muestras de vías respiratorias bajas (y de cualquier otro foco sospechoso) mediante alguno de los métodos comentados. Una vez obtenidas las muestras se empezará de forma inmediata un tratamiento antibiótico empírico según las circunstancias del paciente y las características epidemiológicas locales.
2. Las muestras deberán ser procesadas en el laboratorio de microbiología antes de una hora desde su obtención. De no ser posible, se mantendrán a 4 °C si bien, y a pesar de ello, algunos gérmenes como Haemophilus influenzae pueden verse afectados.
3. Se realizará una tinción directa de las muestras (OIC y/o Gram), lo que puede ayudar a establecer el tratamiento antibiótico empírico inicial. Siempre considerando que algunos gérmenes como Pseudomonas aeruginosa frecuentemente se asocian a tinciones directas negativas. Asimismo, se hará una valoración de la calidad de la muestra enviada con los criterios señalados anteriormente.
4. Si la muestra fuera de calidad suficiente, se realizarán cultivos cuantitativos. La información de estos resultados deberá ser enviada al clínico lo más rápidamente posible y siempre con el recuento exacto.
5. Se valorará individualmente el resultado obtenido, considerando siempre el contexto clínico del paciente y las posibles variables que puedan haber influido en el recuento. En función de todo ello, se decidirán posibles ajustes en el tratamiento pautado.
6. En caso de mala respuesta clínica, antes de cualquier cambio antibiótico y revaluados (mediante TC toracoabdominal y senos) otros posibles focos de infección o causas que justificaran una falta de respuesta al tratamiento (empiema, etc.), se procederá a una nueva toma de muestras, utilizando técnicas endoscópicas.
7. En caso de persistencia de sospecha de neumonía, mala evolución clínica y ausencia de diagnóstico etiológico, se planteará la posibilidad de realizar una biopsia pulmonar por minitoracotomía.
El Grupo de expertos ha contado con la colaboración del Laboratorio Wyeth-Lederle, España, para la realización de las reuniones de trabajo.
Correspondencia: Dr. F. Álvarez Lerma. Servicio de Medicina Intensiva. Hospital del Mar. P. Marítimo, 25-29. 08003 Barcelona. Correo electrónico: FAlvarez@imas.imim.es. Manuscrito aceptado el 27-IV-2001.
Relación de participantes en la comisión de expertos:
GTEI-SEMICYUC: F. Álvarez Lerma* (Hospital del Mar, Barcelona), L. Álvarez Rocha* (Hospital Juan Canalejo, A Coruña), F. Barcenilla Gaite* (Hospital Arnau de Vilanova, Lleida), A. García Labatut (Hospital de Soria), R. Jordà Marcos* (Hospital de Son Dureta, Palma de Mallorca), J. Insausti Ordeñana* (Hospital de Navarra, Pamplona), M.J. López Pueyo* (Hospital General Yague, Burgos), A. Martínez Pellús* (Hospital de la Arrixaca, Murcia), P. Olaechea Astigarraga* (Hospital de Galdakao, Vizcaya), M. Palomar Martínez* (Hospital Vall d'Hebron, Barcelona), J. Rello*,*** (Hospital Joan XXIII, Tarragona), J. Valles Daunis* (Hospital Parc Tauli, Sabadell).
ÁREA TIR-SEPAR. J. Blanquer Olivas** (Hospital Clínico, Valencia), J. Dorca (Hospital de Bellvitge, Barcelona), R. Menéndez (Hospital La Fe, Valencia), F. Rodríguez de Castro (Hospital Universitario Dr. Negrín, Las Palmas de Gran Canaria), A. Torres Martí** (Hospital Clínic, Barcelona).
GEIH-SEIMC. X. Ariza Cardenal (Hospital de Bellvitge, Barcelona), J. Mensa Pueyo (Hospital Clínic, Barcelona), J. Martínez Beltrán (Hospital Ramón y Cajal, Madrid), M.A. Messeguer. (Hospital Ramón y Cajal, Madrid), M. Lizasoain (Hospital 12 de Octubre, Madrid).
*También son miembros del GTIH-SEIMC.
**También son miembros del GTEI-SEMICYUC.
***También son miembros del Área TIR-SEPAR.