Analizar factores de riesgo de fracaso de la ventilación no invasiva (VNI) en pacientes que ingresan en una unidad de cuidados intensivos (UCI) por neumonía primaria por virus influenza A (H1N1)pdm09. Demostrar que los pacientes que fracasan con la VNI tienen mayor mortalidad y estancias más largas.
DiseñoEstudio de cohorte.
ÁmbitoUCI polivalente de un hospital universitario de 16 camas.
PacientesPacientes adultos que ingresaron en la UCI en los que se confirmó el diagnóstico de neumonía por influenza A (H1N1)pdm09 y que recibieron ventilación mecánica.
VariablesEdad, sexo, puntuaciones de gravedad, administración de corticoides, oseltamivir dentro de las 72h de la sintomatología, días de sintomatología previos al ingreso, cuadrantes afectados, fracaso hemodinámico, renal y datos analíticos al ingreso, mortalidad y estancia en UCI y hospitalaria.
ResultadosIngresaron 54 pacientes y 49 fueron ventilados. Sexo femenino, 29 (59,2%) y una edad media±desviación estándar de 66,77±14,77 años. Fueron ventilados con VNI 43 (87,75%), de los que fracasaron 18 (41,9%). Los pacientes que fracasaron presentaron menor edad (63 vs. 74 años; p=0,04), mayor puntuación SOFA (7 vs. 4; p=0,01) y mayor fracaso hemodinámico (61,1 vs. 8%; p=0,01). Además, presentaron estancias más largas tanto en UCI (26,28 vs. 6,88 días; p=0,01) como hospitalarias (32,78 vs. 18,8 días; p=0,01), y mayor mortalidad en UCI (38,9 vs. 0%; p=0,02). Se identificaron como factores de riesgo de fracaso a VNI recibir corticoides (OR 7,08; IC 95% 1,23-40,50) y el fallo hemodinámico precoz (OR 14,77; IC 95% 2,34-92,97).
ConclusionesEl tratamiento con corticoides y el fracaso hemodinámico precoz se asociaron con el fracaso de la VNI en pacientes con neumonía primaria por virus influenza A (H1N1)pdm09. Estos tienen una mortalidad superior.
To evaluate the risk factors associated to noninvasive mechanical ventilation (NIV) failure in patients with primary pneumonia due to influenza A (H1N1)pdm09 virus admitted to the intensive care unit (ICU), and to demonstrate the association of NIV failure to increased mortality and longer stays.
DesignA cohort study was carried out.
ScopeA mixed ICU (16 beds) in a teaching hospital.
PatientsAdult patients admitted to the ICU with a diagnosis of pneumonia due to influenza A (H1N1)pdm09 virus requiring mechanical ventilation.
MeasurementsAge, sex, severity scores, administration of corticosteroids, oseltamivir within 72h of symptoms onset, days of symptoms prior to admission, affected quadrants, hemodynamic parameters, renal failure, laboratory test data on admission, mortality and stay in ICU and in hospital.
ResultsA total of 54 patients were admitted to the ICU and 49 were ventilated; 29 were females (59.2%), and the mean age±standard deviation was 66.77±14.77 years. Forty-three patients (87.75%) were ventilated with NIV, and 18 (41.9%) of them failed. Patients with NIV failure were younger (63 vs. 74 years; P=.04), with a higher SOFA score (7 vs. 4; P=.01) and greater early hemodynamic failure (61.1 vs. 8%; P=.01). In addition, they presented longer ICU (26.28 vs. 6.88 days; P=.01) and hospital stay (32.78 vs. 18.8 days; P=.01). The ICU mortality rate was also higher in the NIV failure group (38.9 vs. 0%; P=.02). In the multivariate analysis, corticosteroid therapy (OR 7.08; 95% CI 1.23-40.50) and early hemodynamic failure (OR 14.77; 95% CI 2.34-92.97) were identified as independent risk factors for NIV failure.
ConclusionsTreatment with corticosteroids and early hemodynamic failure were associated to NIV failure in patients with primary pneumonia due to influenza A (H1N1)pdm09 virus infection admitted to the ICU. The failure of NIV was associated to increased mortality.
La aparición de la pandemia por influenza A (H1N1)pdm09 en 2009 supuso un cambio en la salud mundial y un reto para los servicios sanitarios1. Las unidades de cuidados intensivos (UCI) asumieron gran parte de estos pacientes, llegando a ser de hasta el 54,8% de todos los infectados ingresados en ellas2.
El uso de la ventilación no invasiva (VNI) se ha extendido en las últimas 2 décadas. Sus beneficios han sido demostrados y, por lo tanto, recomendado su uso en pacientes con exacerbación de enfermedad pulmonar obstructiva crónica (EPOC), edema pulmonar cardiogénico e insuficiencia respiratoria en pacientes inmunocomprometidos3. Sin embargo, la utilidad de la VNI en la insuficiencia respiratoria por neumonía por virus influenza A (H1N1)pdm09 no ha quedado clara y está todavía en controversia. A pesar de que en los primeros años de pandemia se observaban tasas de fracaso del 75%4, progresivamente se ha reducido hasta el 35,3% en series más recientes5. La mortalidad de los pacientes que fracasaban varía entre el 25,6-58%4,6,7. El retraso en la intubación orotraqueal de los pacientes en que fracasa la VNI aumenta la mortalidad, por lo que detectar de forma precoz los pacientes susceptibles de fracaso resultaría interesante y podría relacionarse con una reducción de la mortalidad.
El objetivo principal del estudio es conocer factores de riesgo de fracaso de VNI en el paciente que ingresa en UCI por neumonía grave por influenza A (H1N1)pdm09. Además, tratamos de demostrar que los pacientes en que fracasa la VNI tienen mayor mortalidad y estancias tanto en UCI como hospitalarias más prolongadas.
Pacientes y métodosSe incluyó a los pacientes que ingresaron en la UCI del Hospital Universitario Doctor Peset de Valencia desde junio de 2010 hasta diciembre de 2018 por insuficiencia respiratoria, con el diagnóstico confirmado al alta de neumonía por virus influenza A (H1N1)pdm09 y que requirieron ventilación mecánica. Previamente se obtuvo la aprobación de este trabajo por el Comité de Ética de nuestro centro. Se consideró caso confirmado de neumonía por virus influenza A (H1N1)pdm09 aquel en el que se positivizó la prueba molecular de amplificación de ácidos nucleicos (rt-PCR). Para ello se obtuvieron muestras de exudado nasofaríngeo en todos los pacientes y de secreciones respiratorias mediante aspirado bronquial en los que estaban intubados. Se definió neumonía comunitaria como la presencia de signos clínicos compatibles (tos, expectoración, fiebre>38̊C, leucocitosis, elevación de PCR y PCT) y aparición de infiltrados alveolares en la radiografía de tórax. Se consideró insuficiencia respiratoria atendiendo a criterios gasométricos, PaO2<60mmHg y/o PaCO2>45mmHg.
Se excluyeron los pacientes menores de 18 años y en los que se decidió limitar el tratamiento de soporte vital al ingreso o durante su evolución, en sesión clínica.
Los equipos de VNI utilizados fueron BiPAP Vision® (Respironics Inc., Pennsylvania, Estados Unidos) y V60® (Respironics Inc., Pennsylvania, Estados Unidos), tanto en su modo BiPAP como CPAP, conectados a interfaces oronasal o facial total (Respironics Inc., Pennsylvania, Estados Unidos) y a sistema de humidificación activa (Fisher and Paykel Healthcare Auckland, New Zealand).
Se consideró fracaso de la VNI la necesidad de intubación orotraqueal y conexión a ventilación mecánica invasiva (VMI). Para proceder a ello se atendía principalmente a una decisión clínica según el protocolo local, no solo basado en criterios gasométricos (imposibilidad para mantener SatO2>90% con FiO2>0,60), sino también por la persistencia de signos de aumento de trabajo respiratorio, presencia de secreciones copiosas, acidosis metabólica, fracaso multiorgánico, encefalopatía o agitación con rechazo a la terapia con VNI.
Se recogieron datos demográficos, información relacionada con enfermedades previas, el lugar de procedencia, datos analíticos al ingreso en nuestra unidad, el soporte ventilatorio recibido a su llegada, así como puntuaciones de gravedad como el Sequential Organ Failure Assessment (SOFA) al ingreso y el Acute Physiology and Chronic Health Evaluation II (APACHE II) a las 24h. Se definieron los antecedentes respiratorios como enfermedad respiratoria crónica (asma, EPOC y fibrosis pulmonar). Se identificó el fracaso hemodinámico, definido como la necesidad de iniciar soporte con fármacos vasoactivos antes o durante la VNI, y la necesidad de terapia de depuración extrarrenal durante la evolución. A su vez, se registró si había recibido corticoides antes o durante la VNI y si había recibido oseltamivir dentro de las primeras 72h desde el comienzo de la sintomatología, así como la mortalidad en UCI, a los 30 días y hospitalaria, y la estancia en UCI y hospitalaria.
El análisis estadístico se realizó mediante el paquete de software SPSS® 17.0 (Chicago, IL, Estados Unidos). Se evaluó la normalidad de las variables cuantitativas mediante el test de Kolmogorov-Smirnov. Las variables cuantitativas se expresaron mediante media±DE o mediana (RIC), mientras que las cualitativas se expresaron como frecuencia (porcentaje). Las variables cuantitativas se compararon mediante los test t de Student o U de Mann-Whitney, mientras que las cualitativas se compararon mediante Chi-cuadrado o test exacto de Fisher. Se analizaron los factores de riesgo mediante regresión logística y se expresan mediante OR (IC 95%). Se incluyeron en el análisis multivariante aquellas variables que presentaron una p<0,20 en el análisis univariante. Se consideraron diferencias estadísticamente significativas si p<0,05.
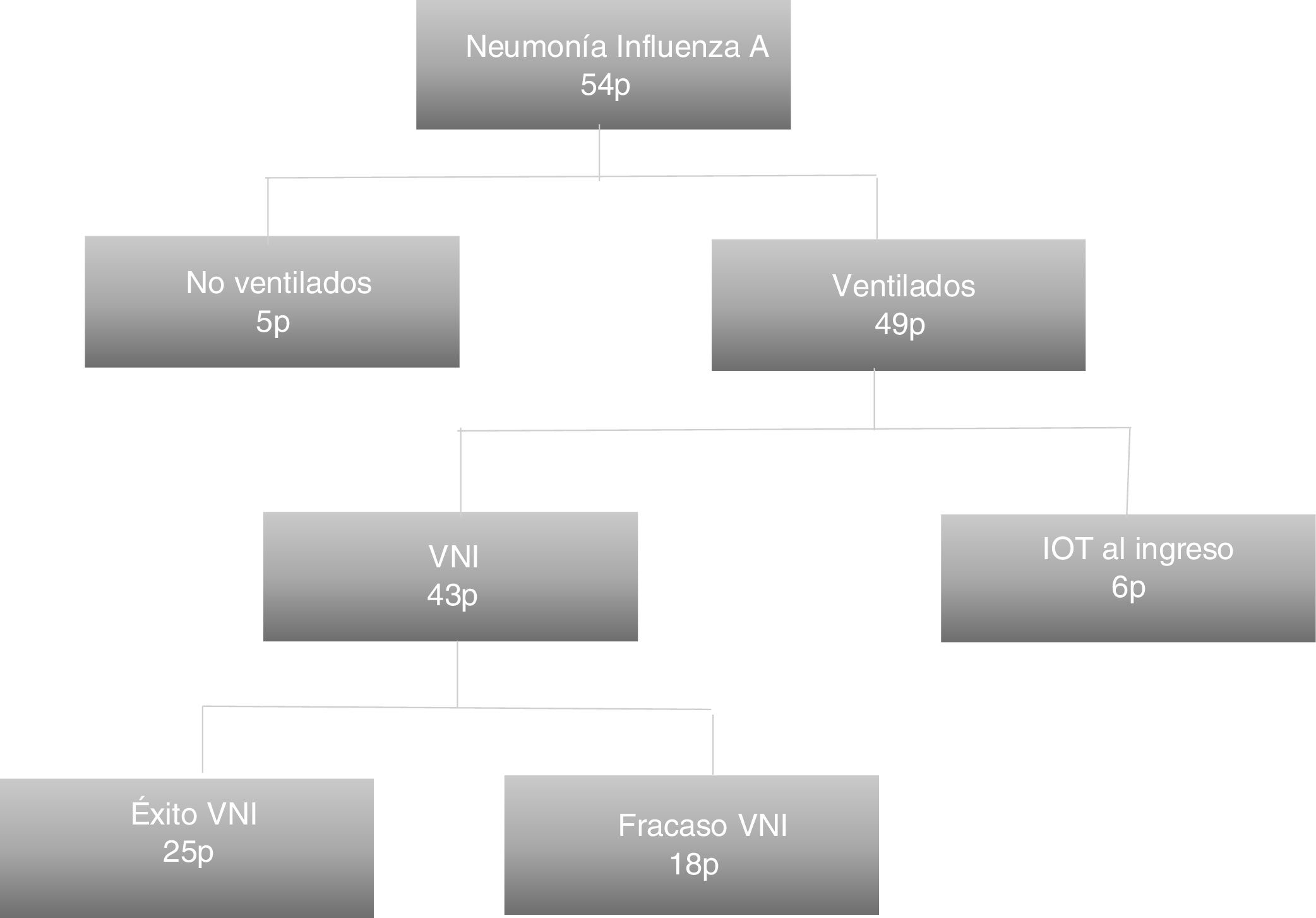
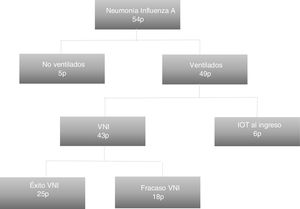
ResultadosEn total ingresaron 54 pacientes en nuestra unidad con el diagnóstico confirmado, de los que 49 fueron ventilados. Principalmente procedieron del servicio de urgencias hospitalarias (26 pacientes; 53,1%). La edad de los ingresados fue de 66,77±14,77 años y 29 (59,2%) fueron mujeres. Entre los antecedentes, 28 (57,1%) eran hipertensos, 19 (38,8%) tenían diabetes mellitus, 17 (34,7%) eran fumadores/as y 19 (38,8%) tenían alguna enfermedad respiratoria crónica, tratándose de EPOC en 11 de ellos (22,4%). A su ingreso tuvieron una puntuación en el SOFA de 5,6±3,5 y un APACHE II de 16 (11-22). Tuvieron 4 (2-7) días de sintomatología previa. Al ingreso, 21 pacientes (42,9%) no habían recibido soporte mecánico respiratorio, en 22 (40,7%) se inició VNI y 6 (11,1%) fueron intubados directamente. En total, a lo largo del ingreso, 43 (87,75%) recibieron VNI, con una duración de 48 (40) h, de los cuales fracasaron 18 (41,9%), requiriendo VMI. La figura 1 muestra la distribución de los pacientes en función del soporte ventilatorio recibido.
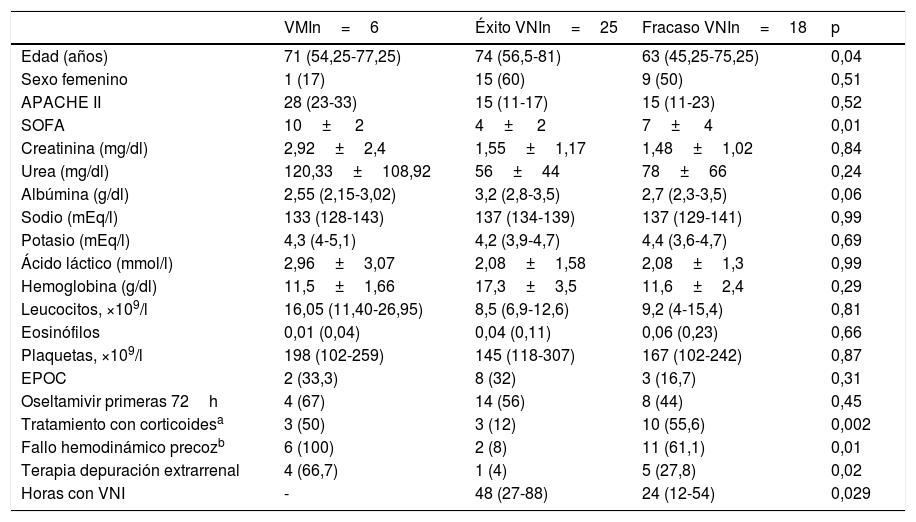
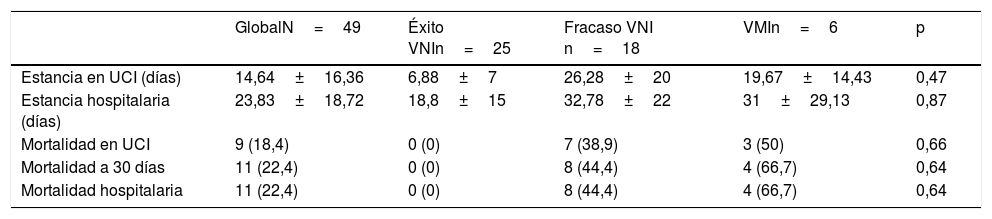
Los pacientes en que fracasó la VNI tuvieron puntuaciones en el SOFA superiores al ingreso (7 vs. 4, p=0,01), eran más jóvenes (63 vs. 74 años, p=0,04), habían recibido más corticoides (55,6 vs. 12%, p=0,002), desarrollaron más fracaso hemodinámico precoz (61,1 vs. 8%, p=0,01) y requirieron más frecuentemente terapia de reemplazo renal (27,8 vs. 4%, p=0,02) (tabla 1). No se objetivaron diferencias significativas entre los pacientes con EPOC (16,7 vs. 32%, p=0,31). El fracaso de la VNI se tradujo en superiores estancias en la UCI (26,28 vs. 6,88 días, p=0,01) y hospitalarias (32,78 vs. 18,8 días, p=0,01), así como en una mayor mortalidad en la UCI (38,9 vs. 0%, p=0,02), a los 30 días y hospitalaria (44,4 vs. 0%, p=0,001) (tabla 2).
Características basales de los pacientes que recibieron soporte con ventilación mecánica. Comparación de pacientes con fracaso vs. éxito de VNI
| VMIn=6 | Éxito VNIn=25 | Fracaso VNIn=18 | p | |
|---|---|---|---|---|
| Edad (años) | 71 (54,25-77,25) | 74 (56,5-81) | 63 (45,25-75,25) | 0,04 |
| Sexo femenino | 1 (17) | 15 (60) | 9 (50) | 0,51 |
| APACHE II | 28 (23-33) | 15 (11-17) | 15 (11-23) | 0,52 |
| SOFA | 10± 2 | 4± 2 | 7± 4 | 0,01 |
| Creatinina (mg/dl) | 2,92±2,4 | 1,55±1,17 | 1,48±1,02 | 0,84 |
| Urea (mg/dl) | 120,33±108,92 | 56±44 | 78±66 | 0,24 |
| Albúmina (g/dl) | 2,55 (2,15-3,02) | 3,2 (2,8-3,5) | 2,7 (2,3-3,5) | 0,06 |
| Sodio (mEq/l) | 133 (128-143) | 137 (134-139) | 137 (129-141) | 0,99 |
| Potasio (mEq/l) | 4,3 (4-5,1) | 4,2 (3,9-4,7) | 4,4 (3,6-4,7) | 0,69 |
| Ácido láctico (mmol/l) | 2,96±3,07 | 2,08±1,58 | 2,08±1,3 | 0,99 |
| Hemoglobina (g/dl) | 11,5±1,66 | 17,3±3,5 | 11,6±2,4 | 0,29 |
| Leucocitos, ×109/l | 16,05 (11,40-26,95) | 8,5 (6,9-12,6) | 9,2 (4-15,4) | 0,81 |
| Eosinófilos | 0,01 (0,04) | 0,04 (0,11) | 0,06 (0,23) | 0,66 |
| Plaquetas, ×109/l | 198 (102-259) | 145 (118-307) | 167 (102-242) | 0,87 |
| EPOC | 2 (33,3) | 8 (32) | 3 (16,7) | 0,31 |
| Oseltamivir primeras 72h | 4 (67) | 14 (56) | 8 (44) | 0,45 |
| Tratamiento con corticoidesa | 3 (50) | 3 (12) | 10 (55,6) | 0,002 |
| Fallo hemodinámico precozb | 6 (100) | 2 (8) | 11 (61,1) | 0,01 |
| Terapia depuración extrarrenal | 4 (66,7) | 1 (4) | 5 (27,8) | 0,02 |
| Horas con VNI | - | 48 (27-88) | 24 (12-54) | 0,029 |
APACHE II: Acute Physiology and Chronic Health Evaluation II; EPOC: enfermedad pulmonar obstructiva crónica; SOFA: Sequential Organ Failure Assessment scoring al ingreso en UCI; VNI: ventilación no invasiva; VMI: ventilación mecánica invasiva.
Datos expresados como media±desviación estándar, mediana (rango intercuartílico P25-P75) o n (porcentaje).
Los datos analíticos corresponden a los de admisión en la UCI.
Estancias y mortalidad de los pacientes con fracaso, no fracaso y VMI. Comparación de los pacientes con fracaso de VNI y los que reciben VMI como primer soporte
| GlobalN=49 | Éxito VNIn=25 | Fracaso VNI n=18 | VMIn=6 | p | |
|---|---|---|---|---|---|
| Estancia en UCI (días) | 14,64±16,36 | 6,88±7 | 26,28±20 | 19,67±14,43 | 0,47 |
| Estancia hospitalaria (días) | 23,83±18,72 | 18,8±15 | 32,78±22 | 31±29,13 | 0,87 |
| Mortalidad en UCI | 9 (18,4) | 0 (0) | 7 (38,9) | 3 (50) | 0,66 |
| Mortalidad a 30 días | 11 (22,4) | 0 (0) | 8 (44,4) | 4 (66,7) | 0,64 |
| Mortalidad hospitalaria | 11 (22,4) | 0 (0) | 8 (44,4) | 4 (66,7) | 0,64 |
VMI: ventilación mecánica invasiva; VNI: ventilación no invasiva.
Datos expresados como media±desviación estándar o n (porcentaje).
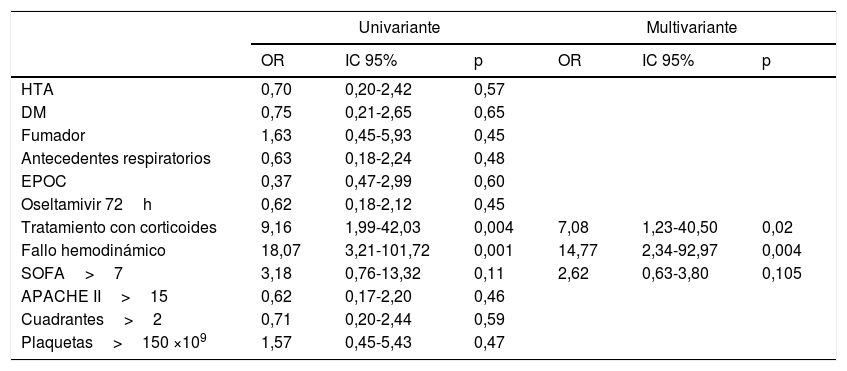
Se identificaron como factores de riesgo de fracaso de VNI el haber administrado precozmente corticoides (OR 7,08; IC 95% 1,23-40,50) y haber desarrollado precozmente fracaso hemodinámico (OR 14,77; IC 95% 2,34-92,97) (tabla 3).
Análisis univariante y multivariante de comorbilidades y parámetros asociados con el fracaso de la VNI
| Univariante | Multivariante | |||||
|---|---|---|---|---|---|---|
| OR | IC 95% | p | OR | IC 95% | p | |
| HTA | 0,70 | 0,20-2,42 | 0,57 | |||
| DM | 0,75 | 0,21-2,65 | 0,65 | |||
| Fumador | 1,63 | 0,45-5,93 | 0,45 | |||
| Antecedentes respiratorios | 0,63 | 0,18-2,24 | 0,48 | |||
| EPOC | 0,37 | 0,47-2,99 | 0,60 | |||
| Oseltamivir 72h | 0,62 | 0,18-2,12 | 0,45 | |||
| Tratamiento con corticoides | 9,16 | 1,99-42,03 | 0,004 | 7,08 | 1,23-40,50 | 0,02 |
| Fallo hemodinámico | 18,07 | 3,21-101,72 | 0,001 | 14,77 | 2,34-92,97 | 0,004 |
| SOFA>7 | 3,18 | 0,76-13,32 | 0,11 | 2,62 | 0,63-3,80 | 0,105 |
| APACHE II>15 | 0,62 | 0,17-2,20 | 0,46 | |||
| Cuadrantes>2 | 0,71 | 0,20-2,44 | 0,59 | |||
| Plaquetas>150 ×109 | 1,57 | 0,45-5,43 | 0,47 | |||
APACHE II: Acute Physiology and Chronic Health Evaluation II; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IC 95%: intervalo de confianza del 95%; OR: odds ratio; SOFA: Sequential Organ Failure Assessment scoring al ingreso en UCI; TDER: terapia de depuración extrarrenal; VMI: ventilación mecánica invasiva; VNI: ventilación no invasiva.
A día de hoy, existen dudas de la utilidad de la VNI en pacientes con fracaso respiratorio hipoxémico por gripe A. Pese a ello, en nuestra unidad, el uso de VNI es una herramienta frecuentemente utilizada como soporte inicial en los pacientes con IRA, en contraposición a otros estudios4,8. Uno de los motivos que clásicamente apoya evitar el uso de VNI, como es la posibilidad de contagio del personal sanitario9,10, no se observó en nuestra cohorte, en la que no se notificó ningún caso. La Sociedad Europea de Cuidados Intensivos también se manifiesta en este sentido, considerándolo un procedimiento de alto riesgo de contagio11. En nuestra unidad se coloca un filtro antibacteriano/viral a la salida del ventilador12.
En nuestra cohorte de pacientes el fracaso a VNI fue del 41,9%, menor que lo referido en otros estudios publicados13–15. Nuestros resultados podrían equipararse a los del trabajo de Marín-Corral et al.5, en el que se objetivaba fracaso en el 35,3%, menor que en nuestra cohorte, pero con mayor mortalidad en UCI (18,4 vs. 24,2%). Por el contrario, en el trabajo de Rodríguez et al.13 la tasa de fracasos fue mayor (56,8%), pero se obtuvo una mortalidad similar a la de nuestra cohorte. Esto último llama la atención, teniendo en cuenta que presentaban similar gravedad y que el fracaso a VNI se ha asociado a mayor mortalidad y peor pronóstico6. En nuestro caso hubo diferencias significativas de mortalidad cuando se compararon los pacientes que fracasaban y los que no.
Las variables que se asociaron con un aumento del fracaso fueron el uso de corticoides y la presencia de fallo hemodinámico precoz. Teniendo esto en cuenta, la menor mortalidad en nuestra cohorte puede deberse a un menor uso de corticoides con respecto al trabajo de Masclans et al.6 (32,65 vs. 39,7%). El uso de corticoides se ha relacionado con un aumento de la mortalidad16,17 y en este sentido se manifiestan las conclusiones de un metaanálisis publicado18. Las de otro metaanálisis más reciente, que evalúa el uso de corticoides en pacientes con neumonía, también van en contra de su uso, aunque el bajo porcentaje de pacientes con neumonía por influenza A (H1N1)pdm09 incluidos debe hacernos ser cautelosos con sus conclusiones19. Pese a ello, existe consenso en que el uso de corticoides en pacientes con neumonía por gripe A debe evitarse, lo cual en nuestra unidad es una de las piedras angulares del manejo de estos pacientes. Las recomendaciones de 2012 no lo incluían como parte del tratamiento20. Como aspecto a discutir quedaría la discrepancia de su uso en pacientes que tienen shock asociado en los que se valoraría inicio de tratamiento corticoideo sustitutorio como parte de tratamiento integral del shock. En nuestro trabajo, los pacientes que desarrollaron fracaso hemodinámico precoz recibieron más corticoides (54,5 vs. 18,8%, p<0,05). Esto último podría apoyar la sospecha de que el uso de corticoides en estos pacientes se debe en gran medida a la aparición de shock.
En cuanto al beneficio del soporte con VNI en el grupo de pacientes con EPOC3, en nuestra serie no se objetivaron diferencias en el éxito de VNI entre estos pacientes y no se asoció de forma independiente con el fracaso de VNI. Este hecho puede ir en consonancia con los resultados de Rodríguez et al.13, según los cuales el efecto beneficioso de VNI en estos pacientes se perdía al presentar un SOFA≥5.
Uno de los aspectos importantes que también puede crear controversia es la evolución de los pacientes que reciben VMI, y si existen diferencias entre los que son intubados a su ingreso y los que la requieren tras el fracaso de la VNI. En nuestra serie, con puntuaciones de gravedad superiores a las de Rello et al.14, la incidencia de VMI al ingreso fue menor. Sin embargo, en la serie de Rodríguez et al.13 el porcentaje de pacientes que recibían inicialmente soporte con VMI fue superior (57,5 vs. 12,24%) y presentaron menor mortalidad en la UCI (31,3 vs. 50%), a pesar del escaso número de pacientes. Destaca la marcada gravedad de estos pacientes en nuestra cohorte. La comparación entre los pacientes que recibían VMI al ingreso y los que la recibieron tras presentar fracaso de VNI no reveló diferencias en cuanto a estancias y mortalidad tanto en la UCI como hospitalarias.
Con respecto al tiempo que se mantiene el soporte con VNI y su asociación con el fracaso de la misma, debemos hacer referencia a los trabajos publicados que demuestran que una demora en la intubación aumenta la mortalidad en pacientes con fracaso respiratorio hipoxémico21. Sin embargo, en nuestro trabajo se observó que los pacientes que fracasaban necesitaban ser intubados más precozmente y, por lo tanto, recibían menos horas de VNI. Esto puede deberse a que la gravedad de estos pacientes era mayor, y además presentaban más fracaso hemodinámico, criterios que probablemente contribuyeron a que se decidiese iniciar VMI más tempranamente. Además, los pacientes que fracasaban requerían a lo largo de la evolución más terapia de reemplazo renal, a pesar de que no había diferencias en los parámetros de función renal al ingreso. Con estos hallazgos podríamos plantear mantener el soporte respiratorio con VNI en el caso de que no se sume un segundo fallo de órgano, especialmente hemodinámico, pudiendo plantearlo y limitarlo únicamente para aquellos que presenten fallo respiratorio.
Las principales limitaciones de nuestro estudio radican en el diseño observacional retrospectivo. Es probable que pacientes con el mismo diagnóstico y con necesidad de soporte con VNI no llegaran a ingresar en nuestra unidad por desestimar su ingreso en la misma. Evidentemente, estos pacientes no forman parte del análisis. A su vez, no fue posible la recogida de variables importantes como todos los datos gasométricos. Su inclusión posibilitaría clasificar el tipo de insuficiencia respiratoria aguda (por ejemplo, PaO2, SatO2, PaO2/FiO2) y analizar su papel como posible factor pronóstico de fracaso de la VNI. El sesgo de selección que existe al incluir los pacientes gravemente enfermos hospitalizados en la UCI hace que estos resultados no sean extrapolables a otras poblaciones.
En conclusión, podría considerarse el uso de VNI en casos de neumonía por virus influenza A (H1N1)pdm09 como primer sistema de soporte respiratorio, sobre todo en personas jóvenes con bajos niveles de gravedad y que no hayan recibido corticoides ni desarrollado fracaso hemodinámico precoz. La presencia de cualquiera de estos 2 últimos aspectos se asociaría con un aumento de la probabilidad de fracaso del soporte con VNI.
AutoríaH. Hernández, A. Navarro y L. Lizama participaron en la confección de la base de datos, así como en la recopilación. H. Hernández realizó el análisis de los datos, así como la redacción y la corrección del artículo. R. Zaragoza supervisó el análisis estadístico y revisó críticamente el artículo en cuanto a contenido intelectual. Todos aprobaron la última versión del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.