La mortalidad del distress respiratorio agudo está disminuyendo, aunque hay poca evidencia sobre su pronóstico después del egreso hospitalario y la adecuada estratificación pronóstica con la nueva clasificación de Berlín.
MétodosSe analizó retrospectivamente la mortalidad de pacientes con SDRA admitidos en la Unidad de Cuidados Críticos de1 Hospital Universitario de la ciudad de Buenos Aires, desde el 1 de 2008 hasta el 6 de 2011. Se definió SDRA por hipoxemia con PaO2/FiO2≤200 mmHg con al menos 10 cmH2O de PEEP y FiO2≥0,5 e infiltrados bilaterales en la radiografía de tórax en ausencia de edema agudo de pulmón cardiogénico en las primeras 72h de ventilación mecánica. Se registraron la mortalidad hospitalaria y a 6 meses, los factores asociados a mortalidad, la utilización de terapias de rescate, y la validez de la clasificación de Berlín para casos moderados y graves.
ResultadosSe incluyeron 98 pacientes; edad 59±19 años; 42,9% con comorbilidades mayores; APACHEII 22±7; SOFA (día 1) 8±3. La VM en posición prono se aplicó en 20,4% y en 12,2% rescates especiales (12 óxido nítrico y 1 ECMO). La mortalidad hospitalaria y a 6 meses fue de 37,7 y 43,8% respectivamente. Los factores asociados a mortalidad fueron: edad, shock séptico en las primeras 72 h, presión plateau (Ppl) >30cmH2O durante las primeras 72 h y la presencia de comorbilidades preexistentes. No hubo diferencia de mortalidad entre los grupos moderado y grave (41,2 vs. 36,8%; p=0,25).
ConclusionesEn este estudio que incluyó pacientes con hipoxemia más grave y alto porcentaje con comorbilidades mayores, la mortalidad fue menor que en algunos estudios previos; no hubo incremento en la mortalidad después del egreso hospitalario. La clasificación de Berlín no diferenció el pronóstico entre los casos moderados y graves.
Mortality in Acute Respiratory Distress Syndrome (ARDS) is decreasing, although its prognosis after hospital discharge and the prognostic accuracy of Berlin's new ARDS stratification are uncertain.
MethodsWe did a restrospective analysis of hospital and 6 month mortality of patients with ARDS admitted to the Intensive Care Unit of a Univeristy Hospital in Buenos Aires, between January 2008 and June 2011. ARDS was defined by PaO2/FiO2 lower than 200 mmHg under ventilation with at least 10 cm H2O of PEEP and a FiO2 higher or equal than 0.5. and the presence of bilateral infiltrates in chest radiography, in the absence of cardiogenic acute pulmonary edema, during the first 72 hs of mechanical ventilation. Mortality associated risk factors, the use of rescue therapies and Berlin's stratification for moderate and severe ARDS patients were considered.
ResultsNinety eight patients were included; mean age was 59±19 years old, 42,9% had mayor co-morbidities; APACHE II at admission was 22±7; SOFA at day 1 was 8±3. Prone position ventilation was applied in 20,4% and rescue measures in 12,2% (12 patients with nitric oxide and 1 with extracorporeal membrane oxygenation). Hospital and 6 months mortality were 37.7 and 43.8% respectively. After logistic regression analysis, only age, the presence of septic shock at admission, Ppl >30 cmH2O, and major co-morbidities were independently associated with hospital outcome. There was no difference between moderate and severe groups (41,2 and 36,8% respectively; p=0,25).
ConclusionIn this cohort, including patients with severe hypoxemia and high percentage of mayor co-morbidities, ARDS associated mortality was lower than some previous studies. There was no increase in mortality after hospital discharge. There was no difference in mortality between moderate and severe groups according to Berlin's definition.
A pesar de un mejor conocimiento de la fisiopatología del síndrome de distress respiratorio agudo (SDRA) y de avances tecnológicos, existen controversias acerca de una reducción de la mortalidad con estudios epidemiológicos recientes en los que se observa una elevada tasa de muerte hospitalaria a pesar de la implementación de estrategias de ventilación mecánica (VM) protectora1–2. Sin embargo, en los pacientes con hipoxemia más grave, el uso de niveles más altos de presión positiva final espiratoria (PEEP) podría disminuir la mortalidad asociada a hipoxemia refractaria, la necesidad de terapias de rescate y los días de VM3–5. Asimismo, de acuerdo a un ensayo reciente, la VM en posición prona resultó en una mejoría significativa en la supervivencia6. No obstante, los ensayos clínicos randomizados suelen excluir pacientes gravemente enfermos y con peor pronóstico7. Por ello, puede ser de interés el reporte de datos pronósticos fuera de este tipo de estudios, con el uso de estrategias protectoras de VM con bajos volúmenes corriente y niveles más altos de PEEP8.
Una definición de SDRA recientemente propuesta ha incluido un nivel mínimo de PEEP para considerar la alteración de la oxigenación y ha clasificado la gravedad según el nivel de PaO2/FiO29. Desde su publicación algunos autores han cuestionado la utilidad clínica de dicha estratificación, dado que el valor inicial de PEEP en el momento del diagnóstico no parece tener relevancia en el pronóstico10,11. Al menos no sin adecuar el nivel de PaO2/FiO2 a un nivel estandarizado de PEEP y FiO2.
Este estudio tiene como objetivo describir la mortalidad de los pacientes con SDRA en nuestro servicio, incluyendo exclusivamente a pacientes con SDRA moderado o grave que persisten con hipoxemia después de 24h de VM con niveles ajustados de PEEP y FiO2, definir las condiciones asociadas a mortalidad y establecer si la clasificación de Berlín permite estratificar el pronóstico en nuestros pacientes.
Material y métodosPacientesRealizamos una revisión de las historias clínicas de todos los pacientes admitidos en nuestra Unidad de Cuidados Críticos entre enero de 2008 y junio de 2011. Seleccionamos inicialmente los pacientes mayores de 18 años con diagnóstico de SDRA definido por los criterios del consenso americano-europeo de 1994 (AECC 1994)12, seleccionando solo para el análisis de este estudio, los pacientes que tuvieran hipoxemia con una PaO2/FiO2 igual o menor a 200mmHg bajo VM con niveles de PEEP iguales o mayores a 10cm H2O y con una FiO2 igual o mayor a 0,5 dentro de las primeras 72 h de VM, y con una radiografía de tórax con infiltrados bilaterales en 4 cuadrantes en ausencia de edema agudo de pulmón cardiogénico. La decisión de incluir solo los pacientes con hipoxemia bajo un nivel de PEEP y FiO2 señalado se basó en un estudio en que una relación PaO2/FiO2 igual o menor a 200mmHg con al menos 10 cmH2O de PEEP, separó claramente el pronóstico de los pacientes.
Adquisición de datosLos datos fueron recolectados en forma retrospectiva de las historias clínicas de los pacientes ingresados en la Unidad de Cuidados Críticos de nuestro hospital universitario durante un periodo de 42 meses consecutivos. Se registraron los datos demográficos, etiológicos, APACHE II al ingreso, comorbilidades mayores (cáncer activo, trasplante de órgano sólido, trasplante de células hematopoyéticas y otros estados de inmunodepresión), intercambio gaseoso (pH, pCO2, pO2, PaO2/FiO2), parámetros de mecánica ventilatoria (presión pico, presión meseta [Ppl], PEEP total, presión de trabajo [Ppl menos PEEP total], Vt espirado, Vt por kilogramo de peso ideal [Vt/kg], compliance estática del sistema respiratorio) y el score de SOFA para valoración de disfunciones orgánicas13. En nuestro servicio, todos los pacientes son medidos al ingreso con cinta métrica consignando y registrando la talla y el peso ideal tanto en la historia clínica como en la tabla de monitorización diaria de los pacientes bajo ventilación mecánica.
Los datos de mecánica ventilatoria y de disfunción orgánica se obtuvieron a los días 1, 3, 7 y 10 de la VM. Se registró la mortalidad hospitalaria y a los 6 meses.
Se definió como hipoxemia e hipercapnia refractarias a la persistencia de una PaO2/FiO2 ≤ 80mmHg con FiO2 ≥ 0,9 por al menos una hora y de un pH ≤ 7,20 con PaCO2 ≥ 80mmHg respectivamente después de optimizar la ventilación mecánica con maniobras de reclutamiento, reducción del VT a entre 4 y 6ml/kg de peso ideal, aumento de la FR (limitado por la generación de auto-PEEP o PEEP intrínseca) y pronación del paciente por 12 h en los pacientes seleccionados. Todos los datos mencionados fueron recolectados de la ya mencionada tabla de monitorización de ventilación mecánica, utilizada en todos los pacientes bajo ventilación mecánica de nuestro servicio. La misma es actualizada cada 8 h desde el inicio de la ventilación mecánica hasta la extubación o fallecimiento del paciente. La VM en posición prona se aplicó en pacientes con valores de PaO2/FiO2 ≤100mmHg con al menos 15cm H2O de PEEP y después de maniobras de reclutamiento.
Todos los pacientes fueron ventilados con modo asistido/controlado por flujo con curva de flujo constante. La sedoanalgesia se realizó con infusión continua de midazolam o propofol más fentanilo y en ocasiones relajantes musculares a consideración del médico tratante.
Dado el carácter retrospectivo del estudio, que los datos fueron obtenidos de los habituales registros de los pacientes y que los datos filiatorios fueron preservados, el Comité de ética del hospital autorizó la realización del estudio.
Análisis estadísticoLas variables continuas se expresan como medias con desvío estándar o medianas con intervalo intercuartilo según corresponda. Las variables continuas y las proporciones fueron comparadas con test de t de Student o Chi-cuadrado respectivamente. Se realizó un modelo de regresión logística utilizando las variables que resultaron significativas en el análisis univariado entre vivos y muertos, considerando la mortalidad como resultado final.
Se utilizó un modelo forward stepwise. En todos los casos se consideró una p ≤ 0,05 como significativo.
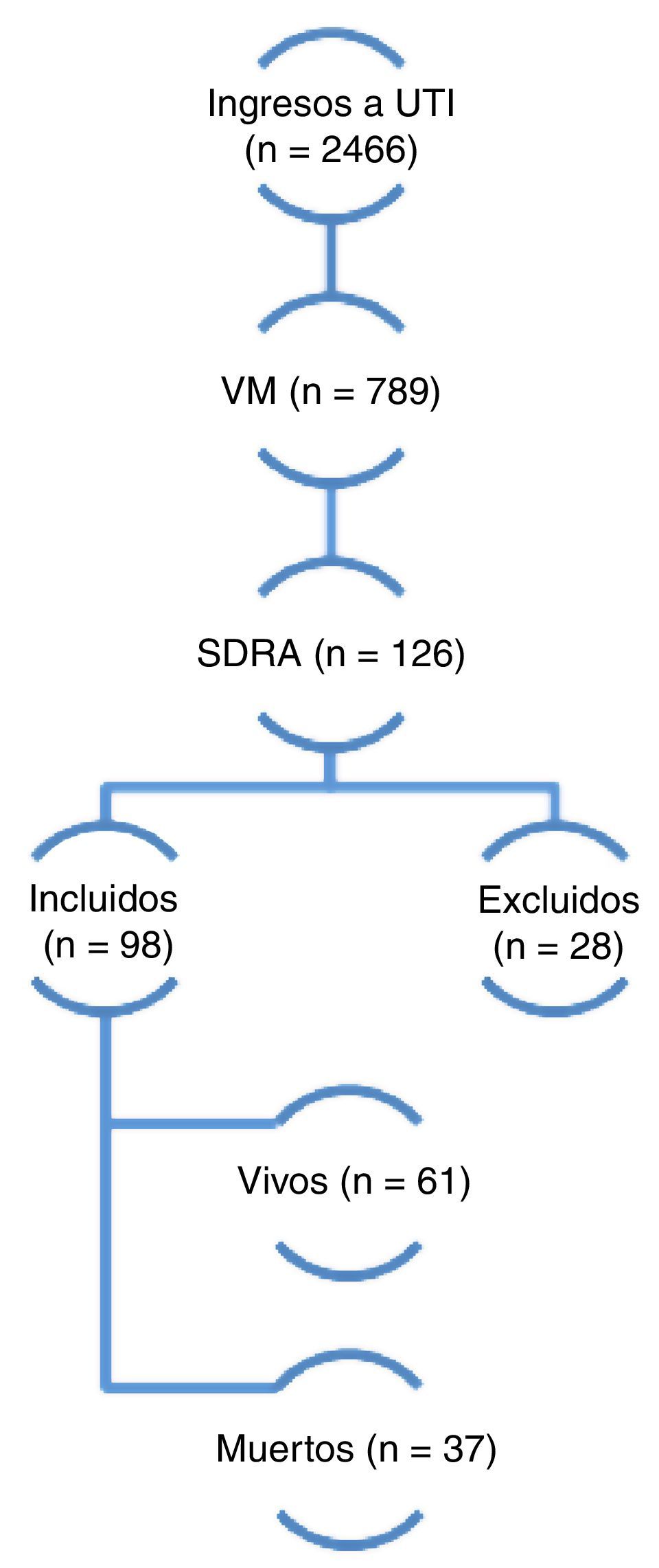
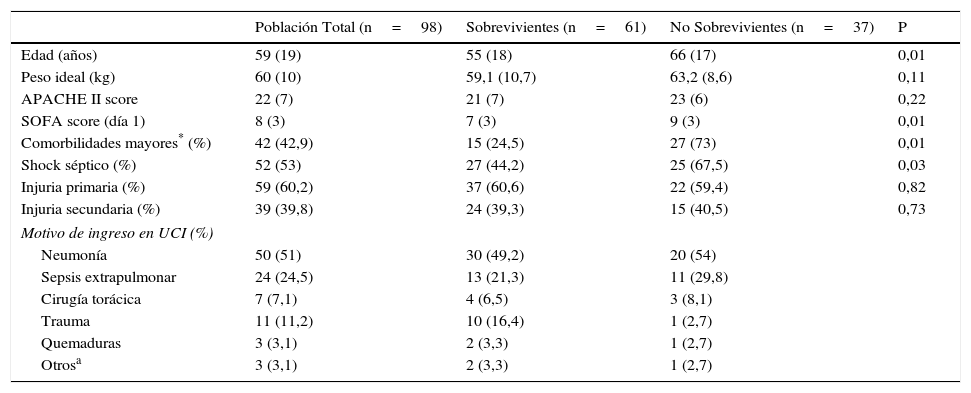
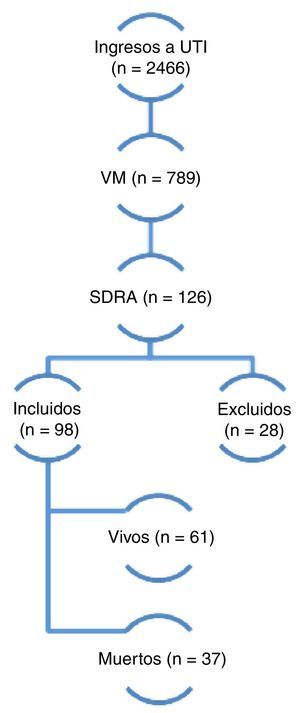
ResultadosDurante el período de estudio 2.466 pacientes fueron ingresados en la UCI y 789 requirieron ventilación mecánica. De estos, 98 (12,4%) cumplieron con los criterios de inclusión y fueron finalmente incluidos en el análisis (fig. 1). El seguimiento a 6 meses pudo completarse en 52 de 61 pacientes que egresaron vivos (85,2%). Los datos demográficos y fisiológicos se describen en la tabla 1. La edad media fue de 59 años, 57% fueron de sexo masculino, el APACHE II al ingreso fue de 22±7 puntos y la puntuación de SOFA al día 1 de 8±3 puntos.
Dos mil cuatrocientos sesenta y seis pacientes ingresaron en la Unidad de Cuidados Criticos en 42 meses consecutivos entre enero de 2008 y junio de 2011, 789 requirieron ventilación mecánica, 126 pacientes presentaron síndrome de distress respiratorio agudo según criterios del consenso americano-europeo de 1994 (AECC). De estos últimos 28 fueron excluidos por presentar mejoría en menos de 24 h al ajustar la ventilación mecánica con niveles adecuados de presión positiva de fin de espiración (PEEP) y FiO2. Finalmente 98 pacientes fueron incluidos al estudio de los cuales 37 fallecieron y 61 sobrevivieron (mortalidad global del 37,7%). VM: ventilación mecánica; SDRA: síndrome de distress repiratorio agudo.
Datos demográficos
| Población Total (n=98) | Sobrevivientes (n=61) | No Sobrevivientes (n=37) | P | |
|---|---|---|---|---|
| Edad (años) | 59 (19) | 55 (18) | 66 (17) | 0,01 |
| Peso ideal (kg) | 60 (10) | 59,1 (10,7) | 63,2 (8,6) | 0,11 |
| APACHE II score | 22 (7) | 21 (7) | 23 (6) | 0,22 |
| SOFA score (día 1) | 8 (3) | 7 (3) | 9 (3) | 0,01 |
| Comorbilidades mayores* (%) | 42 (42,9) | 15 (24,5) | 27 (73) | 0,01 |
| Shock séptico (%) | 52 (53) | 27 (44,2) | 25 (67,5) | 0,03 |
| Injuria primaria (%) | 59 (60,2) | 37 (60,6) | 22 (59,4) | 0,82 |
| Injuria secundaria (%) | 39 (39,8) | 24 (39,3) | 15 (40,5) | 0,73 |
| Motivo de ingreso en UCI (%) | ||||
| Neumonía | 50 (51) | 30 (49,2) | 20 (54) | |
| Sepsis extrapulmonar | 24 (24,5) | 13 (21,3) | 11 (29,8) | |
| Cirugía torácica | 7 (7,1) | 4 (6,5) | 3 (8,1) | |
| Trauma | 11 (11,2) | 10 (16,4) | 1 (2,7) | |
| Quemaduras | 3 (3,1) | 2 (3,3) | 1 (2,7) | |
| Otrosa | 3 (3,1) | 2 (3,3) | 1 (2,7) | |
APACHE II: Scores for the Acute Physiology, Age and Chronic Health Evaluation; SOFA: Sepsis-related Organ Failure Assesment.
Datos expresados como medias (desvío estándar), o número de pacientes (porcentaje).
La comorbilidad más frecuente fue el cáncer activo de órgano sólido en estadio avanzado, presente en 24 pacientes (24,5%); 14 pacientes (14,3%) tenían otros estados de inmunodepresión (5 con transplante de órgano sólido, 4 con leucemia aguda y trasplante de células hematopoyéticas, 2 con tratamiento inmunosupresor por lupus eritematoso sistémico, uno con tratamiento inmunosupresor por enfermedad de Wegener, uno con uso crónico de esteroides, uno con cirrosis CHILD C por virus de hepatitis B). Los principales diagnósticos al ingreso fueron neumonía (51%), sepsis extrapulmonar (24,5%), politraumatismo (11,2%) y cirugía torácica (7,1%).
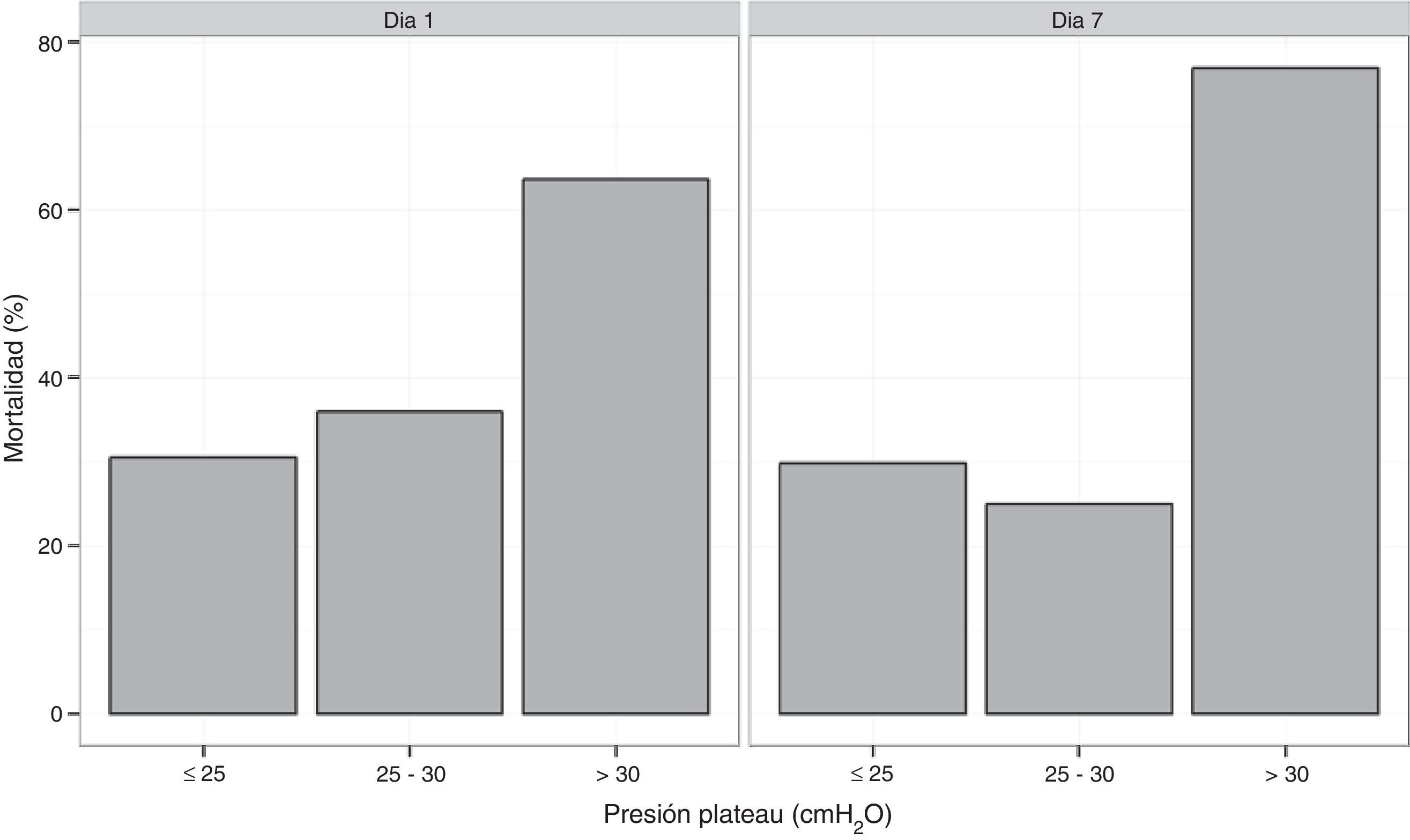
(fig. 2)
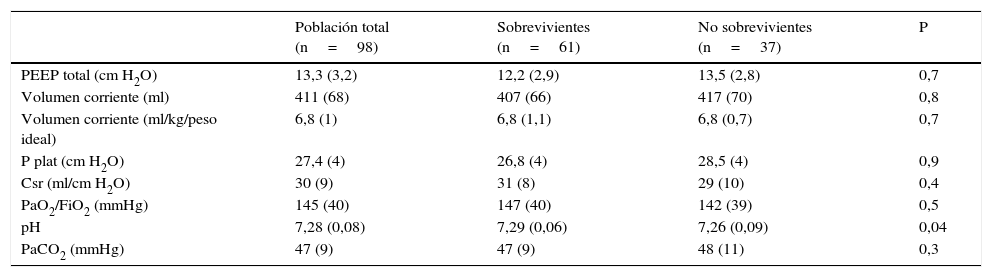
La PEEP y el Vt/kg utilizados en las primeras 48 h de VM fueron de 13,3 (±2,9) cm H2O y 6,8 (±1) ml/kg, respectivamente. La Ppl fue de 27,4 (±4) cm H2O (tabla 2). La PaO2/FiO2 al día 1 de VM fue de 145 (±40) mmHg. En 12 casos (12,2%) por hipoxemia o hipercapnia refractaria se utilizaron terapias de rescate: óxido nítrico (ON) en 12 pacientes y en uno de ellos a su vez, ECMO. La ventilación en posición prona se realizó en 20 pacientes (20,4%). Si bien no pudo realizarse un análisis comparativo al no tratarse de un estudio aleatorizado ni prospectivo, la mortalidad del conjunto de estos pacientes que recibieron tratamientos alternativos fue del 31%, menor a la mortalidad global mencionada en nuestra serie, aun siendo estos los pacientes con mayor compromiso ventilatorio y de oxigenación.
Mecánica ventilatoria y datos de intercambio gaseoso
| Población total (n=98) | Sobrevivientes (n=61) | No sobrevivientes (n=37) | P | |
|---|---|---|---|---|
| PEEP total (cm H2O) | 13,3 (3,2) | 12,2 (2,9) | 13,5 (2,8) | 0,7 |
| Volumen corriente (ml) | 411 (68) | 407 (66) | 417 (70) | 0,8 |
| Volumen corriente (ml/kg/peso ideal) | 6,8 (1) | 6,8 (1,1) | 6,8 (0,7) | 0,7 |
| P plat (cm H2O) | 27,4 (4) | 26,8 (4) | 28,5 (4) | 0,9 |
| Csr (ml/cm H2O) | 30 (9) | 31 (8) | 29 (10) | 0,4 |
| PaO2/FiO2 (mmHg) | 145 (40) | 147 (40) | 142 (39) | 0,5 |
| pH | 7,28 (0,08) | 7,29 (0,06) | 7,26 (0,09) | 0,04 |
| PaCO2 (mmHg) | 47 (9) | 47 (9) | 48 (11) | 0,3 |
Todos los datos fueron obtenidos al día 1 de la ventilación mecánica.
Csr: compliance estática del sistema respiratorio; FiO2: fracción inspirada de oxígeno; PaO2: presión parcial de oxígeno arterial; PaCO2: presión parcial de dióxido de carbono arterial; PEEP: presión positiva de fin de espiración; Pplat: presión meseta de fin de inspiración.
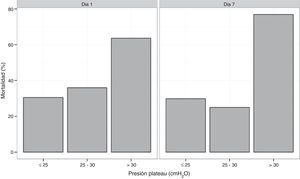
La mortalidad hospitalaria y a los 6 meses fue de 37,7% (37 de 98 pacientes) y 43,8% (39 de 89) respectivamente. Las estadías en UCI y hospitalarias fueron de 21 (14-39) y 34 (21-52) días respectivamente. La mortalidad fue mayor en los pacientes con comorbilidades (60,5 vs. 23,3%, p ≤ 0,01). Todos los pacientes con leucemia aguda y transplante de células hematopoyeticas fallecieron. La mortalidad en los pacientes con PaO2/FiO2 mayor a 100mmHg o menor o igual a 100mmHg no fue estadísticamente diferente (41,2 vs. 36,8%; p=0,25). En 27 pacientes la Ppl fue, durante al menos 24 h, superior a 30cm H2O en las primeras 48h. La mortalidad de este grupo fue de 63 vs. 28% en los casos con Ppl menor o igual a 30 cmH2O (p=0,002). Al agrupar los pacientes en 3 tercilos según rangos crecientes de Ppl: ≤25; >25-≤30; >30 cmH2O, la mortalidad fue progresivamente mayor (22,9, 41,9 y 55%, respectivamente; p=0,046) (fig. 2).
La presión de trabajo fue de 14,6 (±3,7) cm H2O en los pacientes que vivieron y 16,2cm H2O (±3,6) en los que fallecieron (p=0,04).
Otros factores asociados a mayor tasa de muerte fueron: presencia de shock séptico (67,5 vs.25.5%, p=0,03); score de SOFA al día 1 (8,9 [±3,1] vs.7,4 [±2,7] puntos, p=0,01).
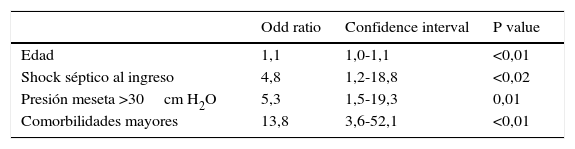
El modelo de regresión logística para predecir mortalidad hospitalaria, incluyó a la edad, el SOFA, la presión de trabajo (día 1), pH (día 1), Ppl >30 cmH2O durante al menos 24h en las primeras 48h, la presencia de comorbilidades mayores y el shock séptico. Solamente la edad, la presencia de shock séptico, la Ppl >30 cmH2O y las comorbilidades mayores se asociaron independientemente a mayor mortalidad (tabla 3).
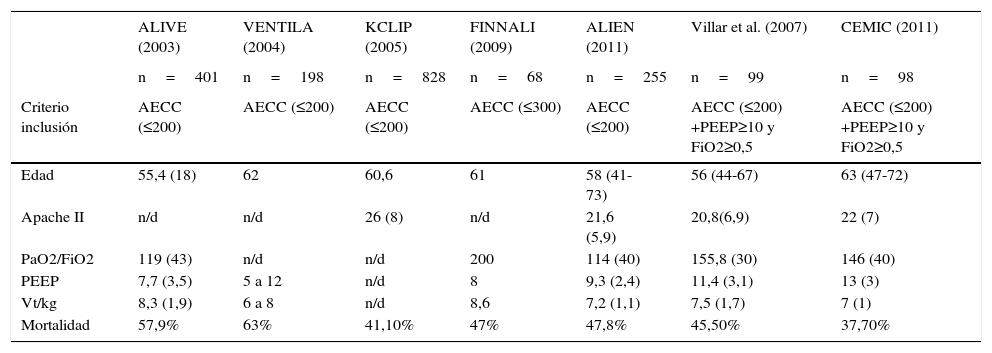
DiscusiónEn este estudio de pacientes con SDRA observamos que aun considerando los casos más graves la mortalidad fue menor que la reportada en estudios previos8,14–18 (tabla 4). Los factores asociados a mortalidad fueron la presencia de comorbilidades mayores, la edad, el shock séptico y la VM con Ppl mayor a 30cm H2O. A diferencia de lo propuesto en la clasificación de SDRA de Berlín donde se estratifica el pronóstico según el deterioro de la relación PaO2/FiO2, no encontramos diferencias significativas en la mortalidad entre los grupos de pacientes con SDRA moderado (PaO2/FiO2 mayor de 100mmHg y menor o igual a 200mmHg) y grave (PaO2/FiO2 menor o igual a 100mmHg)9.
Comparación de las principales variables demográficas y ventilatorias y de la mortalidad entre las distintas series publicadas y nuestra población
| ALIVE (2003) | VENTILA (2004) | KCLIP (2005) | FINNALI (2009) | ALIEN (2011) | Villar et al. (2007) | CEMIC (2011) | |
|---|---|---|---|---|---|---|---|
| n=401 | n=198 | n=828 | n=68 | n=255 | n=99 | n=98 | |
| Criterio inclusión | AECC (≤200) | AECC (≤200) | AECC (≤200) | AECC (≤300) | AECC (≤200) | AECC (≤200) +PEEP≥10 y FiO2≥0,5 | AECC (≤200) +PEEP≥10 y FiO2≥0,5 |
| Edad | 55,4 (18) | 62 | 60,6 | 61 | 58 (41-73) | 56 (44-67) | 63 (47-72) |
| Apache II | n/d | n/d | 26 (8) | n/d | 21,6 (5,9) | 20,8(6,9) | 22 (7) |
| PaO2/FiO2 | 119 (43) | n/d | n/d | 200 | 114 (40) | 155,8 (30) | 146 (40) |
| PEEP | 7,7 (3,5) | 5 a 12 | n/d | 8 | 9,3 (2,4) | 11,4 (3,1) | 13 (3) |
| Vt/kg | 8,3 (1,9) | 6 a 8 | n/d | 8,6 | 7,2 (1,1) | 7,5 (1,7) | 7 (1) |
| Mortalidad | 57,9% | 63% | 41,10% | 47% | 47,8% | 45,50% | 37,70% |
FiO2: fracción inspirada de oxígeno; PaO2: presión parcial de oxígeno arterial 1;PEEP: presión positiva de fin de espiración; Vt/kg: volumen corriente por kilogramo de peso ideal.
Existen controversias sobre si con la implementación de VM protectora se ha obtenido una disminución de la mortalidad del SDRA. Una revisión sistemática reciente que incluyó estudios realizados en la era de la ventilación protectora, no observó diferencias significativas en la mortalidad entre los años 1994 y 20062. Sin embargo, 2 de los estudios realizados con altos niveles de PEEP no fueron incluidos en este análisis (LOVS y Express)3,4. Si bien en estos dos ensayos no se observó mejoría en la supervivencia, en un metaanálisis5 que incluyó a estos trabajos y al estudio ALVEOLI19, se encontró una mejoría pronóstica en el subgrupo de pacientes con mayor compromiso de la oxigenación, expuestos a elevados niveles de PEEP.
En nuestra población, el criterio de selección de PEEP incluyó inicialmente el valor necesario para obtener una Ppl de hasta 28-30cm H2O (tal como es utilizado en el ensayo Express3) y en el grupo de pacientes con hipoxemias más profundas, la PEEP fue seleccionada por valoración de presión transpulmonar (Ptp) con el objetivo de alcanzar una Ptp de fin de espiración entre 0 y 5cm H2O20. Estos métodos de selección seguramente ocasionaron una aplicación de niveles más elevados, lo que podría haber contribuido, junto a la estricta selección de Vt bajos, a la reducción de la mortalidad observada en un grupo de pacientes con SDRA no leve. En dicho grupo la aplicación de elevados niveles de PEEP puede ser perjudicial5.
En un estudio previo con estratificación según FiO2 y PEEP en el grupo de pacientes con PaO2/FiO2 ≤200mmHg y al menos 10 cmH2O de PEEP, similar al criterio utilizado en la selección de nuestros pacientes, se reportó una mortalidad superior8, aunque no se pueda afirmar una diferencia estadística debido en parte al tamaño de las poblaciones de los 2 estudios. Entre distintos factores que podrían explicar esta diferencia, puede mencionarse la utilización de niveles más bajos de PEEP que en nuestro estudio (11,45±3,09 vs.13,3±2,9 cmH2O) y menor uso de medidas de rescate ante casos refractarios. En nuestra población, las terapias de rescate especiales fueron utilizadas en el 12% de los pacientes, especialmente inhalación de ON y en un solo caso oxigenación extracorpórea.
Aún es discutido el rol de las terapias de rescate en el manejo del SDRA. Por ejemplo no se ha demostrado una mejoría en la supervivencia con el uso de ON, pero los ensayos clínicos fueron realizados previos a la implementación de estrategias protectoras de VM y generalmente en pacientes que no presentaban déficits graves en la oxigenación21. Por otro lado, la utilización de ECMO ha tomado un nuevo impulso en los últimos años dados los avances tecnológicos y un ensayo clínico que ha demostrado beneficio en la sobrevida de pacientes seleccionados22–25.
Otra estrategia ventilatoria que puede haber contribuido a la mejor supervivencia observada podría ser la utilización de ventilación en posición prona, que fue mayor que en algunos estudios previos26 llegando a un 20,4% de la población. Hasta ahora, solo algunos ensayos han evaluado el efecto de la ventilación en posición prona sin mostrar mayores beneficios. Sin embargo, en un estudio reciente se observó mejoría significativa en la tasa de supervivencia con ventilación en prono precozmente aplicada y en sesiones más prolongadas junto con estrategias protectoras de VM6.
Otro aspecto a considerar en la estrategia ventilatoria es la recomendación general de mantener niveles inferiores a 30 cmH2O de Ppl27. Se cuestiona si esta recomendación aplica a todos los pacientes teniendo en cuenta que la verdadera presión que distiende el pulmón es la Ptp28. No obstante esta apreciación, tener una Ppl mayor a 30 cmH2O se asoció independientemente a mayor mortalidad. En este sentido algunos trabajos han demostrado la presencia de sobredistensión alveolar y liberación de mediadores inflamatorios con niveles de Ppl incluso superiores a 25cm H2O20,29. Seguramente el subgrupo de pacientes en los que se permitió Ppl mayores a 30cm H2O representen los casos más refractarios al tratamiento a pesar de la selección de niveles elevados de PEEP, estricta reducción del Vt y aplicación de maniobras de reclutamiento. La observación de mayor mortalidad en los pacientes que superaron los 30cm H2O de Ppl, podría avalar la implementación más precoz de terapias alternativas que a través de la remoción extracorpórea de CO2, puedan permitir reducir aún más el Vt aplicado, aún por debajo de los 4ml/kg30.
La diferencia en la mortalidad entre las distintas cohortes podría también explicarse por otros factores, tales como: criterios de selección de pacientes, sus características clínicas, la gravedad del SDRA y las comorbilidades. Las características clínicas previas de los pacientes son importantes en el pronóstico, especialmente la presencia de comorbilidades mayores como el cáncer o la inmunodepresión. En este estudio todos los pacientes receptores de un trasplante de células hematopoyéticas y neutropenia que desarrollaron SDRA grave fallecieron. La mortalidad en los pacientes inmunocomprometidos o con cáncer activo sigue siendo elevada dado que la causa que motiva el cuadro del SDRA suele ser difícil de revertir. Además no es infrecuente que estos pacientes presenten varias complicaciones subsecuentes31,32.
Otro factor asociado a mayor mortalidad fue la presencia concomitante de shock séptico y su asociación con fallo multiorgánico que podría explicar el peor pronóstico en comparación a otras etiologías de SDRA18,33. Finalmente la edad también estuvo asociada a menor supervivencia. Si bien se ha cuestionado el valor de la edad como marcador pronóstico en algunas patologías34, en el SDRA su asociación fue definida previamente en varios estudios18,35.
Recientemente se publicó una propuesta de nueva definición de SDRA, definición de Berlín, basada en la relación PaO2/FiO2 en pacientes ventilados con al menos 5cm H2O de PEEP9; así mismo proponen una estratificación pronóstica según el nivel de PaO2/FiO2. En nuestra serie, al igual que en algunas publicaciones recientes posteriores a la clasificación de Berlin10,11, no encontramos diferencias significativas en la mortalidad entre los grupos de pacientes con PaO2/FiO2 mayor o menor a 100mmHg. Es posible que la aplicación de ventilación en posición prona en los pacientes con mayor alteración del intercambio gaseoso y la posibilidad de utilización de medidas de rescate especiales, hayan contribuido a disminuir la mortalidad en los casos más graves. Por otra parte la mortalidad del SDRA depende no solo del grado de injuria pulmonar sino además de las condiciones basales del paciente y la presencia de otras disfunciones orgánicas.
Aunque tuvimos algunos datos faltantes para el registro de la mortalidad a 6 meses (se perdieron 9 pacientes), solo 2 de los pacientes que fueron dados de alta del hospital fallecieron en ese periodo de seguimiento, los cuales presentaban comorbilidades preexistentes. Los reportes epidemiológicos en general solo reportan la mortalidad hospitalaria y/o a 90 días14–18. En series con seguimiento a más largo plazo, déficits pulmonares, cognitivos, neuromusculares y psicológicos son hallados aun hasta 5 años después del episodio de SDRA36–39. En un estudio epidemiológico con 109 supervivientes, la mortalidad reportada a 12 meses fue del 11%, con la mayoría de los eventos ocurridos durante los primeros meses37.
Nuestro trabajo cuenta con varias limitaciones. Primero, su carácter retrospectivo aumenta el riesgo de que existan datos faltantes. Sin embargo pudimos recabar la información completa de la mayoría de los pacientes, incluso después del alta. Segundo, al ser un trabajo de un solo centro, su validez externa podría ser cuestionada. Tercero, otras condiciones que podrían impactar en la sobrevida como la neumonía asociada a ventilación mecánica y el neumotórax, no fueron consignadas. Finalmente si bien evaluamos la mortalidad a largo plazo, no efectuamos análisis de morbilidad, dependencia crónica de la VM y otras discapacidades.
Si la implementación de VM protectora impactará en mejor pronóstico mas allá de los estudios controlados, requerirá de estudios epidemiológicos multicéntricos con gran número de pacientes.
En conclusión, nuestros hallazgos sugieren que la mortalidad del SDRA grave es menor a la reportada en años anteriores y que la misma está independientemente asociada a la edad, el shock séptico, la VM con Ppl mayor a 30cm H2O y la existencia de comorbilidades preexistentes. La VM usando bajos Vt y niveles elevados de PEEP junto a la ventilación en posición prona y la implementación de medidas de rescate en pacientes con hipoxemia o hipercapnia refractarias pueden haber contribuido a este potencial beneficio en la supervivencia. En los pacientes que fueron egresados del hospital no observamos un incremento de mortalidad en la evaluación a 6 meses. La clasificación de Berlín no permitió estratificar el pronóstico entre los casos con SDRA grave y moderado.
Conflicto de interesesLos autores reconocen no haber recibido ningún financiamiento para la realización de este trabajo y no tienen ningún conflicto de intereses para declarar.
Este trabajo fue presentado en el 22.° Congreso Argentino de Terapia Intensiva.