La enfermedad crítica se caracteriza por estrés oxidativo, el cual conduce a una disfunción orgánica múltiple, siendo dicha disfunción secundaria a sepsis la causa más frecuente de mortalidad en la unidad de cuidados intensivos. Durante las últimas 2 décadas, se ha acumulado una evidencia creciente a favor del uso de los micronutrientes antioxidantes en los pacientes críticos. De acuerdo con la evidencia reciente, la terapéutica con selenio puede ser considerada como la piedra angular dentro de las estrategias antioxidantes en la sepsis. El selenio, administrado como selenito de sodio o ácido selenioso, se comporta como un fármaco o nutrofármaco con efecto citotóxico y prooxidante cuando una dosis de carga en forma de bolo intravenoso es administrada en la fase precoz de la sepsis grave y el shock séptico. Hasta el momento, diversos estudios fase ii sobre suplementación de selenio han demostrado que esta estrategia es capaz de disminuir la mortalidad, la severidad de la disfunción orgánica y las infecciones. En el futuro próximo, nuevos estudios fase iii deberán confirmar los efectos de la farmaconutrición parenteral con selenio en la sepsis. En la presente revisión se discute la evidencia actual sobre la farmaconutrición con selenio en la sepsis.
Critical illness is characterized by oxidative stress which leads to multiple organ failure, and sepsis-related organ dysfunction remains the most common cause of death in the intensive care unit. Over the last 2 decades, different antioxidant therapies have been developed to improve outcomes in septic patients. According to recent evidence, selenium therapy should be considered the cornerstone of the antioxidant strategies. Selenium given as selenious acid or sodium selenite should be considered as a drug or pharmaconutrient with prooxidant and cytotoxic effects when a loading dose in intravenous bolus form is administered, particularly in the early stage of severe sepsis/septic shock. To date, several phase ii trials have demonstrated that selenium therapy may be able to decrease mortality, improve organ dysfunction and reduce infections in critically ill septic patients. The effect of selenium therapy in sepsis syndrome must be confirmed by large, well designed phase iii clinical trials. The purpose of this review is to discuss current evidence on selenium pharmaconutrition in sepsis syndrome.
La enfermedad crítica con síndrome de respuesta inflamatoria sistémica (SRIS) se caracteriza por la existencia de estrés oxidativo; el estrés oxidativo se define como el desequilibrio entre la hiperproducción de radicales libres (especies reactivas de oxígeno y nitrógeno) y la disminución de los mecanismos de defensa antioxidante endógenos1–3. Durante la disfunción orgánica múltiple (DOM) de la sepsis grave, la respuesta inflamatoria y el estrés oxidativo que subyacen a la misma inducen disfunción mitocondrial y muerte celular4–6. Asimismo, el grado del estrés oxidativo se correlaciona con la severidad de la sepsis grave. En efecto, Huet et al.7 evaluaron la producción de radicales libres in vitro mediante la exposición de plasma extraído de pacientes sépticos a células endoteliales de cordón umbilical. Estos autores fueron capaces de demostrar que en los pacientes con sepsis grave/shock séptico el grado de estrés oxidativo se correlaciona con el score Sequential Organ Failure Assessment (SOFA) (p= 0,0012) y con el Simplified Acute Physiology Score II (SAPS II) (p=0,028)7.
A pesar del advenimiento de nuevas terapias de sostén, en las últimas 2 décadas no ha sido posible abatir las cifras de mortalidad por sepsis grave, siendo esta la causa más frecuente de muerte en la UCI. En la actualidad, la mortalidad global de la sepsis se mantiene en un 31%, en tanto que esta cifra asciende al 70% en aquellos pacientes que desarrollan DOM (sepsis grave)8. Por su parte, Annane et al.9 demostraron que las tasas de mortalidad entre los pacientes críticos con sepsis grave oscilan entre el 21 y el 53%.
En tal sentido, durante los últimos años se han desarrollado diferentes terapias adyuvantes, las cuales tienen como objetivo disminuir la morbimortalidad de la sepsis. Entre estas estrategias terapéuticas, la farmaconutrición con micronutrientes antioxidantes, y en particular con altas dosis de selenio intravenoso, con frecuencia administrado como selenito de sodio –Na2SeO3– en su forma pentahidratada –5-H2O-Na2SeO3–, ha sido evaluada en diferentes ensayos clínicos. En este sentido, de acuerdo con la literatura reciente, la suplementación de selenio intravenoso podría ser considerada la piedra angular dentro de la estrategia terapéutica antioxidante en terapia intensiva10,11.
El objetivo del presente artículo de revisión es analizar el estado actual del conocimiento sobre la monoterapia con selenio como estrategia farmacológica antioxidante en la sepsis grave y el shock séptico.
Niveles de selenio en la enfermedad críticaEl contenido corporal total de selenio es de 20-40mg, encontrándose en el plasma el 1% del total corporal, siendo el 60% transportado por la selenoproteína P y el 30% por la glutatión peroxidasa extracelular (GPx-3)12–14.
En el paciente crítico con SRIS se asiste a una disminución de los niveles circulantes de diversos micronutrientes (vitaminas y oligoelementos), entre los cuales el selenio ha sido uno de los más extensamente estudiados12,13. El SRIS se caracteriza por hiperpermeabilidad y fuga capilar, con una redistribución de micronutrientes desde el espacio intravascular hacia el compartimento intersticial, siendo esta la causa más importante que explica el descenso de los niveles circulantes de selenio. Asimismo, existen factores que explican una verdadera deficiencia de selenio en los pacientes críticos, tales como un déficit previo, quemaduras extensas con exudación profusa y otras pérdidas en diferentes fluidos biológicos (fístulas, drenajes, etc.), empleo de técnicas de reemplazo renal (TRR) y nutrición enteral con aportes habitualmente no superiores a los 60μg/L de fórmula enteral, o nutrición parenteral (NP) con dosis convencionales de selenio (<100μg/d)15.
En 1998, Forceville et al.16 constataron en 134 pacientes críticos con sepsis/sepsis grave que aquellos con shock séptico exhibían los niveles más bajos de selenio plasmático dentro de las primeras 24h de ingreso en la UCI, con una reducción próxima al 40% de los valores normales. Asimismo, los autores demostraron que en aquellos pacientes con una concentración de selenio inferior a 0,7mmol/L se apreciaba un incremento significativo de la mortalidad, así como de la incidencia de DOM y neumonía asociada a la ventilación mecánica16.
Por su parte, en 2007 Sakr et al.17 demostraron la existencia de una correlación negativa entre el mínimo valor de selenio plasmático y el score Acute Physiology and Chronic Health Evaluation II (APACHE II), en tanto que el nivel de selenio y el SAPS II tuvieron un fuerte valor predictivo para mortalidad en la UCI (AUC para selenio 0,867 y para SAPS II 0,903)17.
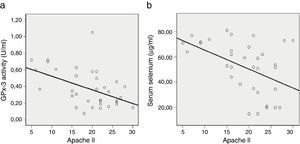
Posteriormente nuestro grupo demostró que los niveles séricos de selenio y GPx-3 descendían precozmente a las 24h luego del ingreso en UCI en los pacientes críticos con SRIS y DOM (p=0,0001 y p=0,002, respectivamente)18, exhibiendo el selenio sérico un buen valor predictivo para mortalidad en UCI (p=0,034). Por otra parte, se constató una relación negativa entre selenio sérico y GPx-3 con la puntuación del score APACHE II (r2=0,225, p=0,003 y r2=0,209, p=0,005 para selenio y GPx-3, respectivamente)18 (fig. 1).
Relación entre la actividad de glutatión peroxidasa 3 y selenio sérico, y el score APACHE II.
GPx-3 vs. APACHE II, r2=0,225, p=0,003; Sevs. APACHE II, r2=0,209, p=0,005.
APACHE II: Acute Physiology and Chronic Health Evaluation II; GPx-3: glutatión peroxidasa 3; Se: selenio sérico; UCI: Unidad de Cuidados Intensivos.
Fuente: Manzanares et al.18, con permiso.
Sin embargo, recientemente fueron reportados niveles de selenio plasmático normales dentro de las primeras 24h de ingreso en UCI, en pacientes con 2 o más disfunciones orgánicas en Estados Unidos, donde los valores normales en la población sana son habitualmente mayores a los que presentan las poblaciones de Europa y América Latina19.
Propiedades farmacológicas de los selenocompuestosDentro de las diferentes formulaciones químicas de selenio, el selenito de sodio (Na2SeO3) en su forma pentahidratada y el ácido selenioso –H2SO3– son las 2 formulaciones inorgánicas disponibles en la práctica clínica para aporte de selenio por vía parenteral20. El uso controlado de selenito en las etapas iniciales de un estado inflamatorio severo como el shock séptico ha cobrado notable interés a partir del reconocimiento del efecto prooxidante y citotóxico del mismo. En efecto, un bolo intravenoso inicial de selenito utilizado como una intervención farmacológica (droga o fármaco) logrando una concentración mayor de 5μmol/L es capaz de inhibir la unión del factor de transcripción nuclear kappa-B (NF-κB) a la molécula de ADN mediante la rotura reversible de los puentes disulfuro con una posible formación de aductos RS-Se-SR20,21. En tal sentido, la dosis de carga de selenito (bolo) tendría una acción bifásica: a) efecto prooxidante inicial, y b) acción antioxidante cuando el átomo de selenio se incorpora al sitio activo de las selenoenzimas13,14.
En los pacientes con shock séptico, este efecto prooxidante transitorio inicial del selenito puede ser utilizado como una estrategia terapéutica antiinflamatoria. Los efectos de una dosis de carga (bolo intravenoso) en la fase temprana de shock séptico podría ser capaz de provocar: a) una inhibición directa y reversible de la unión del factor de trascripción nuclear kappa B NF-κB, controlando la expresión de genes proinflamatorios y, por lo tanto, la síntesis de citocinas proinflamatorias en la etapa temprana de SRIS22,23, b) una inducción de la apoptosis y citotoxicidad en células circulantes proinflamatorias activadas en la microcirculación24, y c) un efecto directo virucida y bactericida23.
En un modelo animal de sepsis grave abdominal, Wang et al.25 han evaluado los efectos bioquímicos y clínicos de 2 esquemas diferentes de suplementación de selenio. El primer grupo recibió un bolo intravenoso inicial de selenito de sodio (2,000μg) seguido de una infusión intravenosa continua de 0,06μg/kg/h. Por su parte, el segundo grupo recibió una infusión continua de 4μg/kg/h sin bolo inicial. El análisis de los resultados mostró que solo aquellos animales que recibieron el bolo intravenoso exhibieron una mejoría en el estado hemodinámico evaluado mediante presión arterial media, índice cardiaco e índice de volumen sistólico, con una mejor respuesta a la reposición de volumen25. Estos datos muestran que en el shock séptico, el efecto prooxidante y antiinflamatorio del bolo inicial de selenito puede ser beneficioso, aunque estos efectos nunca han sido demostrados en humanos. Sin embargo, en un reciente metaanálisis, Huang et al.26, luego de agregar 4 ensayos clínicos aleatorizados (ECA) que administraron una dosis de carga inicial (bolo intravenoso) de selenito de sodio o ácido selenioso, demostraron que esta estrategia se asociaba a una reducción significativa de la mortalidad en la sepsis (RR 0,73, IC 95% 0,58-0,94; p=0,01)26.
Por su parte, nuestro estudio dosis-respuesta fase i evaluó el perfil farmacocinético y farmacodinámico del selenio en el SRIS27. Este estudio concluyó que el aporte de una dosis de carga inicial de 2.000μg de ácido selenioso en un período de 2h, seguido de una infusión continua de 1.600μg/d, es efectivo para normalizar la actividad GPx-3 a partir del día 2 y hasta el día 7 de infusión27.
Farmaconutrición parenteral con selenio como monoterapia antioxidante: análisis de estudios aleatorizadosEl concepto de farmaconutrición supone la administración de ciertos nutrientes considerados como fármacos o nutracéuticos, los cuales son suplementados en dosis supranutricionales y en forma independiente de la nutrición estándar, lo cual asegura el aporte de la dosis preestablecida del nutracéutico28. Con respecto a la monoterapia con selenio intravenoso, en las últimas 2 décadas diferentes ECA han evaluado el rol del selenio intravenoso en diferentes escenarios clínicos, pero en particular en pacientes con SRIS y sepsis/sepsis grave (tabla 1). Por otra parte, dentro de los mismos, aquellos ECA que han mostrado resultados positivos han sido los que administraron con éxito una dosis de carga inicial continuando posteriormente con una infusión intravenosa durante períodos de tiempo variables entre 7 y 14 días. Por el contrario, la ausencia del bolo intravenoso inicial ha demostrado ser clínicamente ineficaz10.
Ensayos clínicos más importantes sobre monoterapia intravenosa con selenio como estrategia farmaconutriente
| Referencia | Población de pacientes | Dosis de selenio | Resultado clínico |
| Angstwurm et al. (1999)48 | Adultos con sepsis severa (n=42) | 500μg días 1-3, 250μg días 4-6, 125μg durante 3 días, y posteriormente 35μg/día (n=21) | Reducción incidencia de fallo renal que requirió hemodiálisis (p=0,035). Reducción de la mortalidad (52 vs. 33,5%, p=0,13) |
| Angstwurm et al. (2007)29 | Sepsis severa, shock séptico. APACHE III>70 (n=249) | Día 1: dosis de carga 1.000μg en 30min y luego infusión continua: 1.000μg/d por 14 días | Intención de tratar (39,7 vs. 50%, p=0,109). Análisis por protocolo (n=189), descenso significativo de la mortalidad (‘p=0,049) |
| Mishra et al. (2007)30 | Sepsis severa. APACHE II>18 (n=40) | Días 1-3: 474μg; días 4-6: 316μg; días 7-9: 158μg; días 9-14: 31,6μg. En infusión continua (n=18) | Correlación negativa entre selenio plasmático y score SOFA (r=−0,36, p=0,03). No diferencia en mortalidad (p=0,95) ni TRR (p=0,99) |
| Forceville et al. (2007)31 | Sepsis severa/shock séptico. APACHE II>25 (n=60) | Día 1: dosis de carga 4.000μg/24h y luego 1.000μg/d por 9 días (n=31) | Sin efecto en outcomes clínicos: tiempo para suspender catecolaminas, estancia hospitalaria y en UCI, días de VM y mortalidad a los 28 d (p=0,59) |
| Montoya et al. (2009)49 | Pacientes con SRIS y sospecha de infección (n=68) | Día 1: dosis de carga 1.000μg; día 2: 500μg, y luego 200μg/d por 7d (n=34) | Reducción de PCR a partir del día 5 |
| Valenta et al. (2011)33 | Sepsis severa/SRIS. APACHE II>30 (n=150) | Día 1: dosis de carga 1.000μg en 30min, y luego infusión de 30min de 500μg/d (2-14) (n=75) | Correlación negativa entre selenio y PCR (p=0,035), PCT (p=0,022) y SOFA (p=0,001) a la admisión, pero no a los 7 y 14 días |
| Manzanares et al. (2011)32 | Sepsis severa/SRIS. APACHE II>15 (n=35) | Día 1: dosis de carga 2.000μg en 2h, y luego infusión continua de 1.600μg/d por 10 d (n=15) | Reducción del score SOFA (1,3±1,2 vs. 4,6±2,0, p=0,0001), NAV precoz (6,7 vs. 37,5%, p=0,04) y neumonía nosocomial postalta de UCI (p=0,03) |
| Andrews et al. (2011)34 | Fallo intestinal que requiere NP (n=502) | Selenio: 500μg/d hasta 7 días (n=127) | Reducción de la incidencia de infecciones en pacientes suplementados al menos 5 d con selenio (OR 0,53, 0,30-0,93) |
APACHE II: Acute Physiology and Chronic Health Evaluation II; n: número de pacientes; NAV: neumonía asociada al ventilador; NP: nutrición parenteral; SOFA: Sequential Organ Failure Assessment; PCR: proteína C reactiva; PCT: procalcitonina; OR: odds ratio; SRIS: síndrome de respuesta inflamatoria sistémica; TRR: técnicas de reemplazo renal; UCI: Unidad de Cuidados Intensivos; VM: ventilación mecánica.
Uno de los ECA más importantes sobre suplementación de selenio en pacientes críticos es el Selenium in Intensive Care29, un ECA multicéntrico, realizado en 11 UCI de Alemania. Este estudio incluyó 249 pacientes con SRIS, sepsis severa, shock séptico y una puntuación APACHE III mayor de 70. Los pacientes fueron aleatorizados para recibir 1.000μg de selenito de sodio (Selenase®, Biosyn, Alemania) como un bolo intravenoso inicial en 30min seguido de una infusión intravenosa continua de 1.000μg/d durante 14 días o placebo29. Los niveles plasmáticos de selenio y la actividad GPx-3 se mantuvieron dentro de límites fisiológicos durante todo el período de estudio, no habiéndose referido efectos tóxicos atribuibles al uso de altas dosis de selenio. El análisis por intención de tratar mostró que la mortalidad fue del 50,0% en el grupo placebo y del 39,7% en el grupo terapéutico (p=0,109). Sin embargo, el análisis «por protocolo» reveló que la mortalidad a los 28 días en el grupo terapéutico fue significativamente menor (42,4 vs. 56,7%, p=0,049, OR 0,56, IC 95% 0,32-1,00)29. Es importante destacar que la reducción en las cifras de mortalidad fue significativamente más importante en los pacientes más graves, en particular en aquellos con shock séptico, coagulación intravascular diseminada (p=0,018), DOM con más de 3 órganos en fallo (p=0,039) y en los que exhibían mayor severidad de su enfermedad crítica con un APACHE III>102 (p=0,04)29.
En otro ECA, Mishra et al.30 en 40 pacientes con sepsis severa evaluaron el efecto de la suplementación de selenio sobre parámetros bioquímicos y clínicos relevantes en la UCI. El esquema de suplementación de selenio en el grupo terapéutico fue de 474μg/d, 316μg/d y 158μg/d, cada dosis repetida durante 3 días consecutivos, continuando posteriormente con una dosis diaria estándar de 31,6μg/d (0,4μmol/d). Este protocolo de suplementación de selenito de sodio no se asoció a una reducción significativa de la mortalidad, aunque sí redujo la puntuación del score SOFA los días 7 y 10, con una correlación negativa entre los valores de selenio plasmático y el score SOFA (r=−0,36; p=0,03)30. Sin embargo, el estrés oxidativo evaluado mediante la determinación de los niveles de F2 isoprostanos no disminuyó significativamente en el grupo suplementado con altas dosis de selenio30.
En el año 2007, Forceville et al.31 publicaron los resultados del ensayo multicéntrico francés que seleccionó a 60 pacientes críticos con sepsis grave/shock séptico. En este ECA los pacientes intervenidos con selenio (n=31) recibieron una dosis de 4.000μg de selenito de sodio en perfusión continua de 24h durante el día 1 del estudio, continuando luego con una infusión continua de 1.000μg/d durante 9 días (total: 13mg en 10 días)31. El análisis de los resultados reveló que la mortalidad no se redujo significativamente en el grupo terapéutico (45 vs. 45%, p=0,59, al día 28; 59 vs. 68%, p = 0,32, a los 6 meses en el grupo placebo y terapéutico, respectivamente)31. Estos resultados difieren de los obtenidos en el estudio Selenium in Intensive Care29, lo cual lleva a plantear que los malos resultados pueden ser debidos a la omisión del efecto antiinflamatorio inicial de bolo intravenoso de selenito de sodio.
En 35 pacientes críticos con un score APACHE II>15, nuestro grupo condujo un ECA fase ii32 suplementando en el grupo intervenido un bolo inicial de ácido selenioso (Selenio®, Rivero, Argentina) de 2,000μg durante 2h, continuando con 1.600μg en infusión continua durante 10 días. Al final del período de estudio, el grupo intervenido presentó una reducción significativa en la variación del score SOFA entre el día 1 y 10 (1,3±1,2 vs. 4,6±2,0, p=0,0001), así como una menor incidencia de neumonía asociada al ventilador temprana (6,7 vs. 37,5%, p=0,04) y de neumonía nosocomial en los primeros 28 días (p=0,03)32. Finalmente, el aporte de selenio no se asoció con una mayor incidencia de eventos adversos durante los primeros 28 días de seguimiento32.
Por su parte, el estudio checo liderado por Valenta et al.33 administró un bolo inicial de 1.000μg de selenito de sodio, continuando luego con una dosis diaria en perfusión rápida de 500μg en 30min durante los días 2 a 14. De modo similar a nuestros hallazgos, estos autores demostraron un aumento significativo en los niveles de selenio plasmático y de la actividad GPx-3 (p<0,001)33. Sin embargo, la evolución temporal de los parámetros inflamatorios fue similar en los 2 grupos estudiados. Por otra parte, una correlación negativa fue demostrada entre los niveles de selenio plasmático y la procalcitonina (p=0,022), así como con el score SOFA (p=0,001) en la admisión a UCI. La mortalidad a los 28 días fue levemente, aunque no de modo significativo, inferior en el grupo intervenido con selenio (25 vs. 32%). Asimismo, se constató una tendencia hacia la reducción de la mortalidad en aquellos pacientes más graves (APACHE II>28) que fueron tratados con selenio intravenoso33.
El ECA multicéntrico Scottish Intensive care Glutamine or seleNium Evaluative Trial34 probó una combinación de glutamina y selenio incorporándolo a un régimen de NP estándar, por lo cual no constituyó una verdadera estrategia farmaconutriente. Sin embargo, en este ensayo clínico de diseño factorial 2×2 hubo una reducción en la incidencia de nuevas infecciones (OR 0,53, IC 95% 0,30-0,93) en el subgrupo de pacientes que recibieron NP suplementada con selenito de sodio durante al menos 5 días34.
Hasta el momento actual, el estudio REDOXS35 constituye el ECA multicéntrico, multinacional, más importante sobre farmaconutrición con glutamina y antioxidantes en pacientes críticos con 2 o más disfunciones orgánicas. El estudio REDOXS seleccionó 1.223 pacientes adultos críticos que recibieron un cóctel de antioxidantes constituido por vitamina C (1.500mg), E (500mg), betacaroteno (10mg), cinc (20mg) y selenio (300μg) por vía enteral asociado a selenito de sodio intravenoso (500μg/d), recibiendo una dosis diaria total de selenio de 800μg35. Esta estrategia de suplementación antioxidante demostró ser segura, aunque no fue capaz de mejorar ningún resultado clínico de relevancia, tales como mortalidad a los 90 días, estancia en UCI y estancia hospitalaria. Sin embargo, es necesario puntualizar que el esquema de administración de selenio careció del bolo intravenoso inicial, por lo que pudieron no haberse constatado los efectos protectores antiinflamatorios atribuibles a altas concentraciones de selenio en sangre35. Además, los pacientes suplementados con antioxidantes recibieron una dosis diaria insuficiente de selenio, puesto que de acuerdo con la evidencia más reciente parece que una dosis mayor de 1.000μg/d es necesaria para optimizar los resultados. Finalmente, en la actualidad carecemos del conocimiento suficiente sobre el perfil farmacocinético y farmacodinámico del selenio administrado por vía enteral en los pacientes críticos con DOM e hipoperfusión esplácnica36.
Para terminar, el recientemente finalizado estudio Sodium Selenite and Procalcitonin Guided Antimicrobial Therapy in Severe Sepsis37 (ClinicalTrials.gov, NCT00832039) ha enrolado a más de 1.200 pacientes. Este estudio tuvo como objetivo primario evaluar todas las causas de mortalidad a los 28 días. Para ello, los autores administraron una dosis de carga inicial de 1.000μg, seguida de una infusión intravenosa de 1.000μg/d en la sepsis grave/shock séptico hasta el egreso y por un período no mayor de 21 días37. Tal vez este ECA ayude a clarificar de modo definitivo el rol del selenio en los pacientes críticos con sepsis/sepsis grave.
Selenio como monoterapia antioxidante en la sepsis: evidencia actualDe acuerdo con la literatura existente, la cual ha sido analizada en la presente revisión, existe evidencia suficiente que avala la farmaconutrición parenteral con selenio en pacientes críticos y, en particular, en aquellos con sepsis grave y shock séptico10.
En el año 2005, Heyland et al.38 publicaron la primera revisión sistemática de la literatura y metaanálisis, donde demostraron que los micronutrientes antioxidantes pueden ser capaces de reducir de modo significativo la mortalidad (RR 0,65, IC 95% 0,44-0,97, p=0,03). Asimismo, estos autores fueron capaces de demostrar que una dosis diaria de selenio intravenosa superior a 500μg se asociaba con una tendencia a reducir la mortalidad (RR 0,52, IC 95% 0,24-1,14, p=0,10)38. Más recientemente, en el año 201239, el mismo grupo canadiense, luego de agregar 20 ECA, demostró que la administración de antioxidantes puede ser capaz de reducir significativamente la mortalidad en los pacientes críticos (RR 0,82, IC 95% 0,72-0,93, p=0,002)39. Asimismo, esta estrategia estuvo asociada con una reducción significativa en el tiempo de ventilación mecánica (diferencia media en días=−0,67, IC 95% −1,22 a −0,13, p=0,02) y una tendencia a la reducción de las infecciones (RR 0,88, IC 95% 0,76-1,02, p=0,08)39. Por otra parte, es importante destacar que el análisis de aquellos ECA con una mortalidad mayor del 10% en el grupo control mostraron una reducción significativa de la mortalidad (RR 0,79, IC 95% 0,68-0,92, p=0,003), mientras que no hubo un efecto en los ECA con una mortalidad inferior al 10% en el grupo de control (RR 1,14, IC 95% 0,72-1,82, p=0,57)39. De acuerdo con este hallazgo, los autores especularon que aquellos pacientes con mayor severidad del daño, y por consiguiente con un grado mayor de estrés oxidativo y disfunción mitocondrial, exhiben una mayor deficiencia de antioxidantes endógenos y exhiben los mayores beneficios con la administración de estos. Por otra parte, la monoterapia con selenio parenteral mostró una tendencia (definiendo tendencia por un valor p<0,20), aunque sin significación estadística, hacia la reducción de la mortalidad (RR 0,89, IC 95% 0, 77-1,03, p=0,12) y de las complicaciones infecciosas (RR 0,87, IC 95% 0,74-1,02, p=0,08)39.
A lo largo de este último año, en un nuevo metaanálisis que evaluó 9 ECA sobre monoterapia con selenio en la sepsis, Alhazzani et al.40 demostraron una reducción significativa de la mortalidad (RR 0,73, IC 95% 0,54-0,98, p=0,03). Sin embargo, los autores no demostraron diferencias entre ambos grupos en la estancia en UCI (diferencia media en días=2,03, IC 95% −0,51-4,56, p=0,12) ni en la incidencia de neumonía nosocomial (OR 0,83, IC 95% 0,28-2,49, p=0,74)40. Por su parte, otro metaanálisis26 agregando 9 ECA sobre monoterapia con selenio en pacientes con sepsis/sepsis grave concluyó que esta estrategia está asociada con una reducción significativa de la mortalidad (RR 0,83, IC 95% 0,70-0,99, p=0,04), en particular cuando la duración del tratamiento fue superior a los 7 días (RR 0,77, IC 95% 0,63-0,94, p=0,01), cuando se administró un bolo intravenoso inicial (RR 0,73, IC 95% 0,58-0,94, p=0,01) y en aquellos ECA que utilizaron una dosis diaria mayor de los 1.000μg (RR 0,77, IC 95% 0,61-0,99 p=0,04)26.
Recomendaciones actuales sobre el uso de selenio en la enfermedad críticaEn el año 2009 las recomendaciones de la European Society for Clinical Nutrition and Metabolism41 concluyeron que altas dosis de selenio no deben ser parte de la NP, aunque las mismas deben ser consideradas en los pacientes críticos con inflamación sistémica, en particular en aquellos con sepsis/sepsis grave. Asimismo, de acuerdo con la referida sociedad, una dosis diaria de selenio de 350 a 1.000μg, administrando inicialmente un bolo intravenoso y posteriormente una infusión continua, es la estrategia que demuestra los mayores beneficios41.
Por su parte, las recomendaciones de la Society of Critical Care Medicine y la American Society of Parenteral and Enteral Nutrition42 aconsejan el agregado de vitaminas y elementos traza (particularmente selenio) en todos los pacientes críticos que requieren terapia nutricional42.
En 2011, las recomendaciones de la Sociedad Española de Medicina Intensiva, Cuidados Críticos y Unidades Coronarias y la Sociedad Española de Nutrición Parenteral y Enteral43 establecieron la necesidad de aportar micronutrientes sin que se pueda determinar su cuantía (recomendación grado A)43. Por su parte, en el capítulo referido a la terapia nutricional en la sepsis, el documento de consenso de dichas sociedades concluye que altas dosis de selenio no pueden ser rutinariamente utilizadas en los pacientes con sepsis, siendo necesarios nuevos estudios para definir su rol en el tratamiento de la sepsis44.
Más recientemente, las Guías Clínicas Canadienses45 recomiendan que la administración de una alta dosis de selenio (bolo inicial continuado de infusión intravenosa continua) como monoterapia o asociada a una combinación de antioxidantes sea considerada en los pacientes críticos46.
Por su parte, las directrices de la Surviving Sepsis Campaign47 recomiendan no utilizar selenio intravenoso para el tratamiento de la sepsis grave (recomendación grado 2C). Sin embargo, estas guías han omitido parte de la evidencia reciente que ha sido presentada y analizada en esta revisión47, siendo ejemplo de ello la no inclusión en su fundamentación de los 2 metaanálisis del grupo canadiense38,39.
ConclusionesDe acuerdo con la literatura actual, existe evidencia creciente para considerar la administración de cócteles antioxidantes y/o la suplementación parenteral de dosis altas de selenio parenteral en los pacientes adultos críticos con sepsis grave/shock séptico. La administración de una dosis de carga inicial en forma de un bolo intravenoso (1.000 a 2.000μg) dentro de las primeras 24h del ingreso en la UCI presenta efectos citotóxicos y antiinflamatorios. Esta estrategia ha demostrado, aunque a veces con resultados contradictorios, ser capaz de mejorar resultados clínicos tales como una reducción de la mortalidad y la incidencia de infecciones. En tal sentido, 3 revisiones sistemáticas y metaanálisis recientes demuestran que el selenio es una estrategia antioxidante capaz de reducir la mortalidad en la sepsis grave y el shock séptico. En el futuro próximo, nuevos estudios fase iii deberán confirmar los efectos de la farmaconutrición parenteral con selenio en la sepsis.
Conflicto de interesesEl Dr. William Manzanares ha dictado conferencias para Biosyn Alemania. Los otros autores declaran no tener conflictos de intereses.