La administración de sedantes y opiáceos (SED-OPI) de forma prolongada, en especial a los pacientes ventilados por SDRA asociado a SARS-CoV-2, en los que se han descrito requerimientos elevados de estos fármacos1, se asocia frecuentemente a fenómenos de tolerancia y dependencia. Un síndrome de deprivación puede ocurrir al disminuir la dosis, impidiendo o retrasando el inicio de las desconexiones de la ventilación mecánica (VM)2,3.
El concepto «sedación difícil» (SAD) engloba estos problemas y se han recomendado estrategias para su manejo, como la sedación secuencial, con rotación de SED-OPI, o la administración de alfa2-agonistas y/o de antipsicóticos4,5. En estas estrategias no se suele contemplar la administración de metadona, probablemente porque, a diferencia de la población infantil, es un fármaco muy poco usado en pacientes críticos adultos6,7. La metadona es un opiáceo de vida media larga, está disponible en solución para su administración enteral, con alta biodisponibilidad, y bloquea los receptores NMDA, cuya activación está muy implicada en el desarrollo de la tolerancia e hiperalgesia8,9.
Este estudio de cohorte, retrospectivo y observacional, tiene como objetivo describir la experiencia con el empleo de metadona para el control de la SAD, en pacientes ventilados por SDRA secundario a COVID-19 en los que se ha fracasado con el uso de los fármacos habituales, e ingresados entre marzo y mayo del 2020. Con la aprobación del Comité de Ética de Investigación Clínica hospitalario se revisaron los registros médicos, analizando los pacientes que recibieron metadona durante al menos 48h para control de la SAD. Se consideró SAD la imposibilidad del descenso de la dosis de SED-OPI para iniciar desconexiones de la VM, o presentar una escala RASS>1 a pesar de SED-OPI a dosis altas4 y/o la presencia de dolor no controlado con opiáceos habituales.
Se recogió información de datos demográficos y clínicos (tabla 1), duración y dosis acumulada de SED-OPI al inicio del tratamiento, y de 5 días antes y hasta 5 días después del inicio de la administración. La dosis de opiáceos se expresa en mg de morfina intravenosa, convirtiendo la dosis equianalgésica de la siguiente forma: 100μg fentanilo=100μg remifentanilo=10mg morfina intravenosa. Se analizaron los registros de enfermería de las escalas RASS, escala visual numérica o ESCID, y los efectos secundarios producidos por la metadona. La metadona se administró en forma de solución enteral al 1% preparada por el Servicio de Farmacia. La decisión de emplear la metadona fue tomada por el médico responsable del paciente una vez fracasada la estrategia habitual.
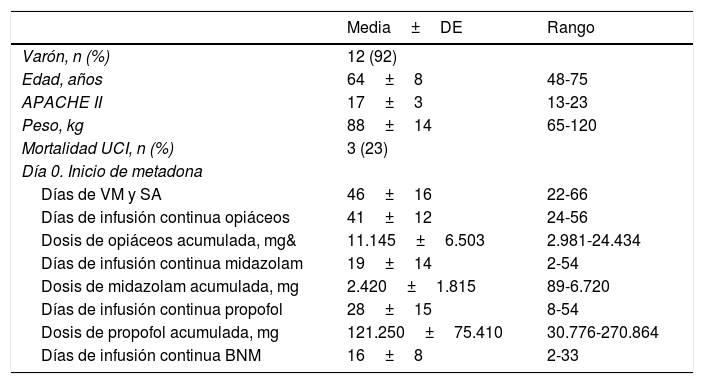
Características demográficas y clínicas de los pacientes. Duración y dosis acumulada de sedantes-opiáceos y bloqueantes neuromusculares al inicio del tratamiento con metadona
| Media±DE | Rango | |
|---|---|---|
| Varón, n (%) | 12 (92) | |
| Edad, años | 64±8 | 48-75 |
| APACHE II | 17±3 | 13-23 |
| Peso, kg | 88±14 | 65-120 |
| Mortalidad UCI, n (%) | 3 (23) | |
| Día 0. Inicio de metadona | ||
| Días de VM y SA | 46±16 | 22-66 |
| Días de infusión continua opiáceos | 41±12 | 24-56 |
| Dosis de opiáceos acumulada, mg& | 11.145±6.503 | 2.981-24.434 |
| Días de infusión continua midazolam | 19±14 | 2-54 |
| Dosis de midazolam acumulada, mg | 2.420±1.815 | 89-6.720 |
| Días de infusión continua propofol | 28±15 | 8-54 |
| Dosis de propofol acumulada, mg | 121.250±75.410 | 30.776-270.864 |
| Días de infusión continua BNM | 16±8 | 2-33 |
BNM: bloqueantes neuromusculares; DE: desviación estándar; SA: sedantes y analgésicos; UCI: Unidad de Cuidados Intensivos; VM: ventilación mecánica; &: dosis en mg de morfina intravenosa.
Las variables cualitativas fueron analizadas mediante los test de Chi-cuadrado o exacto de Fisher y las cuantitativas mediante la prueba U de Mann-Whitney.
Durante el periodo de estudio, 92 pacientes requirieron VM por SDRA secundario a infección por SARS-CoV-2. Catorce recibieron al menos una dosis de metadona, de los cuales 13 cumplieron los requisitos del estudio. La metadona se inició tras 46±16 días de VM y de administración de SED-OPI, con un rango de 21 a 66 días. La dosis inicial diaria fue de 45±23mg repartidas en 2-3 dosis; posteriormente fue ajustada entre 0,1 a 0,4mg/kg, cada 8 o 12h, dependiendo de la respuesta.
En 9 pacientes se indicó la metadona ante la imposibilidad de disminuir la dosis de SED-OPI de cara al inicio de las desconexiones de la VM o por presentar una puntuación en la escala RASS>1 a pesar de dosis altas de SED-OPI. Además de propofol, 6 estaban recibiendo alfa2-agonistas, 4 midazolam en infusión y 5 cisatracurio. En 4 pacientes el tratamiento se indicó por dolor no controlado por tolerancia a dosis altas de opiáceos y a pesar del empleo de analgesia multimodal.
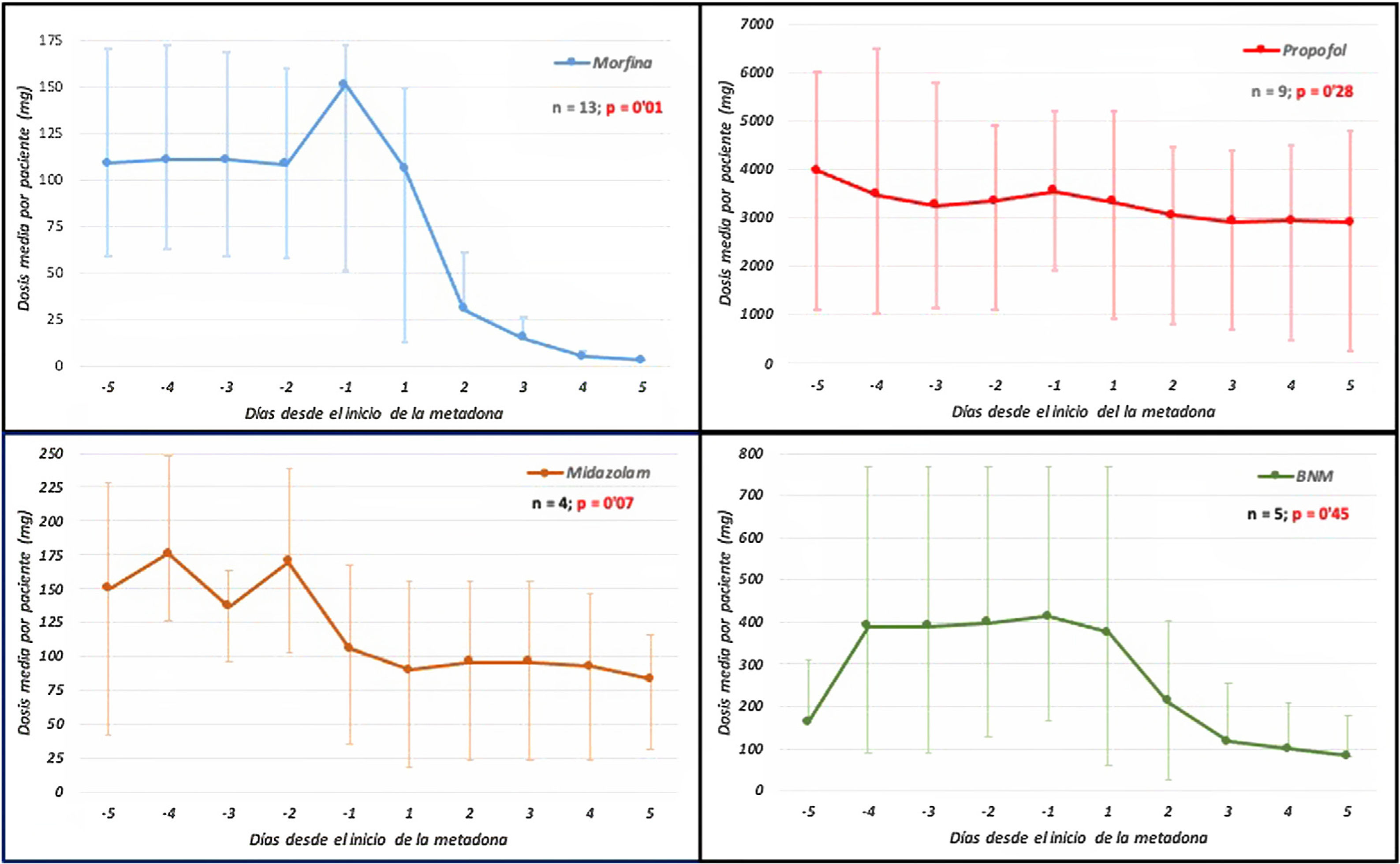
En 11 de 13 pacientes (85%) se mejoró la calidad de la sedoanalgesia, consiguiéndose valores −2 y 0 en la escala RASS, el control del dolor, con escala visual numérica<4, y se pudo disminuir la dosis de los fármacos usados para la adaptación a la VM (fig. 1), progresando en la desconexión del ventilador. Tras 5 días de tratamiento, en 11 pacientes se pudieron suspender los opiáceos convencionales y en 2 se disminuyó la dosis en un 64%. En 5 de 9 pacientes la dosis de propofol se redujo un 68±26% y en 3 de 4 el midazolam en un 51±31%. Además, se pudo suspender el cisatracurio en 3 pacientes, y en los otros 2, aunque persistió su necesidad, impidiendo el progreso en la desconexión de la VM, en uno pudo disminuirse la dosis de cisatracurio un 50% y en otro la de midazolam un 56%.
Dosis de sedantes, opiáceos y bloqueantes neuromusculares, desde el día −5 del inicio de metadona al día +5 de tratamiento. Dosis expresadas en mediana y rango intercuartílico (IQR25-75). Análisis estadístico entre las dosis acumuladas en los 5 días previos con las acumuladas en los 5 días postratamiento.
Nuestro estudio aporta la utilidad de la metadona para el control de la SAD refractaria al tratamiento con otros fármacos durante la sedación prolongada de pacientes con SDRA. Aunque algunos autores no recomiendan el uso de la metadona en el paciente crítico por sus potenciales efectos secundarios10, en nuestro estudio no hemos encontrado complicaciones relevantes. Tres pacientes presentaron hipotensión puntual con la primera dosis de metadona, probablemente debido a su rápida absorción. Con la dosis empleada en nuestros pacientes no se objetivaron prolongaciones del QT ni cuadros serotoninérgicos. La dosis empleada puede servir como una orientación de uso, pero no podemos recomendar una dosis de administración por la variabilidad de la respuesta, que depende del soporte ventilatorio de ese momento, del tiempo y de la dosis administrada de otros opiáceos, tanto acumulada como la que se esté administrando al inicio del fármaco, así como de la integridad de la absorción intestinal, del metabolismo hepático y de la posibilidad de interacciones a nivel del P450. Para minimizar la aparición de complicaciones es prudente no superar una dosis diaria de 100mg y evitar su uso en pacientes tratados con fármacos que puedan prolongar el QT o predisponer a un cuadro serotoninérgico.
En conclusión, por los hallazgos obtenidos en este estudio, pensamos que la metadona es un fármaco a considerar en el abordaje de cuadros de SAD secundaria a la administración de dosis altas y prolongadas de fármacos SED-OPI durante la VM de los pacientes con SDRA.
Conflicto de interesesLos Dres. Chamorro-Jambrina, Alcántara-Carmona y Romera-Ortega declaran haber recibido honorarios de Orion-Pharma por charlas y conferencias científicas. El resto de los autores declara no tener ningún conflicto de intereses.