La enfermedad por SARS-CoV-2 se caracteriza por una tormenta de citoquinas mediadas por la sobreproducción de citoquinas proinflamatorias, que puede manifestarse con un mayor nivel la interleucina 6 (IL-6). Por otro lado, la infección puede presentarse como neumonía que desencadene un síndrome de dificultad respiratoria aguda, siendo una de las principales causas de muerte en estos pacientes1,2.
El pilar del tratamiento para los pacientes críticos con neumonía por SARS-CoV-2 es sintomático y de apoyo; únicamente el empleo de corticoides ha demostrado reducir la mortalidad3, mientras que están demostrados los efectos del tocilizumab como anticuerpo monoclonal humano recombinante antagonizando el receptor de la IL-64.
Durante esta pandemia, un gran número de pacientes han recibido una gran variedad de terapias en todo tipo de combinaciones. Dentro de estas combinaciones, basados en las premisas descritas, se ha producido el empleo combinado de tocilizumab y corticoides.
En este contexto, hemos querido analizar el impacto de la terapia combinada de tocilizumab y corticoideo, en la supervivencia a corto plazo (28 días), de los enfermos ingresados en una unidad de cuidados intensivos (UCI) por SARS-CoV-2. Para ello, realizamos un estudio retrospectivo de todos los casos hospitalizados por infección por SARS-CoV-2, ingresados entre el 15 de marzo y el 5 de diciembre de 2020. Se clasificó a los enfermos en 4 grupos atendiendo a las diferentes combinaciones: grupo A: no recibieron ni tratamiento corticoideo ni tocilizumab; grupo B: recibieron terapia combinada con corticoide y tocilizumab; grupo C: únicamente recibieron tocilizumab; grupo D: únicamente recibieron corticoide.
Se consideró el uso de tocilizumab en aquellos enfermos con progresión clínica con PaO2/FiO2<300 y dimero D>1.500ng/ml (o en aumento progresivo) o IL-6>40pg/ml o ferritina elevada. La dosis administrada fue, en pacientes con peso>75kg: una dosis única de 600mg; y en pacientes con<74kg: una dosis única de 400mg. Cinco enfermos recibieron una segunda dosis de tocilizumab, 6 enfermos recibieron 3 dosis de tocilizumab y 2 enfermos recibieron 4 dosis de tocilizumab.
Se registró el uso de corticoide como una variable binaria (Sí o No) si al menos los pacientes recibían 40mg de metilprednisolona, o su equivalencia, durante un período de al menos 3 días con el fin de tratar la inflamación asociada con la neumonía viral.
Se realizó inicialmente un análisis descriptivo de la muestra y posteriormente una regresión de Cox y un análisis de supervivencia a 28 días con el método de Kaplan-Meier para la variable de tiempo de muerte. Las curvas de supervivencia se compararon mediante el test de log-rank.
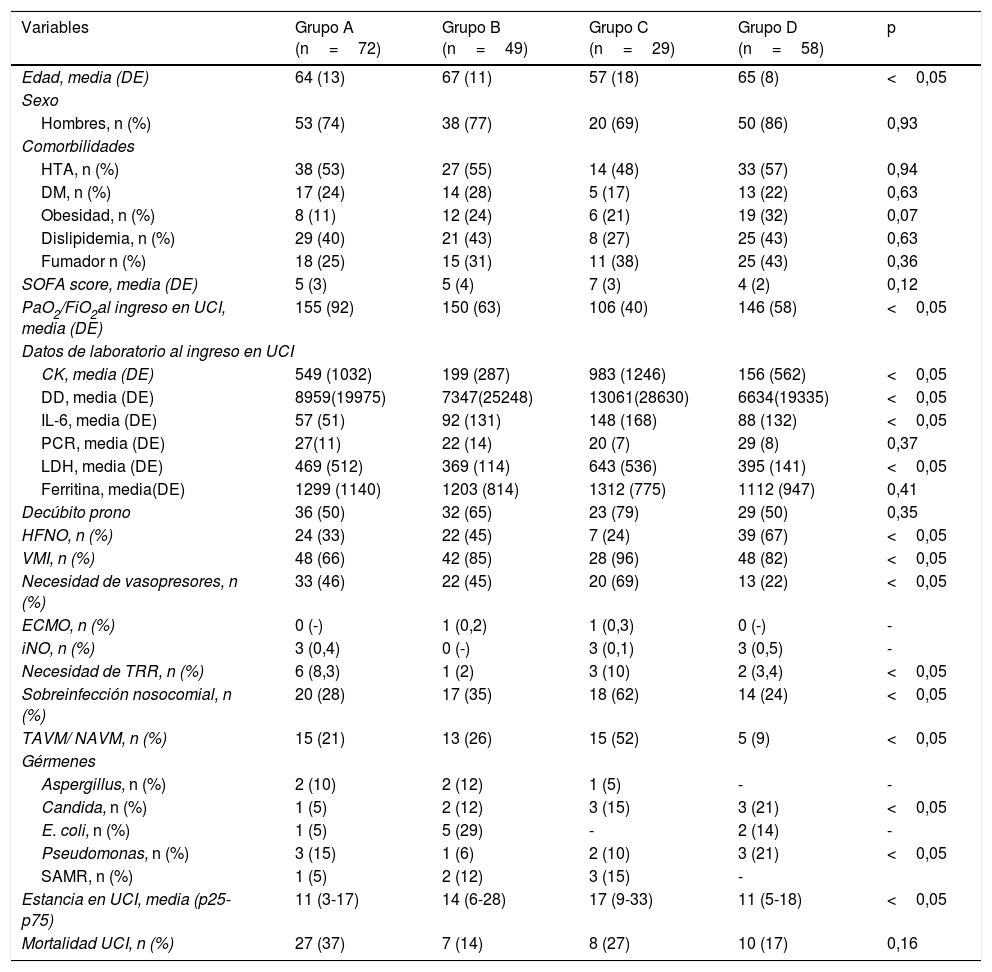
En el periodo estudiado, ingresaron un total de 254 enfermos. Fueron excluidos del análisis 46 pacientes por falta de datos o no confirmación de la presencia de SARS-CoV-2. Se analizaron 208 enfermos. Las principales características de los 4 grupos de pacientes se muestran en la tabla 1.
Principales diferencias entre los pacientes que recibieron tocilizumab y tratamiento corticoideo de la muestra analizada
| Variables | Grupo A (n=72) | Grupo B (n=49) | Grupo C (n=29) | Grupo D (n=58) | p |
|---|---|---|---|---|---|
| Edad, media (DE) | 64 (13) | 67 (11) | 57 (18) | 65 (8) | <0,05 |
| Sexo | |||||
| Hombres, n (%) | 53 (74) | 38 (77) | 20 (69) | 50 (86) | 0,93 |
| Comorbilidades | |||||
| HTA, n (%) | 38 (53) | 27 (55) | 14 (48) | 33 (57) | 0,94 |
| DM, n (%) | 17 (24) | 14 (28) | 5 (17) | 13 (22) | 0,63 |
| Obesidad, n (%) | 8 (11) | 12 (24) | 6 (21) | 19 (32) | 0,07 |
| Dislipidemia, n (%) | 29 (40) | 21 (43) | 8 (27) | 25 (43) | 0,63 |
| Fumador n (%) | 18 (25) | 15 (31) | 11 (38) | 25 (43) | 0,36 |
| SOFA score, media (DE) | 5 (3) | 5 (4) | 7 (3) | 4 (2) | 0,12 |
| PaO2/FiO2al ingreso en UCI, media (DE) | 155 (92) | 150 (63) | 106 (40) | 146 (58) | <0,05 |
| Datos de laboratorio al ingreso en UCI | |||||
| CK, media (DE) | 549 (1032) | 199 (287) | 983 (1246) | 156 (562) | <0,05 |
| DD, media (DE) | 8959(19975) | 7347(25248) | 13061(28630) | 6634(19335) | <0,05 |
| IL-6, media (DE) | 57 (51) | 92 (131) | 148 (168) | 88 (132) | <0,05 |
| PCR, media (DE) | 27(11) | 22 (14) | 20 (7) | 29 (8) | 0,37 |
| LDH, media (DE) | 469 (512) | 369 (114) | 643 (536) | 395 (141) | <0,05 |
| Ferritina, media(DE) | 1299 (1140) | 1203 (814) | 1312 (775) | 1112 (947) | 0,41 |
| Decúbito prono | 36 (50) | 32 (65) | 23 (79) | 29 (50) | 0,35 |
| HFNO, n (%) | 24 (33) | 22 (45) | 7 (24) | 39 (67) | <0,05 |
| VMI, n (%) | 48 (66) | 42 (85) | 28 (96) | 48 (82) | <0,05 |
| Necesidad de vasopresores, n (%) | 33 (46) | 22 (45) | 20 (69) | 13 (22) | <0,05 |
| ECMO, n (%) | 0 (-) | 1 (0,2) | 1 (0,3) | 0 (-) | - |
| iNO, n (%) | 3 (0,4) | 0 (-) | 3 (0,1) | 3 (0,5) | - |
| Necesidad de TRR, n (%) | 6 (8,3) | 1 (2) | 3 (10) | 2 (3,4) | <0,05 |
| Sobreinfección nosocomial, n (%) | 20 (28) | 17 (35) | 18 (62) | 14 (24) | <0,05 |
| TAVM/ NAVM, n (%) | 15 (21) | 13 (26) | 15 (52) | 5 (9) | <0,05 |
| Gérmenes | |||||
| Aspergillus, n (%) | 2 (10) | 2 (12) | 1 (5) | - | - |
| Candida, n (%) | 1 (5) | 2 (12) | 3 (15) | 3 (21) | <0,05 |
| E. coli, n (%) | 1 (5) | 5 (29) | - | 2 (14) | - |
| Pseudomonas, n (%) | 3 (15) | 1 (6) | 2 (10) | 3 (21) | <0,05 |
| SAMR, n (%) | 1 (5) | 2 (12) | 3 (15) | - | |
| Estancia en UCI, media (p25-p75) | 11 (3-17) | 14 (6-28) | 17 (9-33) | 11 (5-18) | <0,05 |
| Mortalidad UCI, n (%) | 27 (37) | 7 (14) | 8 (27) | 10 (17) | 0,16 |
CK: creatin quinasa; DD: dímero D; DM: diabetes mellitus; ECMO: circuito de oxigenación extracorpórea; HFNO: High Flow Nasal Oxygen; HTA: hipertensión arterial; IL-6: interleucina 6; iNO: óxido nítrico inhalado; LDH: lactato deshidrogenasa; NAVM: neumonía asociada a ventilación mecánica; PCR: proteína C reactiva; SAMR: Staphylococcus aureus meticilín resistente; TAVM: traqueobronquitis asociada a ventilación mecánica; TRR: terapias de reemplazo renal; VMI: ventilación mecánica invasiva.
Grupo A: no recibieron ni tratamiento corticoideo ni tocilizumab; grupo B: recibieron terapia combinada con corticoide y tocilizumab; grupo C: únicamente recibieron tocilizumab; grupo D: únicamente recibieron corticoide.
Valores de referencia: CK (46-171U/l); DD (0-500 (ng/ml); IL6 (<5pg/l); PCR (<0,5g/dl); LDH (120-246U/l); ferritina (22-322ng/ml).
La tabla muestra los valores de OR con su intervalo de confianza al 95%.
Mediante un análisis de regresión de Cox (método: intro; estado: fallecimiento en UCI; utilizando como covariables: la edad, el sexo, las comorbilidades de los pacientes, las terapias implicadas en el tratamiento, la escala SOFA, la PaO2/FiO2 al ingreso, los valores analíticos y las terapias de soporte ventilatorio), la PaO2/FiO2 al ingreso en UCI se comportó como un factor protector frente a mortalidad (HR: 0,98; IC95%: 0,97-0,99; p=0,01). De las terapias evaluadas, el uso combinado de corticoides y tocilizumab se asoció con una mejora en la supervivencia en la UCI (HR: 9.623; IC95%: 2,39-38,69; p=0,001). No se encontraron asociaciones significativas con el resto de variables analizadas.
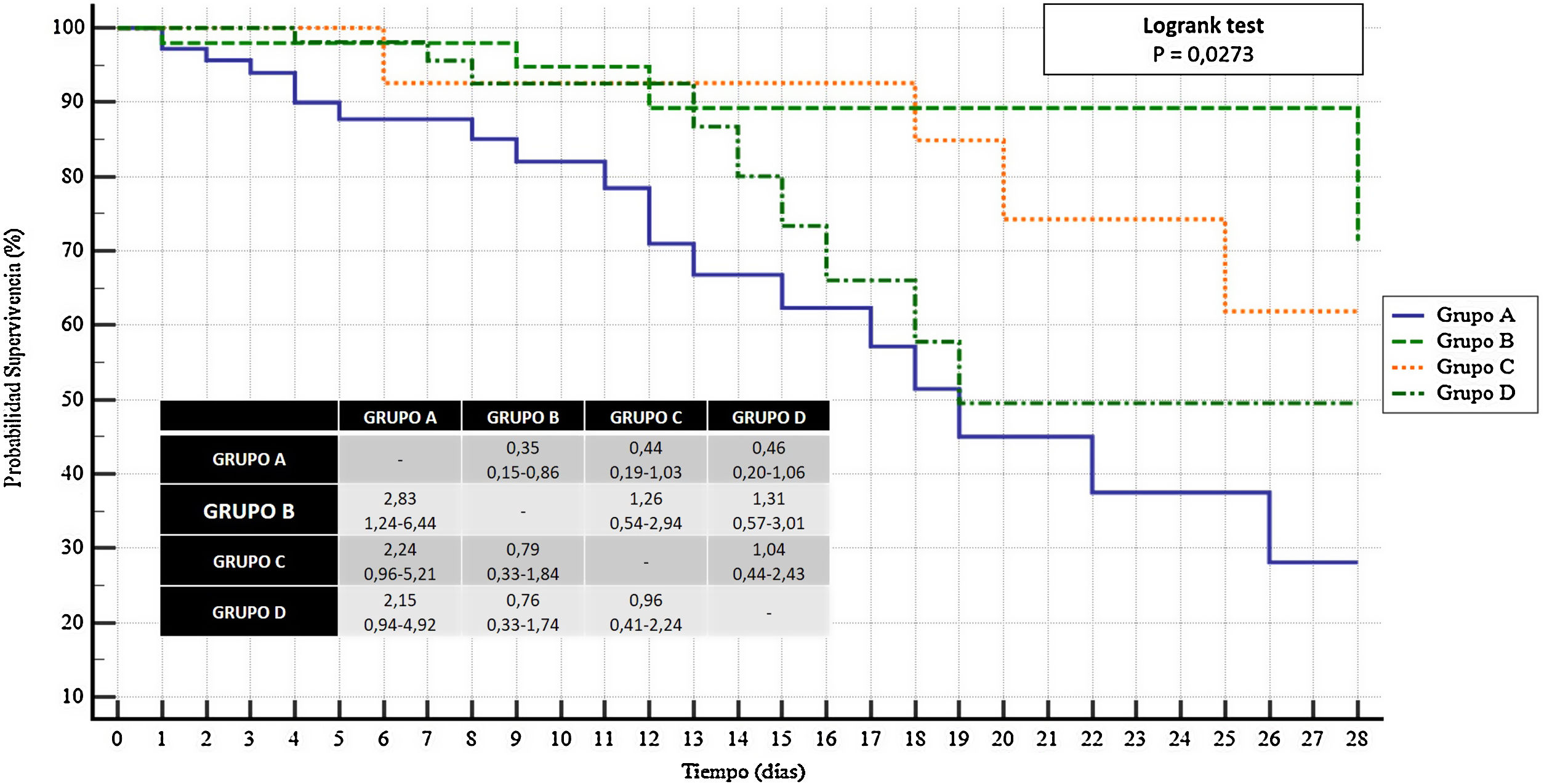
En el análisis de supervivencia a 28 días, el grupo de terapia combinada de tocilizumab y corticoide mostró una mayor probabilidad significativa de sobrevivir a los 28 días (OR: 2,83; IC95%: 1,24-6,44) frente a no recibir tocilizumab y corticoide. No se observó esta diferencia significativa en la comparación con los otros 2 grupos analizados: OR: 1,26; IC95%: 0,54-2,94 frente al tratamiento con tocilizumab; OR: 1,31; IC95%: 0,57-3,01 frente al tratamiento corticoideo (fig. 1).
Análisis de supervivencia (Kaplan-Meier) referido a la supervivencia a los 28 días en los 4 grupos establecidos.
Grupo A: no recibieron ni tratamiento corticoideo ni tocilizumab; grupo B: recibieron terapia combinada con corticoide y tocilizumab; grupo C: únicamente recibieron tocilizumab; grupo D: únicamente recibieron corticoide.
Actualmente, los estudios más consistentes y recientes que evaluaron el tocilizumab en monoterapia en la COVID-19 no revelaron ningún efecto beneficioso5–7. Estos datos pueden demostrar que bloquear una sola citoquina no es suficiente para tener un impacto clínico significativo en estos pacientes.
Del mismo modo, podría interpretarse que usar una dosis fija de esteroides independientemente de la gravedad de la enfermedad, de la tormenta de citoquinas desarrollada o de la presencia de síndrome de dificultad respiratoria aguda, resultaría insuficiente en muchos de estos enfermos8.
Nuestros resultados se encuentran en consonancia con los datos del estudio REMAP-CAP9 que evaluó el empleo de tocilizumab entre una población de pacientes que ingresaron en la UCI para soporte orgánico. En el mismo, se evidenció que la adición de tocilizumab al empleo de dexametasona mejoraba la mortalidad de la muestra. En la misma línea, el trabajo de Mikulska et al. mostró que el impacto negativo de la respuesta inmunitaria en COVID-19 podría mitigarse mediante la administración temprana de tratamiento corticoideo más tocilizumab10.
Por otro lado, queremos destacar cómo en el grupo que únicamente recibió tratamiento con tocilizumab presentaban peor oxigenación al ingreso, desarrollaron mayor necesidad de vasopresores y terapias de reemplazo renal durante su ingreso en UCI, así como desarrollaron más sobreinfección nosocomial, entre ellos traqueobronquitis y neumonías asociadas a ventilación mecánica (TAVM/NAVM). En este sentido es un hecho constatado en la bibliografía que las infecciones de las vías respiratorias altas son los efectos adversos más conocidos del tocilizumab11,12.
Nuestro estudio presenta varias limitaciones: es una serie relativamente pequeña de pacientes procedentes de un solo hospital. Por otro lado, son resultados obtenidos en plena pandemia con saturación de los servicios y en ocasiones con personal médico y de enfermería frecuentemente no experto. Ninguno de los tratamientos se aplicó de forma aleatorizada, sino en el mejor criterio de los profesionales. Recordando además que existen contraindicaciones específicas para el uso del tocilizumab, como la presencia de fallo hepático o infecciones previas que pueden incidir en un sesgo de selección de los pacientes a priori.
Actualmente podría considerarse prematura la indicación de la terapia combinada de tocilizumab más corticoides, siendo necesarios nuevos estudios aleatorizados para establecer las mejores opciones de tratamiento, duración y limitaciones.
FinanciaciónEl presente manuscrito no ha recibido financiación alguna.
Conflicto de interesesTodos los autores reconocen no presentar conflicto de intereses en la realización del presente trabajo.