Editado por: Ana Ochagavía - Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat. Barcelona. Spain.
Más datosEl uso de la ecografía en las unidades de críticos se ha extendido de forma exponencial en las últimas dos décadas y se ha convertido en una parte esencial de nuestra práctica clínica. La ecografía abdominal es una técnica ampliamente establecida en otras especialidades, pero su uso en cuidados intensivos ha quedado rezagado respecto a otras modalidades de ecografía. Sin embargo, su potencial papel en el diagnóstico y manejo de los pacientes lo convertirá en una herramienta invaluable para los intensivistas.
El uso más extendido de la ecografía abdominal a pie de cama es para la valoración de la presencia de líquido libre en el paciente traumático. No obstante, la ecografía abdominal también puede ayudarnos a diagnosticar pacientes con dolor abdominal, hipovolemia o anuria, y puede guiarnos en procedimientos como la paracentesis o el sondaje vesical o gástrico.
The use of ultrasound while caring for critically ill patients has been increasing exponentially in the last two decades and now is an essential component of intensive care practice. Abdominal ultrasound is an established technique in other specialties, but its use in intensive care has lagged behind other ultrasound modalities. However, its potential role in the diagnosis and management of patients will make it an invaluable tool for intensivists.
The main use of abdominal ultrasound at the bedside is for free fluid detection in trauma patients. But abdominal ultrasound can also help us diagnose patients with abdominal pain, hypovolemia or anuria, and it can guide us during procedures such as paracentesis or bladder catheter and gastric tube placement.
La ecografía es una herramienta diagnóstica y terapéutica a pie de cama que, integrada en el contexto clínico, permite al intensivista realizar una valoración rápida y fiable del abdomen en el paciente crítico1. Los primeros consensos tanto nacionales como internacionales sobre ecografía en el paciente crítico ya incluían la ecografía abdominal como una modalidad imprescindible en el cuidado del paciente crítico, y las recientes actualizaciones la siguen recomendando por su gran utilidad2-5.
Líquido libre abdominalLa detección de líquido libre en la cavidad peritoneal en el abdomen agudo no traumático y la realización del examen FAST en el traumatismo grave se consideran una habilidad básica para los intensivistas3-5.
Protocolo FAST (Focused Assessment with Sonography for Trauma)Es un examen de detección de líquido libre, el cual se observa como una colección hipoecoica o anecoica, que se realiza en pacientes con trauma y que ha demostrado su utilidad como herramienta de triaje para acelerar la atención definitiva6. Incluye evaluaciones del pericardio, para buscar hemopericardio y taponamiento, del abdomen y del tórax, para buscar líquido libre intraperitoneal y hemotórax. Si se realiza una evaluación extendida del tórax en busca de neumotórax se denomina extended-FAST. Su única contraindicación es la necesidad de cirugía emergente7.
De acuerdo con las pautas del Advanced Trauma Life Support (ATLS), el examen FAST generalmente se realiza en caso de inestabilidad hemodinámica en la parte «C» del examen primario para identificar posibles puntos de sangrado en el tórax y en el abdomen8. El examen se informará como positivo, negativo o indeterminado, si algún punto no puede evaluarse adecuadamente.
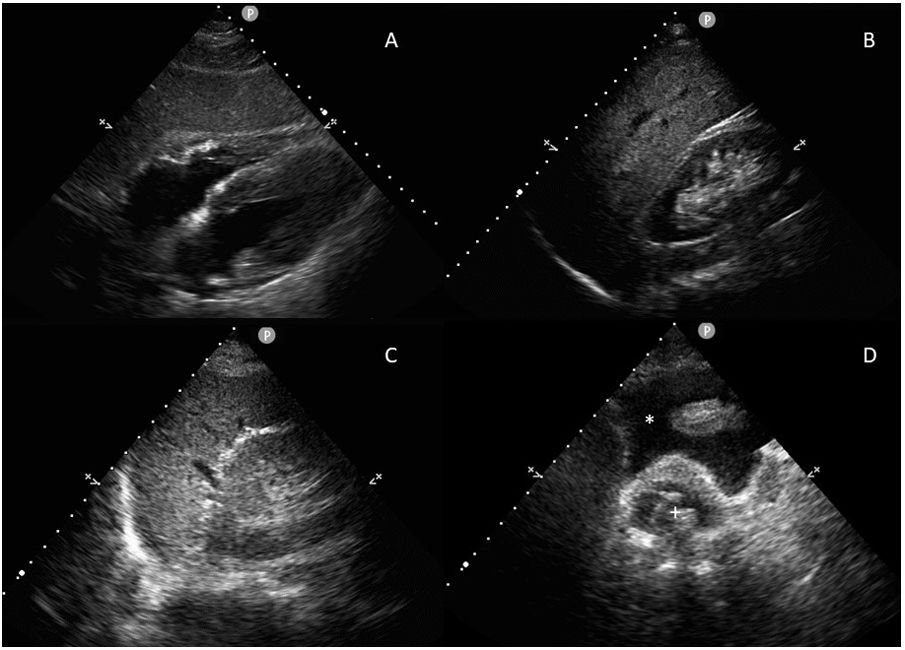
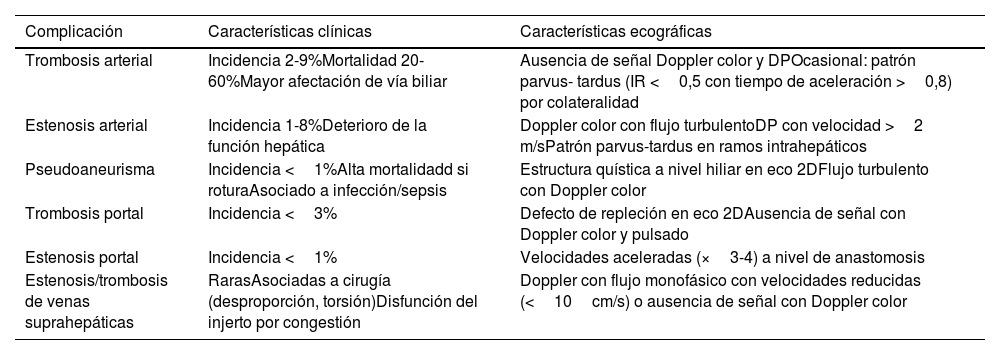
La exploración se realiza rápidamente, en menos de 5minutos, con una sonda sectorial o convexa de baja frecuencia (2,5 a 5MHz) en ventanas ecográficas estandarizadas (pericárdica, flanco derecho, flanco izquierdo y pélvica) (fig. 1). Seguir este orden permite diagnosticar primero el taponamiento cardíaco, la lesión más aguda y potencialmente mortal. Sin embargo, el orden del examen puede cambiar según el mecanismo de la lesión.
Se coloca la sonda en epigastrio, con el indicador hacia el hombro izquierdo y una inclinación de casi 0°. Es importante no confundir la grasa epicárdica con un derrame: la grasa está adherida al corazón y se mueven con él.
Ventana perihepática, flanco derecho o espacio de MorisonSe coloca la sonda, con el indicador hacia la cabeza, entre las líneas medioclavicular y axilar posterior en el espacio intercostal 10°-11°. Se evalúan cuatro espacios: pleural, subfrénico, hepatorrenal (bolsa de Morison) y polo inferior del riñón derecho. Aquí se puede identificar la presencia de líquido libre con mayor sensibilidad.
Ventana periesplénica o flanco izquierdoSe coloca la sonda, con el indicador hacia la cabeza, sobre la línea axilar posterior en el espacio intercostal 8°-9°. Se observan cuatro espacios: pleural, subfrénico, periesplénico y polo inferior del riñón izquierdo. Es una zona de más difícil exploración por la presencia del estómago y por ser el bazo una estructura con peor ventana que el hígado, ya que está asentado más posterior y superiormente.
Ventana pélvica o del espacio de DouglasSe coloca la sonda en una orientación sagital justo por encima de la sínfisis del pubis, en busca de acumulaciones de líquido detrás de la vejiga en los hombres y detrás del útero en las mujeres. La vejiga proporciona la ventana ecográfica; una vejiga vacía no permite la visualización de pequeños volúmenes de líquido libre. Si se ha colocado un catéter vesical, la vejiga puede llenarse parcialmente con suero salino para crear una ventana ecográfica.
El examen FAST es más útil cuando es positivo y el paciente está hemodinámicamente inestable, ya que marcará una actuación inmediata. Sin embargo, cuando el paciente está hemodinámicamente estable, el diagnóstico basado en tomografía computarizada (TC) se considera el estándar de atención9,10.
El examen FAST tiene varias limitaciones, como una sensibilidad baja. Algunos estudios han reportado sensibilidades de entre el 63 y el 100% para la detección de hemoperitoneo11-13. Por ello, si el estudio es negativo, en paciente hemodinámicamente estable requiere más estudios de imagen. La sensibilidad es tan variable porque la detección del líquido libre intraperitoneal depende de varios factores, como la ubicación de la lesión, el tiempo transcurrido desde la lesión, el volumen de líquido, la presencia de adherencias intraabdominales, los patrones de gases intestinales y la calidad del examen. Se han estudiado formas de mejorar su sensibilidad, como la combinación con hallazgos clínicos y analíticos14, o la realización de exámenes seriados15. Otra limitación es que puede no detectar lesiones como colecciones líquidas sutiles (<200ml), lesiones de víscera hueca que se manifiestan por gas libre y no por hemoperitoneo o lesiones en estructuras retroperitoneales. Por último, la ecografía también está limitada por comorbilidades del paciente, como obesidad o EPOC o en poblaciones especiales, como las mujeres en edad reproductiva, ya que tienen una pequeña cantidad de líquido libre en la pelvis que está asociado con la ovulación.
Ecografía renal y genitourinariaEl diagnóstico de la patología renal y genitourinaria tiene un gran aliado en la ecografía. Los riñones y la vejiga son fácilmente accesibles desde un punto de vista ecográfico, y obtener imágenes es relativamente sencillo. Por eso, la ecografía es una pieza importante en el diagnóstico de problemas estructurales de las vías urinarias, y cada vez más en la filiación y el pronóstico del fracaso renal agudo.
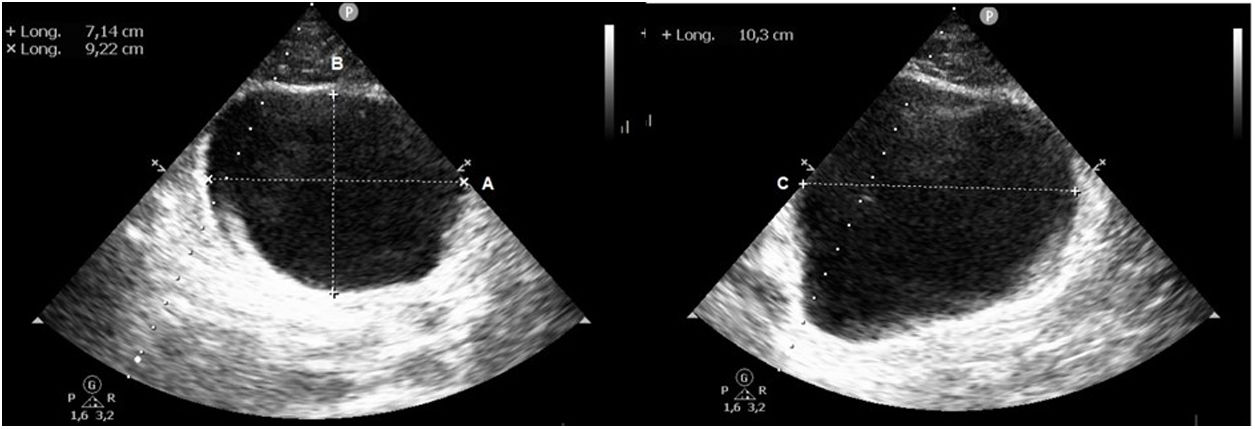
Ecografía vesicalLa vejiga en adultos se sitúa habitualmente en la línea media16,17. La encontramos debajo de los músculos rectos abdominales en la región suprapúbica, anterior al útero en mujeres, y se identifica mejor cuando está distendida. En condiciones normales aparece como una estructura anecoica con una pared muscular bien definida hiperecoica y con refuerzo posterior.
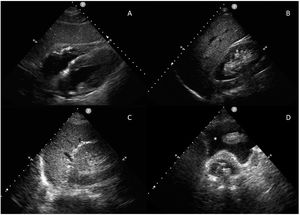
Para valorarla utilizaremos una sonda cónvex en posición transversa, justo encima de la sínfisis del pubis, para el plano transversal, y si giramos la sonda 90° hacia craneal obtenemos el plano longitudinal. Con estos dos planos podemos valorar la presencia de globo vesical mediante el cálculo del volumen de la vejiga con la fórmula alto ×ancho ×largo ×0,52 (fig. 2)18.
Con el Doppler color se puede recoger la presencia o la ausencia de jets ureterales, que son una salida normal y periódica de orina desde el uréter hacia la vejiga. La presencia de jets de orina entrando en la vejiga desde la zona del trígono vesical descartaría uropatía obstructiva (vídeo 1).
Ecografía renalLos riñones son órganos retroperitoneales, y se suelen visualizar con una sonda curvilínea de baja frecuencia. Colocando la sonda en la línea media axilar y posterior, en los espacios intercostales tanto en el eje longitudinal como en el transversal, con el paciente en decúbito supino o lateral contralateral al riñón explorado.
La porción convexa corresponde al parénquima, compuesto por la corteza y las pirámides medulares, estas más centrales e hipoecogénicas respecto a la corteza. En el centro encontramos el seno, hiperecogénico por la presencia de grasa y en el que se encuentran el sistema colector y los vasos que confluyen del íleo. El tamaño renal es variable, normalmente 10-12 ×5 ×3cm. El sistema colector normalmente no se ve, salvo si hay hidronefrosis u obstrucción.
Puede haber cambios en la morfología renal. En el caso de fracaso renal agudo se aprecia una cortical adelgazada y falta de diferenciación cortico-medular; por otro lado, si es crónico, hay un aumento de ecogenicidad en la cortical. En caso de hidronefrosis, veremos zonas anecogénicas en el seno, confluyentes hacia la pelvis mayor. Se ha propuesto una clasificación según el grado de hidronefrosis en leve, moderada y grave. Sería leve cuando el parénquima está conservado y los cálices miden menos de 1cm, moderada cuando los cálices están más dilatados y el parénquima está conservado o poco atrófico (corteza >8mm), y severa o grave cuando la atrofia parenquimatosa es casi total y la anatomía renal está modificada, con formaciones anecogénicas centrales separadas por septos19.
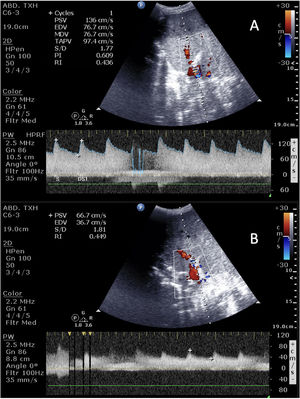
La ecografía es muy útil también para filiar la etiología del fracaso renal, siendo de especial interés el análisis espectral con el Doppler renal20. Las variables más significativas de este análisis son el índice de resistencia (IR) y tiempo de aceleración. El IR es la ratio entre pico sistólico −pico diastólico /pico sistólico. Valores normales 0,58±0,1 (>0,7 son anormales, sobre todo si >0,8). El tiempo de aceleración no debe exceder 0,1segundos. Normalmente la curva sisto-diastólica tiene un largo componente diastólico que indica baja resistencia al flujo21. En el caso del daño renal agudo por sepsis con hipotensión encontraremos bajos picos sistólicos y reducción de la velocidad diastólica. Si por el contrario predomina la vasoconstricción, aumentará la amplitud del pico sistólica con un flujo diastólico casi ausente con un IR casi de 1. Valores de IR >1 son indicativos de necrosis tubular aguda, con daño renal ya instaurado, por lo que habrá que plantear si precisa técnicas de depuración extrarrenal. La recuperación del flujo diastólico indica mejoría próxima de la función renal.
Aneurisma de aorta abdominalLa búsqueda de un aneurisma de aorta abdominal (AAA) debe realizarse en todo paciente con hipotensión sin causa aparente y considerarse en pacientes con dolor abdominal, dolor de espalda o hidronefrosis unilateral. El riesgo de rotura es directamente proporcional al diámetro de la aorta, siendo considerable si el diámetro es mayor a 5,5cm. Múltiples estudios han demostrado que la ecografía tiene una sensibilidad del 94-99% y una especificidad del 98-100% para diagnosticarlo22; sin embargo, es poco sensible para detectar el sangrado asociado a una rotura, ya que este se encuentra típicamente en el retroperitoneo.
Para valorar la aorta debemos visualizar tanto recorrido como sea posible. Empezaremos por el epigastrio, justo debajo de la apófisis xifoides con la sonda perpendicular a la pared abdominal y la marca de la sonda hacia la derecha del paciente. Realizando una leve presión para desplazar el aire dentro de las asas intestinales visualizaremos la aorta a la izquierda de la columna lumbar del paciente y un poco más superficial que esta. Mediremos el diámetro de la aorta desde la zona exterior de ambas paredes y buscaremos engrosamientos, hematomas murales, trombos en la luz o signos de disección. Posteriormente nos iremos desplazando hacia caudal y realizaremos la misma medida en diferentes zonas, de rostral a caudal, tras la salida del tronco celiaco, tras la salida de las arterias renales y antes de la bifurcación de las iliacas. Si además incluimos en la valoración el Doppler color, podremos ver el flujo dentro del aneurisma y, en caso de disección aórtica, nos ayudará a visualizar el flap intimal con una alta especificidad23.
Valoración de la congestión venosa mediante ecografía. Escala VExUSEn los últimos años estamos reconociendo la importancia de la congestión venosa, poco considerada hasta hace poco. Si sobrepasamos ciertos límites de congestión venosa, anulamos el potencial beneficio de incrementar el gasto cardiaco y comprometemos la perfusión visceral, que depende de un rango estrecho de presiones pre y postcapilar24.
Los signos y síntomas clínicos clásicos de congestión tienen una sensibilidad muy limitada, y solo identificamos adecuadamente la volemia en el 50% de las ocasiones. En este contexto, la ecografía es una herramienta muy útil para valorar volemia y la congestión, con tres estrategias principales: 1)la ecografía cardíaca con valoración de función y estimación de presiones; 2)la ecografía pulmonar (líneasB, derrame pleural), y 3)la valoración de la congestión vascular visceral, destacando el protocolo VExUS (Venous Excess Ultrasound Score). Integrar estas estrategias requiere una formación y un entrenamiento específicos que debe tener todo intensivista25.
El reconocimiento de la relación entre la congestión venosa visceral y el desarrollo de fracaso renal, especialmente tras cirugía cardiaca, ha sido una alerta para su aplicación más generalizada en el paciente crítico. Recientemente descrito, el protocolo VExUS utiliza los flujos de las venas hepáticas, porta e intrarrenales para valorar y graduar la congestión venosa26-28.
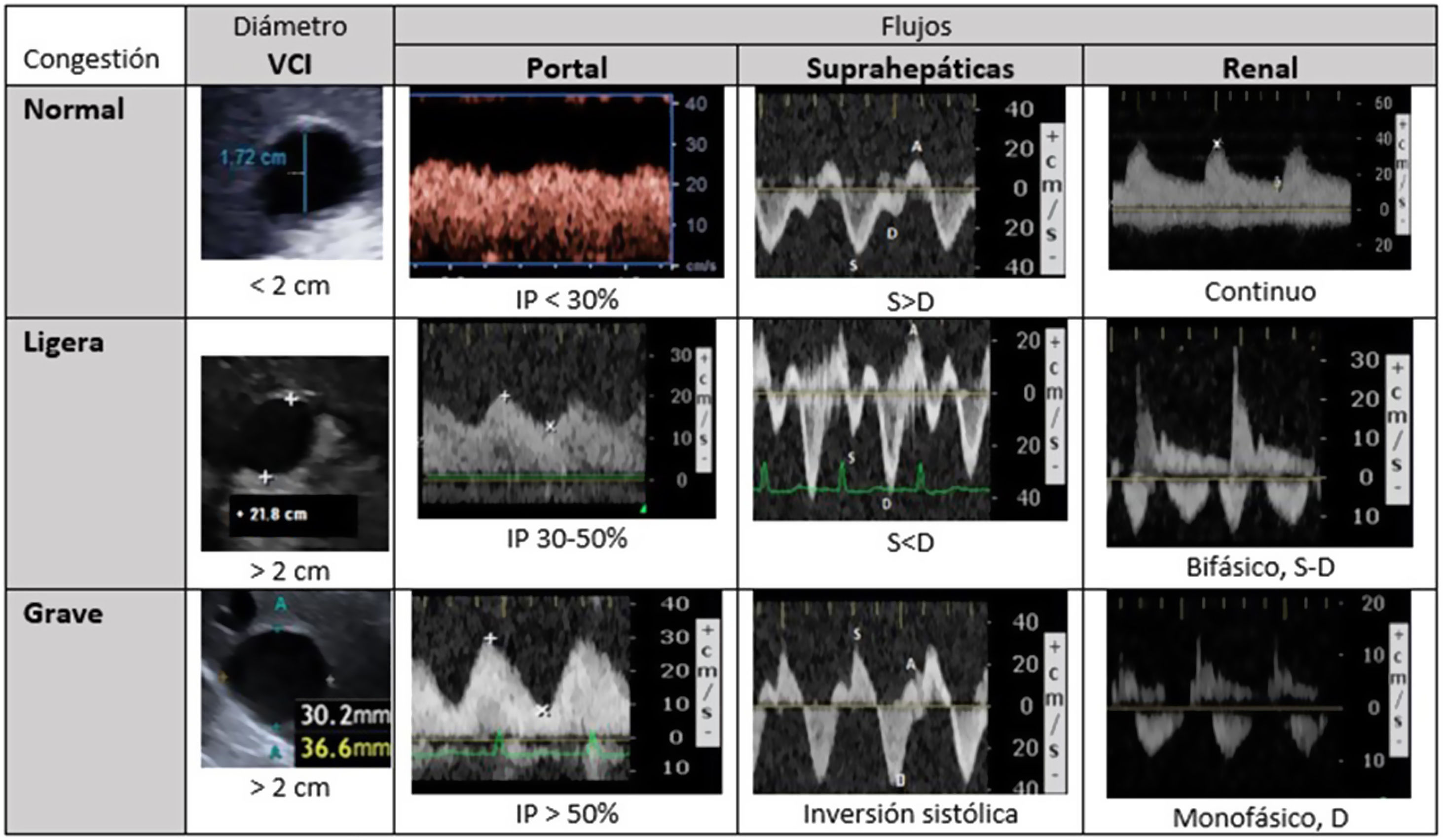
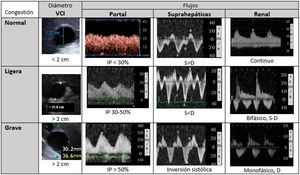
Metodología del sistema VExUS. Patrones de flujoPartiendo de una vena cava inferior (VCI) de al menos 2cm, evaluamos el patrón de flujo venoso en los territorios hepático y renal, que clasificaremos como normal, de congestión moderada o grave (fig. 3).
- 1.
El primer paso es determinar el diámetro máximo de la VCI, en su segmento intrahepático cercano a la unión con la vena suprahepática, aproximadamente a 2cm. La medición será más fiable desde un plano ortogonal, que permite valorar su verdadera dimensión, evitando cortes oblicuos o no diametrales. Un diámetro de la VCI menor de 2cm en principio debería descartar la congestión vascular.
- 2.
A continuación, registraremos con Doppler pulsado el flujo portal y de vena suprahepática, desde la línea axilar media alineando la sonda con los vasos. Emplearemos preferentemente una sonda cónvex, con un perfil hepático/renal vascular. Registraremos los flujos en espiración, evitando el desplazamiento del volumen de muestra, de mínimo 2-3 latidos continuos para conseguir un examen fiable, con registro de ECG24,29.
- 2.1.
El flujo normal de las venas suprahepáticas es pulsátil, reflejando la presión en la aurícula derecha. Incluye dos ondas anterógradas, una mayor sistólica (S) y otra menor diastólica (D), y una A retrógrada (sístole auricular). Estas tres ondas corresponden a las ondas A, X e Y del pulso yugular. Al aumentar las presiones en la aurícula derecha la ondaA será más prominente y la S reducirá su magnitud, hasta que en grados de congestión graves la S invierte su flujo y se fusiona con la ondaA.
- 2.2.
El flujo portal normal es continuo o ligeramente ondulante, hepatópeto, con velocidades de 20-30cm/s. Al estar separado y amortiguado por los sinusoides hepáticos del sistema venoso, su flujo se altera con grados de congestión mayores, siendo un marcador más específico. Con aumentos de presión venosa o insuficiencia tricuspidea moderada-grave, el flujo portal se hará pulsátil, y llega a ser bifásico e incluso oscilante. Mediremos las velocidades pico y nadir, para calcular la fracción de pulsatilidad: FP(%)=100·(Vmax−Vmin)/Vmax. Una FP superior al 30% corresponde a congestión ligera, siendo grave si supera el 50%.
- 2.1.
- 3.
El flujo renal suele ser más difícil de obtener, con mayor riesgo de ofrecer resultados ambiguos. Buscaremos una vena interlobar lo más paralela posible al haz de ultrasonidos. Este flujo, normalmente continuo, pasa a ser pulsátil con mayores grados de congestión. Inicialmente se hará discontinuo hasta diferenciar dos ondas (S y D, patrón discontinuo bifásico). Cuando la congestión es grave, la ondaS disminuye hasta desaparecer y veremos un patrón discontinuo monofásico, solo con ondaD. Estos patrones venosos se relacionan con la congestión renal mejor que el índice de resistencia arterial intrarrenal.
Sistema de clasificación de la congestión venosa (VExUS).
D: diástole; IP: índice de pulsatilidad; S: sístole; VCI: vena cava inferior.
Grado0: VCI inferior a 2cm, patrones normales. Grado1: VCI >2cm y patrones ligeros. Grado2: VCI >2cm y un órgano con patrón grave. Grado3: al menos dos órganos con patrón grave. Con frecuencia el flujo renal incluye arteria (positiva, siempre pulsátil) y vena (bajo línea cero), al discurrir paralelas.
Es importante diferenciar un balance positivo aislado de la congestión venosa con disfunción de órganos. Los escenarios donde existe mayor evidencia de los efectos negativos de la congestión venosa son la cirugía cardiaca, la insuficiencia cardiaca (IC) y el paciente crítico, asociándose con mayor morbimortalidad y desarrollo de fracaso renal, hepatopatía congestiva e incluso encefalopatía y delirio24,26,27,30-34. Más de la mitad de los pacientes con IC pueden presentar congestión sin hipoperfusión, siendo el principal determinante hemodinámico para el deterioro de función renal. Los pacientes con congestión venosa tienen menor supervivencia, mayor estancia hospitalaria y más reingresos. Experimentalmente, la expansión de volumen en pacientes con IC empeora el patrón venoso renal y reduce la eficiencia diurética35. Por otro lado, una depleción guiada por estos patrones sonográficos permite personalizarla de una forma ágil y más objetiva, y parece relacionarse con una mejor recuperación renal25,36. Estos patrones podrían indicar volumen movilizable en una situación congestiva, pues los pacientes críticos con pulsatilidad portal alta y peor patrón venoso renal tienen mejor respuesta a los diuréticos37. En la práctica diaria, los balances negativos efectivos se traducen en cambios de estos patrones de congestión y puntuación.
Precauciones en la interpretaciónMuchos factores pueden influir en los patrones venosos, con complejas interrelaciones y fisiología.
El diámetro aislado de la VCI no discrimina necesariamente el grado de congestión, al estar modificado por múltiples factores. Su dilatación puede reflejar tanto aumento de la volemia como dificultad del retorno venoso y fallo cardiaco (taponamiento, disfunción derecha, insuficiencia tricuspidea, hipertensión pulmonar, ventilación mecánica, etc.). En estas circunstancias debe interpretarse con cautela, pues algunos pacientes pueden aun necesitar una precarga elevada. También puede estar comprimida por aumentos de presión intraabdominal. La propia medición de la VCI debe ser cuidadosa: puede confundirnos en su eje largo, por una alineación central incorrecta o por los diferentes diámetros transversales según la presión o volemia38. Aunque es formalmente el primer paso del VExUS, podemos encontrar pacientes con VCI menor de 2cm y congestión visceral. Y también congestión en órganos sin hipertensión venosa central, por obstrucción entre la VCI y sus tributarias.
En pacientes con cirrosis hepática la transmisión de presiones está amortiguada, el flujo portal es menos fiable y la pulsatilidad puede estar ausente, aun con importante congestión venosa, y viceversa39,40. Ocasionalmente podremos ver pulsatilidad portal en atletas delgados.
Es complejo evaluar el grado de congestión cuando coinciden enfermedad hepática y cardiaca, congestión crónica y aumentos agudos. Mientras la VCI y las suprahepáticas son más sensibles a las condiciones del corazón y a las interacciones toracoabdominales, la pulsatilidad portal refleja mejor una volemia elevada, siendo más sugestiva de congestión visceral.
Sin olvidar estas limitaciones, el principal valor del esquema VExUS es que sistematiza el estudio venoso e integra diferentes parámetros, mejorando la predicción respecto a la presión venosa o un parámetro ecográfico aislado, y nos facilita una visión sencilla de la fisiología venosa. Como siempre en la clínica, debemos finalmente realizar una valoración global e interpretar todos estos patrones de flujos venosos y sus circunstancias modificadoras en su conjunto y contexto.
La ecografía en el trasplante de órganos sólidos abdominalesEl trasplante de órganos sólidos abdominales es un proceso médico-quirúrgico de alta complejidad cuyos resultados han mejorado a lo largo de los años gracias a múltiples factores (quirúrgicos, inmunosupresores), entre los que destacan los cuidados postoperatorios. En ese sentido, la ecografía-Doppler es un instrumento fundamental, ya que permite hacer un seguimiento del injerto y una detección de posibles complicaciones en el postoperatorio inmediato5,41,42.
Exploración generalTras la cirugía, una vez asegurada la situación hemodinámica y respiratoria, debemos realizar una ecografía abdominal que incluya una evaluación del injerto. Para ello deberemos conocer los aspectos anatómicos (lugar de implantación, anomalías vasculares, etc.) y quirúrgicos (anastomosis, tutores, etc.) que nos permitan hacer una correcta interpretación42.
Inicialmente haremos una valoración del órgano mediante planos convencionales evaluando sus características. Normalmente, el injerto presentará contornos homogéneos, una adecuada diferenciación de sus partes (parénquima e hilio), y las vías excretoras serán de paredes finas. La ecogenicidad del órgano la valoraremos comparándola con el riñón ipsilateral o el bazo; además, valoraremos la presencia de lesiones focales (hematomas, quistes simples, etc.) y, en el caso del hígado, signos de afectación difusa que nos indiquen el grado de perfusión o la presencia de una posible infiltración (esteatosis).
Posteriormente evaluaremos la relación que tiene el hígado (hipocondrio derecho) o el riñón (fosa iliaca) con los espacios interviscerales adyacentes (subfrénico, subhepático, Morison, Douglas, hemidiafragma), buscando líquido, hematomas o colecciones42.
Por último, dado que se realizan anastomosis vasculares, con el estudio 2D evaluaremos la morfología y las características de los vasos, con el Doppler color observaremos la distribución y los patrones de flujo sanguíneo y con el Doppler pulsado analizaremos la velocidad y los índices derivados de los principales vasos43.
En los injertos hepáticos identificaremos la arteria hepática principal y su bifurcación, la porta y las venas suprahepáticas. La vena porta discurre paralela y posterior a la vía biliar, tiene un grosor de 10mm sin ecogenicidades en su interior y presenta un flujo hepatópeto, continuo y monofásico, con pequeñas variaciones respiratorias con una velocidad máxima no superior a 40cm/s44. La arteria hepática se encuentra anterior e izquierda a la vena porta, tiene un grosor <5mm, un flujo hepatópeto con un rápido ascenso sistólico y un flujo diastólico continuo y un índice de resistencia (IR=velocidad máxima sistólica −velocidad máxima diastólica /velocidad máxima sistólica) de 0,5-0,8 y un tiempo de aceleración <80ms. Un IR elevado, frecuente en el postrasplante precoz, puede deberse a múltiples factores que no implican patología (hipovolemia, fármacos vasoactivos, edema de anastomosis) que debemos corregir, y en casos de onda sistólica aislada con velocidad disminuida o ausencia de onda, deberemos plantear un angioTAC y/o revascularización emergente. Las venas suprahepáticas son ecoestructuras tubulares anecogénicas que llegan a la VCI, con un flujo hepatófugo continuo, una velocidad de 10-15cm/s y un patrón que suele ser trifásico (vídeo 2).
En los injertos renales, evaluaremos la distribución de la arteria y la vena renal tanto a nivel hiliar como a nivel intraparenquimatoso, y con el Doppler color valoraremos el grado de perfusión. El flujo arterial se acerca al injerto con una onda bifásica y un IR promedio de 0,5-0,8, mientras que el flujo venoso es una onda continua y monofásica que se aleja del injerto. Al igual que el hígado, las velocidades son variables y pueden verse afectadas por múltiples factores, siendo de utilidad la realización evolutiva para que, en caso de cambio, se planteen otras prueba de perfusión45.
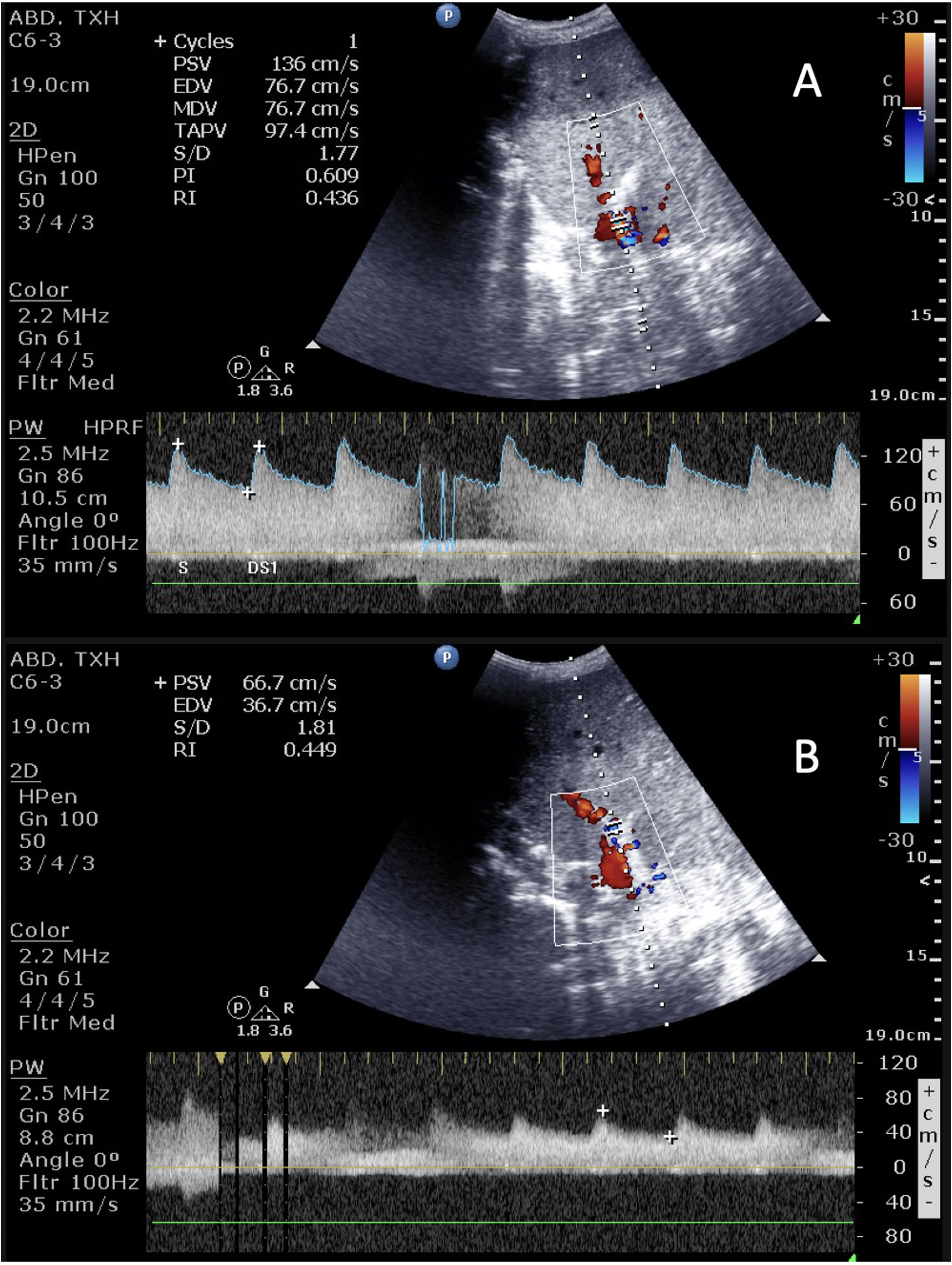
Complicaciones hepáticasAunque la ecografía puede ser de utilidad en la detección de las diferentes complicaciones (biliomas o dilatación de la vía biliar, hematomas o seromas e incluso rechazo), en el postoperatorio inmediato las complicaciones más relevantes son las vasculares (tabla 1 y fig. 4). Dado que la viabilidad del injerto depende de su detección precoz y que conllevan una elevada morbimortalidad, la ecografía es necesaria para su cribado y para su control evolutivo46-48.
Complicaciones vasculares del trasplante hepático
| Complicación | Características clínicas | Características ecográficas |
|---|---|---|
| Trombosis arterial | Incidencia 2-9%Mortalidad 20-60%Mayor afectación de vía biliar | Ausencia de señal Doppler color y DPOcasional: patrón parvus- tardus (IR <0,5 con tiempo de aceleración >0,8) por colateralidad |
| Estenosis arterial | Incidencia 1-8%Deterioro de la función hepática | Doppler color con flujo turbulentoDP con velocidad >2 m/sPatrón parvus-tardus en ramos intrahepáticos |
| Pseudoaneurisma | Incidencia <1%Alta mortalidadd si roturaAsociado a infección/sepsis | Estructura quística a nivel hiliar en eco 2DFlujo turbulento con Doppler color |
| Trombosis portal | Incidencia <3% | Defecto de repleción en eco 2DAusencia de señal con Doppler color y pulsado |
| Estenosis portal | Incidencia <1% | Velocidades aceleradas (×3-4) a nivel de anastomosis |
| Estenosis/trombosis de venas suprahepáticas | RarasAsociadas a cirugía (desproporción, torsión)Disfunción del injerto por congestión | Doppler con flujo monofásico con velocidades reducidas (<10cm/s) o ausencia de señal con Doppler color |
IR: índice de resistencia; DP: Doppler pulsado.
En el trasplante renal, las complicaciones vasculares (trombosis/estenosis arterial o trombosis venosa) son las más frecuentes y el estudio ecográfico es la prueba fundamental para su detección49. En casos de trombosis arterial (incidencia 1-5%) observaremos un injerto hipoecogénico con ausencia tanto de flujo arterial como de flujo venoso. En el caso de la trombosis venosa, encontraremos una ausencia de flujo venoso junto con un flujo arterial de alta resistencia (IR: 0,9-1) con patrones de alta resistencia (picos sistólicos, inversión diastólica del flujo). La estenosis de la arteria renal (incidencia del 1-23%) presenta las mismas características sonográficas que la estenosis de la arteria hepática, y suele diagnosticarse en controles más tardíos.
ProcedimientosParacentesisLa paracentesis se realiza normalmente en el cuadrante inferior izquierdo, en la unión entre el tercio externo y los dos tercios internos de una línea imaginaria que une la espina iliaca anterosuperior y el ombligo6. Con la ecografía se confirma la presencia de líquido, así como la ausencia de vísceras o vasos dentro del rango de punción. Para su realización, se coloca el paciente en decúbito supino y con el transductor se localiza la ascitis como un material anecoico por encima de las asas intestinales. Es importante visualizar la arteria epigástrica inferior mediante el uso del Doppler color, ya que posee muchas modificaciones anatómicas y su trayecto puede verse modificado en pacientes con ascitis severa.
Sondaje urinarioEn condiciones normales se apreciará una vejiga vacía con un manguito inflado (fig. 1D). Si la sonda no funciona de forma correcta o está pinzada, observaremos la sonda intravesical, pero con una vejiga distendida. Se aconseja comprobar su colocación en pacientes con oliguria, ya que la emisión de orina puede ser por rebosamiento (seudoobstrucción del catéter).
Sondaje nasogástricoNo existe un procedimiento estándar para valorar ecográficamente su colocación; algunos autores utilizan solo la ecografía abdominal, mientras que otros la complementan con ecografía cervical para visualizar su paso por el esófago50.
Colocamos el transductor en la zona epigástrica buscando la sonda o la guía metálica en caso de que la lleve; si no la localizamos en esa zona, nos desplazamos hacia el hipocondrio izquierdo buscando el estómago, donde se visualiza el tracto digestivo y la sonda con la guía metálica en su interior. En caso de que la sonda no lleve guía, podemos administrar 50ml de contraste sonicado51 (vídeo 3).
ConclusiónLa ecografía abdominal tiene infinidad de usos en el paciente crítico. Su inclusión en la rutina diaria del intensivista ayudará en el diagnóstico, la monitorización y el tratamiento de nuestros pacientes, evitando así traslados y otras pruebas más invasivas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.