Las quimioquinas son una gran familia de pequeños péptidos que tienen una participación clave no solo en el control del tráfico de los leucocitos, sino también se ha visto que son necesarios en las interacciones entre la inmunidad innata y adaptativa. El papel de estas moléculas es poco conocido en el seno del shock séptico. Nuestra hipótesis es que los niveles séricos de las principales quimioquinas tienen relación con los diferentes fallos orgánicos y con el pronóstico de los pacientes con shock séptico.
DiseñoEstudio prospectivo y observacional.
ÁmbitoUnidad de Cuidados Intensivos médico-quirúrgica.
PacientesNoventa y dos pacientes cumplieron criterios internacionales de shock séptico con demostración de una infección, de los que se excluyeron 40 por presentar diferentes alteraciones inmunitarias adquiridas. Treinta y seis voluntarios sanos sirvieron de grupo control.
IntervencionesNinguna.
ResultadosEl 46% de los pacientes presentaron síndrome de distrés respiratorio agudo (SDRA) y en ellos los niveles séricos de IL-8 se encontraban elevados (499,9±194,1 vs. 190,8±91,7pg/ml; p=0,039). Esta molécula también estaba elevada en el 36% de los pacientes con shock séptico que tenían fracaso renal agudo (FRA) (453,3±181,6 vs. 201,3±95,9pg/ml; p=0,049). El 19% de los pacientes presentaron coagulopatía y en ellos se observó una elevación de los niveles de IL-8 (635,8±292,3 vs. 218,7±87,0pg/ml; p=0,010), de MIP-1α (91,4±27,3 vs. 58,8±11,1pg/ml; p=0,044) y niveles bajos de RANTES (8162,2±6321,0 vs. 18781,8±11,1pg/ml; p=0,027). No encontramos diferencias significativas en los niveles séricos de quimioquinas estudiadas en pacientes con shock séptico entre los supervivientes y los que fallecieron.
ConclusionesAl ingreso en la UCI, la IL-8 es un buen biomarcador de FRA y de SDRA, así como de coagulopatía en pacientes con shock séptico. MIP-1α y RANTES también presentan niveles séricos alterados en la coagulopatía asociada a la sepsis. A pesar de esto, las quimioquinas no parecen ser buenos marcadores pronósticos en estos pacientes.
Chemokines are a large superfamily of small proteins that function not only in leukocyte trafficking, but are also necessary for linkage between innate and adaptive immunity. Little is known about their role in septic shock. We hypothesized that serum levels of the most important chemokines are related to organ failure, disease severity and outcome.
DesignA prospective observational study was carried out.
SettingSurgical-clinical Intensive Care Unit.
PatientsNinety-two patients diagnosed with septic shock using international criteria. Forty patients were excluded due to acquired immunity disturbances. Samples from 36 healthy controls were also analyzed.
InterventionsNone.
ResultsIn 46% of the patients who suffered acute respiratory distress syndrome (ARDS), IL-8 levels were higher than in patients without ARDS (499.9±194.1 vs 190.8±91.7pg/ml; P=.039). This molecule was also higher in 36% of the patients with sepsis-induced acute renal failure (ARF) (453.3±181.6 vs 201.3±95.9pg/ml; P=.049). Coagulopathy was found in 19% of the septic shock patients with elevated serum IL-8 levels (635.8±292.3 vs 218.7±87.0pg/ml; P=.010), elevated MIP-1α (91.4±27.3 vs 58.8±11.1pg/ml; P=.044), and low circulating RANTES levels (8162.2±6321.0 vs 18781.8±11.1pg/ml; P=.027). No significant differences were found between survivors and non-survivors at any time of follow-up.
ConclusionsUpon admission to the ICU, IL-8 is a reliable biomarker of sepsis-induced AFR, ARDS and coagulopathy. Altered circulating MIP-1α and RANTES levels are also found in patients with septic shock and coagulopathy. However, chemokines do not appear to be good biomarkers of mortality in septic shock.
La principal causa de muerte en los pacientes con sepsis es la disfunción multiorgánica1. El pronóstico del síndrome de disfunción multiorgánica (MODS) viene determinado por el número de órganos que fracasan, la gravedad del fallo y de su duración en el tiempo. En un estudio de Knaus et al. la tasa de mortalidad fue del 22% para los pacientes con un solo fallo orgánico de menos de 24h, pero ascendía al 42% si se mantenía durante 7d. La mortalidad era del 80% si la disfunción era de 3 o más órganos durante menos de 24h, pero llegaba al 100% cuando se mantenían durante más de 4d2.
Aunque se han desarrollado puntuaciones de gravedad para caracterizar el grado de disfunción multiorgánica y predecir la mortalidad de los pacientes con sepsis, el conocimiento sobre la fisiopatología del MODS todavía sigue siendo un reto para el conocimiento científico3. El desarrollo del MODS es consecuencia de una excesiva activación de la respuesta inflamatoria. Sin embargo, los tratamientos que han intentado frenar esta supuesta reacción sistémica inflamatoria exagerada han fallado4. Es más, la mayoría de los pacientes que sobreviven a la agresión inicial de la sepsis suelen fallecer días o semanas después de fracaso multiorgánico y en una situación de inmunosupresión3.
A nivel celular hay múltiples mecanismos que contribuyen al desarrollo del MODS. Entre ellos destacan la trombosis microvascular, el daño inducido por los neutrófilos, la traslocación bacteriana, la liberación de citoquinas, la disfunción endotelial, la apoptosis celular, etc.5. Las quimioquinas son una gran familia de citoquinas que estimulan el movimiento de los leucocitos y que regulan su migración desde la sangre a los tejidos. Aunque las quimioquinas son consideradas como citoquinas proinflamatorias ya que inducen la producción y liberación de histamina, enzimas y defensinas, a diferencia de otras citoquinas de este grupo, no inducen a otras citoquinas ni producen fiebre ni tampoco reactantes de fase aguda. Es más, cuando circulan a grandes concentraciones poseen efectos desensibilizadores y pueden suprimir la inflamación local6.
El factor nuclear-κB (NF-κB) tiene un papel fundamental en la fisiopatología de la sepsis y el shock séptico. El incremento de su actividad se ha asociado con una mayor tasa de mortalidad y un peor pronóstico7. El NF-κB media la transcripción de múltiples genes de moléculas inflamatorias como citoquinas, moléculas de adhesión, enzimas, inmunorreceptores, reactantes de fase aguda y quimioquinas, entre las que se encuentran la interleuquina-8 (IL-8), la proteína inflamatoria del macrófago 1-α (MIP-1α), la proteína quimiotáctica de monocitos de tipo 1 (MCP-1) y RANTES o «regulated on activation, normal T cell expressed and secreted». El papel de estas quimioquinas cuando se encuentran solubles en plasma en el desarrollo de las diferentes disfunciones orgánicas en los pacientes con sepsis no ha sido bien definido.
La hipótesis de este trabajo es que los niveles plasmáticos de estas quimioquinas circulantes están elevados en pacientes con shock séptico y que ello contribuye al desarrollo de disfunción de diferentes órganos y en la mortalidad de los pacientes.
Pacientes y métodosDe forma prospectiva y en un periodo aproximado de 36 meses se incluyeron en el estudio los pacientes mayores de 18 años que presentaban sepsis grave ingresados en la Unidad de Cuidados Intensivos (UCI). Para categorizar a un enfermo con sepsis grave debía cumplir los criterios de sepsis y, además, algún fallo orgánico, hipoperfusión o hipotensión con los criterios definidos en la conferencia de consenso del «American College of Chest Physicians/Society of Critical Care Medicine»8 (tabla 1).También fue imprescindible la demostración de una infección, bien mediante técnicas microbiológicas (tinción de Gram y/o cultivo), bien por técnicas radiológicas o por visión directa del foco de la infección.
Criterios de sepsis, shock séptico y de cada fallo orgánico
| Criterios de sepsis: deben cumplir 2 o más de estos 4 criterios |
| Fiebre o hipotermia: temperatura>38° o<36°C |
| Taquicardia: frecuencia cardiaca>90 lat/min |
| Hiperventilación: frecuencia respiratoria>20 resp/min o presión parcial de CO2<32mmHg o volumen-min>10 l/min |
| Leucocitosis:>12.000/mm3o leucopenia<4.000/mm3o más de 10% de formas jóvenes (cayados, etc.) |
| Criterios de shock séptico: enfermos con sepsis asociada a hipotensión, hipoperfusión o necesidad de soporte circulatorio |
| Hipotensión: tensión arterial sistólica<90mmHg o una caída>40mmHg respecto a su situación basal en el enfermo con historia de hipertensión arterial |
| Hipoperfusión: presencia de acidosis láctica, oliguria<0,5 ml/kg de peso y hora y/o alteración de nivel de conciencia |
| Soporte circulatorio: necesidad de balance positivo mayor de 2.000ml/d sin otra causa que lo justifique o necesidad de administración de fármacos vasoactivos |
| Definición de fallo orgánico: deben mantenerse estos criterios durante más de 24h |
| Cardiovascular: presencia de uno o más |
| Frecuencia cardiaca:<55 lpm |
| Tensión arterial media:<50mmHg |
| Existencia de taquicardia o fibrilación ventricular |
| Necesidad de fármacos vasoactivos |
| Respiratorio: criterios de síndrome de distrés respiratorio agudo |
| Relación PaO2/FiO2:<200mmHg |
| Infiltrado bilateral en la radiografía de tórax |
| Presión capilar pulmonar:<19mmHg |
| Proceso agudo que lo justifique |
| Renal: presencia de al menos uno de los siguientes criterios |
| Diuresis:<160ml/8h o<480ml en 24h |
| Nitrógeno ureico en sangre (BUN):>100mg/dl |
| ∘ Creatinina plasmática:>3,5mg/dl |
| Hematológico: presencia de al menos uno |
| Leucopenia:<1.000/mm3 |
| Trombocitopenia:<20.000/mm3 |
| Hematocrito:<20% |
| Neurológico: escala de Glasgow:<7 |
| Hepático |
| INR:>1,5 |
| Bilirrubina:>6mg/dl |
Los criterios de exclusión fueron:
- a)
Cualquier causa de inmunodeficiencia primaria o adquirida.
- b)
Tratamiento inmunosupresor o inmunomodulador previo.
- c)
Padecer una neoplasia no controlada o en tratamiento activo.
- d)
Enfermedades autoinmunes o alérgicas en actividad.
- e)
Necesidad de utilizar técnicas de depuración extrarrenal que pudieran afectar al aclaramiento de los diferentes mediadores inflamatorios.
- f)
Estar bajo algún tipo de tratamiento en fase experimental.
Se analizaron muestras de sangre periférica procedentes de 36 voluntarios sanos con una distribución de edades y una composición por sexos similares al grupo de pacientes estudiados para que estos parámetros demográficos no interfirieran en la interpretación de los resultados. El protocolo fue aprobado por el Comité Local de Ética e Investigación Clínica. Los familiares de los pacientes y los controles sanos dieron su consentimiento informado al protocolo experimental.
Todos los pacientes recibieron tratamiento convencional. Ninguno recibió proteína C activada y si el paciente necesitaba hidrocortisona por hipotensión refractaria el paciente era excluido del estudio.
Se tomaron muestras de sangre a través de la cateterización arterial en tubos sin anticoagulante en las primeras 12h de ingreso en la UCI (muestra basal), 48h después y a los 7, 14 y 28d. Se extrajeron 10ml adicionales de sangre que se dejaron coagular a temperatura ambiente, separándose posteriormente el suero por centrifugación a 600xg durante 20min. Se recogieron los sobrenadantes, se filtraron, se dividieron en alícuotas y se conservaron a -70°C.
Tras la descongelación de los sobrenadantes hasta temperatura ambiente se realizó un ELISA del tipo «sandwich». Los resultados así obtenidos se midieron en el lector de enzimoinmunoanálisis Multititer Plus® (Tiertek Multiscan Plus, Flow Laboratories, Reino Unido). Estos resultados se comparan con una curva estándar obtenida a partir de concentraciones conocidas de cada citoquina proporcionadas por la casa comercial.
El análisis de las distintas curvas estándar y la interpolación subsiguiente se llevó a cabo con el programa Delta Soft II® versión 4.1 (Biometallies, Inc., Estados Unidos) en un ordenador Macintosh®.
Las determinaciones de las concentraciones de las diferentes citoquinas se realizaron mediante la utilización de los preparados comerciales con una sensibilidad en la cuantificación de sobrenadantes de 25pg/ml para IL-8 (Diaclone, EE. UU.), 5pg/ml para MCP-1 (R&D System, Minneapolis, EE. UU.), 10pg/ml para MIP-1α (R&D System, Minneapolis, EE. UU.) y 10pg/ml para RANTES (R&D System, Minneapolis, EE. UU.).
Para el estudio estadístico inicialmente se analizó la naturaleza de las distribuciones empleando el contraste de normalidad de Shapiro-Whilk. Cuando los datos obtenidos siguieron distribuciones normales se utilizaron contrastes de medias con la t de Student; cuando los datos no cumplían criterios de normalidad se empleó el contraste no paramétrico de la U de Mann-Whitney para efectuar comparaciones. Para comparar datos del mismo grupo a diferentes intervalos de tiempo se utilizó el test de Friedman. Para establecer correlaciones entre las distintas variables se usó el coeficiente de correlación de Pearson.
Los resultados de los estudios experimentales se presentan en forma de medias y errores estándar de la media. En todos los casos se valoraron niveles de significación inferiores al 5% (p<0,05). El análisis estadístico se llevó a cabo mediante el paquete estadístico SPSS 11.0 (SPSS Inc. Chicago, Illinois 60606, EE. UU.).
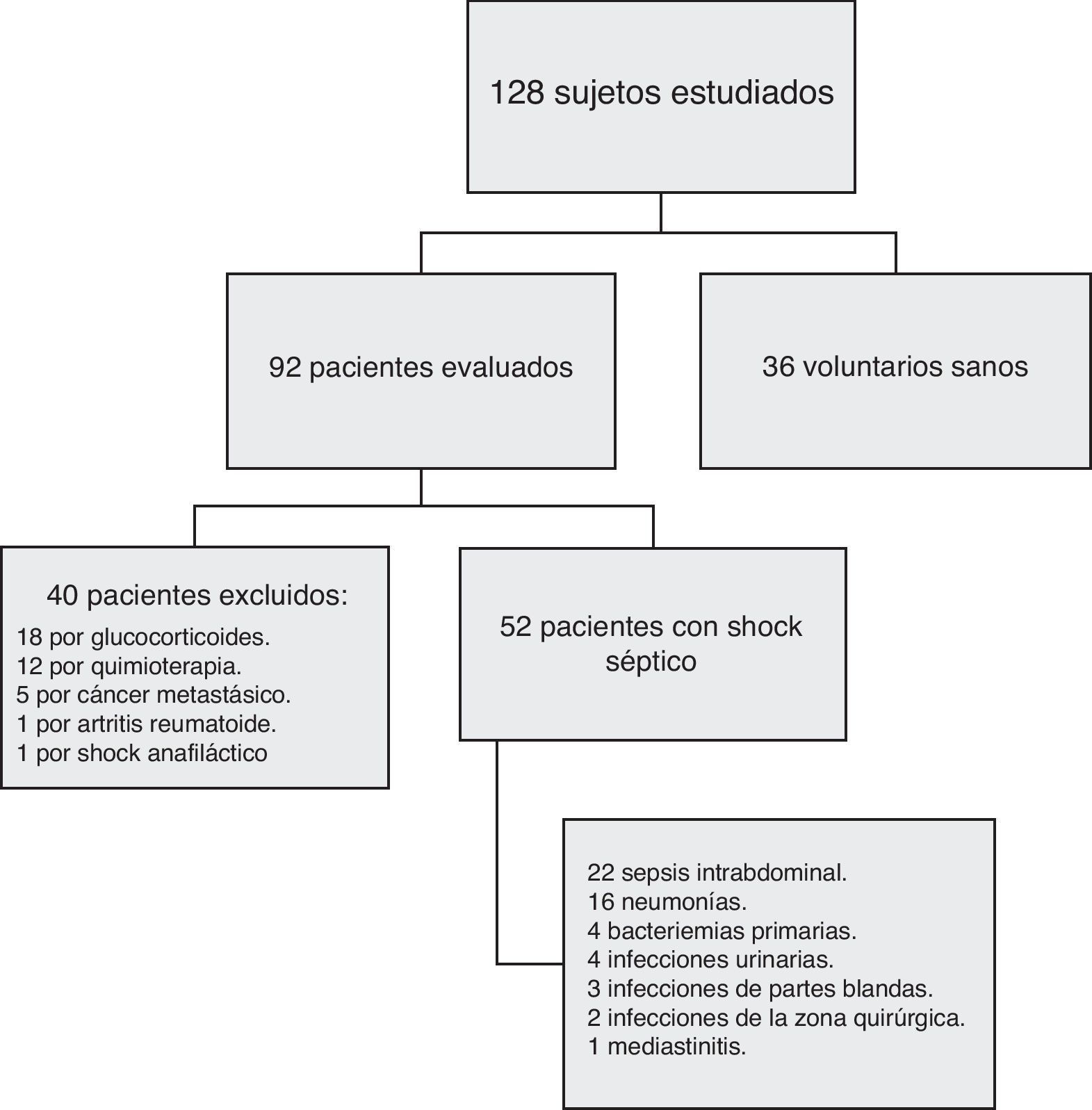
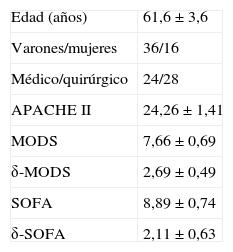
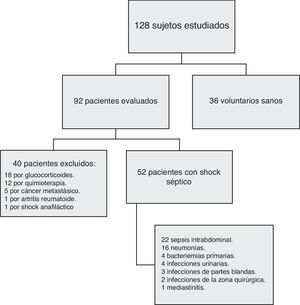
ResultadosLa figura 1 muestra el flujo de los 128 sujetos estudiados que incluye a 52 pacientes, todos ellos con shock séptico, 40 excluidos y 36 voluntarios sanos. Las características demográficas de los pacientes se resumen en la tabla 2.
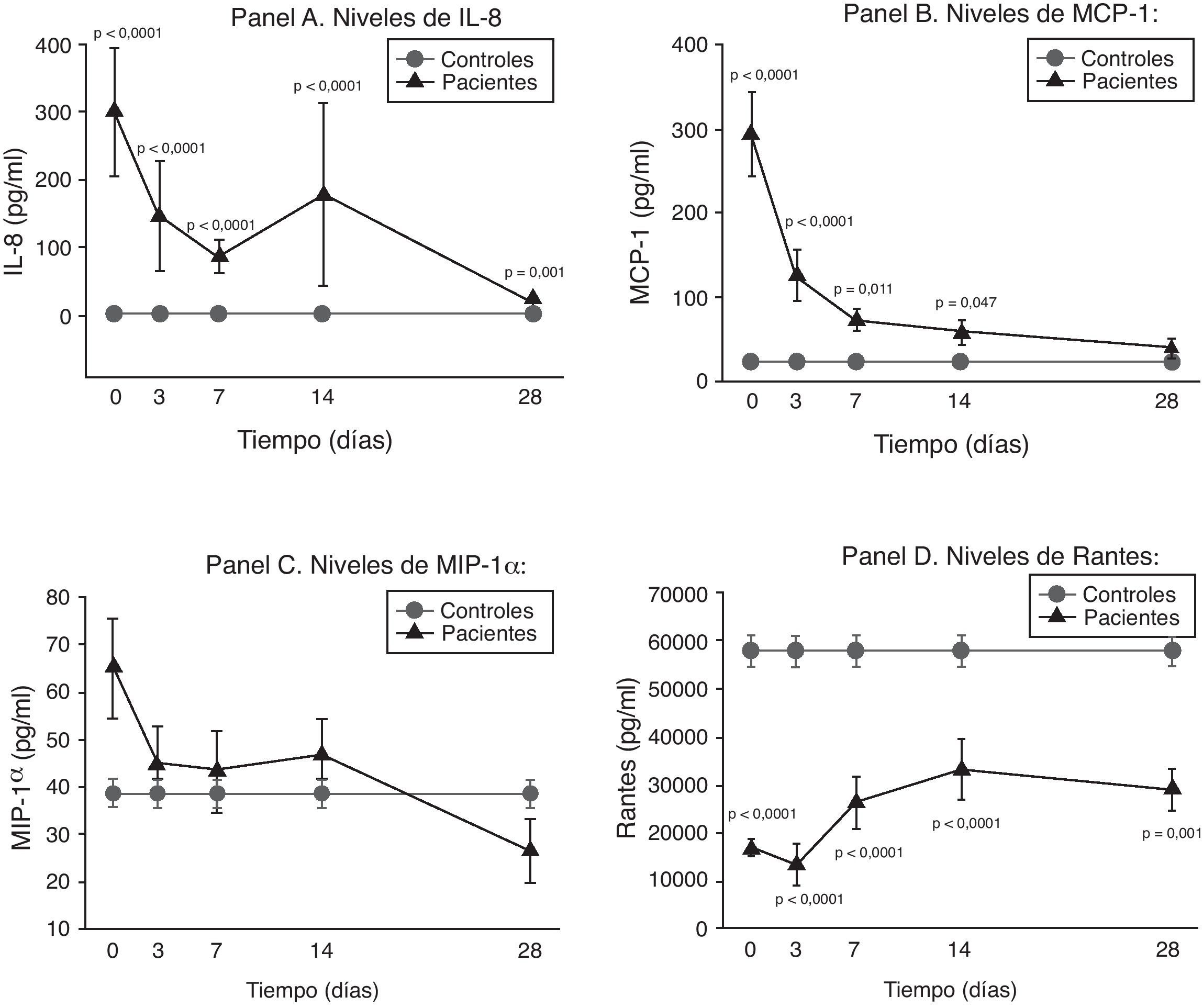
Los niveles séricos de las quimioquinas solubles que se estudiaron (IL-8, MCP-1, MIP-1α y RANTES) mostraron un comportamiento especial e individualizado para cada una ellas.
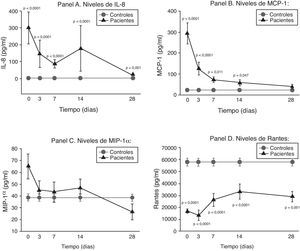
La IL-8, como puede observarse en el panel A de la figura 2, mantuvo unos niveles extraordinariamente elevados durante toda la evolución de la sepsis.
Niveles de quimioquinas solubles en pacientes con shock séptico. Panel A: niveles de IL-8 en pg/ml respecto al tiempo en días. Panel B: niveles de MCP-1 en pg/ml respecto al tiempo en días. Panel C: niveles de MIP-1α en pg/ml respecto al tiempo en días. Panel D: niveles de RANTES en pg/ml respecto al tiempo en días. Los valores se expresan como media y como el error estándar de la media.
La concentración de MCP-1 fue muy alta en la primera fase para después ir disminuyendo progresivamente hasta normalizarse a los 28d (panel B de la figura 2).
No hubo diferencias significativas entre los niveles de MIP-1α de los controles y de los pacientes en ningún momento evolutivo (panel C de la figura 2).
Por otra parte, como podemos ver en el panel D de la figura 2, los niveles de RANTES están por debajo de los controles en todos los tiempos de la enfermedad.
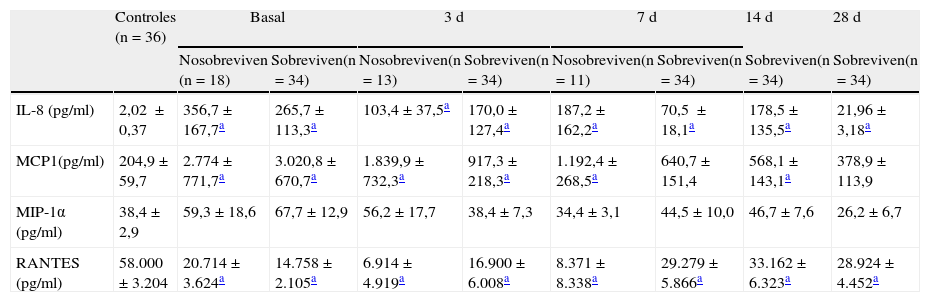
Valor pronóstico de los niveles de quimioquinas solublesLa mortalidad de los pacientes estudiados fue del 34,6%. No encontramos diferencias significativas en los niveles séricos de quimioquinas estudiadas en pacientes con shock séptico entre los supervivientes y los que fallecieron (tabla 3).
Niveles de quimioquinas en el grupo control y en cada momento evolutivo de la sepsis
| Controles (n=36) | Basal | 3d | 7d | 14d | 28d | ||||
| Nosobreviven (n=18) | Sobreviven(n=34) | Nosobreviven(n=13) | Sobreviven(n=34) | Nosobreviven(n=11) | Sobreviven(n=34) | Sobreviven(n=34) | Sobreviven(n=34) | ||
| IL-8 (pg/ml) | 2,02±0,37 | 356,7±167,7a | 265,7±113,3a | 103,4±37,5a | 170,0±127,4a | 187,2±162,2a | 70,5±18,1a | 178,5±135,5a | 21,96± 3,18a |
| MCP1(pg/ml) | 204,9±59,7 | 2.774±771,7a | 3.020,8±670,7a | 1.839,9±732,3a | 917,3±218,3a | 1.192,4±268,5a | 640,7±151,4 | 568,1±143,1a | 378,9±113,9 |
| MIP-1α (pg/ml) | 38,4±2,9 | 59,3±18,6 | 67,7±12,9 | 56,2±17,7 | 38,4±7,3 | 34,4±3,1 | 44,5±10,0 | 46,7±7,6 | 26,2±6,7 |
| RANTES (pg/ml) | 58.000±3.204 | 20.714±3.624a | 14.758±2.105a | 6.914±4.919a | 16.900±6.008a | 8.371±8.338a | 29.279±5.866a | 33.162±6.323a | 28.924±4.452a |
Los valores se expresan como media y como el error estándar de la media.
De los 6 fallos orgánicos analizados (cardiovascular, síndrome de distrés respiratorio agudo [SDRA], fracaso renal agudo [FRA], coagulopatía, fallo hepático o neurológico) la incidencia de fracaso hepático (n=3) y de fallo neurológico (n=2) es tan baja que no se pueden extraer conclusiones. Por otro lado, todos los pacientes cumplieron criterios de fallo cardiovascular y fueron etiquetados como shock séptico. Los pacientes que presentaron SDRA al ingreso fueron un 46%, mientras que la incidencia de FRA fue del 36% y la de coagulopatía del 19%.
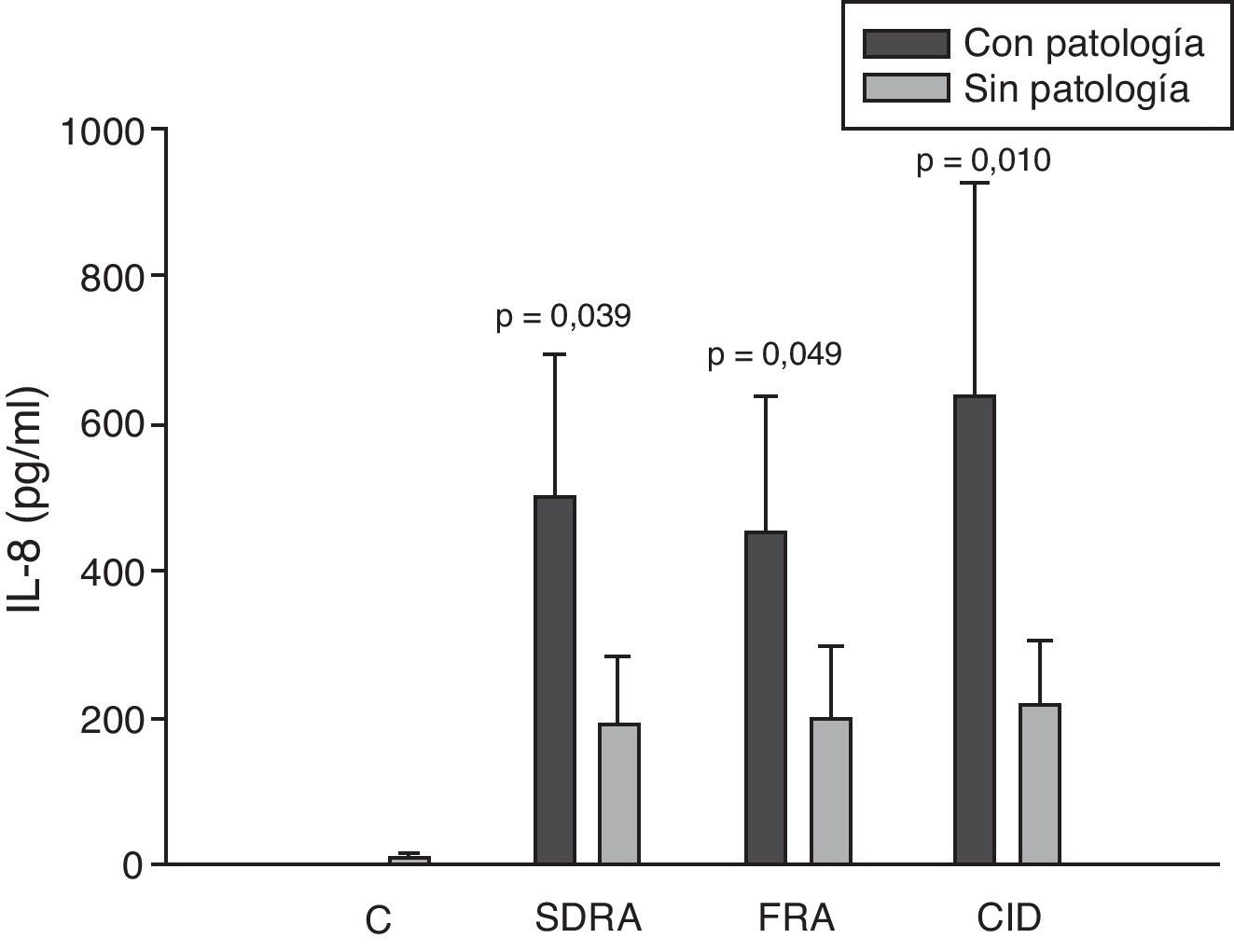
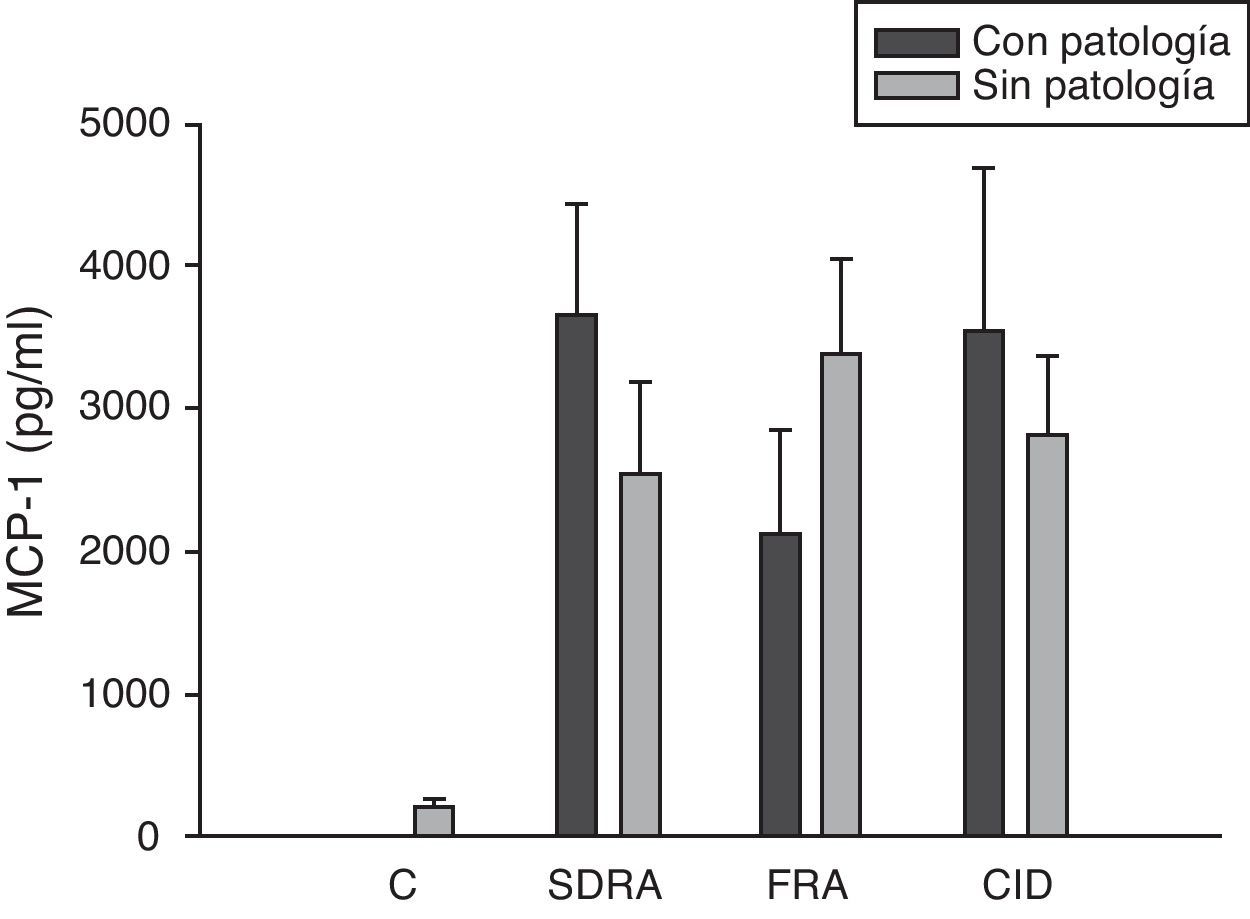
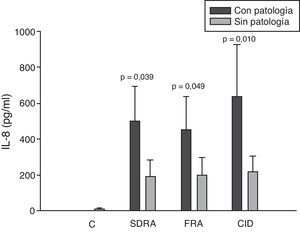
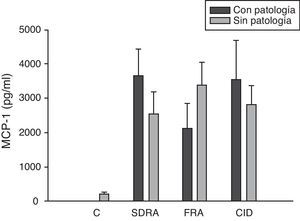
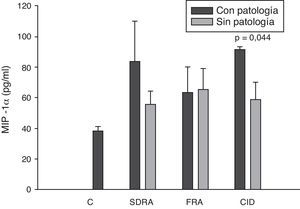
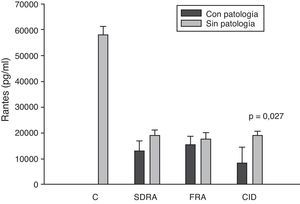
Si analizamos los niveles de las quimioquinas en el momento del ingreso en la UCI para los diferentes fallos orgánicos podemos apreciar cómo los niveles séricos de IL-8 fueron significativamente más altos en los pacientes que ingresaron con SDRA que en aquellos pacientes que no lo sufrían, así como los que desarrollaron FRA comparados con los que no tuvieron fallo renal (fig. 3). En el resto de las quimioquinas estudiadas (MCP-1, MIP-1α y RANTES) en el momento del ingreso no presentaron diferencias significativas en aquellos que padecían SDRA y tampoco en los que ingresaron con FRA (figs. 4–6).
Niveles de IL-8 en pacientes con shock séptico a su ingreso en la UCI. C: controles; SDRA: síndrome de distrés respiratorio agudo; FRA: fracaso renal agudo; CID: coagulopatía. Los criterios se especifican en la tabla 1.
Niveles de MCP-1 en pacientes con shock séptico a su ingreso en la UCI. C: controles; SDRA: síndrome de distrés respiratorio agudo; FRA: fracaso renal agudo; CID: coagulopatía. Los criterios se especifican en la tabla 1.
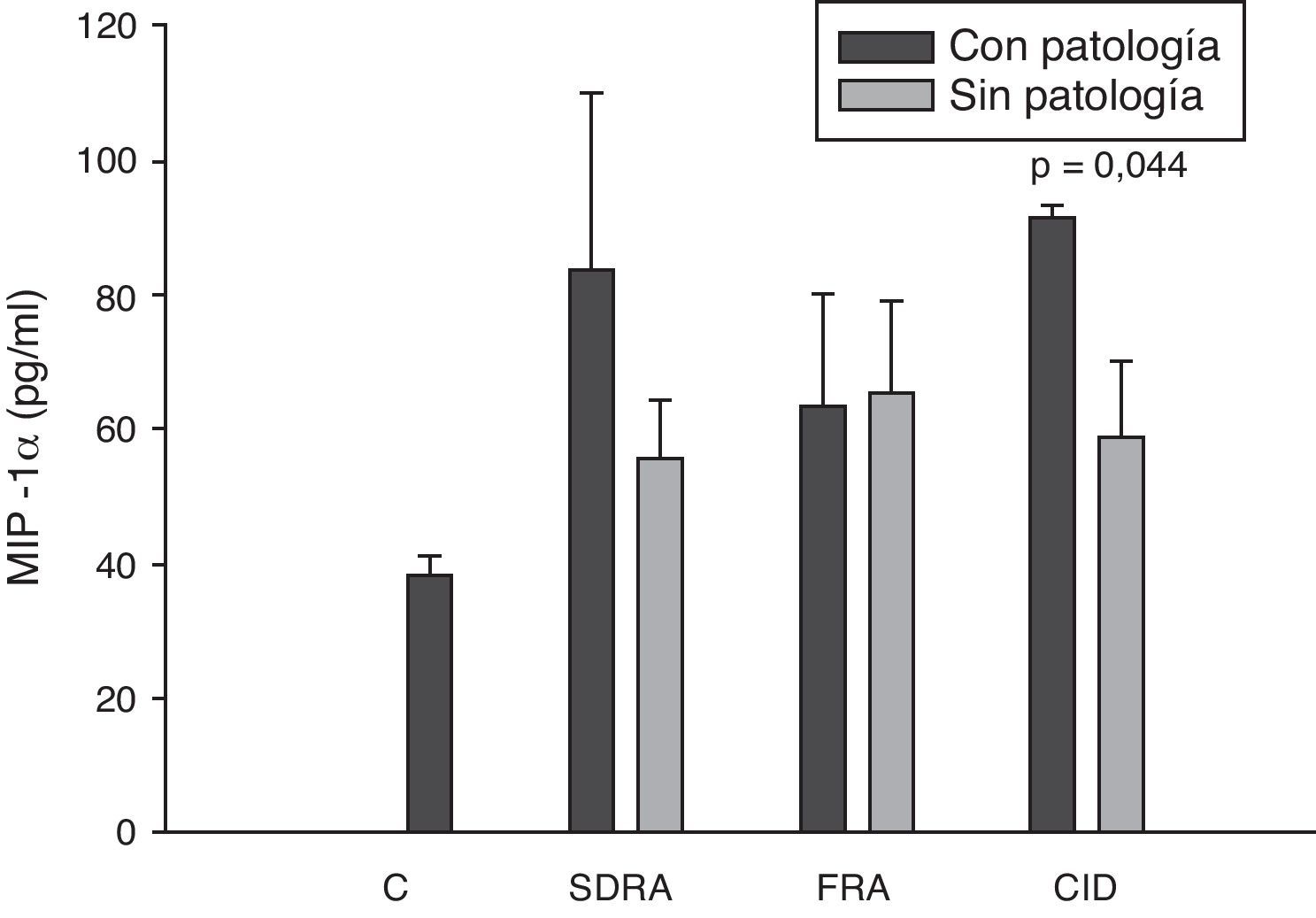
Niveles de MIP-1α en pacientes con shock séptico a su ingreso en la UCI. C: controles; SDRA: síndrome de distrés respiratorio agudo; FRA: fracaso renal agudo; CID: coagulopatía. Los criterios se especifican en la tabla 1.
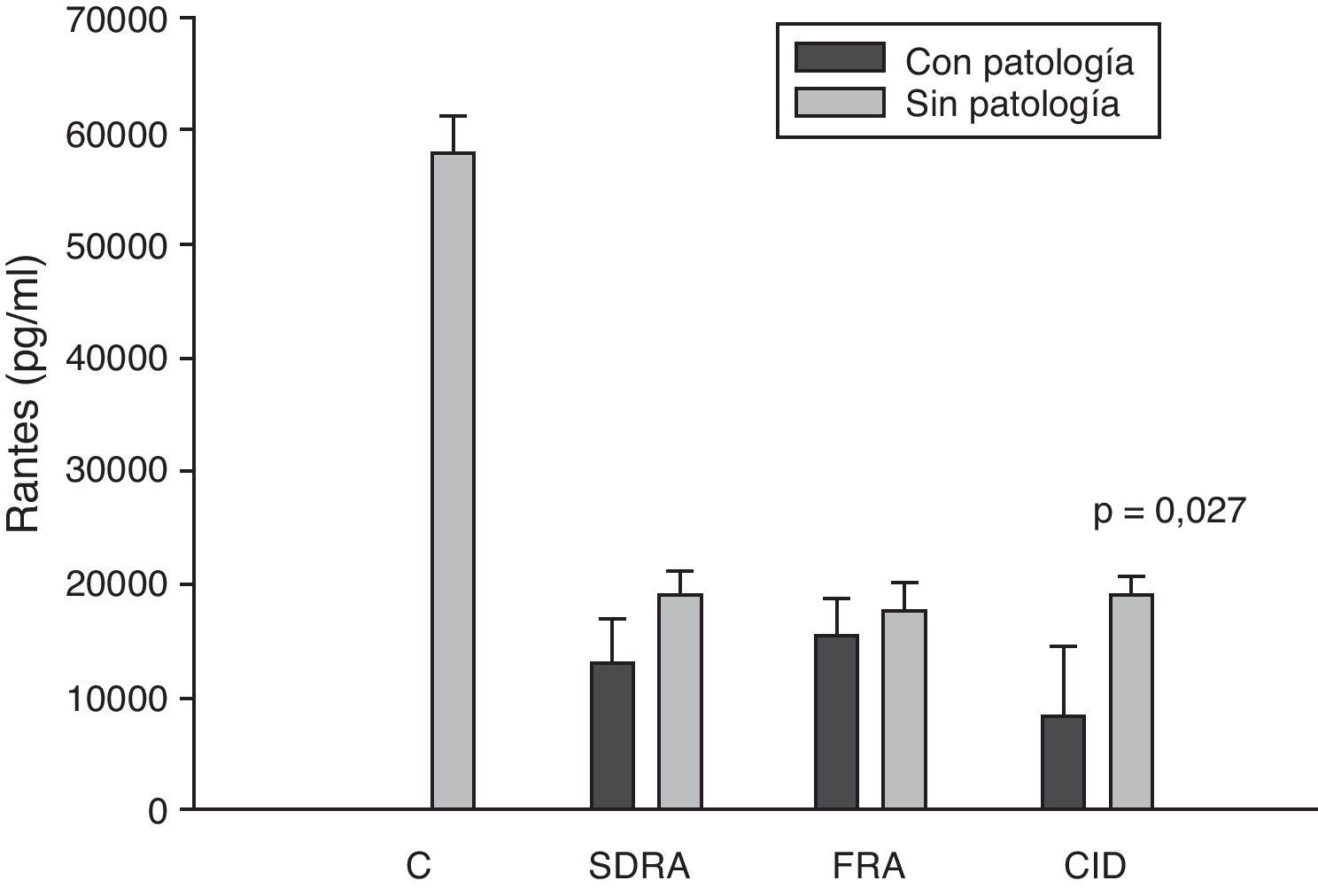
Niveles de RANTES en pacientes con shock séptico a su ingreso en la UCI. C: controles; SDRA: síndrome de distrés respiratorio agudo; FRA: fracaso renal agudo; CID: coagulopatía. Los criterios se especifican en la tabla 1.
Los niveles de IL-8 y de MIP-1α en los enfermos con coagulopatía fueron más elevados que en aquellos que no tuvieron coagulopatía al ingreso (figs. 3 y 5). También hubo diferencias significativas en los niveles de RANTES, de tal manera que los pacientes con coagulopatía tenían unos niveles menores a su ingreso en la UCI que los que no lo padecían (fig. 6).
DiscusiónEn nuestro estudio encontramos que las quimioquinas están implicadas en el desarrollo de diferentes daños orgánicos. La IL-8 presenta unos niveles elevados en pacientes con shock séptico y estos niveles son buenos marcadores de fallo respiratorio, renal y hematológico. En pacientes con coagulopatía también hay implicación de otras 2 quimioquinas como son MIP-1α y RANTES.
Hack et al.9 fueron los primeros en describir cómo el 89% de los pacientes con sepsis presentaban niveles altos de IL-8 al ingreso y en el seguimiento durante 60h, aunque, a diferencia de nuestros resultados, en ese seguimiento descendían. El sustrato fisiopatológico de este hallazgo se debe al hecho de que la endotoxina, la IL-1β y sobre todo el TNF-α son los principales estímulos para su producción y liberación. La medición de las concentraciones séricas de IL-8 se ha utilizado para predecir los pacientes que tenían bacteriemia en un grupo de enfermos que acudían a urgencias con un cuadro de SIRS10, aunque otros autores prefieren los niveles de procalcitonina para este fin11.
Múltiples moléculas solubles han sido evaluadas como marcadores del pronóstico de los pacientes con sepsis12–15. En este sentido, el valor pronóstico de los niveles de IL-8 ha sido descrito por varios autores16,17. Recientemente, varios estudios que han utilizado multitest comerciales y que determinan simultáneamente 17 moléculas en pacientes con sepsis han hallado que la IL-8 era uno de los mejores biomarcadores del pronóstico en estos pacientes18–20. Nosotros no encontramos estos hallazgos, aunque no fuimos los únicos21. Tal vez la razón de esta discrepancia está en que nuestros enfermos, a diferencia del resto de los estudios, eran enfermos más graves con más puntuación APACHE II y prácticamente todos con shock, lo que hace que sea más difícil encontrar diferencias en los niveles de IL-8. Efectivamente, en el estudio de Halstensen et al.22 y en el de Damas16 los pacientes con shock tenían mayores niveles que los pacientes con sepsis sin fracaso cardiovascular.
La IL-8 ha sido identificada como el principal factor quimiotáctico de los polimorfonucleares neutrófilos en el pulmón23. Boutten et al.24 demostraron una correlación entre la cantidad de neutrófilos y la concentración de IL-8 en el lavado broncoalveolar obtenido de diferentes segmentos pulmonares en 17 pacientes con neumonía unilateral. Nosotros encontramos concentraciones más elevadas de IL-8 en pacientes con SDRA a su ingreso en la UCI que en los que no presentaban este fallo respiratorio. Algunos artículos analizan este punto y confirman nuestros resultados16,25. Está demostrado que los niveles de IL-8 en el lavado broncoalveolar son elevados en pacientes con SDRA26,27 y, lo que es más, se correlacionan también con su paso a la cronicidad28.
Nosotros encontramos diferencias significativas en los niveles de IL-8 entre los pacientes que presentaban FRA al ingreso en la UCI como consecuencia de la sepsis. Fujishima et al.17 correlacionaron los niveles en sangre de IL-8 con el desarrollo del FRA y con la mortalidad. También el trabajo de Ahlstrom et al.29 confirma nuestros resultados. Probablemente la IL-8 esté relacionada en la fisiopatología del FRA en los pacientes con sepsis, aunque no hay datos experimentales que lo corroboren y, por lo tanto, no podemos descartar que se trate simplemente de un problema de aclaramiento renal y acúmulo de esta sustancia ante una situación de fallo renal. En nuestro estudio observamos que los niveles de IL-8 eran superiores en pacientes con coagulopatía en el momento inicial de la sepsis. De los trabajos previamente citados tanto el de Damas16 como el de Fujishima17 en pacientes sépticos confirman nuestros resultados. La IL-8 está implicada en la inducción de la coagulación intravascular asociada a la endotoxina30. La IL-8 promueve la activación de la coagulación, especialmente a través de la mediación de monocitos CD14+31. La trombina, a su vez, estimula la producción de la IL-8 por parte del monocito y de la célula endotelial31. También se ha demostrado un aumento de la IL-8 sanguínea en la coagulopatía asociada a la leucemia promielocítica aguda32.
La proteína quimiotáctica de monocitos de tipo 1 o MCP-1 es una quimioquina CC que actúa como un mediador en la infiltración de los monocitos y de los linfocitos T a tejidos de una gran variedad de enfermedades inflamatorias. En el presente trabajo encontramos niveles séricos de MCP-1 elevados al ingreso respecto al grupo de control y, posteriormente, van bajando paulatinamente para normalizarse a los 28d. Estos mismos resultados han sido encontrados por otros autores33,34. Sin embargo, otros autores35 solo obtuvieron niveles elevados de MCP-1 en el lavado broncoalveolar de pacientes con sepsis y no en el suero. En este sentido, nosotros no encontramos niveles elevados en aquellos con SDRA ni ningún otro fallo orgánico al ingreso del cuadro. Bien es verdad que el MCP-1 es considerado como una segunda señal y que estaría implicado en la infiltración monocitaria y, por lo tanto, tal vez en el momento del ingreso no se pueda ver la transcendencia clínica que posteriormente este mediador probablemente tenga.
Nosotros no encontramos diferencias entre los pacientes que fallecieron y los supervivientes en los niveles séricos de MCP-1 durante la primera semana de la sepsis. Este mismo resultado ha sido encontrado en otros trabajos34.
La MIP-1α o proteína inflamatoria de los macrófagos de tipo-1α es fundamentalmente una proteína quimiotáctica de macrófagos, aunque también se le atribuyen efectos quimiotácticos y proadhesivos sobre otros tipos celulares. Además, presenta funciones moduladoras en la producción de citoquinas y es un pirógeno endógeno. A pesar de que experimentalmente la MIP-1α aparece tras la administración de lipopolisacáridos tanto in vitro36 como in vivo34,37, los resultados obtenidos al estudiar los niveles séricos en pacientes con sepsis grave fueron muy llamativos. Encontramos niveles normales durante toda la evolución de la enfermedad, independientemente de cuál fue su pronóstico. Estos mismos hallazgos han sido descritos por otros grupos17,33–35,38.
Todos los autores parecen estar de acuerdo en que los niveles de MIP-1α no tienen ningún valor pronóstico ni relación con el desarrollo de fracaso multiorgánico17,38. Sin embargo, en nuestro estudio sí encontramos diferencias en los niveles de MIP-1α en los pacientes que a su ingreso en la UCI sufren coagulopatía respecto a los que no tenían coagulopatía. El único trabajo que hemos encontrado ha sido el de Fujishima et al.17 y, aunque existe una tendencia a tener mayores niveles de MIP-1α en los pacientes con coagulopatía, esta no llega a ser estadísticamente significativa.
La RANTES o «regulated on activation, normal T cell expressed and secreted» es una quimioquina de la clase CC producida por una serie de tipos celulares que incluye a las plaquetas, los linfocitos y las células epiteliales en respuesta a señales pirógenas como la endotoxina, las infecciones bacterianas y el TNF-α39. Su principal acción biológica es el tráfico y la activación de células tanto inflamatorias como no inflamatorias40. Cavaillon et al.41 describieron que los niveles de RANTES en la sepsis eran inversamente proporcionales a la puntuación de APACHE II, de lo que dedujeron que la RANTES es más baja en los pacientes que fallecen. Moller et al.33 demostraron que los pacientes con meningococemia fulminante tenían niveles de RANTES menores que en otro tipo de infecciones meningocócicas menos graves.
Nosotros también observamos niveles extraordinariamente bajos de RANTES respecto al grupo de control de voluntarios sanos. Sin embargo, no encontramos diferencias significativas entre los niveles de los pacientes supervivientes respecto a los que fallecieron. El único fallo orgánico en el que hubo concentraciones significativamente más bajas en los pacientes fue la presencia de coagulopatía al ingreso en la UCI con respecto a los que no la presentaron. Este resultado presenta una interpretación difícil. Es conocido que las bacterias pueden estimular la liberación de RANTES39 y que la administración de 4ng/kg de endotoxina a 8 voluntarios sanos supuso una caída en los niveles de RANTES42. Por otro lado, también sabemos que las plaquetas son la principal fuente de RANTES43. Las plaquetas expresan CD40 en su superficie que interacciona con CD154 de los linfocitos T activados, con lo que se libera RANTES que estaba almacenada en las plaquetas43.
Durante la respuesta inflamatoria RANTES se libera dentro del espacio intravascular y se une rápidamente a la superficie endotelial, con lo que se produce el reclutamiento y la retención de leucocitos, incluyendo los linfocitos T40. Surge aquí la dificultad en la interpretación: la caída de RANTES encontrada en la coagulopatía es debida a su consumo por unión al endotelio vascular o se trata de una caída en su almacén, que no es otro que las plaquetas. Ellis et al.40,en pacientes hematológicos, observaron que en los pacientes con fiebre los niveles de RANTES se relacionaban con la presencia de trombocitopenia. Nosotros, a posteriori, estudiamos la correlación entre los niveles de RANTES y de plaquetas en la sangre obtenidos de pacientes con sepsis grave durante el primer día de ingreso en la UCI. Esta correlación no paramétrica estudiada por el test de Spearman obtuvo una correlación de 0,546 con un valor de p=0,007. Por lo tanto, no podemos descartar que esta caída en los niveles de RANTES obtenidos de pacientes con coagulopatía sea simplemente un reflejo de la trombocitopenia que estos enfermos padecen.
En conclusión, en este estudio se demuestra la participación de las quimioquinas IL-8, MIP-1α y RANTES en la coagulopatía asociada al shock séptico, así como el valor como biomarcador de fallo respiratorio y renal de la IL-8. A pesar de ello, estas moléculas parece que carecen de valor pronóstico en pacientes con shock séptico.
FinanciaciónEste estudio ha sido financiado en parte por la Comunidad de Madrid S-BIO-0189/2006 y por el Fondo de Investigación Sanitaria PI-08-1890.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a todo el equipo médico y de enfermería de la UCI del Hospital Universitario Príncipe de Asturias que colaboraron en la realización de este trabajo.