INTRODUCCIÓN
Aproximadamente un 50% de los pacientes que reciben soporte nutricional enteral presentan, durante el tiempo de dicho soporte, alguna complicación gastrointestinal1. Aunque la mayor parte de las veces no tienen una repercusión clínica importante, la principal consecuencia de estas complicaciones es la reducción en el volumen de la dieta administrada y, como consecuencia, la reducción del aporte calórico2. El incremento del residuo gástrico es una de las complicaciones frecuentes de la nutrición enteral en los pacientes críticos y uno de los motivos habituales de su interrupción, con una incidencia alrededor del 20-70%, y estaría definido por la presencia de un volumen superior a 200 ml obtenido en cada valoración del contenido gástrico mediante la conexión periódica de la sonda a una bolsa de drenaje o mediante la aspiración con jeringa.
Es precisamente la valoración periódica de este residuo gástrico el test estándar empleado para evaluar la tolerancia a la alimentación enteral. Sin embargo, el tiempo en ocasiones prolongado necesario para comprobar una inadecuada tolerancia y el hecho de que, además, este volumen residual gástrico no sea un marcador preciso del vaciado gástrico3 hacen que no resulte adecuado para evaluar la eficacia del aporte nutricional. Por este motivo se han descrito diferentes técnicas con el objetivo de evaluar el vaciado gástrico en los pacientes críticos: una de ellas es el test de absorción del paracetamol4.
El paracetamol es un analgésico cuya absorción tiene lugar en la región proximal del intestino delgado y, usualmente, es completa una hora después de su administración. Dado que la tasa de absorción depende del vaciado gástrico, administrando una dosis conocida de paracetamol por sonda nasogástrica y midiendo sus valores plasmáticos en tiempos conocidos, se puede construir una curva cuya área sería un indicador del vaciado gástrico. Se considera que un valor del área bajo la curva (ABC60) de absorción a los 60 min, tras la administración de 1 g de paracetamol disuelto, superior a 600 mg/min/l es indicativo de un vaciado gástrico normal5.
Este test se ha empleado en diferentes poblaciones de pacientes críticos con objetivos de investigación6-9. Sin embargo, su aplicación en la práctica clínica habitual es compleja debido a la necesidad de obtener varias determinaciones de valores plasmáticos y de construir la curva para el cálculo del valor del área, algo que ha dificultado su utilización sistemática.
En diferentes poblaciones de pacientes se ha comprobado que la concentración plasmática máxima de paracetamol, tras su administración enteral, se alcanza antes de los 30 min10,11. En una población de pacientes críticos en ventilación mecánica se ha descrito un tiempo medio hasta alcanzar la máxima concentración plasmática de paracetamol de 22,5 min en un grupo de pacientes con un ABC60 de 819 mg/min/l; mientras que en otro grupo con un ABC60 de188 mg/min/l, la concentración máxima se alcanzó a los 60 min5. Es decir, los pacientes con retraso en el vaciado gástrico presentan un ABC menor y también un enlentecimiento en alcanzar el valor pico de la concentración plasmática de paracetamol.
Realizamos el presente estudio con el objetivo de simplificar el test de absorción de paracetamol, probando la hipótesis de que la concentración plasmática de paracetamol a los 30 min de la administración de una cantidad conocida de dicho fármaco por SNG (P30) es capaz de predecir qué pacientes van a tolerar un adecuado aporte nutricional enteral en las siguientes 24 h. En una segunda fase, el objetivo es validar el valor (P30) en una población de pacientes críticos en los que se inicia soporte nutricional enteral convencional por sonda nasogástrica.
PACIENTES Y MÉTODO
Ámbito
Unidad de cuidados críticos polivalente (12 camas). El estudio fue revisado por la comisión de investigación del centro.
Población
Fase I
Pacientes ingresados de forma consecutiva por cualquier patología, en los que se inició nutrición enteral por sonda nasogástrica, según el protocolo habitual de la unidad, y que presentaron un episodio de intolerancia a dicha nutrición (n = 6). En ese momento se realizó un test de absorción de paracetamol. En estos mismos pacientes, además, se repitió el test cuando llevaban un período de, al menos, 24 h de adecuada tolerancia a la dieta enteral a una velocidad no inferior a 63 ml/h.
Fase II
Pacientes ingresados de forma consecutiva por cualquier patología en los que se inició nutrición enteral por sonda nasogástrica, según el protocolo habitual de la unidad (n = 35). En esta cohorte únicamente se realizó la determinación del valor plasmático de paracetamol a los 30 min de su administración, previo al inicio del aporte enteral y sin que se conocieran los resultados de la determinación hasta pasadas las primeras 24 h.
Se excluyó a los pacientes menores de 18 años, los diagnosticados de hepatopatía crónica, los que habían recibido paracetamol por cualquier vía de administración en las 24 h previas, y los que presentaban una situación de inestabilidad hemodinámica grave.
Modo de realización del test
Los pacientes fueron colocados en posición de decúbito supino, con el cabecero elevado a 30º. Se confirmó la colocación correcta de la sonda nasogástrica mediante la inyección de aire por la sonda y la auscultación del estómago; además, cada 24 h se confirmó la correcta posición de la SNG mediante radiografía de tórax y manipulación de imagen con tecnología digital. Se administró 1 g de paracetamol disuelto en 100 ml de H2O por la sonda y, posteriormente, otros 10 ml de H2O, manteniendo la sonda pinzada durante los 90 min siguientes a su administración12. Se obtuvieron valores plasmáticos de paracetamol a los 30, 60 y 90 min de su administración. La determinación de paracetamol se realizó por un método de inmunoanálisis de polarización de fluorescencia de la casa Abbott, para su sistema automatizado AxSYM. El sistema admite muestras de suero y plasma. El rango analítico va de 0 a 200 μg/ml; la sensibilidad es de 1 μg/ml. Posteriormente, se calculó el área bajo la curva de absorción de paracetamol mediante el método geométrico.
Protocolo de nutrición
La nutrición enteral se administró en infusión continua mediante una bomba peristáltica, inicialmente a 21 ml/h, y se aumentó de forma progresiva hasta alcanzar el aporte calórico pautado (velocidad de infusión entre 63 y 84 ml/h dependiendo del tipo de dieta empleado y de las características del paciente). En las siguientes 24 h se comprobó el residuo gástrico cada 6 h mediante la aspiración del contenido gástrico y la posterior colocación a caída libre durante 30 min. Se consideró intolerancia a la presencia, en alguna de las comprobaciones, de un residuo gástrico superior a 200 ml13.
Método estadístico
Se empleó el paquete estadístico Sigma-Stat®, así como un programa diseñado específicamente para calcular el área bajo la curva en unos tiempos determinados mediante método geométrico.
La comparación de medias se realizó mediante la prueba de la t de Student para datos apareados y, tras comprobar la distribución normal de la muestra, mediante el test de Kolmogorov-Smirnov.
El cálculo del tamaño muestral se hizo con el objetivo de encontrar una diferencia significativa en el valor P30 para la fase I del estudio mediante la realización de un test de la t de Student para datos apareados, basándonos en los resultados de estudios publicados previamente2 (n = 5 pacientes para demostrar una diferencia entre medias del valor P30 de 5 μg/ml con un valor de alfa de 0,05). Después de comprobar una diferencia significativa en este valor, se estableció un punto de corte (P30) que clasificaba correctamente la totalidad de las determinaciones, según la tolerancia de la nutrición enteral.
En la fase II, la validación del test diagnóstico en la cohorte de pacientes se hizo mediante el cálculo de sensibilidad, especificidad, valor predictivo positivo y negativo, y cociente de probabilidad.
Los datos se expresan como media y desviación estándar de la media.
RESULTADOS
Fase I
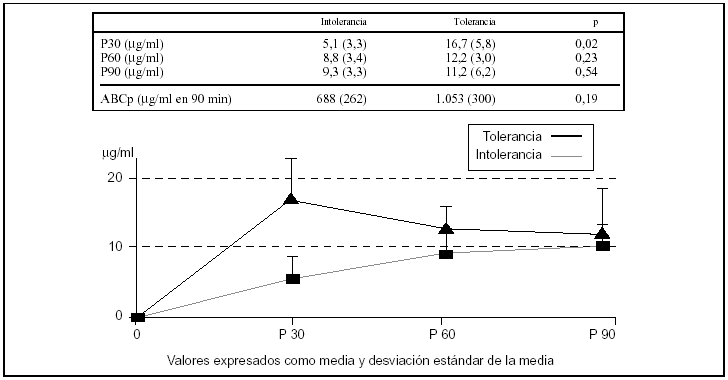
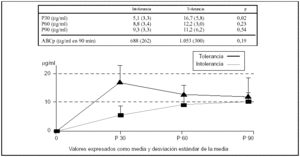
Se realizó el test de forma repetida tras un episodio de intolerancia a la dieta enteral y tras tolerarla durante 24 h, al menos, a una velocidad de 63 ml/h en 6 pacientes (dos con shock séptico; uno posparada cardiorrespiratoria; uno con insuficiencia respiratoria crónica reagudizada y un paciente politraumatizado). El tiempo medio transcurrido entre las dos determinaciones en cada paciente fue de 72 h. En todos los casos, tras comprobarse la intolerancia, se inició tratamiento con procinéticos según la pauta habitual de la unidad, con eritromicina (100 mg/6 h i.v.) o con metoclopramida (10 mg/8 h i.v.). Los valores se muestran en la figura 1. Hemos encontrado diferencias estadísticamente significativas en el valor de P30: intolerancia de 5,1 (3,3) μg/ml frente a tolerancia de 16,7 (5,8) μg/ml; p = 0,02. Aunque no era estadísticamente significativo, el área bajo la curva de los valores plasmáticos de paracetamol a los 90 min era claramente diferente entre los dos grupos. Sin embargo, el tamaño de la muestra necesario para demostrar estadísticamente esta diferencia debería ser mayor.
Figura 1. Comparación de los valores plasmáticos de paracetamol tras su administración por sonda nasogástrica y cálculo del área bajo la curva, en función de la tolerancia a la nutrición enteral en las siguientes 24 h (n = 6). El concepto de intolerancia corresponde al inicio de la nutrición enteral (n = 6) y el de tolerancia corresponde a la determinación realizada en los mismos 6 pacientes cuando toleraron la nutrición enteral durante un mínimo de 24 h consecutivas.
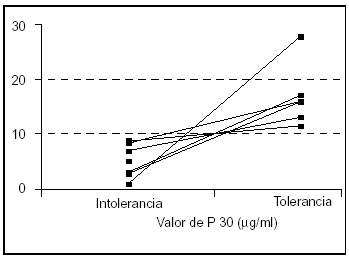
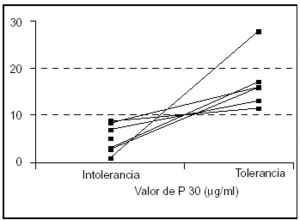
El punto de corte P30 que clasificaba correctamente el 100% de las determinaciones en función de la tolerancia a la nutrición enteral en esta población era de 10 μg /ml (fig. 2).
Figura 2. Localización del punto de corte P30 (n = 6). Un valor de paracetamol de 10 μg/ml clasifica correctamente el 100% de las determinaciones en función de la tolerancia a nutrición enteral.
Fase II
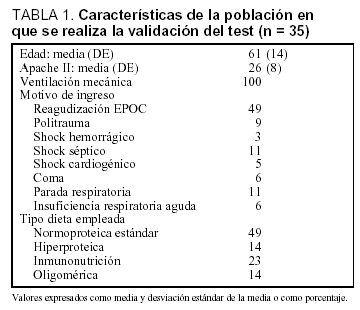
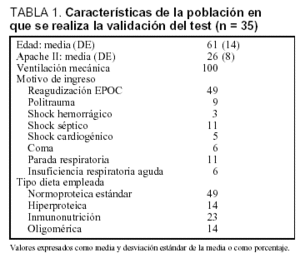
Se realizó la modificación del test plasmático de paracetamol determinando únicamente el valor de P30 en una cohorte de 35 pacientes consecutivos en los que se inició la nutrición enteral según el protocolo habitual de la unidad. Las características de los pacientes se muestran en la tabla 1.
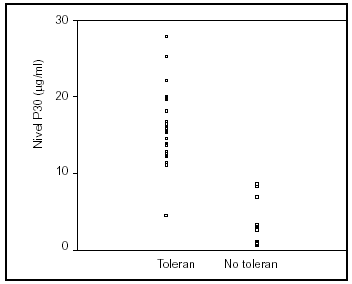
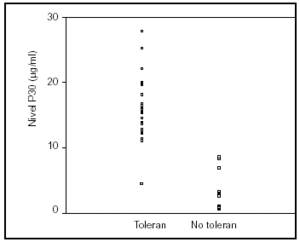
De los 24 pacientes que toleraron la nutrición enteral en las siguientes 24 h, 23 (96%) tuvieron un valor de P30 superior a 10 μg/ml. Únicamente uno de los 12 pacientes con un valor de P30 inferior a 10 μg/ml toleró la dieta enteral en las siguientes 24 h (fig. 3).
Figura 3. Valores de P30 en 35 pacientes consecutivos. Sólo uno de los 24 pacientes que tuvieron una adecuada tolerancia a la nutrición enteral presentó un valor de P30 inferior a 10 μg/ml. Ninguno de los pacientes en los que fracasó el aporte enteral tuvo un valor de P30 superior a 10 μg/ml.
En el presente estudio, la modificación del test de paracetamol, teniendo en cuenta un valor de concentración plasmática del mismo a los 30 min de su administración por SNG de 10 μg/ml, predijo la tolerancia a la dieta enteral con una sensibilidad del 100%, una especificidad del 92% (IC del 95%, 76-100%), un valor predictivo positivo del 96% (IC del 95%, 88-100%), un valor predictivo negativo del 100% y un cociente de probabilidad positivo de 12,0 (IC del 95%, 1,9-78,4).
DISCUSIÓN
En los pacientes críticamente enfermos, en especial aquellos que precisan soporte ventilatorio completo14, se produce una afección de la función gastrointestinal; una de sus manifestaciones más evidentes es la alteración de la motilidad y, en particular, la gastroparesia, que motiva un retraso en el vaciamiento gástrico y produce fenómenos de intolerancia a la nutrición enteral convencional por sonda nasogástrica15.
La administración de nutrición enteral es un importante estímulo para el mantenimiento del flujo sanguíneo esplácnico y de la integridad de la mucosa, previniendo tanto su atrofia como su ulceración16. Por ello, su administración precoz ofrece beneficios a los pacientes críticos, describiéndose, incluso, un descenso en las complicaciones infecciosas, tiempo de estancia en el hospital y mortalidad17,18.
Sin embargo, este aporte precoz de nutrición enteral es frecuentemente interrumpido por problemas de intolerancia. Así, en un estudio reciente realizado en 5 UCI del Reino Unido se describe cómo los pacientes reciben únicamente un 76% de las calorías que se prescriben, debido fundamentalmente a la presencia de residuos gástricos elevados19. De hecho, se han diseñado diferentes estrategias encaminadas a aumentar el aporte nutricional administrado por vía enteral en estos pacientes y disminuir las posibles complicaciones asociadas. Estas estrategias se basan fundamentalmente en el empleo generalizado de fármacos que estimulan la motilidad intestinal y gástrica12, y en la utilización generalizada de sondas pospilóricas. En un estudio llevado a cabo por el Grupo de Nutrición y Metabolismo de la SEMICYUC se intenta mejorar el aporte calórico mediante el empleo de sondas nasoyeyunales; sin embargo, esta estrategia no mejora la cantidad de calorías aportadas a los pacientes cuando se compara con una estrategia convencional, debido a las complicaciones asociadas con el manejo de la sonda pospilórica (fundamentalmente obstrucción y autorretirada de la misma)20.
En este contexto, se han desarrollado diferentes técnicas encaminadas a valorar la motilidad gastrointestinal y las posibilidades de nutrición enteral en los pacientes críticos. La técnica que se emplea de forma estándar es la medición del residuo gástrico, fundamentalmente porque el resto de las técnicas son complejas y difíciles de emplear en la clínica habitual. La modificación del test de paracetamol descrita en este estudio, empleando únicamente la determinación de la concentración plasmática de paracetamol a los 30 min de su administración por sonda nasogástrica, es un método económico, no invasivo y muy sencillo para su realización en la práctica clínica habitual. En nuestro centro, el test se realiza en el laboratorio central en un tiempo de 30 min tras la extracción de la muestra, y tiene un coste aproximado de 11 euros. Es, además, una técnica segura en la predicción de una adecuada tolerancia de la nutrición enteral cuando se decide iniciarla en los pacientes críticamente enfermos.
Una limitación de la técnica es que los valores plasmáticos de paracetamol pueden estar interferidos por el volumen de distribución aumentado en estos pacientes21. Sin embargo, al restringir el análisis de la cinética del paracetamol a los primeros 30 min de su administración, este artefacto puede ser considerado como insignificante.
Una de las utilidades de la modificación del test de paracetamol es la mejor evaluación de la motilidad intestinal que la que se obtiene al medir el residuo gástrico. Pero también puede ser útil en la predicción de qué pacientes se pueden beneficiar del empleo de las diferentes estrategias encaminadas a garantizar un adecuado aporte enteral: empleo de procinéticos, empleo de sondas nasoyeyunales, etc. De la misma manera, con este test también se podría evaluar la eficacia de la indicación de estos procinéticos o incluso la posibilidad de asociar, durante períodos cortos, una alimentación mixta, enteral y parenteral, para asegurar el adecuado soporte nutricional.
Como conclusión, se puede establecer que un valor plasmático de paracetamol de 10 μg/ml a los 30 min de su administración por sonda nasogástrica predice qué pacientes tolerarán un aporte completo de nutrición enteral en las siguientes 24 h. La utilidad de su incorporación a los algoritmos de nutrición debe ser testada, no obstante, en futuros estudios.