Desarrollar una escala clínica predictiva de hipofibrinogenemia en pacientes con trauma grave.
DiseñoEstudio de cohortes retrospectivo.
ÁmbitoUnidad de cuidados intensivos (UCI) del Hospital Joan XXIII.
PacientesSe incluyeron pacientes ingresados en la UCI, de forma consecutiva, por traumatismo grave y con hemorragia significativa entre 2015 y 2021. Se excluyeron pacientes con un ISS<16.
IntervencionesSe analizaron los datos procedentes del registro ICUTRAUMA, diseñado para establecer el perfil epidemiológico de pacientes críticos traumáticos en la provincia de Tarragona. Se evaluó la relación entre los niveles de fibrinógeno al ingreso y la mortalidad en la UCI mediante regresión de Cox con splines cúbicos restringidos. Posteriormente se construyó un modelo de regresión logística para predecir hipofibrinogenemia (≤203mg/dl), a partir del cual se desarrolló y validó internamente una escala clínica que se denominó FiT-6.
Variables de interés principalesAsociación entre los niveles iniciales de fibrinógeno y la mortalidad en la UCI.
ResultadosSe observó una relación no lineal entre los valores de fibrinógeno y la mortalidad en la UCI. A partir de niveles ≤203mg/dl, la mortalidad aumentó significativamente (HR: 1,66; IC95%: 1,01-2,72). Se identificaron seis predictoras independientes de hipofibrinogenemia: calcio iónico <1mmol/l, hemoglobina <10g/dl, plaquetas <100×109/l, exceso de base <–6, índice de Shock >0,9 y lactato >2mmol/l. El modelo mostró un buen rendimiento diagnóstico (AUROC: 0,90) tras validación cruzada.
ConclusionesLa escala FiT-6 presenta una alta capacidad predictiva para detectar hipofibrinogenemia, que se asocia a un incremento de la mortalidad en UCI.
To develop a clinical predictive score for hypofibrinogenemia in severely injured trauma patients.
DesignRetrospective cohort study.
SettingIntensive Care Unit (ICU) at Hospital Joan XXIII.
PatientsConsecutive patients admitted to the ICU for severe trauma with significant bleeding between 2015 and 2021 were included. Patients with an Injury Severity Score (ISS) <16 were excluded.
InterventionsData were analyzed from the ICUTRAUMA registry, designed to establish the epidemiological profile of critically ill trauma patients in the province of Tarragona. The association between admission fibrinogen levels and ICU mortality was assessed using Cox regression with restricted cubic splines. A logistic regression model was then constructed to predict hypofibrinogenemia (≤203mg/dL), from which a clinical score was developed and internally validated, and subsequently named FiT-6.
Main variables of interestAssociation between initial fibrinogen levels and ICU mortality.
ResultsA non-linear relationship was observed between fibrinogen levels and ICU mortality. Fibrinogen levels ≤203mg/dL were significantly associated with increased mortality (HR: 1.66; 95%CI: 1.01-2.72). Six independent predictors of hypofibrinogenemia were identified: ionized calcium <1mmol/L, hemoglobin <10g/dL, platelets <100×109/L, base excess <–6, Shock Index >–0.9, and lactate >2mmol/L. The model demonstrated good diagnostic performance (AUROC 0.90) after cross-validation.
ConclusionsThe FiT-6 score shows high predictive ability for identifying hypofibrinogenemia, which is associated with increased ICU mortality.
La enfermedad traumática grave es una causa relevante de morbimortalidad, especialmente en pacientes jóvenes, y sigue representando un importante desafío asistencial. Este pronóstico está significativamente condicionado por la coagulopatía inducida por traumatismo (CIT), que se presenta hasta en el 25% de los casos1,2. La CIT se asocia clásicamente con mayores requerimientos transfusionales, así como con estancias prolongadas en unidades de cuidados intensivos (UCI) y hospitalarias. Aunque no existe consenso en una definición de la CIT, un aspecto relevante es que no se limita exclusivamente al sangrado masivo o a la hipoperfusión. El daño tisular ocasionado por el trauma grave y la disrupción endotelial activa el sistema de coagulación a través de la exposición del factor tisular al torrente sanguíneo, desencadenando una serie de mecanismos que conducen a un estado de hipocoagulabilidad temprana3.
Uno de los pilares fundamentales de la CIT es la depleción de fibrinógeno, el factor de coagulación presente en mayor concentración en el plasma, con niveles normales que oscilan entre 200 y 400mg/dl. El fibrinógeno actúa como sustrato esencial para la formación de fibrina, promoviendo la formación y estabilización del coágulo junto con la agregación plaquetaria y el factorXIII. Los mecanismos que contribuyen a la hipofibrinogenemia tras el trauma grave incluyen su propio consumo durante la coagulación, la hipotermia, la hipoperfusión, la acidosis, así como la hiperfibrinólisis y la dilución por la resucitación4,5. Se ha demostrado que la hipofibrinogenemia se asocia con mayores eventos adversos, incluyendo mayor mortalidad6.
Las recomendaciones actuales sugieren la administración de fibrinógeno en situaciones de hemorragia masiva traumática cuando los niveles descienden de 150-200mg/dl7,8. Sin embargo, los métodos clásicos de coagulación pueden retrasar la obtención de estos valores, y los test viscoelásticos no están disponibles de manera generalizada en todos los centros. Dado que la enfermedad traumática es una condición tiempo-dependiente, la implementación de estrategias de resucitación hemostática precoz o empírica podría mejorar los resultados clínicos. En este contexto, el reciente ensayo CRYOSTAT-29 evaluó el efecto de la administración precoz y empírica de crioprecipitado en pacientes con trauma grave y hemorragia, sin demostrar una reducción significativa en la mortalidad a los 28días.
En el ámbito del trauma grave es crucial el reconocimiento del riesgo de desarrollar hipofibrinogenemia en la fase inicial, especialmente si consideramos el impacto negativo de la hipofibrinogenemia y la falta de consenso para la administración empírica de fibrinógeno. Por esto, el objetivo del presente estudio fue desarrollar una escala predictiva precoz de hipofibrinogenemia en el trauma grave, con el fin de que su aplicación sea práctica, factible y eficaz.
Pacientes y métodosDiseño del estudio y participantesEstudio observacional retrospectivo de cohortes basado en el registro territorial de trauma grave Proyecto ICUTRAUMA, inscrito en ClinicalTrials.gov (ID: NCT06007807). Este registro recopiló información de pacientes ingresados de forma consecutiva en la UCI en un centro de referencia en la provincia de Tarragona entre el 1 de enero de 2015 y el 31 de diciembre de 2021. El hospital, clasificado como centro IIb por la Generalitat de Catalunya, recibe pacientes traumáticos derivados de seis hospitales de la provincia, que abarca un área con aproximadamente 800.000 habitantes.
Los criterios de inclusión fueron pacientes ingresados en la UCI durante el periodo de estudio con: 1)traumatismo grave por Injury Severity Score (ISS) ≥16; 2)hemorragia significativa (shock hemorrágico, hemorragia masiva, transfusión ≥2 concentrados de hematíes, y/o 3)CIT. Se excluyeron pacientes menores de 15años. El estudio fue aprobado por el Comité de Ética del centro (Ref. CEIM: 192/2021).
Recopilación de datos y selección de variablesSe recopilaron datos demográficos, del mecanismo lesional, así como de índices de severidad como ISS, Retrascore10, Abbreviated Injury Scale (AIS), Glasgow Coma Scale (GCS), Índice de Shock (IS), hemorragia masiva, necesidad de soporte vasoactivo y parada cardiaca traumática. También se registraron la necesidad de transfusión de hemocomponentes y hemoderivados, recursos intrahospitalarios como cirugía de control de daños, complicaciones como la CIT, disfunción multiorgánica (SDMO), distrés respiratorio (SDRA), trombosis e infecciones nosocomiales, entre otras (material suplementario). El shock hemorrágico se definió como la situación clínica de hipoperfusión caracterizada por hipotensión (presión arterial sistólica <90mmHg), taquicardia, frialdad, vasoconstricción periférica, necesidad de vasopresores, alteración del estado mental, oliguria, hiperlactacidemia o un déficit de exceso de base mayor a −6, debido a la pérdida de sangre tras una lesión. La hemorragia masiva se definió como la transfusión de más de 10 concentrados de hematíes (CH) en las primeras 24horas, más de cuatro CH en las primeras 2horas tras el ingreso o como hemorragia que compromete la vida. La CIT se definió como la presencia de al menos uno de los siguientes criterios: prolongación en tiempos de coagulación ratio-tiempo protrombina (TP) >1,5 o ratio-tromboplastina parcial activada >1,2, plaquetas ≤100×109/l o fibrinógeno <150mg/dl.
Los parámetros de laboratorio se recopilaron en urgencias y al ingreso en la UCI. Para la evaluación precoz de los factores asociados a hipofibrinogenemia se utilizaron las primeras determinaciones analíticas obtenidas durante la atención inicial al paciente traumatizado. Los niveles de fibrinógeno se determinaron mediante el análisis de fibrinógeno derivado del TP o por método Clauss (cuando estos fueron <170mg/dl). Debido a la falta de consenso en la definición de hipofibrinogenemia, las cohortes del estudio se definieron a partir del análisis inicial de mortalidad: hipofibrinogenemia (≤203mg/dl) y fibrinógeno normal (>203mg/dl).
El objetivo principal fue determinar un punto de corte de fibrinógeno predictivo de mortalidad en la UCI en pacientes con traumatismo grave y hemorragia significativa. El objetivo secundario, desarrollar una escala predictiva de hipofibrinogenemia basada en dicho umbral. Asimismo, se evaluaron la necesidad de transfusiones, el desarrollo de complicaciones y los desenlaces clínicos, incluyendo estancia y días libres de ventilación mecánica a los 28días.
Análisis estadístico- •
Descriptivo. Las variables discretas se expresaron como recuentos y porcentajes (%), mientras que las variables continuas se describieron mediante medianas y sus respectivos rangos intercuartílicos (RIC: 25-75%).
- •
Univariante. Para la comparación de las características basales entre los grupos se emplearon la prueba de chi-cuadrado para las variables categóricas y la prueba de U de Mann-Whitney para las variables continuas.
- •
Análisis multivariante para factores predictores de mortalidad en la UCI. Para determinar la asociación independiente entre la hipofibrinogenemia y la mortalidad en la UCI se utilizó un modelo de regresión de Cox con splines cúbicos restringidos11, ajustado por múltiples factores de confusión (tabla S3, material suplementario). Tras identificar una relación no lineal entre los niveles de fibrinógeno y la mortalidad, se determinó el valor crítico de fibrinógeno a partir del cual la mortalidad aumentaba de forma significativa. Este valor de corte permitió clasificar a los pacientes en dos grupos: hipofibrinogenemia (≤203mg/dl) y fibrinógeno normal.
- •
Análisis multivariante para factores predictores de hipofibrinogenemia. Para identificar los factores de riesgo independientemente asociados con la hipofibrinogenemia se realizó una regresión logística binaria en la que la hipofibrinogenemia fue la variable dependiente. Las siguientes variables continuas se categorizaron en binarias, según criterios clínicos relevantes, con el objetivo de optimizar la aplicabilidad clínica y la facilidad de uso de la escala predictiva: exceso base <–6, lactato >2mmol/l, pH<7,35, hemoglobina <10g/dl, plaquetas <100×109/l, calcio iónico <1mmol/l e IS>0,9. La edad también se categorizó (≤45años), de acuerdo con la media española de traumatismo grave. La bondad de ajuste del modelo se evaluó utilizando el test de Hosmer-Lemeshow. Los resultados de la regresión se expresaron como Odds ratio (OR) con sus respectivos intervalos de confianza al 95% (IC95%). Se evaluó la multicolinealidad para ambas regresiones, Cox y logística, cuyos resultados se reportan en el material suplementario.
- •
Curva ROC (Receiver Operating Characteristic). Para la construcción de la escala predictiva de hipofibrinogenemia se asignó un punto a cada uno de los seis predictores independientes identificados, lo que permitió generar una escala con un rango (0-6). El nombre FiT-6 (Fibrinogen in Trauma-6) fue escogido en alusión al número total de predictores incluidos y con el objetivo de facilitar su memorización, su aplicabilidad y su difusión clínica. La capacidad predictiva del FiT-6 se evaluó mediante el área bajo la curva (AUC)-ROC. Para cada punto de la escala se calcularon la sensibilidad, la especificidad, el valor predictivo positivo (VPP), el valor predictivo negativo (VPN) y la exactitud. El test de Youden se utilizó para seleccionar el punto de corte óptimo de probabilidad pronosticada.
- •
Validación interna de la escala. Para validar la estabilidad del modelo se aplicaron dos estrategias de validación interna. Primero se realizó una validación cruzada con diez pliegues, promediando el rendimiento del modelo entrenado y validado en subconjuntos alternos de la muestra. En segundo lugar se utilizó la metodología Bootstrap con 1.000 repeticiones para estimar el AUC-ROC ajustado por optimismo.
El análisis estadístico se realizó utilizando SPSS v24 (Armonk, NY: IBM Corp.) y R v4.4.1 (R Core Team, Austria). Los valores perdidos, que no superaron el 10%, fueron manejados mediante imputación (material suplementario). Se consideró una p<0,05 como el umbral de significación estadística.
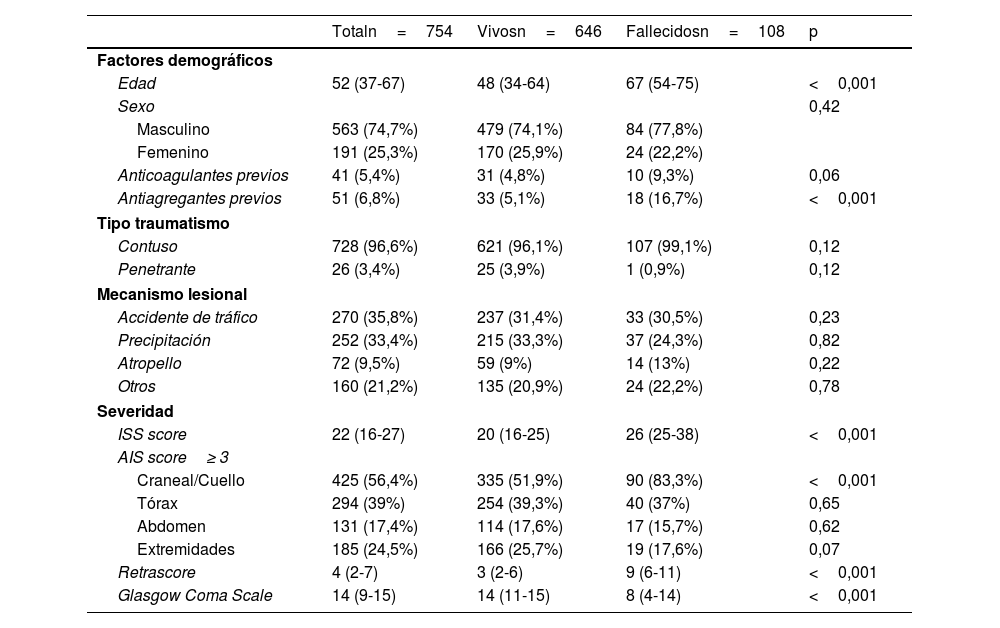
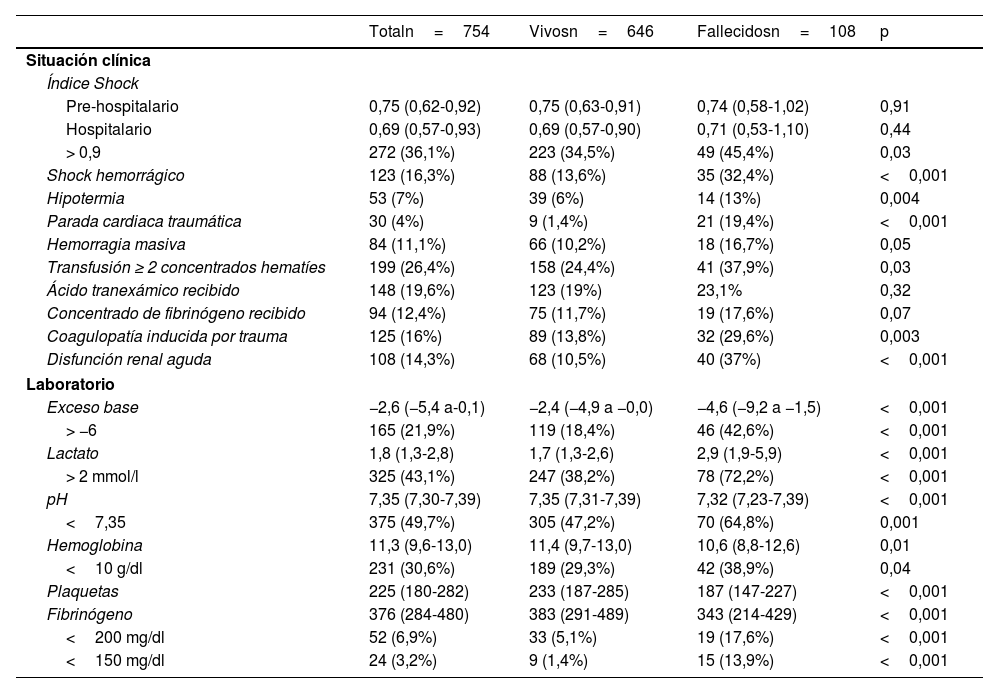
ResultadosDurante el periodo de estudio ingresaron 931 pacientes por enfermedad traumática, de los cuales 754 se incluyeron en el análisis. La mediana de edad fue de 52años (RIC: 37-67), y el 74,4% eran varones. La mayoría de los sujetos presentaron traumatismo contuso, siendo el traumatismo penetrante poco frecuente (3,4%). La mediana de ISS y Retrascore fue de 22 (RIC: 16-27) y 4 (RIC: 2-7), respectivamente. Las características basales se describen en las tablas 1 y 2.
Características demográficas de la población y comparación entre vivos y fallecidos
| Totaln=754 | Vivosn=646 | Fallecidosn=108 | p | |
|---|---|---|---|---|
| Factores demográficos | ||||
| Edad | 52 (37-67) | 48 (34-64) | 67 (54-75) | <0,001 |
| Sexo | 0,42 | |||
| Masculino | 563 (74,7%) | 479 (74,1%) | 84 (77,8%) | |
| Femenino | 191 (25,3%) | 170 (25,9%) | 24 (22,2%) | |
| Anticoagulantes previos | 41 (5,4%) | 31 (4,8%) | 10 (9,3%) | 0,06 |
| Antiagregantes previos | 51 (6,8%) | 33 (5,1%) | 18 (16,7%) | <0,001 |
| Tipo traumatismo | ||||
| Contuso | 728 (96,6%) | 621 (96,1%) | 107 (99,1%) | 0,12 |
| Penetrante | 26 (3,4%) | 25 (3,9%) | 1 (0,9%) | 0,12 |
| Mecanismo lesional | ||||
| Accidente de tráfico | 270 (35,8%) | 237 (31,4%) | 33 (30,5%) | 0,23 |
| Precipitación | 252 (33,4%) | 215 (33,3%) | 37 (24,3%) | 0,82 |
| Atropello | 72 (9,5%) | 59 (9%) | 14 (13%) | 0,22 |
| Otros | 160 (21,2%) | 135 (20,9%) | 24 (22,2%) | 0,78 |
| Severidad | ||||
| ISS score | 22 (16-27) | 20 (16-25) | 26 (25-38) | <0,001 |
| AIS score≥ 3 | ||||
| Craneal/Cuello | 425 (56,4%) | 335 (51,9%) | 90 (83,3%) | <0,001 |
| Tórax | 294 (39%) | 254 (39,3%) | 40 (37%) | 0,65 |
| Abdomen | 131 (17,4%) | 114 (17,6%) | 17 (15,7%) | 0,62 |
| Extremidades | 185 (24,5%) | 166 (25,7%) | 19 (17,6%) | 0,07 |
| Retrascore | 4 (2-7) | 3 (2-6) | 9 (6-11) | <0,001 |
| Glasgow Coma Scale | 14 (9-15) | 14 (11-15) | 8 (4-14) | <0,001 |
AIS: Abbreviated Injury Scale; ISS: Injury Severity Score.
Los datos se reportan como números con su correspondiente porcentaje (%) o medianas con su correspondiente intervalo de confianza (IC 95%).
Características clínicas y de laboratorio de la población y comparación entre vivos y fallecidos
| Totaln=754 | Vivosn=646 | Fallecidosn=108 | p | |
|---|---|---|---|---|
| Situación clínica | ||||
| Índice Shock | ||||
| Pre-hospitalario | 0,75 (0,62-0,92) | 0,75 (0,63-0,91) | 0,74 (0,58-1,02) | 0,91 |
| Hospitalario | 0,69 (0,57-0,93) | 0,69 (0,57-0,90) | 0,71 (0,53-1,10) | 0,44 |
| > 0,9 | 272 (36,1%) | 223 (34,5%) | 49 (45,4%) | 0,03 |
| Shock hemorrágico | 123 (16,3%) | 88 (13,6%) | 35 (32,4%) | <0,001 |
| Hipotermia | 53 (7%) | 39 (6%) | 14 (13%) | 0,004 |
| Parada cardiaca traumática | 30 (4%) | 9 (1,4%) | 21 (19,4%) | <0,001 |
| Hemorragia masiva | 84 (11,1%) | 66 (10,2%) | 18 (16,7%) | 0,05 |
| Transfusión ≥ 2 concentrados hematíes | 199 (26,4%) | 158 (24,4%) | 41 (37,9%) | 0,03 |
| Ácido tranexámico recibido | 148 (19,6%) | 123 (19%) | 23,1% | 0,32 |
| Concentrado de fibrinógeno recibido | 94 (12,4%) | 75 (11,7%) | 19 (17,6%) | 0,07 |
| Coagulopatía inducida por trauma | 125 (16%) | 89 (13,8%) | 32 (29,6%) | 0,003 |
| Disfunción renal aguda | 108 (14,3%) | 68 (10,5%) | 40 (37%) | <0,001 |
| Laboratorio | ||||
| Exceso base | −2,6 (−5,4 a-0,1) | −2,4 (−4,9 a −0,0) | −4,6 (−9,2 a −1,5) | <0,001 |
| > −6 | 165 (21,9%) | 119 (18,4%) | 46 (42,6%) | <0,001 |
| Lactato | 1,8 (1,3-2,8) | 1,7 (1,3-2,6) | 2,9 (1,9-5,9) | <0,001 |
| > 2 mmol/l | 325 (43,1%) | 247 (38,2%) | 78 (72,2%) | <0,001 |
| pH | 7,35 (7,30-7,39) | 7,35 (7,31-7,39) | 7,32 (7,23-7,39) | <0,001 |
| <7,35 | 375 (49,7%) | 305 (47,2%) | 70 (64,8%) | 0,001 |
| Hemoglobina | 11,3 (9,6-13,0) | 11,4 (9,7-13,0) | 10,6 (8,8-12,6) | 0,01 |
| <10 g/dl | 231 (30,6%) | 189 (29,3%) | 42 (38,9%) | 0,04 |
| Plaquetas | 225 (180-282) | 233 (187-285) | 187 (147-227) | <0,001 |
| Fibrinógeno | 376 (284-480) | 383 (291-489) | 343 (214-429) | <0,001 |
| <200 mg/dl | 52 (6,9%) | 33 (5,1%) | 19 (17,6%) | <0,001 |
| <150 mg/dl | 24 (3,2%) | 9 (1,4%) | 15 (13,9%) | <0,001 |
Los datos se reportan como números con su correspondiente porcentaje (%) o medianas con su correspondiente intervalo de confianza (IC95%).
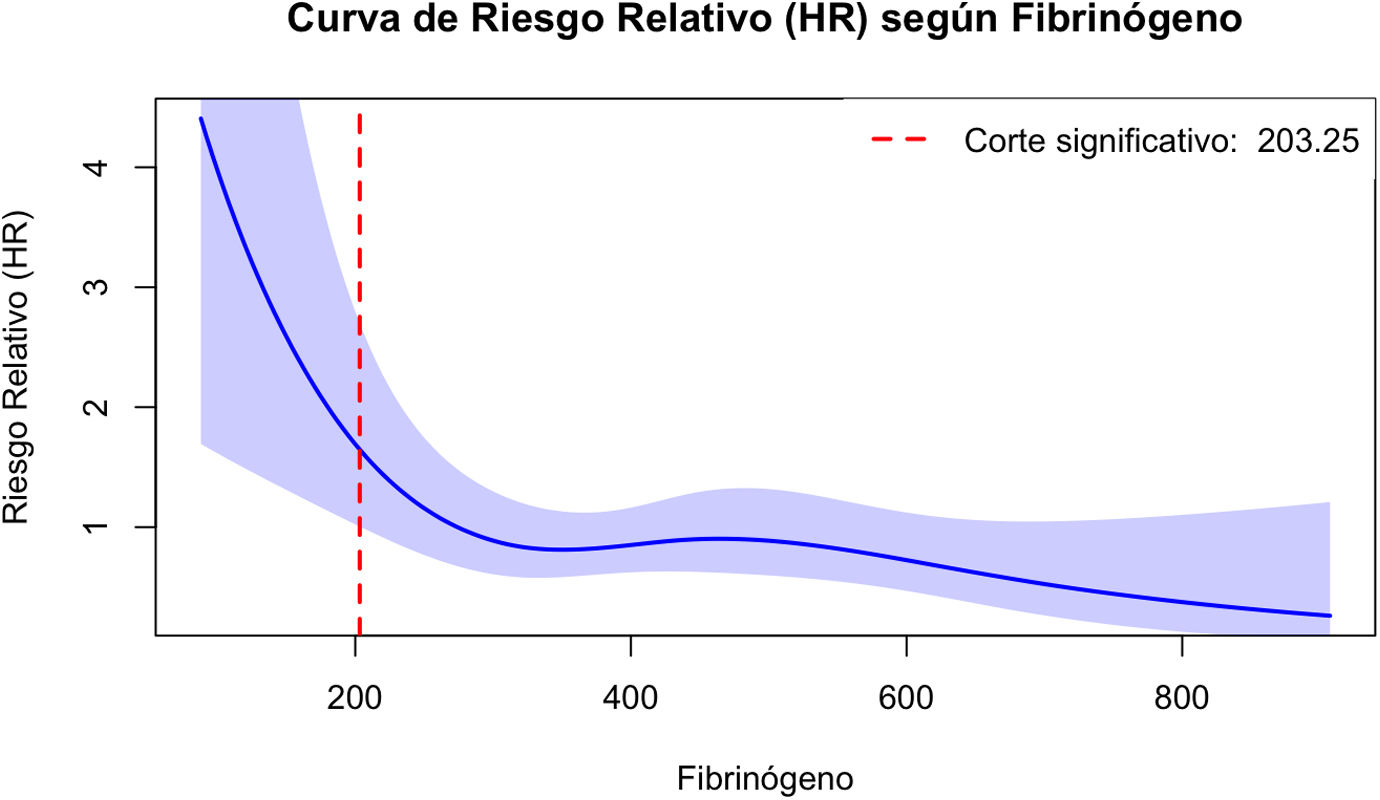
La mortalidad en la UCI fue del 14,3% (108/754). Los pacientes fallecidos presentaron una edad y gravedad por ISS significativamente mayor (mediana 67 [RIC: 54-75] vs. 48 [RIC: 34-64] años; p<0,001; mediana 26 [RIC: 25-38] vs. 20 [RIC: 16-25]; p<0,001, respectivamente). Asimismo, en este mismo grupo se observó una mayor incidencia de shock hemorrágico (32,4% vs. 13,6%; p<0,001), parada cardiaca traumática (19,4% vs. 1,4%; p<0,001), CIT (29,6% vs. 13,8%; p=0,003) y disfunción renal aguda (37% vs. 10,5%; p<0,001). En cuanto a los niveles de fibrinógeno, en los fallecidos se observaron con mayor frecuencia valores <200mg/dl (17,6% vs. 5,1%; p<0,001) y <150mg/dl (13,9% vs. 1,4%; p<0,001). La regresión de Cox mostró una asociación no lineal entre los niveles de fibrinógeno y la mortalidad en la UCI. Tras ajustar por factores de confusión, se identificó un punto de inflexión en 203mg/dl, a partir del cual la mortalidad aumentaba de forma significativa (HR: 1,66; IC95%: 1,01-2,72; p=0,046, fig. 1). Este umbral fue utilizado para definir la presencia de hipofibrinogenemia.
Gráfico del análisis de regresión de Cox con splines cúbicos restringidos.
Se evidencia una clara asociación no lineal de los niveles de fibrinógeno iniciales con la mortalidad en la UCI. A partir de un umbral crítico (fibrinógeno 203mg/dl, Hazard ratio 1,66; IC95%: 1,01-2,72; p=0,046), la mortalidad aumentó de forma significativa conforme los niveles de fibrinógeno disminuyeron. El modelo de regresión fue ajustado por edad, Injury Severity Score (ISS), necesidad de vasopresores iniciales, coagulopatía inducida por trauma, disfunción renal aguda, necesidad de transfusión >2 concentrados de hematíes, acidosis, Abbreviated Injury Scale (AIS) Craneal, hipotermia, escala de Glasgow, parada cardiaca traumática, hemoglobina inicial <10g/dl y antiagregantes previos.
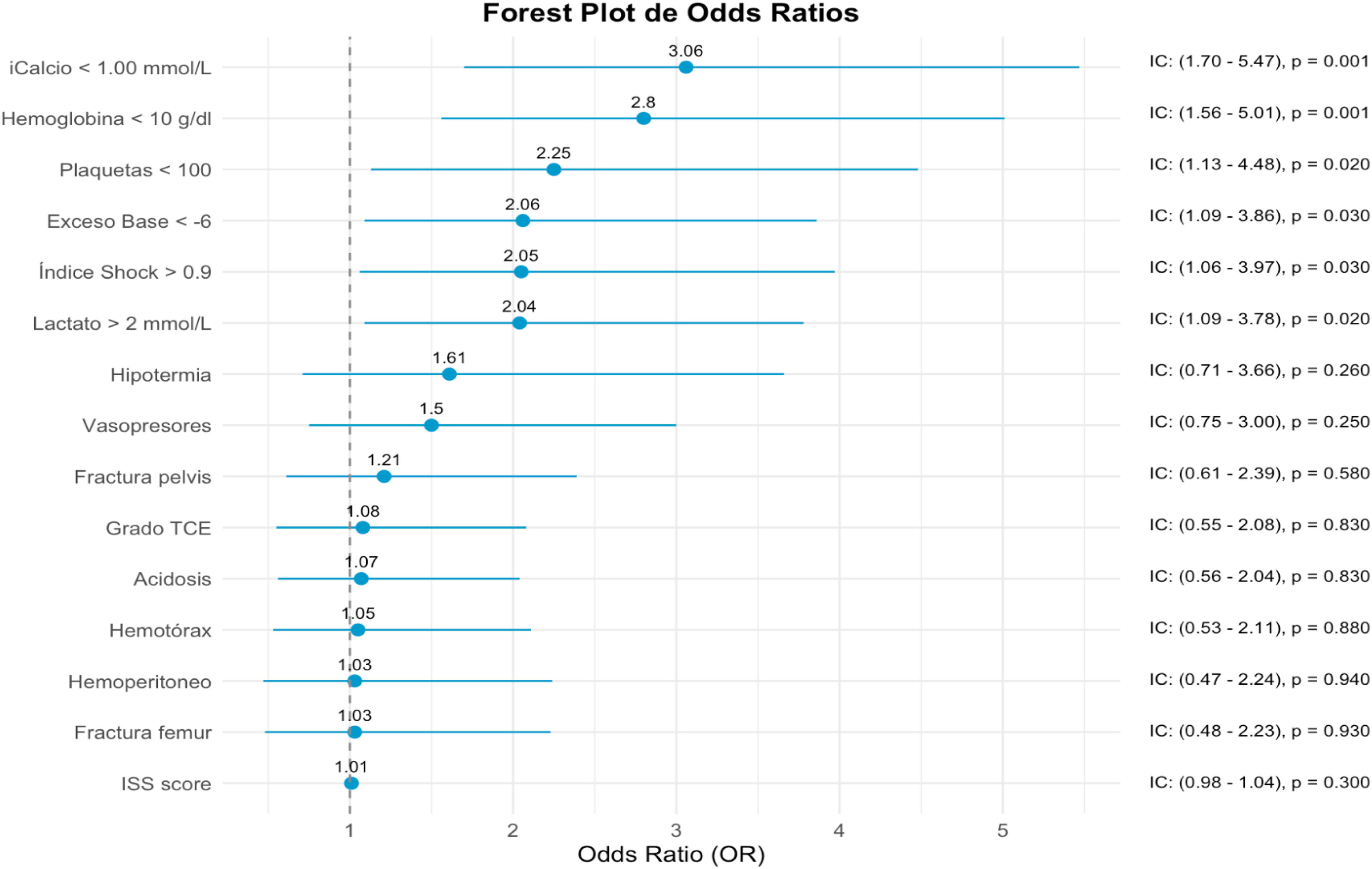
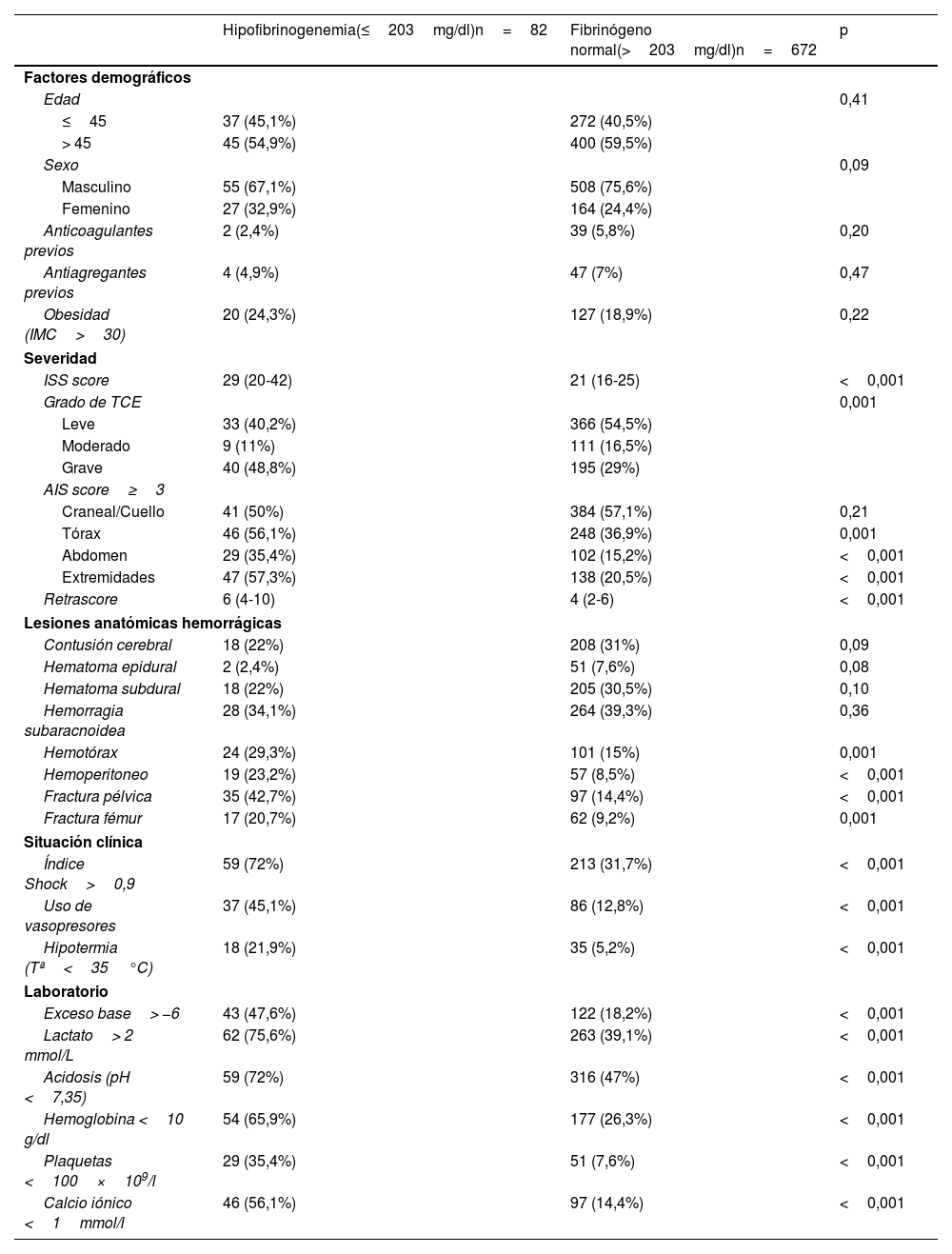
La tabla 3 describe las características comparativas entre los grupos con/sin hipofibrinogenemia. La cohorte con hipofibrinogenemia (≤203mg/dl) presentó mayor gravedad clínica, una mayor incidencia de lesiones hemorrágicas extracraneales, mayor inestabilidad hemodinámica y datos analíticos sugestivos de hipoxia tisular. El análisis multivariante identificó las siguientes variables asociadas de forma independiente con la presencia de hipofibrinogenemia (≤203mg/dl): calcio iónico <1,00mmol/l (OR: 3,06; IC95%: 1,70-5,47), hemoglobina <10g/dl (OR: 2,80; IC95%: 1,56-5,01), recuento plaquetario <100×109/l (OR: 2,25; IC95%: 1,13-4,48), exceso de base <−6 (OR: 2,06; IC95%: 1,09-3,86), IS>0,9 (OR: 2,05; IC95%: 1,06-3,97) y lactato >2mmol/l (OR: 2,04; IC95%: 1,09-3,78), como se muestra en la figura 2.
Comparación entre individuos con hipofibrinogenemia y niveles de fibrinógeno normales
| Hipofibrinogenemia(≤203mg/dl)n=82 | Fibrinógeno normal(>203mg/dl)n=672 | p | |
|---|---|---|---|
| Factores demográficos | |||
| Edad | 0,41 | ||
| ≤45 | 37 (45,1%) | 272 (40,5%) | |
| > 45 | 45 (54,9%) | 400 (59,5%) | |
| Sexo | 0,09 | ||
| Masculino | 55 (67,1%) | 508 (75,6%) | |
| Femenino | 27 (32,9%) | 164 (24,4%) | |
| Anticoagulantes previos | 2 (2,4%) | 39 (5,8%) | 0,20 |
| Antiagregantes previos | 4 (4,9%) | 47 (7%) | 0,47 |
| Obesidad (IMC>30) | 20 (24,3%) | 127 (18,9%) | 0,22 |
| Severidad | |||
| ISS score | 29 (20-42) | 21 (16-25) | <0,001 |
| Grado de TCE | 0,001 | ||
| Leve | 33 (40,2%) | 366 (54,5%) | |
| Moderado | 9 (11%) | 111 (16,5%) | |
| Grave | 40 (48,8%) | 195 (29%) | |
| AIS score≥3 | |||
| Craneal/Cuello | 41 (50%) | 384 (57,1%) | 0,21 |
| Tórax | 46 (56,1%) | 248 (36,9%) | 0,001 |
| Abdomen | 29 (35,4%) | 102 (15,2%) | <0,001 |
| Extremidades | 47 (57,3%) | 138 (20,5%) | <0,001 |
| Retrascore | 6 (4-10) | 4 (2-6) | <0,001 |
| Lesiones anatómicas hemorrágicas | |||
| Contusión cerebral | 18 (22%) | 208 (31%) | 0,09 |
| Hematoma epidural | 2 (2,4%) | 51 (7,6%) | 0,08 |
| Hematoma subdural | 18 (22%) | 205 (30,5%) | 0,10 |
| Hemorragia subaracnoidea | 28 (34,1%) | 264 (39,3%) | 0,36 |
| Hemotórax | 24 (29,3%) | 101 (15%) | 0,001 |
| Hemoperitoneo | 19 (23,2%) | 57 (8,5%) | <0,001 |
| Fractura pélvica | 35 (42,7%) | 97 (14,4%) | <0,001 |
| Fractura fémur | 17 (20,7%) | 62 (9,2%) | 0,001 |
| Situación clínica | |||
| Índice Shock>0,9 | 59 (72%) | 213 (31,7%) | <0,001 |
| Uso de vasopresores | 37 (45,1%) | 86 (12,8%) | <0,001 |
| Hipotermia (Tª<35°C) | 18 (21,9%) | 35 (5,2%) | <0,001 |
| Laboratorio | |||
| Exceso base> −6 | 43 (47,6%) | 122 (18,2%) | <0,001 |
| Lactato> 2 mmol/L | 62 (75,6%) | 263 (39,1%) | <0,001 |
| Acidosis (pH <7,35) | 59 (72%) | 316 (47%) | <0,001 |
| Hemoglobina <10 g/dl | 54 (65,9%) | 177 (26,3%) | <0,001 |
| Plaquetas <100×109/l | 29 (35,4%) | 51 (7,6%) | <0,001 |
| Calcio iónico <1mmol/l | 46 (56,1%) | 97 (14,4%) | <0,001 |
AIS: Abbreviated Injury Scale; IMC: índice masa corporal; ISS: Injury Severity Score; TCE: traumatismo craneoencefálico.
Los datos se reportan como números con su correspondiente porcentaje (%) o medianas con su correspondiente intervalo de confianza (IC95%). El índice de Shock se consideró tanto si fue mayor a 0,9 en la prehospitalaria como en la atención inicial en urgencias.
Regresión logística binaria construida para identificar factores asociados de forma independiente con la hipofibrinogenemia (≤203mg/dl).
Los predictores asociados con la hipofibrinogenemia fueron aquellos marcadores subrogados de hipoperfusión tisular clínica (índice de Shock) o analíticos (lactato, exceso de base, hemoglobina baja) así como implicados en la hemostasia (cifra de plaquetas y calcio iónico), mientras que ni la gravedad por ISS ni ninguna lesión anatómica hemorrágica por sí sola fueron factores asociados a la hipofibrinogenemia.
iCalcio: calcio iónico; ISS: Injury Severity Score; TCE: traumatismo craneoencefálico.
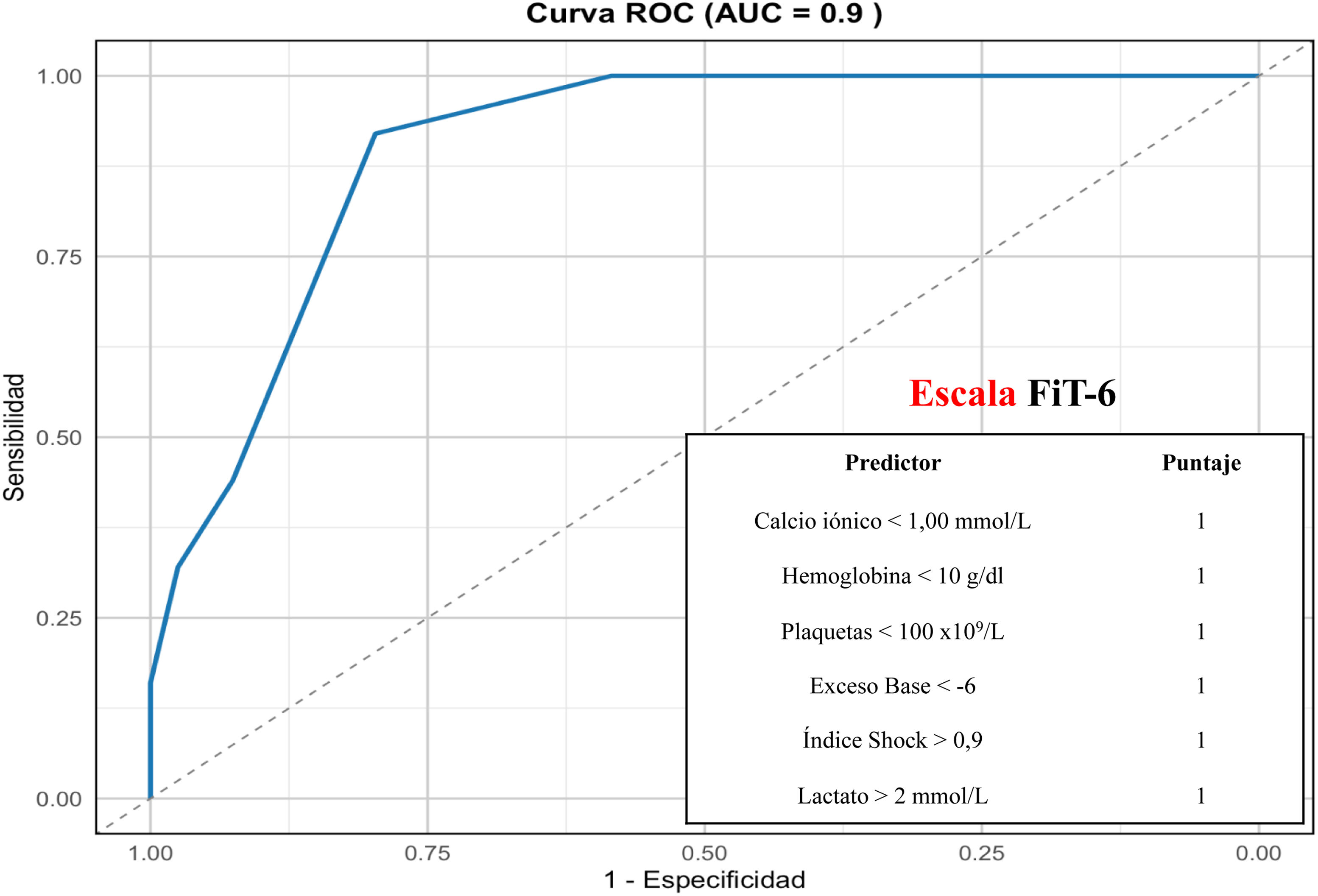
En la cohorte global, el AUC-ROC de la escala FiT-6 fue de 0,86 (IC95%: 0,82-0,90). Tras validación cruzada, FiT-6 mantuvo una elevada capacidad predictiva en la cohorte de validación (AUC-ROC: 0,90; IC95%: 0,86-0,94, fig. 3). Adicionalmente, se realizó una validación interna mediante Bootstrap, que mostró un AUC-ROC ajustado por optimismo de 0,86, confirmando la estabilidad del modelo y minimizando el riesgo de sobreajuste. El punto de corte óptimo para la detección de hipofibrinogenemia fue ≥3 puntos, con una sensibilidad del 78%, una especificidad del 81%, un índice de Youden de 0,59 y una exactitud del 81%. En el análisis de sensibilidad se evaluó la discriminación de la escala para los cortes ≤200mg/dl y ≤150mg/dl, encontrando resultados similares (AUC-ROC: 0,86, sensibilidad 77% y especificidad 81%; AUROC: 0,91, sensibilidad 87% y especificidad 77%, respectivamente). El análisis de sensibilidad específicamente para el traumatismo contuso (excluyendo el traumatismo penetrante) mostró que la escala FiT-6 tuvo una AUC-ROC de 0,89, con un punto de corte óptimo en 3puntos, resultados muy similares a los del análisis principal.
Área bajo la curva COR (característica operativa del receptor) de la escala FiT-6 en la cohorte de validación.
El índice de Shock se consideró tanto en prehospitalaria como en la atención inicial hospitalaria. El resto de predictores fueron los extraídos durante la atención inicial al trauma.
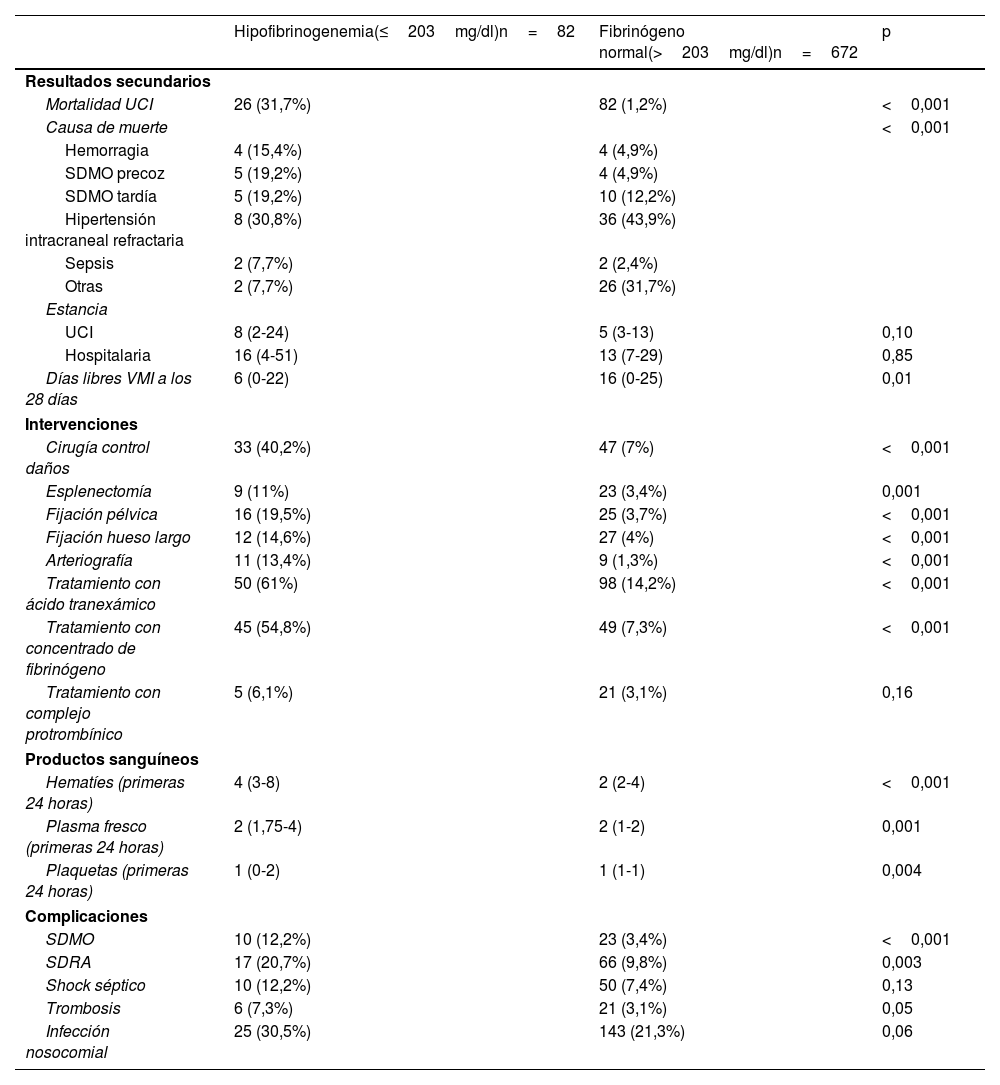
Los resultados secundarios se resumen en la tabla 4. Los pacientes con hipofibrinogenemia requirieron con mayor frecuencia intervenciones quirúrgicas para el control de hemorragias, mayor número de transfusiones de hemoderivados, y presentaron mayor incidencia de SDMO y SDRA.
Resultados secundarios entre grupos de estudio
| Hipofibrinogenemia(≤203mg/dl)n=82 | Fibrinógeno normal(>203mg/dl)n=672 | p | |
|---|---|---|---|
| Resultados secundarios | |||
| Mortalidad UCI | 26 (31,7%) | 82 (1,2%) | <0,001 |
| Causa de muerte | <0,001 | ||
| Hemorragia | 4 (15,4%) | 4 (4,9%) | |
| SDMO precoz | 5 (19,2%) | 4 (4,9%) | |
| SDMO tardía | 5 (19,2%) | 10 (12,2%) | |
| Hipertensión intracraneal refractaria | 8 (30,8%) | 36 (43,9%) | |
| Sepsis | 2 (7,7%) | 2 (2,4%) | |
| Otras | 2 (7,7%) | 26 (31,7%) | |
| Estancia | |||
| UCI | 8 (2-24) | 5 (3-13) | 0,10 |
| Hospitalaria | 16 (4-51) | 13 (7-29) | 0,85 |
| Días libres VMI a los 28 días | 6 (0-22) | 16 (0-25) | 0,01 |
| Intervenciones | |||
| Cirugía control daños | 33 (40,2%) | 47 (7%) | <0,001 |
| Esplenectomía | 9 (11%) | 23 (3,4%) | 0,001 |
| Fijación pélvica | 16 (19,5%) | 25 (3,7%) | <0,001 |
| Fijación hueso largo | 12 (14,6%) | 27 (4%) | <0,001 |
| Arteriografía | 11 (13,4%) | 9 (1,3%) | <0,001 |
| Tratamiento con ácido tranexámico | 50 (61%) | 98 (14,2%) | <0,001 |
| Tratamiento con concentrado de fibrinógeno | 45 (54,8%) | 49 (7,3%) | <0,001 |
| Tratamiento con complejo protrombínico | 5 (6,1%) | 21 (3,1%) | 0,16 |
| Productos sanguíneos | |||
| Hematíes (primeras 24 horas) | 4 (3-8) | 2 (2-4) | <0,001 |
| Plasma fresco (primeras 24 horas) | 2 (1,75-4) | 2 (1-2) | 0,001 |
| Plaquetas (primeras 24 horas) | 1 (0-2) | 1 (1-1) | 0,004 |
| Complicaciones | |||
| SDMO | 10 (12,2%) | 23 (3,4%) | <0,001 |
| SDRA | 17 (20,7%) | 66 (9,8%) | 0,003 |
| Shock séptico | 10 (12,2%) | 50 (7,4%) | 0,13 |
| Trombosis | 6 (7,3%) | 21 (3,1%) | 0,05 |
| Infección nosocomial | 25 (30,5%) | 143 (21,3%) | 0,06 |
SDMO: síndrome de disfunción multiorgánica; SDRA: síndrome de distrés respiratorio agudo; VMI: ventilación mecánica invasiva.
Los datos se reportan como números con su correspondiente porcentaje (%) o medianas con su correspondiente intervalo de confianza (IC95%).
Nuestro principal hallazgo fue que la escala FiT-6 permitió identificar precozmente y de forma adecuada a los pacientes con elevado riesgo de hipofibrinogenemia en la enfermedad traumática grave. Una escala FiT-6 ≥3puntos se asoció con elevada probabilidad de niveles de fibrinógeno ≤203mg/dl, a una mayor mortalidad y a mayores requerimientos transfusionales. Su aplicación en la práctica clínica podría servir para alertar precozmente a los clínicos sobre la necesidad de aporte de fibrinógeno antes de llegar a niveles críticos.
Este estudio permitió desarrollar una escala predictiva de hipofibrinogenemia precoz basada en variables rápidamente accesibles desde el primer contacto hospitalario. Algunas de estas, como el exceso de base, los niveles de lactato, el IS y la hemoglobina, reflejan de manera indirecta la magnitud de la hipoxia y el daño tisular, fenómenos íntimamente relacionados con el consumo acelerado de fibrinógeno12-15. Además, de manera interesante, el FiT-6 incorpora dos variables que no han sido previamente descritas como predictores de hipofibrinogenemia: el recuento plaquetario y los niveles de calcio iónico. El primero interviene en la agregación plaquetaria mediada por la fibrina16, mientras que el segundo actúa como cofactor esencial en diversas fases de la coagulación y puede reducirse durante la hemostasia o por efecto del citrato en los hemocomponentes17. Ambos parámetros mostraron asociación independiente con la alteración precoz del fibrinógeno, lo que refuerza su papel en la fisiopatología de la CIT. Es importante señalar que si bien el FiT-6 se desarrolló como una escala predictiva de hipofibrinogenemia precoz, no predice de forma directa la hipofibrinogenemia en sí, dado que esta condición depende de múltiples mecanismos fisiopatológicos complejos más allá del sangrado, como la hemodilución, el consumo acelerado, la fibrinólisis, la hipotermia, la acidosis y la disfunción endotelial. El FiT-6 identifica, más bien, un perfil clínico compatible con hemorragia aguda y lesión tisular, en el cual la probabilidad de presentar hipofibrinogenemia es significativamente mayor.
Previamente, Gauss et al.18 propusieron la escala FibAT para detectar hipofibrinogenemia precoz (≤150mg/dl) en pacientes con trauma grave. Esta escala se basa en ocho variables (edad <33años, frecuencia cardíaca >100lpm, presión arterial sistólica <100mmHg, hemoglobina <12g/dl, delta de hemoglobina >2g/dl, lactato >2,5mmol/l, temperatura <36°C y presencia de líquido libre intraabdominal). Los autores consideraron una puntuación ≥5 como una alta especificidad para detectar hipofibrinogenemia, lo cual podría permitir valorar el inicio temprano del tratamiento. Si bien el FibAT es una herramienta valiosa, precoz y bien construida para la detección temprana de hipofibrinogenemia en trauma grave, presenta algunas diferencias relevantes respecto al FiT-6 que podrían hacer a este último más eficiente y aplicable en nuestro entorno. En primer lugar, el FiT-6 requiere únicamente tres variables positivas para plantear la reposición precoz de fibrinógeno, en comparación con las cinco necesarias en el FibAT, lo que lo hace más ágil y factible en escenarios de alta presión asistencial. Además, el FiT-6 incorpora dos marcadores clave en la fisiopatología de la coagulopatía traumática (el recuento plaquetario y los niveles de calcio iónico) que no están contemplados en el FibAT, otorgándole una mayor profundidad biológica. Otro aspecto importante es que algunos criterios del FibAT, como la edad menor de 33años, que podría limitar su sensibilidad en poblaciones como la nuestra donde la media de edad de los pacientes fue de 57años (siendo la media España cercana a los 45años), o el punto de corte de temperatura <36°C, que podría considerarse ligeramente permisivo, al incluir como hipotérmicos a pacientes con temperaturas superiores a 35°C, que no se clasificarían habitualmente como tales desde el punto de vista clínico.
Por otra parte, el FiT-6 presentaría una ventaja estratégica si se dispusiera de dispositivos de medición de gases en sangre en el medio prehospitalario, ya que cinco de sus seis variables podrían ser evaluadas desde la escena del trauma. Esto permitiría identificar pacientes con alto riesgo de hipofibrinogenemia antes del ingreso hospitalario, posibilitando la administración precoz de fibrinógeno incluso antes de la llegada al hospital, en casos con tres o más criterios presentes. Esta aplicación tendría gran potencial clínico y podría integrarse de forma efectiva incluso en centros que disponen de pruebas viscoelásticas, donde el FiT-6 funcionaría como herramienta inicial de cribado o activación terapéutica mientras se procesan los resultados de los test viscoelásticos. Sin embargo, estas estrategias y el posible impacto terapéutico derivado de la aplicación de la escala FiT-6 en el ámbito prehospitalario deberían ser validados en estudios prospectivos futuros19. También cabe destacar que, incluso en el ámbito hospitalario, el FiT-6 podría resultar útil en centros que no disponen de test viscoelásticos, ya que todos sus parámetros pueden obtenerse en cuestión de minutos durante la atención inicial mediante analizador de gases sanguíneos y hemograma urgente. Este enfoque permitiría anticipar la reposición de fibrinógeno con mayor rapidez que mediante las pruebas convencionales de coagulación, que suelen tardar considerablemente más en estar disponibles. Un aspecto importante de la puntuación FiT-6 es su buen rendimiento diagnóstico para la detección de hipofibrinogenemia en pacientes con trauma grave. Su elevado VPN lo convierte en una herramienta útil para descartar esta alteración cuando la puntuación es inferior a3, lo que puede evitar pruebas o tratamientos innecesarios. En cambio, cuando la puntuación es igual a3, el VPP alcanza el 33,3%, lo que implica que uno de cada tres pacientes con esta puntuación presenta un perfil de hipofibrinogenemia. Si bien este valor puede parecer limitado, representa un incremento clínicamente relevante respecto a la prevalencia basal (cercana al 11%) y podría ser suficiente para justificar la administración precoz de fibrinógeno según el juicio clínico, especialmente en contextos de alta sospecha. Por otro lado, cuando el FiT-6 es ≥4, el VPP aumenta considerablemente, lo que podría respaldar de forma aún más sólida la toma de decisiones terapéuticas de forma precoz en la atención inicial al trauma grave.
Por otro lado, los niveles de fibrinógeno a partir de los cuales se debe considerar su reposición siguen siendo motivo de debate. Las guías europeas sobre hemorragia masiva recomiendan la administración de fibrinógeno cuando sus niveles sean ≤150mg/dl7. No obstante, los propios autores de estas guías reconocen que este valor representa un umbral crítico, y en los últimos años se ha observado una tendencia creciente a iniciar la reposición con el objetivo de alcanzar niveles superiores a 200mg/dl. El documento HEMOMASII8, que recoge las recomendaciones españolas en el manejo de la hemorragia masiva, sugiere considerar la administración de fibrinógeno cuando los niveles están por debajo de 150-200mg/dl. Esta variabilidad en los umbrales propuestos se explica en parte porque numerosos estudios han descrito peores desenlaces clínicos en pacientes con trauma grave y niveles ≤150mg/dl20,21, así como en pacientes con hemorragia masiva traumática22. La mayoría de estos trabajos definen la hipofibrinogenemia a partir de valores críticos, pero otros estudios han identificado asociaciones adversas incluso con niveles por debajo de 200mg/dl. Hagemo et al.23, en un estudio multicéntrico con 1.133 pacientes politraumatizados en varios países, identificaron un punto de inflexión en 229mg/dl, por debajo del cual se incrementa significativamente la mortalidad a los 28días. En línea con estos hallazgos, nuestro estudio mostró una relación no lineal similar con la mortalidad en UCI, estableciendo el umbral de hipofibrinogenemia en 203mg/dl. Ambos trabajos respaldan la hipótesis de que concentraciones de fibrinógeno inferiores a este valor se asocian con un incremento notable en el riesgo de muerte, lo que refuerza la necesidad de estrategias de reposición precoz en pacientes con sangrado masivo.
El impacto de la hipofibrinogenemia no se limita únicamente a los casos de hemorragia activa. También ha demostrado tener un efecto negativo en pacientes con traumatismo craneoencefálico (TCE) aislado. En un estudio retrospectivo llevado a cabo por Lv et al.24, con 2.570 individuos con TCE, se observó que niveles de fibrinógeno <200mg/dl al ingreso se asociaron de forma independiente con una mayor mortalidad a los tres meses. Además, identificaron que niveles entre 250 y 300mg/dl se correlacionaban con mejores resultados funcionales, según el Glasgow Outcome Score, lo que refuerza aún más la relevancia clínica del fibrinógeno como biomarcador pronóstico, incluso en ausencia de hemorragia masiva. La relevancia clínica de mantener niveles de fibrinógeno superiores a 200mg/dl ha sido respaldada recientemente por dos ensayos clínicos en neurotrauma. En uno de ellos, Sabouri et al.25 demostraron que la administración de concentrado de fibrinógeno para mantener niveles por encima de ese umbral en participantes con TCE grave se asoció con una mejoría en los resultados neurológicos a corto plazo, así como con un mejor control de la expansión del hematoma. Niakan et al.26 evidenciaron que la corrección de niveles bajos de fibrinógeno (150-200mg/dl) hasta valores >200mg/dl en sujetos con TCE grave que requerían neurocirugía se tradujo en una reducción significativa de la hemorragia intraoperatoria. En conjunto, estos hallazgos sugieren que mantener concentraciones de fibrinógeno en rangos óptimos podría contribuir a optimizar el pronóstico en pacientes con TCE, tanto en términos funcionales como en el control del sangrado. Cabe destacar, además, que en pacientes con TCE que presentan simultáneamente shock hemorrágico, la incidencia de CIT puede alcanzar cifras cercanas al 60%, asociándose también a un incremento significativo de la mortalidad. Estos datos refuerzan la necesidad de identificar de forma precoz alteraciones como la hipofibrinogenemia en subgrupos de especial vulnerabilidad, como el TCE con sangrado concomitante27.
Este estudio presenta varias limitaciones que deben considerarse al interpretar los resultados.
Primera, la naturaleza retrospectiva del análisis lo hace susceptible a factores de confusión no observados, que podrían haber influido en los resultados o limitar su aplicabilidad a otras poblaciones. No obstante, se empleó un modelo de regresión ajustado por múltiples covariables relevantes en la población traumática, y se realizó un análisis de regresión no lineal que evidenció una asociación progresiva entre los niveles de fibrinógeno y la mortalidad, lo que aporta mayor solidez a los hallazgos frente a la simple definición de un punto de corte. Aunque es posible que exista cierto sesgo de indicación debido a que los pacientes con hipofibrinogenemia recibieron más intervenciones de control de daños, el impacto real sobre los resultados parece ser limitado por dos razones. En primer lugar, la gravedad clínica fue cuidadosamente ajustada en los modelos multivariantes, lo cual reduce el riesgo de confusión por indicación. En segundo lugar, a pesar de haber recibido un manejo más intensivo, el grupo con hipofibrinogenemia presentó una mayor mortalidad, lo que sugiere que el tratamiento no intervino como un factor de confusión favorable. Por el contrario, si dichas intervenciones hubieran tenido un efecto protector, es razonable pensar que la asociación entre hipofibrinogenemia y mortalidad podría estar subestimada, y no sobrestimada. Además, los predictores incluidos en el modelo (marcadores de hipoxia tisular, hemorragia y coagulopatía) tienen un fundamento fisiopatológico robusto que respalda su relevancia clínica.
Segunda, aunque la escala FiT-6 fue desarrollada y validada internamente mediante técnicas de validación cruzada y Bootstrap, es necesaria una validación externa. Será necesario confirmar su reproducibilidad y aplicabilidad en otras cohortes de pacientes traumáticos. Además, dado que el número de pacientes con hipofibrinogenemia fue limitado, es posible que se requiera una cohorte más amplia para reforzar la estabilidad y la generalización del modelo. La validación externa ya ha sido contemplada como una siguiente fase del presente proyecto, con el objetivo de reforzar la robustez del modelo y su aplicabilidad clínica.
Tercera, en este estudio, los niveles de fibrinógeno fueron determinados mediante el método derivado del tiempo de protrombina (TP), incluido en el panel estándar de pruebas de coagulación al ingreso hospitalario. Aunque el método de referencia internacional es la medición por Clauss, en nuestro centro esta se reserva para casos con niveles derivados inferiores a 170mg/dl, en línea con la práctica habitual de muchos centros de referencia a nivel nacional. Es importante destacar que el método derivado del TP puede sobreestimar los niveles reales de fibrinógeno medidos por Clauss, especialmente cuando estos son bajos, como ocurre en contextos de coagulopatía, hipoperfusión o hemorragia masiva. Esta sobreestimación puede llevar a una subvaloración de la gravedad de la hipofibrinogenemia, con posibles implicaciones clínicas. No obstante, la escala FiT-6 no pretende predecir valores absolutos de fibrinógeno, sino identificar un perfil clínico compatible con un alto riesgo de hipofibrinogenemia. Por ello, consideramos que la utilidad de la herramienta se mantiene, incluso en contextos donde se emplea el método derivado. Esta consideración metodológica se relaciona estrechamente con la necesidad de una validación externa, ya expuesta en la limitación previa.
Cuarta, la mayoría de los casos de nuestra cohorte corresponden a traumatismo cerrado, con escasa representación del traumatismo penetrante, lo que podría reducir la capacidad discriminativa de la escala en ese subgrupo específico. No obstante, el traumatismo penetrante presenta una baja incidencia tanto en España como en Europa, con tasas reportadas en torno al 4%, por lo que la distribución de nuestra cohorte es consistente con la observada en otros registros nacionales e internacionales de mayor escala, lo que respalda la aplicabilidad del análisis en nuestro contexto asistencial28. Por último, no se ha evaluado el impacto terapéutico de la escala FiT-6 sobre los resultados clínicos, lo que requeriría estudios prospectivos futuros que validen su utilidad como herramienta de decisión en el manejo del paciente traumático.
En conclusión, se desarrolló y validó internamente la escala FiT-6, una herramienta clínica simple, basada en parámetros accesibles desde el ingreso, que permite predecir de forma precoz niveles bajos de fibrinógeno, condición asociada a mayor mortalidad y requerimientos transfusionales. Su aplicación podría servir de ayuda para la toma de decisiones terapéuticas tempranas en la enfermedad traumática grave, aunque nuestra escala debe ser validada en forma prospectiva y externamente para confirmar su utilidad y su impacto clínico sobre los pacientes.
FinanciaciónNinguna.
Declaración sobre el uso de inteligencia artificialLos autores utilizaron ChatGPT-4 (OpenAI) como herramienta de apoyo para mejorar la legibilidad y la claridad del texto, bajo su supervisión y responsabilidad.
Contribución de los autoresARB, GS, MC, SC, SU, XD, NM, JB, RA, MB, AR y GM han contribuido en la concepción, el diseño del estudio, la adquisición de datos, el análisis y la interpretación de datos. ARB, GS, MC, SC, SU, AR, MB y GM han participado en la confección del borrador del artículo y en la revisión crítica del contenido intelectual. ARB, GS, MC, SC, SU, XD, NM, JB, RA, MB, AR y GM han contribuido a la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Los autores agradecen a todo el equipo multidisciplinar implicado en la atención al paciente traumático grave tanto pre-hospitalario como intrahospitalario.