Editado por: el Dr. Juan Antonio Llompart Pou
Médico especialista en Medicina Intensiva, Doctor en Ciencias de la Salud por la Universitat Illes Balears. Servicio de Medicina Intensiva, UCI Trauma y Neurocríticos, Hospital Universitari Son Espases. Palma, España.
Última actualización: Diciembre 2025
Más datosEn los pacientes con hemorragia intracraneal, ya sea espontánea o traumática, la expansión del hematoma se asocia con peores resultados neurológicos y mayor mortalidad. La limitación del sangrado intracraneal y su expansión mediante la administración de un agente antifibrinolítico como el ácido tranexámico (ATX) puede mejorar potencialmente los desenlaces clínicos en los pacientes con daño cerebral agudo. Sin embargo, los estudios sobre el impacto del ATX en estos pacientes han mostrado resultados variables, y aún no está clara su eficacia, la dosificación adecuada y ni el momento óptimo de administración. El objetivo de esta revisión es resumir la evidencia clínica sobre el uso adecuado del ATX en el tratamiento de las hemorragias intracraneales, tanto traumáticas como no traumáticas, y sus implicaciones para la práctica clínica.
In patients with spontaneous or traumatic intracranial hemorrhage, hematoma expansion is associated with poorer neurological outcomes and increased mortality. The administration of an antifibrinolytic agent like tranexamic acid (TXA) may potentially improve clinical outcomes in patients with acute brain injury by preventing such intracranial expansion. However, studies on the impact of TXA in these patients have yielded variable results, and its efficacy, appropriate dosing and optimal timing of administration remain unclear. The present review summarizes the clinical evidence regarding the proper use of tranexamic acid in the treatment of intracranial traumatic and non-traumatic hemorrhage, and its implications for clinical practice.
El ácido tranexámico (ATX), un análogo sintético de la lisina, presenta propiedades antifibrinolíticas y antiinflamatorias, y ha demostrado ser eficaz para disminuir la necesidad de transfusión de hemoderivados en los pacientes quirúrgicos1,2, evitar la progresión del volumen de la hemorragia y controlar la inflamación asociada en los pacientes traumatizados3,4, y reducir la mortalidad en los pacientes con hemorragia perinatal5.
El uso del ATX, como agente antifibrinolítico, en los pacientes con enfermedad estructural neurológica aguda (traumatismo craneoencefálico [TCE], hemorragia subaracnoidea [HSA] o hemorragia intracraneal [HIC]), puede ayudar a reducir o prevenir la expansión del sangrado intracraneal y el aumento del riesgo asociado de muerte y discapacidad. Sin embargo, el papel del ATX sigue siendo controvertido6,7 y existe incertidumbre con respecto a su beneficio clínico, la dosis recomendada y los riesgos asociados.
El objetivo de la presente revisión narrativa es resumir la evidencia clínica más relevante sobre los efectos del ATX en los pacientes neurocríticos, y establecer las recomendaciones de su uso sobre la base de la literatura revisada.
MétodologíaSe seleccionaron artículos en la plataforma PubMed, EMBASE, Science Direct y The Cochrane Database utilizando los términos: «tranexamic acid», «traumatic brain injury», «intracerebral hemorrhage» y «subarachnoid hemorrhage», utilizando el operador booleano «OR» y «AND».
Impacto del uso del ATX en los pacientes con traumatismo craneoencefálicoEl ensayo CRASH-24, en el que se incluyeron 20.211 pacientes con traumatismos (intra y extracraneales) y hemorragia extracraneal importante, fue el primer estudio aleatorizado y controlado (ECA) que demostró que la administración temprana8 (dentro de las 3h posteriores a la lesión) del ATX reduce la mortalidad sin aumentar el riesgo de eventos adversos.
Las directrices europeas de 20169 recomiendan (grado 1A) el uso del ATX en los pacientes traumatizados que sangran o corren riesgo de sufrir una hemorragia significativa, dentro de las primeras 3h tras el trauma (grado 1B), y la administración de la primera dosis preferiblemente en el camino al hospital (grado 2C).
Posteriormente, se realizó un ECA anidado dentro del CRASH-210, que incluyó a 270 pacientes traumatizados con, o en riesgo de hemorragia extracraneal significativa y TCE, definido por una escala de coma de Glasgow (GCS)≤14 y una tomografía axial computarizada (TAC) compatible con lesión cerebral traumática. En este subgrupo, la administración de ATX se asoció con una reducción no significativa del crecimiento de hematomas (diferencia ajustada −3,8ml, intervalo de confianza [IC] del 95%: −11,5-3,9) y del desarrollo de nuevas hemorragias intracraneales. La tendencia no significativa hacia posibles beneficios clínicos, en términos de menor mortalidad y dependencia funcional, justificaron la realización de nuevos ensayos clínicos en esta población.
A continuación, el ensayo CRASH-311 incluyó 12.737 pacientes con TCE y GCS≤12 o hemorragia intracraneal en la TAC y sin hemorragia extracraneal grave, que fueron aleatorizados a ATX (6.406, 50,3%) o placebo (6.331, 49,7%). Entre los 9.202 (72,2%) pacientes tratados en las 3h tras la lesión, la mortalidad relacionada con lesiones craneales a los 28 días fue menor en el grupo del ATX (18,5 vs. 19,8%; riesgo relativo [RR]: 0,94; IC 95%: 0,86-1,02), en los pacientes con TCE de leve a moderado (GCS: 9-15) (RR: 0,78; IC 95%: 0,64-0,95), pero no en los pacientes con TCE grave (GCS: 3-8) (RR: 0,99; IC 95%: 0,91-1,07). El tratamiento precoz (<3h) fue más eficaz que el tratamiento tardío (>3h) en los pacientes con TCE leve y moderado (p=0,005), pero el tiempo transcurrido hasta el tratamiento no tuvo un efecto evidente en los pacientes con TCE grave (p=0,73). El riesgo de eventos oclusivos vasculares y de convulsiones fue similar en ambos grupos. El estudio CRASH-3 sugiere que la efectividad del AXT en el tratamiento del TCE depende de la gravedad de la lesión y del tiempo de inicio del tratamiento, pero presenta varias limitaciones. Estas incluyen criterios de inclusión subjetivos, cambios en el objetivo principal del estudio, y posibles sesgos en la clasificación de la causa de muerte. La validez externa es cuestionable debido a la participación mayoritaria de países de bajos ingresos. Además, el estudio carece de poder suficiente para analizar subgrupos y plantea dudas sobre la plausibilidad biológica de los resultados, ya que el AXT parece ser efectivo solo en casos de TCE leve a moderado, pero no para en el TCE grave7. El beneficio del uso de ATX en los pacientes con TCE podría no solo deberse a su efecto antifibrinolítico y prevención de hemorragias, sino también a sus efectos antiinflamatorios, protección del endotelio y mejora de la función plaquetaria12.
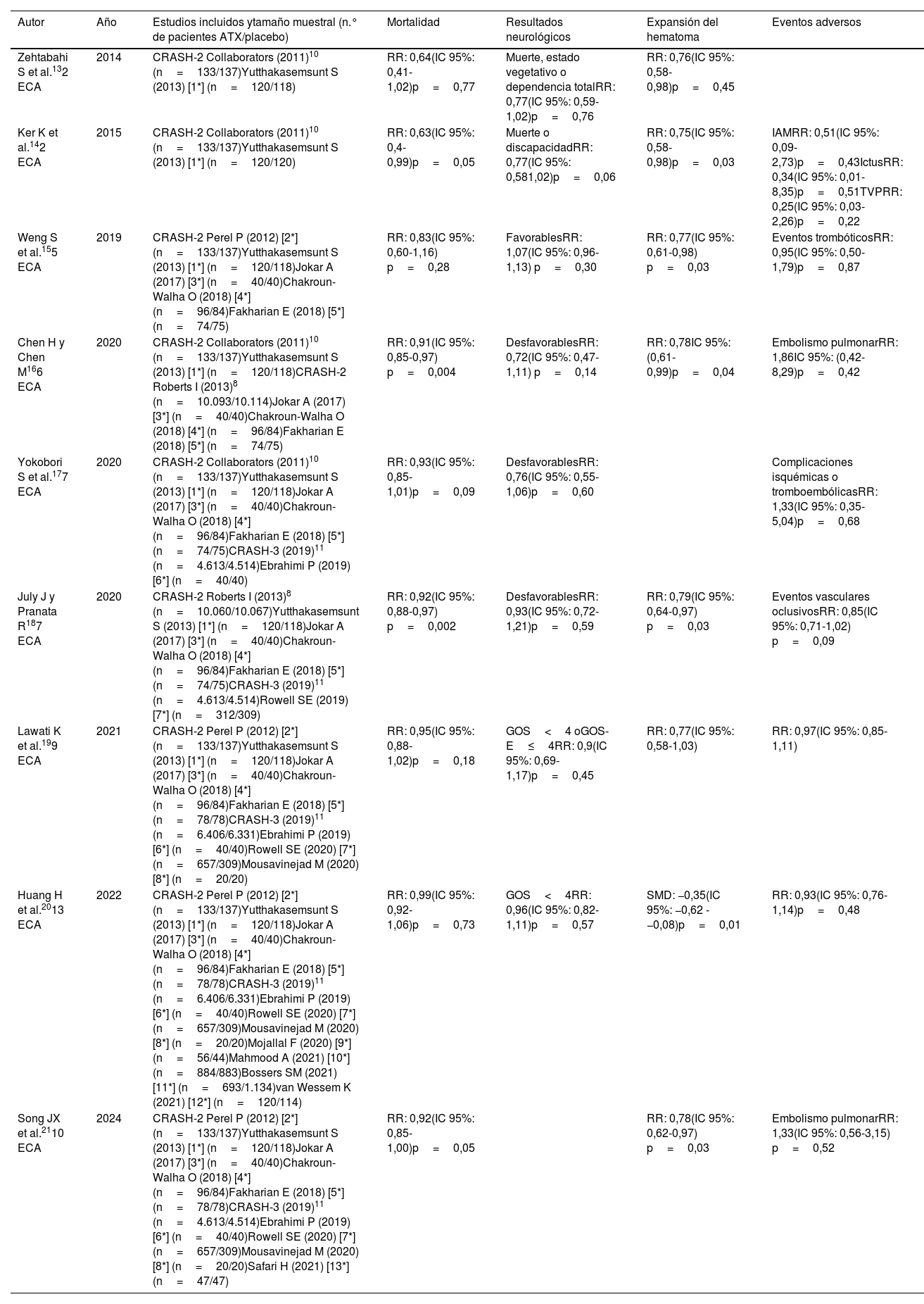
Varias revisiones sistemáticas y metaanálisis han examinado los efectos del ATX en los pacientes con TCE13–21, y sus resultados se resumen en la tabla 1. Las revisiones y metaanálisis anteriores a la publicación del estudio CRASH-313–16, y que incluyeron mayoritariamente pacientes del estudio CRASH-2, concluyen que el ATX es eficaz para reducir el riesgo de expansión del hematoma, reducir la tasa de mortalidad y mejorar los resultados funcionales en los pacientes con TCE sin aumentar la tasa de eventos trombóticos. A partir del año 2020, las revisiones sistemáticas y metaanálisis17–21 incorporan los resultados del estudio CRASH-3 (ensayo clínico más grande en el contexto de TCE y con el mayor peso en los metaanálisis publicados) y confirman los efectos del ATX sobre la reducción de la expansión del hematoma y la ausencia de eventos adversos asociados a su administración, pero los efectos encontrados sobre la mortalidad son heterogéneos. Es interesante señalar que las revisiones que demuestran un efecto sobre la mortalidad son aquellas que incluyen todos los pacientes del ensayo CRASH-2 (no solo a los pacientes con TCE), de forma que las conclusiones no pueden atribuirse concretamente a la población de pacientes con TCE.
Principales metaanálisis que evalúan el efecto del ATX en los pacientes con TCE
| Autor | Año | Estudios incluidos ytamaño muestral (n.° de pacientes ATX/placebo) | Mortalidad | Resultados neurológicos | Expansión del hematoma | Eventos adversos |
|---|---|---|---|---|---|---|
| Zehtabahi S et al.132 ECA | 2014 | CRASH-2 Collaborators (2011)10 (n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/118) | RR: 0,64(IC 95%: 0,41-1,02)p=0,77 | Muerte, estado vegetativo o dependencia totalRR: 0,77(IC 95%: 0,59-1,02)p=0,76 | RR: 0,76(IC 95%: 0,58-0,98)p=0,45 | |
| Ker K et al.142 ECA | 2015 | CRASH-2 Collaborators (2011)10 (n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/120) | RR: 0,63(IC 95%: 0,4-0,99)p=0,05 | Muerte o discapacidadRR: 0,77(IC 95%: 0,581,02)p=0,06 | RR: 0,75(IC 95%: 0,58-0,98)p=0,03 | IAMRR: 0,51(IC 95%: 0,09-2,73)p=0,43IctusRR: 0,34(IC 95%: 0,01-8,35)p=0,51TVPRR: 0,25(IC 95%: 0,03-2,26)p=0,22 |
| Weng S et al.155 ECA | 2019 | CRASH-2 Perel P (2012) [2*] (n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/118)Jokar A (2017) [3*] (n=40/40)Chakroun-Walha O (2018) [4*] (n=96/84)Fakharian E (2018) [5*] (n=74/75) | RR: 0,83(IC 95%: 0,60-1,16) p=0,28 | FavorablesRR: 1,07(IC 95%: 0,96-1,13) p=0,30 | RR: 0,77(IC 95%: 0,61-0,98) p=0,03 | Eventos trombóticosRR: 0,95(IC 95%: 0,50-1,79)p=0,87 |
| Chen H y Chen M166 ECA | 2020 | CRASH-2 Collaborators (2011)10 (n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/118)CRASH-2 Roberts I (2013)8 (n=10.093/10.114)Jokar A (2017) [3*] (n=40/40)Chakroun-Walha O (2018) [4*] (n=96/84)Fakharian E (2018) [5*] (n=74/75) | RR: 0,91(IC 95%: 0,85-0,97) p=0,004 | DesfavorablesRR: 0,72(IC 95%: 0,47-1,11) p=0,14 | RR: 0,78IC 95%: (0,61-0,99)p=0,04 | Embolismo pulmonarRR: 1,86IC 95%: (0,42-8,29)p=0,42 |
| Yokobori S et al.177 ECA | 2020 | CRASH-2 Collaborators (2011)10 (n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/118)Jokar A (2017) [3*] (n=40/40)Chakroun-Walha O (2018) [4*] (n=96/84)Fakharian E (2018) [5*] (n=74/75)CRASH-3 (2019)11 (n=4.613/4.514)Ebrahimi P (2019) [6*] (n=40/40) | RR: 0,93(IC 95%: 0,85-1,01)p=0,09 | DesfavorablesRR: 0,76(IC 95%: 0,55-1,06)p=0,60 | Complicaciones isquémicas o tromboembólicasRR: 1,33(IC 95%: 0,35-5,04)p=0,68 | |
| July J y Pranata R187 ECA | 2020 | CRASH-2 Roberts I (2013)8 (n=10.060/10.067)Yutthakasemsunt S (2013) [1*] (n=120/118)Jokar A (2017) [3*] (n=40/40)Chakroun-Walha O (2018) [4*] (n=96/84)Fakharian E (2018) [5*] (n=74/75)CRASH-3 (2019)11 (n=4.613/4.514)Rowell SE (2019) [7*] (n=312/309) | RR: 0,92(IC 95%: 0,88-0,97) p=0,002 | DesfavorablesRR: 0,93(IC 95%: 0,72-1,21)p=0,59 | RR: 0,79(IC 95%: 0,64-0,97) p=0,03 | Eventos vasculares oclusivosRR: 0,85(IC 95%: 0,71-1,02) p=0,09 |
| Lawati K et al.199 ECA | 2021 | CRASH-2 Perel P (2012) [2*] (n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/118)Jokar A (2017) [3*] (n=40/40)Chakroun-Walha O (2018) [4*] (n=96/84)Fakharian E (2018) [5*] (n=78/78)CRASH-3 (2019)11 (n=6.406/6.331)Ebrahimi P (2019) [6*] (n=40/40)Rowell SE (2020) [7*] (n=657/309)Mousavinejad M (2020) [8*] (n=20/20) | RR: 0,95(IC 95%: 0,88-1,02)p=0,18 | GOS<4 oGOS-E≤4RR: 0,9(IC 95%: 0,69-1,17)p=0,45 | RR: 0,77(IC 95%: 0,58-1,03) | RR: 0,97(IC 95%: 0,85-1,11) |
| Huang H et al.2013 ECA | 2022 | CRASH-2 Perel P (2012) [2*](n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/118)Jokar A (2017) [3*] (n=40/40)Chakroun-Walha O (2018) [4*] (n=96/84)Fakharian E (2018) [5*] (n=78/78)CRASH-3 (2019)11 (n=6.406/6.331)Ebrahimi P (2019) [6*] (n=40/40)Rowell SE (2020) [7*] (n=657/309)Mousavinejad M (2020) [8*] (n=20/20)Mojallal F (2020) [9*] (n=56/44)Mahmood A (2021) [10*] (n=884/883)Bossers SM (2021) [11*] (n=693/1.134)van Wessem K (2021) [12*] (n=120/114) | RR: 0,99(IC 95%: 0,92-1,06)p=0,73 | GOS<4RR: 0,96(IC 95%: 0,82-1,11)p=0,57 | SMD: −0,35(IC 95%: −0,62 - −0,08)p=0,01 | RR: 0,93(IC 95%: 0,76-1,14)p=0,48 |
| Song JX et al.2110 ECA | 2024 | CRASH-2 Perel P (2012) [2*] (n=133/137)Yutthakasemsunt S (2013) [1*] (n=120/118)Jokar A (2017) [3*] (n=40/40)Chakroun-Walha O (2018) [4*] (n=96/84)Fakharian E (2018) [5*] (n=78/78)CRASH-3 (2019)11 (n=4.613/4.514)Ebrahimi P (2019) [6*] (n=40/40)Rowell SE (2020) [7*] (n=657/309)Mousavinejad M (2020) [8*] (n=20/20)Safari H (2021) [13*] (n=47/47) | RR: 0,92(IC 95%: 0,85-1,00)p=0,05 | RR: 0,78(IC 95%: 0,62-0,97) p=0,03 | Embolismo pulmonarRR: 1,33(IC 95%: 0,56-3,15) p=0,52 |
ECA: ensayo clínico aleatorizado; GOS: Glasgow Outcome Scale; GOS-E: Glasgow Outcome Scale Extended; IAM: infarto agudo de miocardio; IC: intervalo de confianza; RR: riesgo relativo; SMD: standardized mean difference; TVP: trombosis venosa profunda.
*Referencia en material adicional.
Las únicas guías publicadas hasta el momento que mencionan el uso del ATX en los pacientes con TCE son las directrices para el manejo pre-hospitalario del TCE en su tercera edición22, en las que se hace referencia a 2 ensayos clínicos23,24. En estos estudios la administración extra-hospitalaria del ATX en los pacientes con TCE moderado o grave, no proporcionó ningún beneficio clínico, incluso aumentó la mortalidad. En base a los resultados de estos estudios y del estudio CRASH-3, estas guías no recomiendan el uso del ATX en el entorno pre-hospitalario.
En conclusión, la administración temprana del ATX podría ofrecer beneficios modestos en los pacientes con TCE leve a moderado, al disminuir el crecimiento de hemorragias intracraneales y reducir discretamente la mortalidad, pero no ha demostrado ningún efecto en los casos graves. Aunque el riesgo asociado de eventos adversos es bajo, dada la ausencia de un claro beneficio clínico, estos autores no recomiendan su uso en los pacientes con TCE grave. Únicamente se podría considerar su empleo en los pacientes con TCE leve o moderado (GCS: 9-15) y evidencia de sangrado intracraneal en la TAC inicial.
Impacto del uso del ATX en los pacientes con hemorragia subaracnoidea aneurismáticaLa hemorragia subaracnoidea por rotura de un aneurisma intracraneal (HSAa) representa aproximadamente el 5% de todos los ictus. Una de las principales causas de muerte y discapacidad de la HSAa es el resangrado del aneurisma, que ocurre antes de que se pueda realizar la oclusión del aneurisma entre el 10 y el 22% de los pacientes afectados, siendo su mayor incidencia en las primeras 24h y, alcanzando su punto máximo en las primeras 6h después del evento inicial25. Hasta el 60% de los pacientes que sufren un resangrado mueren, y otro 30% desarrollan secuelas graves26. La forma más efectiva de prevención del resangrado es la exclusión del aneurisma roto de la circulación (endovascular o quirúrgica) lo más precozmente posible, de manera ideal en las primeras 24h27. Sin embargo, en la práctica clínica diaria, el tratamiento del aneurisma a menudo se pospone, ya sea por un retraso en el diagnóstico o por el traslado a un centro de tratamiento terciario28.
Los primeros estudios indicaron que la administración de antifibrinolíticos, previa a la oclusión del aneurisma, podría reducir la tasa de resangrado, pero sin mejoría de los resultados funcionales, probablemente a expensas de un mayor riesgo de isquemia cerebral diferida (ICD). Sin embargo, estos ensayos probaron el uso del fármaco antifibrinolítico en tratamientos prolongados, durante al menos 10 días, a altas dosis y no utilizaron de forma generalizada medidas específicas de prevención de la ICD29.
Posteriormente, el primer ECA que evaluó la administración temprana (dentro de las primeras 48h desde el ingreso hospitalario), y a corto plazo (durante un máximo de 72h) del ATX en 596 pacientes con HSA, mostró una reducción del riesgo de resangrado (2,4 vs. 10,8%), sin un aumento del riesgo de eventos isquémicos tardíos, y con una reducción de la mortalidad atribuible al resangrado del 80%, aunque sin mejoría de los resultados funcionales30. La siguiente actualización de la revisión Cochrane31, en la que se incluyó este estudio, concluye que los resultados del tratamiento a corto plazo son prometedores, pero que se necesitan ensayos aleatorios adicionales.
El siguiente gran ECA es el estudio ULTRA recientemente publicado32. Fue diseñado con el objetivo de evaluar el efecto de la administración de ATX lo antes posible tras el diagnóstico de HSA (se excluyeron HSA de distribución perimesencefálica o de origen traumático, pero no se exigía la identificación de una anomalía vascular como causa de la HSA), y por un breve periodo de tiempo (hasta la oclusión del aneurisma o hasta un máximo de 24h) para reducir el riesgo de ICD. Este estudio incluyó 955 pacientes (480 en el grupo tratado y 475 en el grupo control), la mayoría con una Escala Fisher grado IV (66 y 64%, respectivamente). No hubo diferencias significativas en los resultados funcionales a los 6 meses (porcentaje de pacientes con una puntuación favorable en la escala modificada de Rankin [mRS]: 0-3, 60 vs. 64%; odds ratio [OR]: 0,87; IC 95%: 0,67-1,13). Sin embargo, en un análisis secundario, la tasa de resultados funcionales excelentes (mRS: 0-2) fue menor en el grupo de ATX (48 vs. 56%; OR: 0,74; IC 95%: 0,57-0,96). No hubo diferencias en la mortalidad ni en la tasa de resangrados antes del tratamiento del aneurisma (10 vs. 14%; OR: 0,71; IC 95%: 0,48-1,04). Aunque, tampoco se identificó un aumento de eventos adversos con el uso de ATX, con tasas de ICD (23 vs. 22%; OR: 1,01; IC 95%: 0,74-1,37), y complicaciones tromboembólicas (11 vs. 13%; OR: 0,81; IC 95%: 0,48-1,38) similares en ambos grupos.
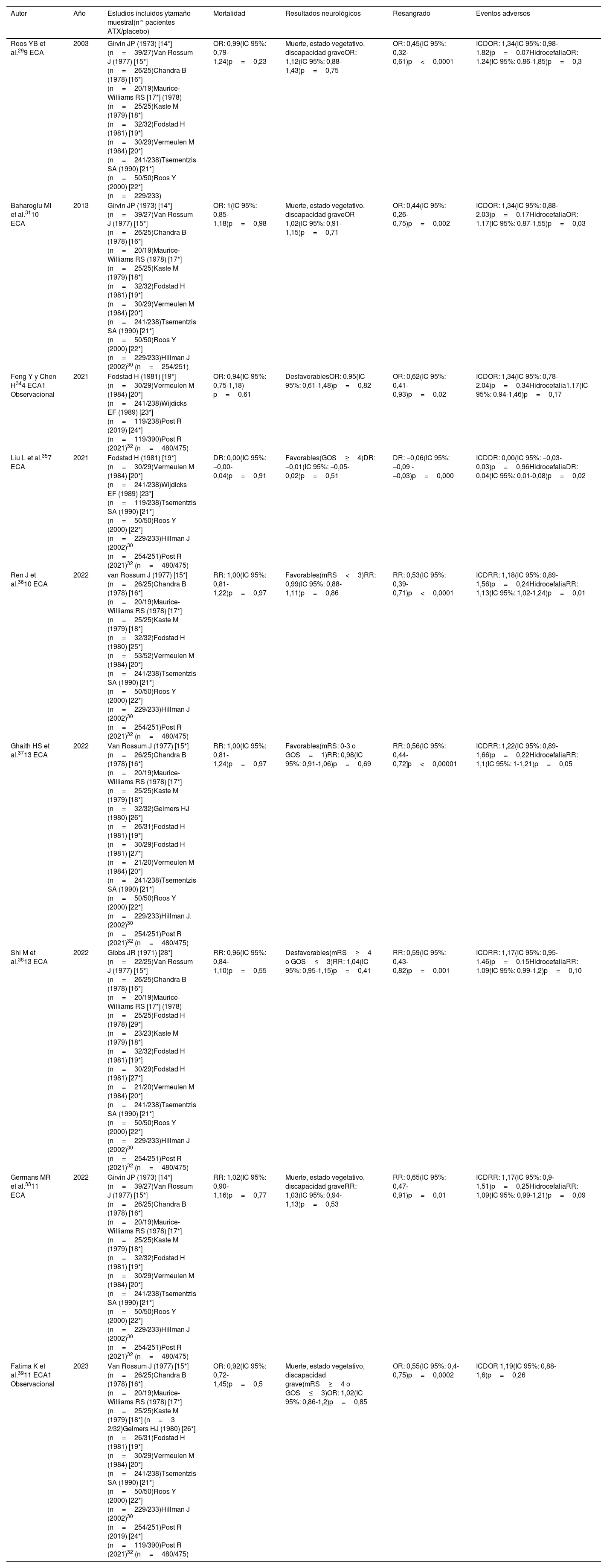
En la última revisión Cochrane publicada en 202233 y, desde la publicada con anterioridad31, solo se añadió este último ECA32 a los previos. Los autores concluyen que el tratamiento antifibrinolítico, después de la implementación de medidas preventivas de isquemia y administrado dentro de las primeras de 72h, reduce el riesgo de nuevas hemorragias (RR: 0,65; IC 95%: 0,47-0,91, p=0,01; 11 ensayos, 2.717 participantes; reducción del riesgo absoluto 7%, IC 95%: 3-12%; evidencia de calidad moderada), sin aumento del riesgo de ICD (RR: 1,10; IC 95%: 0,83-1,46; p=0,49; 2 ensayos, 1.318 participantes; evidencia de alta calidad), pero no mejora la supervivencia global ni la posibilidad de independencia funcional. Estos resultados son congruentes con los reportados en las diferentes revisiones sistemáticas y metaanálisis publicados29,31,33–39, cuyos resultados se resumen en la tabla 2, aunque los estudios analizados presentan una gran heterogeneidad, en dosis, tiempo de inicio y duración de tratamiento40.
Principales metaanálisis que evalúan el efecto del ATX en los pacientes con HSA
| Autor | Año | Estudios incluidos ytamaño muestral(n° pacientes ATX/placebo) | Mortalidad | Resultados neurológicos | Resangrado | Eventos adversos |
|---|---|---|---|---|---|---|
| Roos YB et al.299 ECA | 2003 | Girvin JP (1973) [14*] (n=39/27)Van Rossum J (1977) [15*] (n=26/25)Chandra B (1978) [16*] (n=20/19)Maurice-Williams RS [17*] (1978) (n=25/25)Kaste M (1979) [18*] (n=32/32)Fodstad H (1981) [19*] (n=30/29)Vermeulen M (1984) [20*] (n=241/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*] (n=229/233) | OR: 0,99(IC 95%: 0,79-1,24)p=0,23 | Muerte, estado vegetativo, discapacidad graveOR: 1,12(IC 95%: 0,88-1,43)p=0,75 | OR: 0,45(IC 95%: 0,32-0,61)p<0,0001 | ICDOR: 1,34(IC 95%: 0,98-1,82)p=0,07HidrocefaliaOR: 1,24(IC 95%: 0,86-1,85)p=0,3 |
| Baharoglu MI et al.3110 ECA | 2013 | Girvin JP (1973) [14*] (n=39/27)Van Rossum J (1977) [15*] (n=26/25)Chandra B (1978) [16*] (n=20/19)Maurice-Williams RS (1978) [17*] (n=25/25)Kaste M (1979) [18*] (n=32/32)Fodstad H (1981) [19*] (n=30/29)Vermeulen M (1984) [20*] (n=241/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*] (n=229/233)Hillman J (2002)30 (n=254/251) | OR: 1(IC 95%: 0,85-1,18)p=0,98 | Muerte, estado vegetativo, discapacidad graveOR 1,02(IC 95%: 0,91-1,15)p=0,71 | OR: 0,44(IC 95%: 0,26-0,75)p=0,002 | ICDOR: 1,34(IC 95%: 0,88-2,03)p=0,17HidrocefaliaOR: 1,17(IC 95%: 0,87-1,55)p=0,03 |
| Feng Y y Chen H344 ECA1 Observacional | 2021 | Fodstad H (1981) [19*] (n=30/29)Vermeulen M (1984) [20*] (n=241/238)Wijdicks EF (1989) [23*] (n=119/238)Post R (2019) [24*] (n=119/390)Post R (2021)32 (n=480/475) | OR: 0,94(IC 95%: 0,75-1,18) p=0,61 | DesfavorablesOR: 0,95(IC 95%: 0,61-1,48)p=0,82 | OR: 0,62(IC 95%: 0,41-0,93)p=0,02 | ICDOR: 1,34(IC 95%: 0,78-2,04)p=0,34Hidrocefalia1,17(IC 95%: 0,94-1,46)p=0,17 |
| Liu L et al.357 ECA | 2021 | Fodstad H (1981) [19*] (n=30/29)Vermeulen M (1984) [20*] (n=241/238)Wijdicks EF (1989) [23*] (n=119/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*] (n=229/233)Hillman J (2002)30 (n=254/251)Post R (2021)32 (n=480/475) | DR: 0,00(IC 95%: −0,00-0,04)p=0,91 | Favorables(GOS≥4)DR: −0,01(IC 95%: −0,05-0,02)p=0,51 | DR: −0,06(IC 95%: −0,09 - −0,03)p=0,000 | ICDDR: 0,00(IC 95%: −0,03-0,03)p=0,96HidrocefaliaDR: 0,04(IC 95%: 0,01-0,08)p=0,02 |
| Ren J et al.3610 ECA | 2022 | van Rossum J (1977) [15*] (n=26/25)Chandra B (1978) [16*] (n=20/19)Maurice-Williams RS (1978) [17*] (n=25/25)Kaste M (1979) [18*] (n=32/32)Fodstad H (1980) [25*] (n=53/52)Vermeulen M (1984) [20*] (n=241/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*] (n=229/233)Hillman J (2002)30 (n=254/251)Post R (2021)32 (n=480/475) | RR: 1,00(IC 95%: 0,81-1,22)p=0,97 | Favorables(mRS<3)RR: 0,99(IC 95%: 0,88-1,11)p=0,86 | RR: 0,53(IC 95%: 0,39-0,71)p<0,0001 | ICDRR: 1,18(IC 95%: 0,89-1,56)p=0,24HidrocefaliaRR: 1,13(IC 95%: 1,02-1,24)p=0,01 |
| Ghaith HS et al.3713 ECA | 2022 | Van Rossum J (1977) [15*] (n=26/25)Chandra B (1978) [16*] (n=20/19)Maurice-Williams RS (1978) [17*] (n=25/25)Kaste M (1979) [18*] (n=32/32)Gelmers HJ (1980) [26*] (n=26/31)Fodstad H (1981) [19*] (n=30/29)Fodstad H (1981) [27*] (n=21/20)Vermeulen M (1984) [20*] (n=241/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*] (n=229/233)Hillman J. (2002)30 (n=254/251)Post R (2021)32 (n=480/475) | RR: 1,00(IC 95%: 0,81-1,24)p=0,97 | Favorables(mRS: 0-3 o GOS=1)RR: 0,98(IC 95%: 0,91-1,06)p=0,69 | RR: 0,56(IC 95%: 0,44-0,72]p<0,00001 | ICDRR: 1,22(IC 95%: 0,89-1,66)p=0,22HidrocefaliaRR: 1,1(IC 95%: 1-1,21)p=0,05 |
| Shi M et al.3813 ECA | 2022 | Gibbs JR (1971) [28*] (n=22/25)Van Rossum J (1977) [15*] (n=26/25)Chandra B (1978) [16*] (n=20/19)Maurice-Williams RS [17*] (1978) (n=25/25)Fodstad H (1978) [29*] (n=23/23)Kaste M (1979) [18*] (n=32/32)Fodstad H (1981) [19*] (n=30/29)Fodstad H (1981) [27*] (n=21/20)Vermeulen M (1984) [20*] (n=241/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*](n=229/233)Hillman J (2002)30 (n=254/251)Post R (2021)32 (n=480/475) | RR: 0,96(IC 95%: 0,84-1,10)p=0,55 | Desfavorables(mRS≥4 o GOS≤3)RR: 1,04(IC 95%: 0,95-1,15)p=0,41 | RR: 0,59(IC 95%: 0,43-0,82)p=0,001 | ICDRR: 1,17(IC 95%: 0,95-1,46)p=0,15HidrocefaliaRR: 1,09(IC 95%: 0,99-1,2)p=0,10 |
| Germans MR et al.3311 ECA | 2022 | Girvin JP (1973) [14*] (n=39/27)Van Rossum J (1977) [15*] (n=26/25)Chandra B (1978) [16*] (n=20/19)Maurice-Williams RS (1978) [17*] (n=25/25)Kaste M (1979) [18*] (n=32/32)Fodstad H (1981) [19*] (n=30/29)Vermeulen M (1984) [20*](n=241/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*] (n=229/233)Hillman J (2002)30 (n=254/251)Post R (2021)32 (n=480/475) | RR: 1,02(IC 95%: 0,90-1,16)p=0,77 | Muerte, estado vegetativo, discapacidad graveRR: 1,03(IC 95%: 0,94-1,13)p=0,53 | RR: 0,65(IC 95%: 0,47-0,91)p=0,01 | ICDRR: 1,17(IC 95%: 0,9-1,51)p=0,25HidrocefaliaRR: 1,09(IC 95%: 0,99-1,21)p=0,09 |
| Fatima K et al.3911 ECA1 Observacional | 2023 | Van Rossum J (1977) [15*] (n=26/25)Chandra B (1978) [16*] (n=20/19)Maurice-Williams RS (1978) [17*] (n=25/25)Kaste M (1979) [18*] (n=3 2/32)Gelmers HJ (1980) [26*] (n=26/31)Fodstad H (1981) [19*] (n=30/29)Vermeulen M (1984) [20*] (n=241/238)Tsementzis SA (1990) [21*] (n=50/50)Roos Y (2000) [22*] (n=229/233)Hillman J (2002)30 (n=254/251)Post R (2019) [24*] (n=119/390)Post R (2021)32 (n=480/475) | OR: 0,92(IC 95%: 0,72-1,45)p=0,5 | Muerte, estado vegetativo, discapacidad grave(mRS≥4 o GOS≤3)OR: 1,02(IC 95%: 0,86-1,2)p=0,85 | OR: 0,55(IC 95%: 0,4-0,75)p=0,0002 | ICDOR 1,19(IC 95%: 0,88-1,6)p=0,26 |
DR: diferencia de riesgos; ECA: ensayo clínico aleatorizado; GOS: Glasgow Outcome Scale; IC: intervalo de confianza; ICD: isquemia cerebral diferida; mRS: escala modificada de Rankin; RR:: riesgo relativo; OR: odds ratio.
*Referencia en material adicional.
En un análisis post hoc del estudio ULTRA41, se incluyeron a los 813 participantes con un aneurisma cerebral confirmado en angiografía por TAC y/o angiografía por sustracción digital. No hubo diferencias en el resultado funcional (mRS: 0-3, 58% en el grupo de ATX y 60% en el grupo control, OR: 0,92; IC 95%: 0,69-1,24), ni en ninguno de los desenlaces secundarios: excelente resultado clínico (mRS: 0-2; OR: 0,76; IC 95%: 0,57-1,03), mortalidad por todas las causas a los 30 días (OR: 0,91; IC 95%: 0,65-1,28) y a los 6 meses (OR: 1,10; IC 95%: 0,80-1,52). Sin embargo, se observó una disminución del resangrado antes del tratamiento del aneurisma (11,2 vs. 16,1%; OR: 0,66; IC 95%: 0,44-0,99), de nuevo sin aumento en la incidencia de ICD (OR: 0,99; IC 95%: 0,72-1,36).
Un nuevo análisis post hoc del estudio ULTRA42 investigó el impacto del tiempo transcurrido hasta el inicio del ATX sobre el resangrado y el resultado funcional tras una HSAa. Se incluyeron 807 pacientes estratificados en 3 categorías, en función del momento de inicio del tratamiento (0-3, 3-6 y más de 6h). Los pacientes del grupo de ATX presentaron menos episodios de resangrado (16,2 vs. 19,9%; hazard ratio [HR]: 0,86; IC 95%: 0,62-1,19), y se comprobó que el momento de inicio de AXT tuvo un efecto significativo en la tasa de resangrado (p<0,001). Sin embargo, solo se observó un efecto protector cuando el ATX se inició después de 6h (reducción de la tasa absoluta del 1,4%), clínicamente no relevante, dado el bajo número de resangrados en esta categoría de tiempo, con un impacto global mínimo en la tasa total de resangrados. El tratamiento con ATX no mostró ningún efecto sobre la obtención de un resultado funcional favorable (OR: 0,96; IC 95%: 0,72–1,27), sin evidencia de modificación del efecto por el momento de inicio del ATX (p=0,53).
Recientemente se han publicado las guías americanas de 2023 de la AHA/ASA43, que hacen referencia al estudio ULTRA. Estas guías no recomiendan el uso rutinario del AXT en los pacientes con HSAa (recomendación de clase 3, nivel de evidencia A) debido a la variabilidad de los resultados en los ensayos publicados. Sin embargo, consideran la posibilidad de su uso con una duración corta en los pacientes cuyo tratamiento del aneurisma se retrase por circunstancias logísticas o médicas.
En resumen, la administración del AXT en los pacientes con HSAa antes de la oclusión del aneurisma puede reducir el riesgo de resangrado, sin aumento de eventos adversos, pero sin mejoría de los resultados funcionales ni disminución de la mortalidad. Por tanto, estos autores consideran que los agentes antifibrinolíticos no deben usarse de forma rutinaria, pero pueden ser una opción terapéutica utilizados por un período breve (<72h) para reducir el riesgo de resangrado, en los pacientes con un retraso inevitable de la oclusión del aneurisma (>24h), y sin contraindicaciones médicas como factores de riesgo para el desarrollo de complicaciones tromboembólicas (historia previa de enfermedad tromboembólica o de hipercoagulabilidad, alteraciones ECG agudas, elevación de la troponina o síntomas de tromboembolismo) y/o insuficiencia renal grave (creatinina >1,7mg/dl). La administración de ATX se debe suspender entre 2-4h antes del procedimiento endovascular, dado que la arteriografía, por sí misma, tiene riesgo tromboembólico.
Impacto del uso del ATX en los pacientes con hemorragia intracraneal espontáneaAunque la hemorragia intracraneal (HIC) no traumática o espontánea representa solo entre 10-20% de todos los accidentes cerebrovasculares, es responsable de casi la mitad de todas las muertes por ictus y se asocia con una morbilidad significativa44. La expansión del hematoma (EH) (definida como un incremento mayor o igual a 6ml o del 33% del hematoma basal) se produce en hasta un tercio de los pacientes tras una HIC y es la principal causa de deterioro neurológico. En casi la mitad de los pacientes, la EH ocurre en las primeras 24h del inicio de los síntomas, siendo más frecuente en las primeras 4-6h, y se asocia a peor pronóstico, mayor discapacidad funcional y mortalidad45.
El primer estudio que estudió el uso del ATX en la HIC espontánea fue el TICH-246. Se trata de un ECA que comparó el tratamiento con ATX con placebo, en el que se incluyeron 2.325 pacientes de 12 países. La administración de ATX produjo una reducción significativa pero modesta de la EH (OR: 0,80; IC 95%: 0,66-0,8; p=0,03) y de la mortalidad precoz a los 7 días (OR: 0,73; IC 95%: 0,53-0,99; p=0,04), pero sin diferencias significativas en el resultado funcional ni en la mortalidad a los 90 días. Sin embargo, se identificó un subgrupo de pacientes con una presión arterial sistólica (PAS) inicial menor o igual a 170mmHg, en los que la administración de ATX se asoció a una mejora en la puntuación de la escala de Rankin modificada (mRS) a los 90 días (OR: 0,73; IC 95%: 0,59-0,9). Este resultado puede estar confundido por el efecto de la gravedad de la HIC, dado que los hematomas de mayor volumen se acompañan de cifras mayores de PAS y peores resultados47. El empleo de ATX no se asoció con un aumento de eventos tromboembólicos ni otros eventos adversos graves. Una de las limitaciones de este estudio se debe a la heterogeneidad de la población incluida, con una gran proporción de pacientes con hemorragia intraventricular (32%). La falta de beneficio del ATX podría deberse a que la mayoría de los pacientes fueron tratados más de 3h después del inicio de la hemorragia, fuera de la ventana ideal para prevenir la EH. Por otro lado, dado que la recuperación funcional de la HIC puede tardar varios meses (hasta 6 meses), quizás hubiera sido necesario ampliar el tiempo de seguimiento48.
En un ensayo clínico posterior (TICH-NOAC)49 de pequeño tamaño muestral se incluyeron 63 pacientes con HIC que recibían anticoagulantes orales no antagonistas de la vitamina K. En este estudio la incidencia de EH (38 vs. 45%, aOR: 0,63; IC 95%: 0,22-1,82; p=0,40), la mortalidad (47 vs. 42%, aOR: 1,07; IC 95%: 0,37-3,04; p=0,91) y las complicaciones tromboembólicas (13 vs. 6%, aOR: 1,86; IC 95%: 0,37-9,50; p=0,45) no difirieron entre el grupo tratado con ATX en comparación con el grupo placebo. Sin embargo, este ensayo se interrumpió prematuramente debido al agotamiento de los fondos.
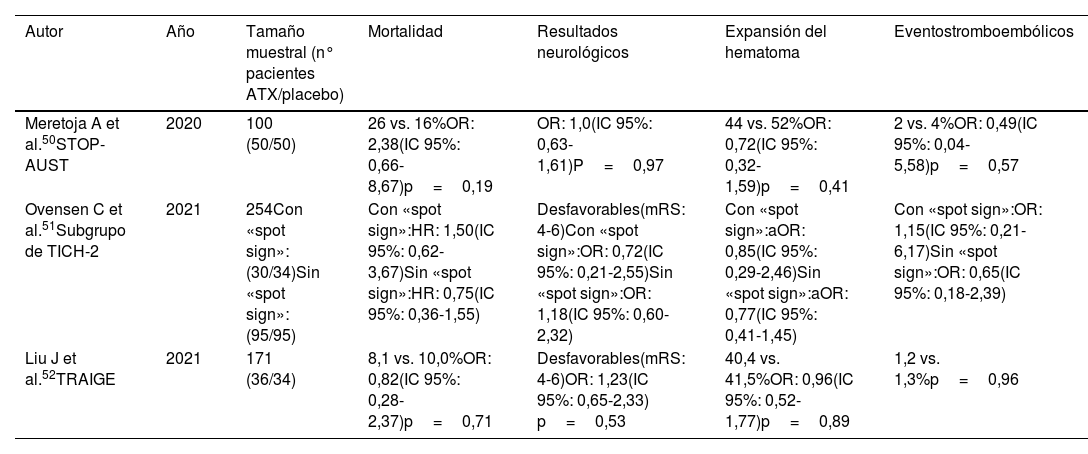
Tras el estudio TICH-2, se ha puesto especial énfasis en identificar los pacientes con mayor riesgo de EH y, por tanto, con mayor beneficio potencial del empleo de ATX. El «spot sign» en una angiografía por TAC o en un TAC con contraste, que indica una extravasación de contraste y fuga activa de sangre en la zona del hematoma, es un predictor de EH. Sin embargo, estudios recientes como el STOP-AUST, publicado en 202050 y otros 2 en 2021, un análisis de un subgrupo preespecificado del ensayo TICH-251 y el estudio TRAIGE52, no encontraron beneficios significativos del ATX en los pacientes con «spot sign» en términos de EH, resultados funcionales, mortalidad, ni eventos tromboembólicos. Aunque se observó una ligera tendencia a menor mortalidad en el estudio TRAIGE52, los resultados no fueron concluyentes debido a limitaciones como el pequeño tamaño muestral, en probable relación con la dificultad para la realización de pruebas de imagen en tiempo óptimo, así como la correcta identificación del «spot sign»53, y el retraso en el tratamiento. Los resultados de estos estudios se resumen en la tabla 3.
Principales ECA que evalúan el efecto del ATX en los pacientes con HIC espontánea e identificación de «spot sign»
| Autor | Año | Tamaño muestral (n° pacientes ATX/placebo) | Mortalidad | Resultados neurológicos | Expansión del hematoma | Eventostromboembólicos |
|---|---|---|---|---|---|---|
| Meretoja A et al.50STOP-AUST | 2020 | 100 (50/50) | 26 vs. 16%OR: 2,38(IC 95%: 0,66-8,67)p=0,19 | OR: 1,0(IC 95%: 0,63-1,61)P=0,97 | 44 vs. 52%OR: 0,72(IC 95%: 0,32-1,59)p=0,41 | 2 vs. 4%OR: 0,49(IC 95%: 0,04-5,58)p=0,57 |
| Ovensen C et al.51Subgrupo de TICH-2 | 2021 | 254Con «spot sign»: (30/34)Sin «spot sign»: (95/95) | Con «spot sign»:HR: 1,50(IC 95%: 0,62-3,67)Sin «spot sign»:HR: 0,75(IC 95%: 0,36-1,55) | Desfavorables(mRS: 4-6)Con «spot sign»:OR: 0,72(IC 95%: 0,21-2,55)Sin «spot sign»:OR: 1,18(IC 95%: 0,60-2,32) | Con «spot sign»:aOR: 0,85(IC 95%: 0,29-2,46)Sin «spot sign»:aOR: 0,77(IC 95%: 0,41-1,45) | Con «spot sign»:OR: 1,15(IC 95%: 0,21-6,17)Sin «spot sign»:OR: 0,65(IC 95%: 0,18-2,39) |
| Liu J et al.52TRAIGE | 2021 | 171 (36/34) | 8,1 vs. 10,0%OR: 0,82(IC 95%: 0,28-2,37)p=0,71 | Desfavorables(mRS: 4-6)OR: 1,23(IC 95%: 0,65-2,33) p=0,53 | 40,4 vs. 41,5%OR: 0,96(IC 95%: 0,52-1,77)p=0,89 | 1,2 vs. 1,3%p=0,96 |
aOR: odds ratio ajustada; HR: hazard ratio; IC: intervalo de confianza; mRS: escala de Rankin modificada; OR: odds ratio;
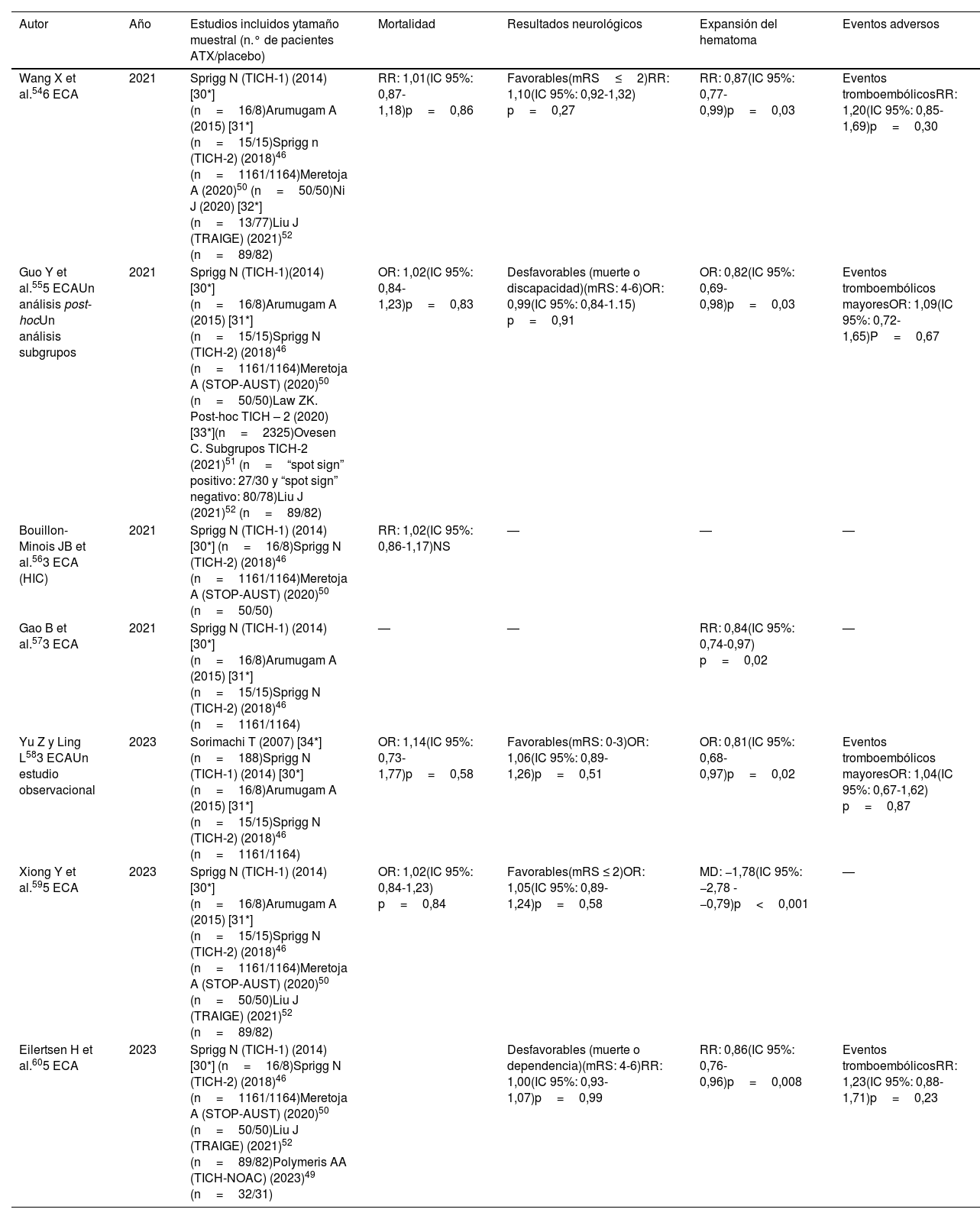
En conjunto, los principales metaanálisis y revisiones sistemáticas que evalúan el empleo del ATX en los pacientes con HIC espontánea54–60, cuyos resultados se recogen en la tabla 4, concluyen que el ATX reduce la EH, pero sin que se traduzca en un beneficio significativo en el desenlace funcional o en la mortalidad del paciente.
Principales metaanálisis que evalúan el efecto del ATX en los pacientes con HIC espontánea
| Autor | Año | Estudios incluidos ytamaño muestral (n.° de pacientes ATX/placebo) | Mortalidad | Resultados neurológicos | Expansión del hematoma | Eventos adversos |
|---|---|---|---|---|---|---|
| Wang X et al.546 ECA | 2021 | Sprigg N (TICH-1) (2014) [30*] (n=16/8)Arumugam A (2015) [31*] (n=15/15)Sprigg n (TICH-2) (2018)46 (n=1161/1164)Meretoja A (2020)50 (n=50/50)Ni J (2020) [32*] (n=13/77)Liu J (TRAIGE) (2021)52 (n=89/82) | RR: 1,01(IC 95%: 0,87-1,18)p=0,86 | Favorables(mRS≤2)RR: 1,10(IC 95%: 0,92-1,32) p=0,27 | RR: 0,87(IC 95%: 0,77-0,99)p=0,03 | Eventos tromboembólicosRR: 1,20(IC 95%: 0,85-1,69)p=0,30 |
| Guo Y et al.555 ECAUn análisis post-hocUn análisis subgrupos | 2021 | Sprigg N (TICH-1)(2014) [30*] (n=16/8)Arumugam A (2015) [31*] (n=15/15)Sprigg N (TICH-2) (2018)46 (n=1161/1164)Meretoja A (STOP-AUST) (2020)50 (n=50/50)Law ZK. Post-hoc TICH – 2 (2020) [33*](n=2325)Ovesen C. Subgrupos TICH-2 (2021)51 (n=“spot sign” positivo: 27/30 y “spot sign” negativo: 80/78)Liu J (2021)52 (n=89/82) | OR: 1,02(IC 95%: 0,84-1,23)p=0,83 | Desfavorables (muerte o discapacidad)(mRS: 4-6)OR: 0,99(IC 95%: 0,84-1.15) p=0,91 | OR: 0,82(IC 95%: 0,69-0,98)p=0,03 | Eventos tromboembólicos mayoresOR: 1,09(IC 95%: 0,72-1,65)P=0,67 |
| Bouillon-Minois JB et al.563 ECA (HIC) | 2021 | Sprigg N (TICH-1) (2014) [30*] (n=16/8)Sprigg N (TICH-2) (2018)46 (n=1161/1164)Meretoja A (STOP-AUST) (2020)50 (n=50/50) | RR: 1,02(IC 95%: 0,86-1,17)NS | — | — | — |
| Gao B et al.573 ECA | 2021 | Sprigg N (TICH-1) (2014) [30*] (n=16/8)Arumugam A (2015) [31*] (n=15/15)Sprigg N (TICH-2) (2018)46 (n=1161/1164) | — | — | RR: 0,84(IC 95%: 0,74-0,97) p=0,02 | — |
| Yu Z y Ling L583 ECAUn estudio observacional | 2023 | Sorimachi T (2007) [34*] (n=188)Sprigg N (TICH-1) (2014) [30*] (n=16/8)Arumugam A (2015) [31*] (n=15/15)Sprigg N (TICH-2) (2018)46 (n=1161/1164) | OR: 1,14(IC 95%: 0,73-1,77)p=0,58 | Favorables(mRS: 0-3)OR: 1,06(IC 95%: 0,89-1,26)p=0,51 | OR: 0,81(IC 95%: 0,68-0,97)p=0,02 | Eventos tromboembólicos mayoresOR: 1,04(IC 95%: 0,67-1,62) p=0,87 |
| Xiong Y et al.595 ECA | 2023 | Sprigg N (TICH-1) (2014) [30*] (n=16/8)Arumugam A (2015) [31*] (n=15/15)Sprigg N (TICH-2) (2018)46 (n=1161/1164)Meretoja A (STOP-AUST) (2020)50 (n=50/50)Liu J (TRAIGE) (2021)52 (n=89/82) | OR: 1,02(IC 95%: 0,84-1,23) p=0,84 | Favorables(mRS ≤ 2)OR: 1,05(IC 95%: 0,89-1,24)p=0,58 | MD: −1,78(IC 95%: −2,78 - −0,79)p<0,001 | — |
| Eilertsen H et al.605 ECA | 2023 | Sprigg N (TICH-1) (2014) [30*] (n=16/8)Sprigg N (TICH-2) (2018)46 (n=1161/1164)Meretoja A (STOP-AUST) (2020)50 (n=50/50)Liu J (TRAIGE) (2021)52 (n=89/82)Polymeris AA (TICH-NOAC) (2023)49 (n=32/31) | Desfavorables (muerte o dependencia)(mRS: 4-6)RR: 1,00(IC 95%: 0,93-1,07)p=0,99 | RR: 0,86(IC 95%: 0,76-0,96)p=0,008 | Eventos tromboembólicosRR: 1,23(IC 95%: 0,88-1,71)p=0,23 |
ECA: ensayo clínico aleatorizado; IC: intervalo de confianza; MD: mean difference; mRS: escala Rankin modificada; RR:: riesgo relativo; OR: odds ratio.
*Referencia en material adicional.
Por último, recientemente se han publicado los resultados del estudio STOP-MSU61. Se trata de un ECA, que incluyó 202 pacientes, con el objetivo de determinar el efecto del tratamiento con ATX en las 2h posteriores a la HIC. No se han obtenido diferencias en comparación con placebo en ninguno de los siguientes desenlaces: EH a las 24h (43 vs. 38%, OR: 1,31; IC 95%: 0,72-2,40; p=0,37), resultado funcional en el día 90 (OR: 0,83; IC 95%: 0,60-1,14), mortalidad a los 7 días (8 vs. 8%, OR: 1,08; IC 95%: 0,35-3,35), mortalidad a los 90 días (18 vs. 15%, OR: 1,61; IC 95%: 0,65-3,98), sin observar tampoco ninguna diferencia significativa en el análisis por subgrupos. Entre los factores que pueden haber contribuido a estos hallazgos se encuentra la inclusión de los pacientes con hematomas relativamente pequeños y profundos, y el pequeño crecimiento absoluto medio de los hematomas basales a las 24h. Este estudio presenta como limitaciones un pequeño tamaño muestral, y que únicamente se registró la PAS inicial del paciente, por lo que no se pudo estudiar la posible interacción entre el efecto del ATX y el control de la PAS en la EH.
En las últimas guías de la AHA/ASA62 no se establece ninguna recomendación para el uso del ATX en los pacientes con HIC y se hace referencia con un grado de evidencia 2b a que en los pacientes con HIC espontánea (con o sin «spot sign»), la eficacia del ATX para mejorar el resultado funcional no está bien establecida.
En conclusión, el empleo de ATX no mejora los resultados funcionales ni influye en la mortalidad en la HIC espontánea, y solo ha demostrado pequeñas reducciones en el volumen del hematoma, lo que no justifica su uso. Es necesario la realización de nuevos estudios, sin las limitaciones de los previos, con un tamaño muestral adecuado, la inclusión de los pacientes con signos radiológicos de alto riesgo de aumento del hematoma, mayor tiempo de seguimiento de los mismos, la administración precoz de ATX y evaluar el efecto concomitante del control estrecho de la PAS.
Actualmente, los investigadores del estudio TICH están llevando a cabo un gran ensayo de fase 3, que incluirá a 5.500 participantes, de ATX frente a placebo, que se administrará dentro de las 4,5h posteriores al inicio de los síntomas, cuyo objetivo principal es evaluar la mortalidad a los 7 días63.
Por tanto, en base a la evidencia disponible en la actualidad y, a la espera de los resultados de nuevos estudios, estos autores no recomiendan la administración del ATX en los pacientes con HIC espontánea.
ConclusionesEn base a los estudios publicados, a pesar de que el ATX ofrece un beneficio modesto en términos de mortalidad en pacientes con TCE leve o moderado, su uso se desaconseja en casos graves y, únicamente puede recomendarse de modo general en presencia de lesiones extracraneales. En pacientes con HSAa, la prevención de nuevas hemorragias debe centrarse en la obliteración endovascular o quirúrgica precoz del aneurisma responsable del sangrado inicial; sin embargo, el ATX puede tener un papel en aquellas situaciones dónde no es posible una intervención rápida. Y, en los pacientes con HIC no traumática, los datos solo han demostrado pequeñas disminuciones en el volumen del hematoma. Por tanto, a pesar de la ausencia de eventos adversos, el ATX no mejora los resultados funcionales ni influye en la mortalidad, por lo que su uso no puede recomendarse de forma rutinaria. Se necesitan más estudios para establecer qué tipo de pacientes con daño cerebral agudo tienen más probabilidades de beneficiarse del ATX, la dosis óptima y el momento de administración.
FinanciaciónEsta investigación no recibió ninguna subvención específica de organismos de financiación de los sectores público, comercial o sin fines de lucro.
Conflicto de interesesTodos los autores declaran que no tienen conflictos de intereses relevantes.