INTRODUCCIÓN
En ocasiones, ya por la gravedad o duración de la agresión, ya por las específicas condiciones del paciente, la respuesta inflamatoria no se limita al punto lesionado, y da lugar a una serie de síndromes sistémicos. Una vez desencadenados éstos, la ulterior evolución de los pacientes dependerá más de las características de estas respuestas generales, que de la etiología de la agresión1. En los últimos años se ha centrado la atención en el papel de la hemostasia y, en particular, de los trastornos hemostáticos2.
Aunque poco numerosos, existen algunos estudios que analizan los diferentes parámetros de la coagulación, determinan el rango patológico de sus desviaciones y establecen con ellos valoraciones pronósticas al incluirlos en escalas de gravedad.
De cualquier forma se está presentando, día a día, una creciente evidencia sobre la efectividad de promocionar la eficacia hemostática en pacientes con hemorragia grave y que presentan coagulación normal o con alteraciones inespecíficas3. Además, no debemos olvidar que en los pacientes con hemorragia grave, aguda o shock hipovolémico hemorrágico, la detención de la pérdida hemática y la estabilización hemodinámica del paciente son más importantes que la normalización de los parámetros de laboratorio.
En el caso de prevención de la hemorragia, la principal finalidad de cualquier medida terapéutica no debe ir dirigida a la reducción per se de las pérdidas hemáticas, sino a prevenir y disminuir los requerimientos transfusionales, ya que éstos han demostrado estar relacionados con un aumento de la morbimortalidad. En el mundo quirúrgico y en el paciente traumático quirúrgico, este concepto se ha desarrollado bajo el epígrafe de cirugía de control de daños y presenta buenos resultados. Este enfoque es lógicamente aplicable a otras situaciones que concurren en el paciente crítico, siendo asimismo la finalidad última evitar los fenómenos de isquemia-reperfusión que concurren en la situación de hipotensión y shock hemorrágico independientemente de su etiología y que a posteriori van a repercutir sobre la evolución del paciente y sobre la incidencia de disfunción multiorgánica4.
¿SE PUEDE CONSIDERAR A LA ALTERACIÓN DE LA COAGULACIÓN COMO UN FACTOR PRONÓSTICO?
En la literatura científica, cuando revisamos las escalas de puntuación de fallo orgánico, encontramos que los parámetros hematológicos son considerados como representativos de un sistema más, si bien no existe ninguna escala de puntuación que relacione el fallo de este sistema con un pronóstico de morbimortalidad5-20.
Los parámetros hematológicos considerados son: cifras de plaquetas (el más empleado habitualmente), de leucocitos, caída de hematocrito, cifras de fibrinógeno, de productos de degradación del fibrinógeno (PDF), de tiempo de protrombina (TP) y de tiempo parcial de tromboplastina activada (TTPa)5-20.
Asimismo, tampoco existe ninguna escala de puntuación de fallo orgánico que se base en parámetros de la coagulación, por lo que es un problema para los diversos autores establecer unos criterios diagnósticos de coagulación intravascular diseminada en la fase subclínica, y así es diferente el número de parámetros de la coagulacón que utilizan para establecer dicho diagnóstico, que va desde los que consideran exclusivamente las cifras de fibrinógeno y PDF22, hasta los que además de estas cifras consideran las que determinan las actividades plasmáticas procoagulantes (descenso de antitrombina III e incremento del fibrinopéptido A) y fibrinolíticas (descenso de alfa 2 antiplasmina y ascenso de fibrinopéptido B)23.
Diversos autores24 han revisado el valor de la hemostasia como factor pronóstico independiente en los pacientes con traumatismo craneoencefálico (TCE), así como otros han utilizado el valor de los PDF como factor predictivo del grado de daño neurológico y desarrollo de síndrome de distrés respiratorio agudo (SDRA)25. Kumura et al realizaron un estudio amplio de parámetros de la coagulación en una muestra de 100 pacientes con TCE26. En este trabajo se analizaron de forma independiente mediante técnicas de regresión múltiple el recuento de plaquetas, TP, TTPa, concentración plasmática de fibrinógeno, PDF y test del sulfato de protamina, respecto de la variable supervivencia. El 24% de los pacientes presentaron CID (con una mortalidad entre éstos del 58%) y la mortalidad global fue del 19%. Los parámetros de hemostasia que mejor predijeron el pronóstico de vida fueron el TTPa y el valor de fibrinógeno.
Olson et al evaluaron mediante modelo de regresión logística diversos parámetros de la coagulación respecto de la variable supervivencia23. En este estudio, además de los parámetros de la coagulación clásicos, se evaluó los valores de la escala de coma de Glasgow, valores de DD y una escala compleja de CID, en 269 pacientes con traumatismo craneal (TC). La conclusión fue que los parámetros de la coagulación, fundamentalmente los valores de DD, pueden resultar de gran valor predictivo del pronóstico de pacientes con valores más altos en la escala de coma de Glasgow, en los que posiblemente puedan aplicarse medidas terapéuticas más eficaces.
Pieck et al, en un estudio retrospectivo, analizaron datos de 734 pacientes con TC archivados en el Traumatic Coma Data Bank27. Se evidenció de nuevo, que las alteraciones de la coagulación en estos pacientes se dan fundamentalmente a los 2-4 días del traumatismo, y se concluyó que las complicaciones extracraneales significativas independientes para la supervivencia fueron las infecciones pulmonares en primer lugar, la presencia de shock al ingreso en segundo, la presencia de coagulopatía en tercero y el estado séptico en cuarto.
Suzuki et al28 estudiaron los valores de complejos trombina-antitrombina (TAT) y complejos plasmina-antiplasmina (PAP) en sangre de vena yugular y sangre venosa periférica en 27 pacientes con TC grave, con la intención de evaluar en el tiempo (3, 12, 24 y 72 h) la generación intracerebral local y específica de trombina y plasmina. Los investigadores observaron que los valores de TAT en vena periférica aumentaban mucho a las 3 h postraumatismo, para disminuir seguidamente, mientras que en sangre yugular presentaban un segundo incremento a las 72 h. Los valores de complejos PAP aumentaban a las 3 h en ambas localizaciones para disminuir posteriormente. Los investigadores concluyeron que TAT y PAP traducen en una fase precoz la activación sistémica de la coagulación y fibrinólisis que se da tras el shock traumático y la hipoxia, mientras que los valores altos de TAT a las 72 h reflejan la generación específica de trombina en el sistema nervioso central (SNC). Ello puede deberse a que es en ese momento en que suele producirse el mayor daño de permeabilidad de la barrera hematoencefálica y, por tanto, un mayor contacto de los factores procoagulantes con el TF. La importante activación de trombina en tejido cerebral a las 72 h puede condicionar microtrombosis cerebral, isquemia y quizás el daño observado en las autopsias de los casos más graves.
Touho et al29 estudiaron un grupo de 12 pacientes con traumatismo exclusivamente craneal y exentos de otras patologías, y al igual que Kaufman et al30 llegaron a la conclusión de que los parámetros de la coagulación pueden mejorar la estimación del pronóstico en pacientes con valores altos de la escala de coma de Glasgow.
Lo que sí podemos considerar, a este respecto, como una buena aproximación del pronóstico es la utilización de la escala de puntuación de Bick de forma secuencial tras administración de tratamiento, y así una mejora de 10 puntos a las 48 h de iniciar el tratamiento permite considerar una evolución favorable, cuando es menor de 9 puntos se considera una situación estacionaria y cuando hay un empeoramiento de 10 puntos, además de evidenciar un fallo de la terapéutica, es indicativo de pronóstico fatal31.
TRATAMIENTO DE LAS ALTERACIONES DE LA COAGULACIÓN Y DE LA HEMORRAGIA
Esta es una pregunta difícil de contestar, ya que partimos de la base de la dificultad de establecer el diagnóstico y el momento de activación de la coagulación en el paciente crítico, por lo que habitualmente tratamos los cuadros que tienen una significativa expresividad clínica. En cualquier caso, la estrategia del tratamiento podría dividirse en tratamiento etiológico (de la causa desencadenante de la activación de la coagulación), fisiopatológico (de los mecanismos de producción) y sintomático (de los efectos sobre la hemostasia).
Tratamiento etiológico
Lo esencial es revertir el proceso desencadenante, y no se deben corregir "valores de laboratorio", la clínica será la que marcará las decisiones terapéuticas32.
Tratamiento fisiopatológico33
Se trata de neutralizar la actividad tromboplástica circulante, que induce la generación de trombina a partir de la protrombina.
Heparina convencional
La administración de heparina en la CID siempre ha sido motivo de controversia. Sin embargo, la necesidad de frenar la actividad procoagulante a veces es imprescindible para detener la actividad generalizada de las cascadas de la coagulación. La actividad aceleradora de la inhibición de la trombina de la heparina puede hacer cesar rápidamente esta activación masiva y caótica que produce el depósito de fibrina intravascular, particularmente cuando el tratamiento de la causa de la CID no es posible o no es suficiente para detener esta activación. La pauta de actuación puede oscilar entre la abstención terapéutica y el tratamiento exclusivamente de la causa, el tratamiento sustitutivo o la heparinoterapia con tratamiento sustitutivo, dado que en estudios experimentales se ha mostrado beneficiosa, no beneficiosa e incluso dañina. La respuesta clínica está fuertemente correlacionada con los valores funcionales de antitrombina III (ATIII), generalmente descendidos. Además puede inducir trombocitopenia, con lo que podríamos agravar la hemorragia e inducir trombosis34-38.
Heparina de bajo peso molecular
Aunque no existen estudios publicados sobre su empleo en el tratamiento de la CID11, desde el punto de vista teórico ofrece la ventaja de tener una marcada actividad antifactor Xa y una menor tendencia hemorragípara39,40.
Tratamiento sintomático
Reposición de sustratos
Tiene varios aspectos, dependiendo del tipo de déficit a reponer.
Plasma fresco congelado
Una unidad de plasma fresco congelado incrementa los valores de todos los factores de la coagulación en un 2-3%. Se consideran normales los valores superiores a un 80% de actividad, aunque el riesgo de hemorragia sólo es evidente cuando estos valores descienden a menos de la mitad de estas cifras. Las dosis aconsejadas son de 10-15 ml de plasma por kg de peso41. En el caso de un déficit selectivo o predominante de uno de los factores se deberá considerar la administración de un concentrado de este factor. Es importante considerar que sólo la detección de un valor disminuido de un factor no es motivo de tratamiento sustitutivo, excepto en casos de descenso muy marcado en los que deba practicarse algún procedimiento invasivo al paciente, o cuando éste presente ya una hemorragia42. No podemos olvidar los riesgos de sobrecarga de volumen y de transmisión de enfermedades.
Transfusión de plaquetas
Una unidad de plaquetas incrementa el recuento de plaquetas en alrededor de 5.000-10.000 elementos, por lo que se recomienda una unidad de concentrado por cada 10 kg de peso. Existe gran controversia respecto a en qué momento deben administrarse, pudiendo ser la cifra clave por debajo de 10.00043-45. Su indicación principal es en las situaciones de alteración de la producción o aumento del consumo asociado a hemorragia46. Se objetiva peor respuesta en pacientes con fiebre, coagulopatía de consumo, esplenomegalia o aloinmunización.
Fibrinógeno
En algunos casos en los que predomine una fibrinólisis importante, es posible reponer fibrinógeno exclusivamente, disponible en frascos de Ig comercial. La dosis aproximada es de un frasco por litro de volemia. No obstante el PFC aporta fibrinógeno (aproximadamente, 2 g).
Antitrombina III
La ATIII es el anticoagulante endógeno más importante, capaz de inhibir todas las enzimas de la coagulación ya que existe un lugar de unión común a todas las enzimas de la coagulación y a la molécula de ATIII. Después de la activación de la coagulación aumenta el consumo de ATIII y, por tanto, la administración de concentrados de ATIII restaurará el sistema de anticoagulación endógeno. Además, la ATIII estimula la liberación de PGF2, que además de sus efectos antiagregantes y vasodilatadores, también posee efectos inhibitorios en diversas fases del proceso inflamatorio (es decir, además de efectos profilácticos, antitrombóticos y de antipermeabilidad sobre los vasos, tiene efecto antiinflamatorio). Algunos autores recomiendan la utilización profiláctica de concentrados de ATIII en todo paciente crítico con objeto de evitar la aparición de una coagulación intravascular clínica diseminada y sus complicaciones47. Otros autores no son partidarios de esta práctica48,49, pues creen que no existe evidencia científica de que la administración profiláctica de concentrados de ATIII en individuos no deficientes pueda evitar la aparición de CID. Quizás una solución intermedia esté en la administración de estos concentrados en pacientes con cifras de ATIII inferiores al 70%, siendo necesario llegar a cifras entre 100-150% del valor normal, aunque para justificar los costes de este tratamiento serían necesarios extensos ensayos clínicos en que se resaltara la disminución de muertes y estudios con una metodología estadística rigurosa para corroborarlo50-54. No obstante, sí parece demostrado que el tratamiento con dosis suprafisiológicas, tanto de éste como de los otros inhibidores endógenos (PC y PS), puede mejorar la evolución de la coagulopatía, probablemente a través de una reacción antiinflamatoria que module la respuesta del sujeto a la endotoxina54.
Crioprecipitados concentrados de complejos de protrombina y concentrados purificados específicos
El empleo de crioprecipitados ricos en factor VIII, y fibrinógeno, puede ser útil en los casos en los que el fibrinógeno sea muy bajo. Se preparan a partir de la precipitación del plasma fresco al descongelarlo, contienen menor cantidad de fibrinógeno (250 mg por unidad), pero al poseer menor volumen son de elección en pacientes que no admiten sobrecarga hídrica. La dosis recomendada es de una a 2 unidades por cada 10 kg de peso, para retornar al fibrinógeno a valores hemostáticos (iguales o superiores a 100 mg/dl). También pueden estar indicados los concentrados de complejos de protrombina (PCC) que son factores de la coagulación dependientes de la vitamina K (FII, FBI, FIX y FX) y los concentrados purificados específicos (FBI en la hemofilia tipo A)46.
Fármacos prohemostáticos
Tal como indican Levi et al, la mayor parte de la experiencia con fármacos prohemostáticos ha sido obtenida en la prevención y tratamiento de la hemorragia secundaria a alteraciones de la coagulación congénitas o adquiridas, esta terapia es de una alta eficacia en esas situaciones46.
Los fármacos prohemostáticos actualmente disponibles se pueden dividir en 3 grupos:
Antifibrinolíticos: aprotonina y análogos de la lisina.
Desmopresina.
Factor VII recombinante activado.
Otros agentes prohemostáticos como las preparaciones de estrógenos conjugados sólo parecen tener clara indicación en la trombocitopatía urémica, mientras que la fibrina tópica (combinación de fibrinógeno humano con trombina bovina) no ha demostrado, de forma fehaciente, reducción en las pérdidas hemáticas intra o perioperatorias. Debemos efectuar un comentario sobre la seguridad global de las medicaciones prohemostáticas. La interferencia entre los mecanismos coagulantes y anticoagulantes puede, teóricamente, condicionar efectos adversos y en el caso de la medicación procoagulante estos efectos serán eminentemente trombóticos. La incidencia de estas complicaciones, afortunadamente raras, debe de ser valorada en estudios amplios y multicéntricos que recojan las particularidades específicas de cada grupo de medicamentos en relación a entidades nosológicas específicas.
Antifibrinolíticos
Los fármacos que presentan un efecto antifibrinolítico son la aprotonina y el grupo de los análogos de la lisina55. Su acción prohemostática proviene de 2 circunstancias: inhibición de la fibrinólisis, decantando el equilibrio entre pro y anticoagulación hacia una situación más procoagulante y a un efecto protector sobre las plaquetas, demostrado al menos en la aprotonina X. El mecanismo de este último efecto se centra en una potencial prevención de pérdida de los receptores plaquetares mediada por la plasmina.
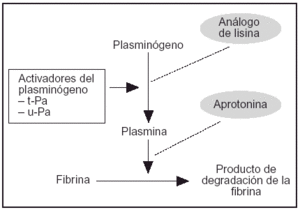
Aprotonina. Es un polipéptido de 58 aminoácidos de origen bovino (pulmón, parótida o páncreas). Su modo de acción es inespecífico y actúa inhibiendo directamente la actividad de las proteasas de la serina (incluida la plasmina), de los factores e inhibidores de la coagulación y de los constituyentes de los sistemas quinina-calicreína y angiotensina (fig. 1).
Figura 1. Activadores del plasminógeno.
Numerosos trabajos se han centrado en el estudio de los beneficios potenciales de este fármaco en la prevención del sangrado excesivo, aunque sólo en pacientes sometidos a cirugía cardíaca y ocasionalmente en trasplante hepático ortotópico. Sus resultados muestran una reducción en las pérdidas sanguíneas perioperatorias, menor drenaje hemático postoperatorio por el tubo de tórax y reducción, tanto en el número de transfusiones como en el número de pacientes que reciben transfusión. Los metaanálisis efectuados sobre los estudios placebo-aprotonina55-60 indican una reducción media en la pérdida sanguínea de unos 400 ml así como una disminución en la precisión de transfusión. Los resultados de Leviet al56 y de Muñoz et al57 también observan reducción en el número de reexploraciones y en la mortalidad. Las dosis altas se han demostrado más efectivas: 280 mg como dosis de carga seguidos de 70 mg/h durante la intervención quirúrgica y, ocasionalmente, otra dosis de 280 mg en los fluidos del circuito de bypass. Como efecto clínico adverso infrecuente pero grave, puede presentar reacciones alérgicas o anafilácticas. Se contraindica en la CID y en los pacientes con fracaso renal. También se ha descrito una cierta incidencia de oclusiones tardías del injerto (20,5 frente a 12,7%) postangiografía coronaria, así como la presencia de infarto agudo de miocardio61.
Análogos de lisina. El épsilon-aminocaproico y el ácido tranexámico, han sido estudiados como potenciales fármacos prohemostáticos al actuar como potentes inhibidores de la fibrinólisis. Su acción biológica se basa en su unión competitiva a los lugares de unión de la lisina en el coágulo de fibrina, compitiendo de esta forma con el ligando del plasminógeno (fig. 1). La alteración de la unión del plasminógeno a la fibrina retrasa la conversión del plasminógeno a plasmina y la subsecuente fibrinólisis mediada por ésta. Debido a que la potencia biológica del segundo es superior en unas 10 veces a la del épsilon-aminocaproico, la mayor parte de los trabajos se han centrado en el ácido tranexámico.
Los resultados obtenidos con su aporte a altas dosis (más de 10 g en el período perioperatorio, también en el contexto de la cirugía cardíaca y del trasplante), son superponibles a los referidos para la aprotonina56,57.
Los metaanálisis dirigidos a la comparación de los estudios realizados con ácido tranexámico (más de 10 g en el perioperatorio) o con aprotonina parecen indicar mayor eficacia de ésta, aunque no se han presentado diferencias estadísticamente significativas en lo referente a mortalidad o a retoracotomía.
Los estudios efectuados indican que mientras la aprotonina puede presentar anafilaxia grave, el ácido tranexámico está prácticamente desprovisto de efectos negativos. Por otra parte, la aprotonina es más cara que los análogos de la lisina. El uso clínico de análogos de lisina está contraindicado en las situaciones de activación de la coagulación (CID) y en la hematuria macroscópica debido a que al inhibir la fibrinólisis urinaria (alta concentración) pueden causar insuficiencia renal obstructiva.
Desmopresina (vasopresina D-amino D-arginina)
Es un análogo de la vasopresina que conserva su efecto antidiurético y alguno de sus efectos vasoactivos, lo que ocasionalmente se ha asociado a infarto agudo de miocardio y hace que no esté indicada en los pacientes de riesgo. Induce la liberación del contenido de las células endoteliales asociadas a los cuerpos de Weibel Palade, incluyendo al factor de von Willebrand y al factor VIII y, por mecanismos no explicados, potencia la hemostasia primaria. Aunque su forma de administración puede ser intravenosa, subcutánea o intranasal, es la primera de ellas la que se demuestra como más efectiva. Se emplea como prevención y tratamiento de la hemorragia en pacientes con enfermedad de von Willebrand o con hemofilia tipo A, así como en pacientes con alteración funcional de la hemostasia primaria (uremia, cirrosis hepática o hemorragia asociada a aspirina)62.
En pacientes sometidos a cirugía de bypass coronario ha demostrado reducción (15-40%) en las pérdidas hemáticas perioperatorias63. Los metaanálisis confirman este punto pero no encuentran diferencias en lo que respecta al porcentaje de pacientes que precisan transfusión, incidencia de reexploraciones o mortalidad. Hay que destacar que aunque su efectividad parece ser menor que la de la aprotonina o la del ácido tranexámico, puede ser de especial eficacia en el subgrupo de pacientes que han tomado aspirina en el preoperatorio56.
Factor VII recombinante activado (rFVIIa)
Basándose en la premisa de que la activación de la coagulación in vivo procede predominantemente de la vía factor tisular/factor VII (fig. 2) se ha desarrollado, recientemente, un potente fármaco prohemostático64. El rFVIIa forma un complejo con el factor tisular (localizado en la media subendotelial y sólo expuesto cuando hay lesión tisular) activando al FIX y al FX lo que provoca una explosión o liberación de trombina que a su vez produce un coágulo de fibrina sobre la lesión vascular. Por otra parte, también tiene efectos independientes de los factores tisulares (superficie plaquetar). Básicamente circunvala toda la vía intrínseca de la coagulación y acorta el tiempo requerido para completar la formación secundaria del coágulo. Su modo de acción es local, y no condiciona la activación sistémica de la coagulación ni trombogenicidad.
Figura 2. Factor tisular y factor VIIa.
Con este fármaco se dispone de variada experiencia clínica, tanto en pacientes con problemas de coagulación como sin ellos, incluyendo entre estos últimos a los testigos de Jehová, que demuestra excelentes resultados. Entre los problemas de la coagulación destacan los estudios realizados en pacientes con anticuerpos a los factores de coagulación y sangrado excesivo, trombocitopenia grave o alteraciones de la hemostasia primaria que no responden a tratamiento convencional. En todas estas situaciones ha mostrado gran eficacia en el control de la hemorragia65,66.
Ahora bien, en el mundo de la patología crítica quizás sean de más relevancia clínica los trabajos realizados en el control de la hemorragia en pacientes politraumatizados o quirúrgicos de alto riesgo. Entre estos últimos cabe destacar los resultados de Friederich et al67,68 en pacientes prostatectomizados, en los que reduce las pérdidas hemáticas y así evita la necesidad de transfusión, los objetivados en pacientes cirróticos sangrantes (cese de la hemorragia, mortalidad) y los referidos tanto en pacientes sometidos a hepatectomía parcial como a trasplante de hígado (disminución de las necesidades de transfusión)69.
Entre los pacientes politraumatizados destacan las series de Martinowitz et al70, Kenet et al71 y O'Neil et al72, a dosis de 60 a 212 µg/kg. La velocidad de acción del fármaco fue ultracorta (5-15 min) y se redujeron de forma significativa tanto los requerimientos hemáticos como los parámetros de coagulación.
Finalmente, podemos indicar que en las recientes revisiones de Lynn et al73 y de Erhardtsen69 se pueden encontrar, respectivamente, resultados experimentales que amplían los conceptos fisiopatológicos sobre este tema y una excelente puesta al día sobre la situación actual, los resultados de los estudios clínicos en marcha con rFVIIa y la muy baja incidencia de complicaciones (17 complicaciones de diverso tipo, sin clara relación causal en todas ellas, en más de 480.000 dosis estándar).
Otras terapéuticas
Regulación de los mecanismos fisiopatológicos
Su filosofía es disminuir la respuesta sistémica actuando sobre el mecanismo inflamatorio o sobre alguno de los procesos implicados. El desarrollo de anticuerpos monoclonales frente al factor tisular y el factor VIIa podría ser útil para inhibir la activación de la coagulación sanguínea y tratar los grados más avanzados de coagulación intravascular diseminada, ya que inhiben la generación de trombina y la conversión de fibrinógeno en fibrina. Estudios experimentales con animales a los que se les ha inducido una sepsis con Escherichia coli sugieren su efecto beneficioso sobre los trastornos hemostáticos74. Alternativamente, anticuerpos monoclonales frente a las citocinas que producen la liberación del TF (como anti-TNF, y anti-IL1) pueden inhibir la trombosis. Actualmente, se está estudiando la utilización de la pentoxifilina75, inhibidor de la síntesis de FNT alfa en la pretranscripción, que es un mediador de la respuesta inflamatoria que aumenta tras la estimulación producida por la endotoxina y genera una activación de la coagulación que no se produce en animales de experimentación cuando se administra este producto.
También hay estudios con anticuerpos monoclonales tipo FTPI, inhibidor del complejo FT-FVIIa, ya que se conoce que la deplección del inhibidor del FT plasmático favorece el desarrollo de CID, pero su administración bloquea la respuesta inflamatoria, previene el consumo de factores de la coagulación, reduce los depósitos de fibrina en varios órganos y disminuye la mortalidad. El problema es que esto no está tan demostrado en la especie humana donde sí se inhibe la activación de la coagulación, pero no afecta la fibrinólisis ni la respuesta inflamatoria76. La utilización combinada de inhibidores de la liberación y función del factor tisular puede ser más eficaz; sin embargo, serán necesarios futuros estudios para comprobar esta hipótesis.
Proteína C activada
La proteína C purificada y activada (PCA) ha demostrado ser eficaz en el tratamiento de un modelo experimental de shock séptico en monos77, y en humanos en púrpura fulminans78,79, aunque no está claro cuál es el mecanismo fisiopatológico que se cree que está más en relación con sus propiedades antiinflamatorias. Y tiene un valor pronóstico innegable, por cuanto su déficit es proporcional a la gravedad del cuadro clínico79,80. La capacidad de la proteína C activada y de la antitrombina III de inhibir la formación de trombina y aumentar la fibrinólisis puede proporcionarnos en el futuro una nueva modalidad terapéutica de la coagulopatía del paciente crítico81,82, y esto se basa en que el sistema de la PC se activa en la medida que se activa la coagulación, de tal modo que la capacidad anticoagulante es proporcional al grado de generación de trombina76.
Los estudios actuales83,84, concluyen que la administración de concentrados de proteína C en pacientes con sepsis grave y, por tanto, mayor riesgo de hemorragia, reducen significativamente la mortalidad.
Proteína S
Aparte de su papel como anticoagulante endógeno, se sabe muy poco de su papel fisiopatológico, ya que tradicionalmente se le ha concedido un papel secundario, si bien los estudios experimentales demuestran que su ausencia da lugar a una respuesta antiinflamatoria descompensada76,82.
Mutante alfa1-antitripsina
Recientemente se ha descubierto que una mutación del centro activo metionina de la alfa1-antitripsina por arginina (alfa1-antitripsina Pittsburgh), convierte la molécula de un inhibidor de la elastasa en un inhibidor de la trombina85. Este mutante es un inhibidor eficaz del sistema contacto y es el inhibidor más activo conocido de la calicreína, sin necesidad de la heparina para ser activo. Este mutante podría ser útil en el tratamiento de la CID, sustituyendo a la ATIII e inhibiendo las proteínas comprometidas en la actividad del sistema contacto de la coagulación sanguínea. Estudios experimentales han demostrado su eficacia en el tratamiento de la sepsis por bacilos gramnegativos en cerdos51.
Hirudina recombinante
La hirudina es un potente inhibidor de la trombina, que forma complejos de alta afinidad con la trombina; es decir, tiene un efecto similar a la heparina, aunque a diferencia de ésta no precisa de ATIII para su efecto anticoagulante. Los estudios realizados en voluntarios sanos y en pacientes con una CID indican su posible utilidad como agente antitrombótico. Estudios en animales han demostrado que la hirudina recombinante tiene un potente efecto antitrombótico con un limitado potencial hemorrágico86. Bajo el punto de vista de la utilización de la hirudina en la práctica clínica, cabe destacar que debido a su corta vida media y a su escasa biodisponibilidad (por vía subcutánea), no parece probable su uso en la profilaxis de la activación de la coagulación en el paciente crítico.
Bloqueo de selectinas
Aunque son necesarios más estudios en este campo, los realizados hasta ahora permiten suponer que interferir en los mecanismos de adhesión podría ofrecer nuevas estrategias terapéuticas para reducir la lesión tisular provocada por la activación de la coagulación en el paciente crítico. Se ha demostrado la participación de varias de las moléculas de adhesión, entre las que se incluyen CD11b/CD18 e ICAM-1, como mediadoras de la lesión tisular postisquémica en diversos experimentos en los que el bloqueo de esas moléculas producía una reducción significativa de la lesión celular y una mejoría de la función orgánica y de la supervivencia87,88. Estudios in vivo han demostrado que el bloqueo de selectinas, CD11b/CD18 e ICAM-1 reduce significativamente la adhesión leucocitaria y evita la lesión microvascular y tisular89,90. Otros inhibidores de la proteasa que se basan en la duplicidad de propiedades al producir inhibición de plasmina y calicreina como el gabexate, que es un inhibidor sintético de la serinproteasa que ha demostrado en coagulopatías graves (de origen neoplásico e infeccioso) tener un efecto mayor que la heparina al disminuir los efectos de coagulopatía severa y de las proteasas fibrinolíticas, incluidas plasmina y trombina, aunque son estudios no aleatorizados y preliminares. También hay estudios experimentales en ratas comunes con el inhibidor sintético del factor Xa (DX-9065a) que están pendientes de valorar sus efectos.
CONCLUSIONES
Los trastornos del sistema de la coagulación son consecuencia de la causa desencadenante del proceso crítico, pero también ellos pueden desempeñar un papel fundamental en el curso del cuadro clínico en los pacientes críticos. Cuando no se reconocen ni se tratan en una fase precoz, estos trastornos pueden transformarse en procesos irreversibles. A este fin, sería aconsejable incluir en las pruebas rutinarias de la coagulación realizadas en los pacientes críticos aquellas que permitan un diagnóstico precoz. La revisión de la bibliografía, permite un acercamiento exploratorio aunque con evidentes limitaciones a los mecanismos patogénicos de los trastornos de la coagulación en los pacientes críticos y sugiere algunas soluciones, aunque de momento con escasa expresividad práctica.
En resumen, la activación masiva de la coagulación que se produce en mayor o menor grado conlleva 3 consecuencias: 1) la oclusión trombótica de la microcirculación por depósitos de fibrina (aunque en animales de experimentación se inhiben los depósitos de fibrina pero no se reduce la mortalidad; 2) la generación de enzimas proteolíticas de la coagulación (fundamentalmente la trombina, el factor Xa y el factor VIIa) que pueden tener efectos proinflamatorios, y 3) el consumo de plaquetas y factores de la coagulación que pueden ser responsables de la aparición de hemorragias.
Así, se ha destacado el papel de las citocinas proinflamatorias en la génesis de la CID y de la hemofagocitosis, pero la utilización de anticuerpos anticitocinas no ha proporcionado resultados excelentes, al menos hasta el momento, aunque podría resultar útil en el control de las coagulopatías inducidas por la sepsis. También parece claro la utilización profiláctica de las heparinas fraccionadas frente a las no fraccionadas, ya que a una mayor eficacia suman una disminución en la aparición de la trombopenia inducida por la heparina y en la aparición de "resistencia" a la heparina (ausencia de efectos anticoagulantes después de la administración de heparina) como consecuencia de una menor unión a proteínas plasmáticas, que está muy aumentada cuando la inflamación está en su fase activa, como es el caso de los pacientes críticos, especialmente los sépticos.
En cualquier caso, parece claro que se van entendiendo mejor los acontecimientos celulares y humorales de la inflamación y de la respuesta inflamatoria sistémica, aunque los conocimientos globales en este campo son todavía muy limitados, y se evidencia la necesidad de realizar análisis retrospectivos que identifiquen subpoblaciones de pacientes y amplios ensayos clínicos con agentes antiinflamatorios de nueva generación que permitan modular la respuesta inflamatoria, considerando que ésta es en principio y a largo plazo beneficiosa para el paciente.
En lo que respecta a la hemorragia activa, con o sin alteraciones de la coagulación, debemos contemplar el abanico de fármacos prohemostáticos, destacando entre ellos los resultados recientemente conseguidos con el factor VII recombinante activado, no sólo en pacientes quirúrgicos cardíacos, sino también en el traumatismo agudo y grave, en otros modelos de cirugía y en situaciones que cursan con mayor potencialidad hemorrágica.