Editado por: Federico Gordo - Medicina Intensiva del Hospital Universitario del Henares (Coslada-Madrid)
Última actualización: Octubre 2023
Más datosConocer el rendimiento de los criterios de aislamiento preventivo del programa Resistencia Zero (RZ) e identificar los factores que pudieran mejorar su rendimiento.
DiseñoEstudio de cohorte prospectivo y multicéntrico.
ÁmbitoUnidades de cuidados críticos que aplicaban el protocolo RZ, y que aceptaron la invitación al estudio.
Pacientes o participantesPacientes a los que se les realizaron cultivos de vigilancia (nasal, faríngeo, axilar y rectal) y/o diagnósticos al ingreso en la UCI.
IntervencionesAnálisis de los factores de riesgo (FR) RZ y otras variables del registro ENVIN. Se realizó un estudio univariable y multivariable con metodología de regresión logística binaria (significación con p<0,05). Se efectuó análisis de sensibilidad y especificidad para cada uno de los factores seleccionados.
Variables de interés principalesPortador de bacteria multirresistente (BMR) al ingreso en la UCI, FR (antecedente de colonización/infección por BMR, ingreso hospitalario en los 3 meses previos, uso de antibiótico el mes previo, estar institucionalizado, diálisis y otras condiciones crónicas) y comorbilidades.
ResultadosParticiparon 2.252 pacientes de 9 UCI españolas. Fueron identificados BMR en 283 (12,6%). Ciento noventa y tres (68,2%) presentaban algún FR (OR: 4,6; IC 95%: 3,5-6,0). Todos los FR del programa RZ alcanzaron significación estadística (sensibilidad: 66%; especificidad: 79%), siendo el antecedente de BMR el factor con más peso. Inmunodepresión, tratamiento antibiótico al ingreso y sexo masculino son FR adicionales para BMR. Se aislaron BMR en 87 (31,8%) sin FR.
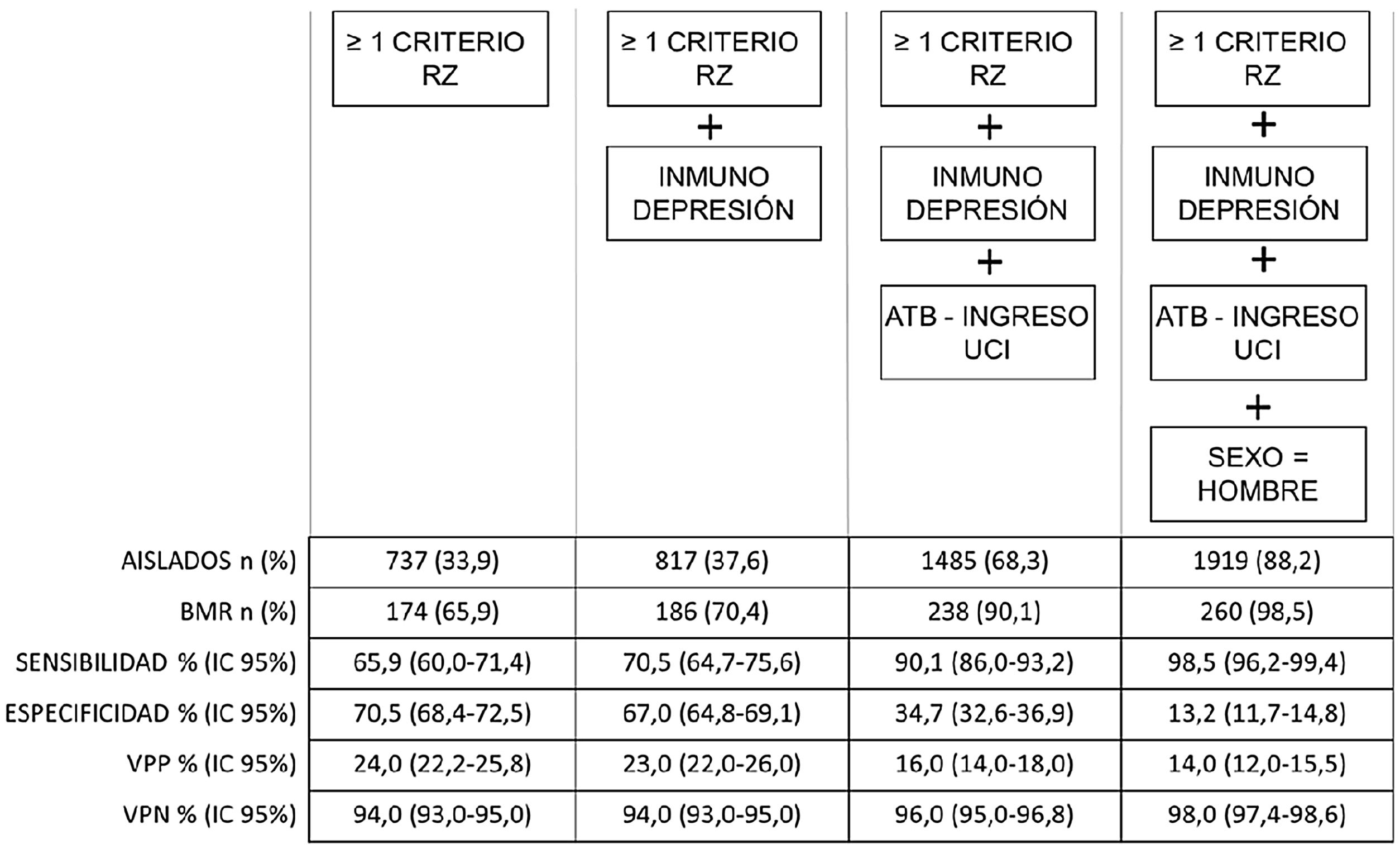
ConclusionesLa presencia de al menos un FR aumenta el riesgo de ser portador de BMR, siendo el más importante el antecedente de colonización/infección por BMR. Casi el 32% de las BMR se encuentran en pacientes sin FR. Inmunodepresión, tratamiento antibiótico al ingreso y sexo masculino podrían ser añadidos al algoritmo de FR para decidir el aislamiento preventivo.
To verify the validity of a check list of risk factors (RF) proposed by the Spanish “Resistencia Zero” project (RZ) in the detection of multi-resistant bacteria (MRB), as well as to identify other possible RF for colonization and infection by MRB at intensive care (ICU) admission.
DesignA prospective cohort study, conducted in 2016.
SettingMulticenter study, patients who needed admission to adult critical care units that applied the RZ protocol and accepted the invitation for the study.
Patients or participantsConsecutive sample of patients admitted to ICU, who underwent surveillance (nasal, pharyngeal, axillary, and rectal) or clinical cultures.
InterventionsAnalysis of the RF of RZ project, in addition to other comorbidities, included in the ENVIN registry. A univariate and multivariate study was conducted, with binary logistic regression methodology (significance with P<.05). Sensitivity and specificity analyses were performed for each of the selected factors.
Main variables of interestCarrier of BMR at ICU admission, RF (previous MRB colonization/infection, hospital admission in the previous 3 months, antibiotic use in the past month, institutionalization, dialysis, and other chronic conditions) and comorbidities.
ResultsTwo thousand two hundred and seventy patients were included from 9 Spanish ICUs. We identified BMR in 288 (12.6% of total patients admitted). One hundred and ninety-three (68.2%) had some RF (OD 4.6 -95% CI 3.5-6.0). All 6 RF from check list achieved statistical significance in the univariate analysis (sensitivity 66%, specificity 79%). Immunosuppression, antibiotic use at ICU admission and male gender were additional RF for BMR. BMR were isolated in 87 patients (31.8%) without RF.
ConclusionsPatients with at least one RF had an increased risk of being a carrier of BMR. However, almost 32% of BMR were isolated in patients without RF. Other comorbidities such as immunosuppression, antibiotic use at ICU admission and male gender could be considered as additional RF.
La emergencia de bacterias multirresistentes (BMR) es un fenómeno biológico natural y creciente a escala mundial, amplificado por la utilización amplia e inadecuada de antibióticos1. Incrementa los costes de la atención sanitaria, los fracasos del tratamiento y la mortalidad, tanto en hospitales como en la comunidad2,3.
Los pacientes ingresados en las unidades de cuidados intensivos (UCI) son especialmente susceptibles de adquirir BMR, bien como colonización o infección. En el caso de las infecciones por BMR, las opciones terapéuticas son limitadas, incrementando la probabilidad de un tratamiento empírico inadecuado y el retraso de la terapéutica apropiada, agravando la enfermedad, prolongando la estancia en la UCI, así como los costes y la morbimortalidad4,5. La mortalidad de los pacientes con infecciones por BMR es superior a la producida por bacterias sensibles a los antibióticos habitualmente empleados4–6. Incluso en los casos de colonización sin infección concomitante se ha demostrado un riesgo mayor de muerte y aumento en los tiempos de hospitalización y costes2,7.
En España, la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) ha liderado la implementación de los proyectos «Tolerancia Zero», patrocinados por el Ministerio de Sanidad, con el objetivo de incrementar la seguridad de los pacientes críticos y disminuir las infecciones relacionadas a dispositivos2, con resultados exitosos. En el año 2014 se inició el proyecto Resistencia Zero (RZ), con el objetivo de reducir la aparición de BMR durante la estancia en la UCI8. Entre las recomendaciones propuestas, se contempla la identificación precoz de los portadores de BMR al ingreso en la UCI y la instauración de medidas de aislamiento preventivo en aquellos pacientes con factores de riesgo (FR) de ser portadores de BMR.
Los objetivos de este trabajo son conocer el rendimiento de los criterios de aislamiento preventivo propuestos por el proyecto RZ, utilizados como FR para la condición de portador de BMR de los pacientes críticos al ingreso en la UCI, e identificar los factores que, añadidos a dichos criterios, pudieran mejorar su rendimiento.
Pacientes y métodosDiseñoEstudio prospectivo, observacional y multicéntrico.
ÁmbitoEl estudio se concibió dentro del Grupo de Trabajo de Infecciones y Sepsis (GTEIS) de la SEMICYUC. Se envió una invitación a todas las unidades de críticos en España a través de medios de difusión de la misma sociedad. Finalmente, 9 UCI españolas que participaron en el proyecto RZ de enero a diciembre de 2016 aceptaron la invitación de participar en el estudio.
PacientesSe incluyeron los ingresados en la UCI a los que se les realizaron en las primeras 48h cultivos de frotis de diferentes mucosas para la búsqueda activa de BMR (nasal, faríngeo, axilar, rectal) según recomendaciones del proyecto RZ y el protocolo de cada hospital, además de cultivos diagnósticos de muestras clínicas según criterio médico. Se excluyeron los pacientes menores de 15 años y aquellos a los que no se realizó la toma de cultivos.
MétodoEl cumplimiento del proyecto RZ incluye rellenar una lista de verificación en la que se recogen FR asociados a BMR: ingreso hospitalario de más de 5 días en los 3 meses previos; pacientes institucionalizados; antecedente de portador de BMR; antibioterapia durante más de 7 días en el mes previo al ingreso; pacientes sometidos a hemodiálisis o diálisis peritoneal; enfermedad crónica con alta incidencia de colonización/infección por BMR (fibrosis quística, bronquiectasias, úlceras crónicas, etc.). A los pacientes que cumplen con algún criterio se les aplican medidas de aislamiento preventivo de contacto, que incluyen higiene de manos obligatoria según protocolo universal y uso de bata y guantes de un solo uso. Según los resultados microbiológicos, se decide mantener o retirar dichas medidas. Ninguna recogida de muestra adicional a las ya empleadas habitualmente en las UCI participantes fue necesaria para la realización del estudio. Se analizaron variables demográficas (edad, sexo, Acute Physiology And Chronic Health Evaluation [APACHE II], como score de gravedad al ingreso en las UCI), estancia y mortalidad, y otras variables patológicas y comorbilidades incluidas en el registro ENVIN-HELICS (disponible en http://hws.vhebron.net/envin-helics/)9 (diabetes mellitus [DM], insuficiencia renal aguda o crónica [IRAC], inmunodepresión, neoplasia previa, cirrosis hepática, enfermedad pulmonar obstructiva crónica [EPOC], desnutrición y trasplante de órgano sólido). Se incluyó la procedencia (comunidad, residencia u otra institución, planta de hospitalización u otra UCI) y el motivo de ingreso (paciente médico, quirúrgico programado, quirúrgico urgente, traumatológico o coronario), y si se indicó tratamiento antibiótico (ATB) al ingreso en la UCI. La información se recogió inicialmente en un cuaderno de recogida de datos en formato papel, que luego se transcribió a un cuaderno digital en formato Access®. Los pacientes y/o familiares recibieron información sobre los procedimientos microbiológicos y sobre la política de aislamiento preventivo. Se obtuvo la aprobación por el comité de ética de Hospital del Mar, Hospital 12 de Octubre y Burgos para el registro ENVIN.
DefinicionesSe consideró un paciente como portador de BMR al ingreso cuando uno de los cultivos de vigilancia y/o las muestras clínicas (hemocultivos, urinocultivo, cultivos de esputo, aspirado traqueal o broncoalveolar, frotis de herida quirúrgica u otro), tomadas en las primeras 48h de ingreso en la UCI resultaron positivos para una BMR. Los BMR incluidas fueron: Staphylococcus aureus resistente a metilicina (SARM); Enterococcus spp resistente a vancomicina (ERV); enterobacterias productoras de betalactamasa de espectro extendido (BLEE) y carbapenemasas; Pseudomonas aeruginosa resistente a ≥3 familias de antibióticos habitualmente sensibles; Acinetobacter baumannii resistente a carbapenémicos. Las BMR no incluidas en ese listado (Enterobacterlaes gram-negativas resistentes a 3 o más familias de antibióticos o productoras de otros mecanismos de resistencia como las AmpC) se clasificaron como «otras».
Análisis estadísticoLas variables se describieron como mediana (intervalo intercuartil) o como porcentaje según tipo de variable. La comparación entre grupos se realizó con los test de Mann-Whitney o Chi-cuadrado según el tipo de variable (significación estadística con p<0,05). El análisis se realiza en 2 fases: una primera que incluye a todos los hospitales con datos sobre criterios de aislamiento RZ, y una segunda fase de estudio de factores de riesgo que excluye a 2 hospitales que no recogieron esos datos. Se realizaron 2 modelos de regresión logística binaria multivariante con variable resultado la positividad de BMR. En el primer modelo, ajustado por edad y sexo, se incluyeron los factores definidos por el programa RZ10. En el segundo modelo se incluyeron las variables que alcanzaron significación en el análisis bivariado añadidas a las de criterio de aislamiento RZ (≥1 criterio), con un sistema de selección de variables por pasos. Se realizó análisis de sensibilidad del segundo modelo obteniendo valores de sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) con intervalos de confianza del 95% (IC 95%). Los cálculos fueron realizados con el paquete estadístico SPSS® (v.23).
ResultadosEn este estudio participaron 9 UCI españolas de 6 comunidades autonómicas: Aragón, Castilla y León, Cataluña, Galicia, Madrid y País Vasco.
Se incluyeron 2.252 registros. De las 9 UCI participantes, solo en 7 de ellas se tomaron muestras de vigilancia de todos los pacientes a su ingreso en la UCI, mientras que en las otras 2 se tomaron únicamente de los que tenían FR de ser portadores de BMR según la lista de verificación RZ. Por ese motivo, el estudio se dividió en 2 fases: una primera que incluyó a los 9 hospitales con datos de pacientes con criterios de aislamiento y las BMR encontradas, y una segunda fase con datos de los 7 hospitales que recogieron también los pacientes sin criterios de aislamiento RZ, utilizados para realizar el estudio de factores de riesgo.
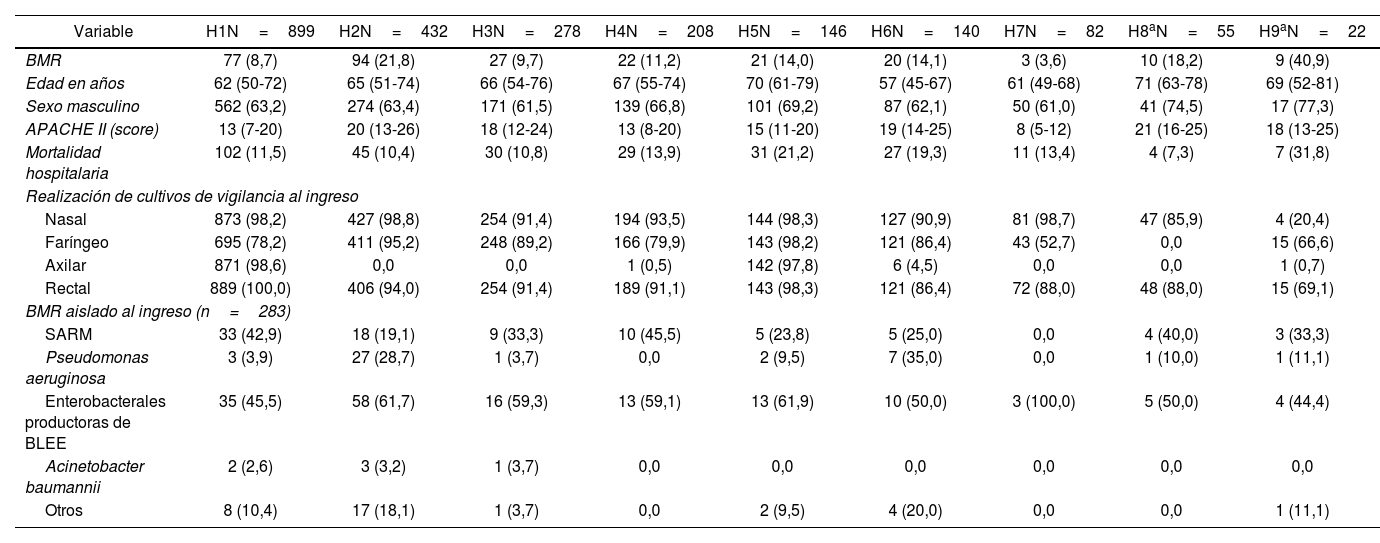
Fase 1. Diferencias según hospitales y bacterias multirresistentesUn total de 2252 pacientes se incluyeron en esta fase. En la tabla 1 se analizan las características demográficas de los pacientes, nivel de gravedad, muestras de vigilancia realizadas y BMR identificadas para cada una de las UCI participantes. Se objetivan diferencias en el porcentaje de BMR (con un rango del 3,6 al 21,8%), en la utilización de cultivos de vigilancia (muchos hospitales no realizan cultivo axilar y en uno de ellos solo cultivos rectales) y en las BMR identificadas.
Características diferenciales entre los 9 hospitales incluidos en el estudio (n=2.252)
| Variable | H1N=899 | H2N=432 | H3N=278 | H4N=208 | H5N=146 | H6N=140 | H7N=82 | H8aN=55 | H9aN=22 |
|---|---|---|---|---|---|---|---|---|---|
| BMR | 77 (8,7) | 94 (21,8) | 27 (9,7) | 22 (11,2) | 21 (14,0) | 20 (14,1) | 3 (3,6) | 10 (18,2) | 9 (40,9) |
| Edad en años | 62 (50-72) | 65 (51-74) | 66 (54-76) | 67 (55-74) | 70 (61-79) | 57 (45-67) | 61 (49-68) | 71 (63-78) | 69 (52-81) |
| Sexo masculino | 562 (63,2) | 274 (63,4) | 171 (61,5) | 139 (66,8) | 101 (69,2) | 87 (62,1) | 50 (61,0) | 41 (74,5) | 17 (77,3) |
| APACHE II (score) | 13 (7-20) | 20 (13-26) | 18 (12-24) | 13 (8-20) | 15 (11-20) | 19 (14-25) | 8 (5-12) | 21 (16-25) | 18 (13-25) |
| Mortalidad hospitalaria | 102 (11,5) | 45 (10,4) | 30 (10,8) | 29 (13,9) | 31 (21,2) | 27 (19,3) | 11 (13,4) | 4 (7,3) | 7 (31,8) |
| Realización de cultivos de vigilancia al ingreso | |||||||||
| Nasal | 873 (98,2) | 427 (98,8) | 254 (91,4) | 194 (93,5) | 144 (98,3) | 127 (90,9) | 81 (98,7) | 47 (85,9) | 4 (20,4) |
| Faríngeo | 695 (78,2) | 411 (95,2) | 248 (89,2) | 166 (79,9) | 143 (98,2) | 121 (86,4) | 43 (52,7) | 0,0 | 15 (66,6) |
| Axilar | 871 (98,6) | 0,0 | 0,0 | 1 (0,5) | 142 (97,8) | 6 (4,5) | 0,0 | 0,0 | 1 (0,7) |
| Rectal | 889 (100,0) | 406 (94,0) | 254 (91,4) | 189 (91,1) | 143 (98,3) | 121 (86,4) | 72 (88,0) | 48 (88,0) | 15 (69,1) |
| BMR aislado al ingreso (n=283) | |||||||||
| SARM | 33 (42,9) | 18 (19,1) | 9 (33,3) | 10 (45,5) | 5 (23,8) | 5 (25,0) | 0,0 | 4 (40,0) | 3 (33,3) |
| Pseudomonas aeruginosa | 3 (3,9) | 27 (28,7) | 1 (3,7) | 0,0 | 2 (9,5) | 7 (35,0) | 0,0 | 1 (10,0) | 1 (11,1) |
| Enterobacterales productoras de BLEE | 35 (45,5) | 58 (61,7) | 16 (59,3) | 13 (59,1) | 13 (61,9) | 10 (50,0) | 3 (100,0) | 5 (50,0) | 4 (44,4) |
| Acinetobacter baumannii | 2 (2,6) | 3 (3,2) | 1 (3,7) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Otros | 8 (10,4) | 17 (18,1) | 1 (3,7) | 0,0 | 2 (9,5) | 4 (20,0) | 0,0 | 0,0 | 1 (11,1) |
Valores expresados como n (porcentaje) o mediana (rango intercuartil).
BLEE: betalactamasa de espectro extendido; BMR: bacteria multirresistente; SARM: Staphylococcus aureus resistente a meticilina.
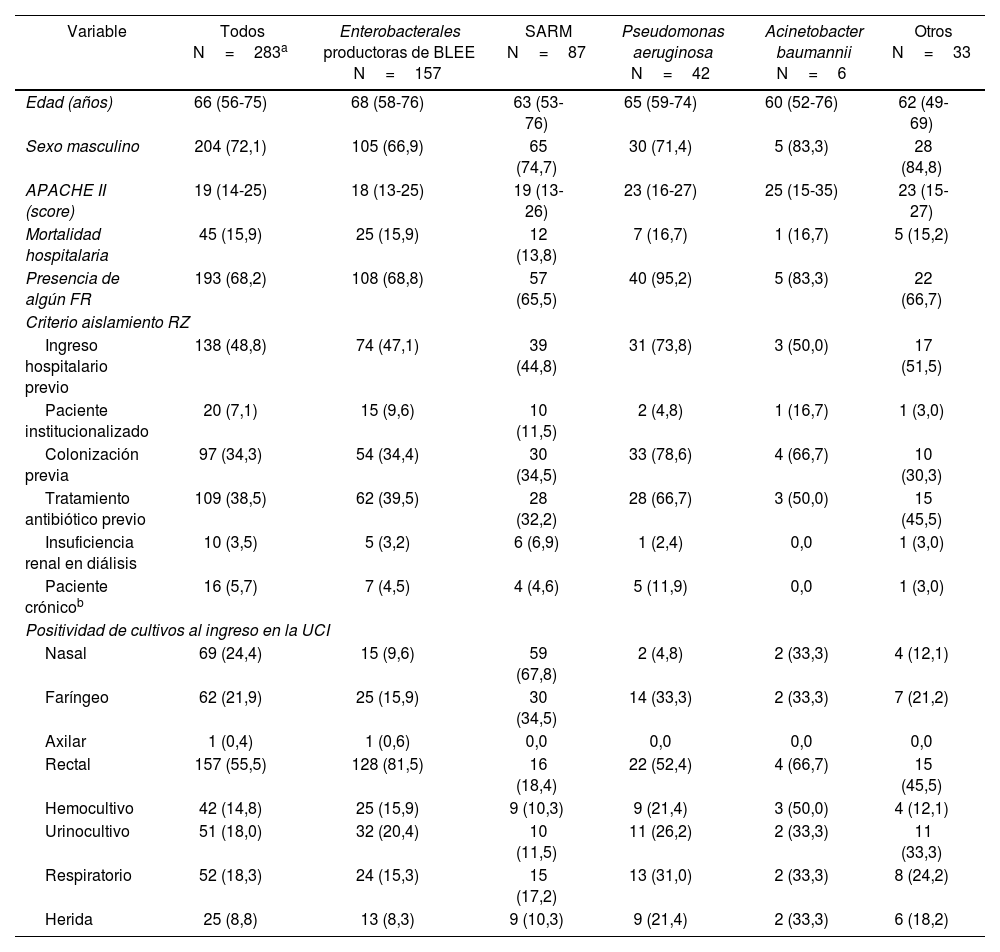
Se identificaron una o más BMR en 283 pacientes (12,6% del total de ingresos), de los cuales 193 (68,2%) presentaban uno o más FR según la lista de verificación RZ. En la tabla 2 se incluyen las características de esos pacientes con BMR diferenciadas según germen. Se observan diferencias en la presencia de criterios de aislamiento RZ, siendo P. aeruginosa la BMR que presenta más FR. Se objetiva la variabilidad en la utilización y en la rentabilidad de los cultivos en la detección de las distintas BMR, predominando el cultivo nasal en SARM y el rectal en BLEEs y Acinetobacter spp.
Características diferenciales según bacteria multirresistente aislada (n=283)
| Variable | Todos N=283a | Enterobacterales productoras de BLEE N=157 | SARM N=87 | Pseudomonas aeruginosa N=42 | Acinetobacter baumannii N=6 | Otros N=33 |
|---|---|---|---|---|---|---|
| Edad (años) | 66 (56-75) | 68 (58-76) | 63 (53-76) | 65 (59-74) | 60 (52-76) | 62 (49-69) |
| Sexo masculino | 204 (72,1) | 105 (66,9) | 65 (74,7) | 30 (71,4) | 5 (83,3) | 28 (84,8) |
| APACHE II (score) | 19 (14-25) | 18 (13-25) | 19 (13-26) | 23 (16-27) | 25 (15-35) | 23 (15-27) |
| Mortalidad hospitalaria | 45 (15,9) | 25 (15,9) | 12 (13,8) | 7 (16,7) | 1 (16,7) | 5 (15,2) |
| Presencia de algún FR | 193 (68,2) | 108 (68,8) | 57 (65,5) | 40 (95,2) | 5 (83,3) | 22 (66,7) |
| Criterio aislamiento RZ | ||||||
| Ingreso hospitalario previo | 138 (48,8) | 74 (47,1) | 39 (44,8) | 31 (73,8) | 3 (50,0) | 17 (51,5) |
| Paciente institucionalizado | 20 (7,1) | 15 (9,6) | 10 (11,5) | 2 (4,8) | 1 (16,7) | 1 (3,0) |
| Colonización previa | 97 (34,3) | 54 (34,4) | 30 (34,5) | 33 (78,6) | 4 (66,7) | 10 (30,3) |
| Tratamiento antibiótico previo | 109 (38,5) | 62 (39,5) | 28 (32,2) | 28 (66,7) | 3 (50,0) | 15 (45,5) |
| Insuficiencia renal en diálisis | 10 (3,5) | 5 (3,2) | 6 (6,9) | 1 (2,4) | 0,0 | 1 (3,0) |
| Paciente crónicob | 16 (5,7) | 7 (4,5) | 4 (4,6) | 5 (11,9) | 0,0 | 1 (3,0) |
| Positividad de cultivos al ingreso en la UCI | ||||||
| Nasal | 69 (24,4) | 15 (9,6) | 59 (67,8) | 2 (4,8) | 2 (33,3) | 4 (12,1) |
| Faríngeo | 62 (21,9) | 25 (15,9) | 30 (34,5) | 14 (33,3) | 2 (33,3) | 7 (21,2) |
| Axilar | 1 (0,4) | 1 (0,6) | 0,0 | 0,0 | 0,0 | 0,0 |
| Rectal | 157 (55,5) | 128 (81,5) | 16 (18,4) | 22 (52,4) | 4 (66,7) | 15 (45,5) |
| Hemocultivo | 42 (14,8) | 25 (15,9) | 9 (10,3) | 9 (21,4) | 3 (50,0) | 4 (12,1) |
| Urinocultivo | 51 (18,0) | 32 (20,4) | 10 (11,5) | 11 (26,2) | 2 (33,3) | 11 (33,3) |
| Respiratorio | 52 (18,3) | 24 (15,3) | 15 (17,2) | 13 (31,0) | 2 (33,3) | 8 (24,2) |
| Herida | 25 (8,8) | 13 (8,3) | 9 (10,3) | 9 (21,4) | 2 (33,3) | 6 (18,2) |
Valores expresados como n (porcentajes) o mediana (rango intercuartil).
BLEE: betalactamasa de espectro extendido; FR: factor de riesgo; RZ: Resistencia Zero; SARM: Staphylococcus aureus resistente a meticilina.
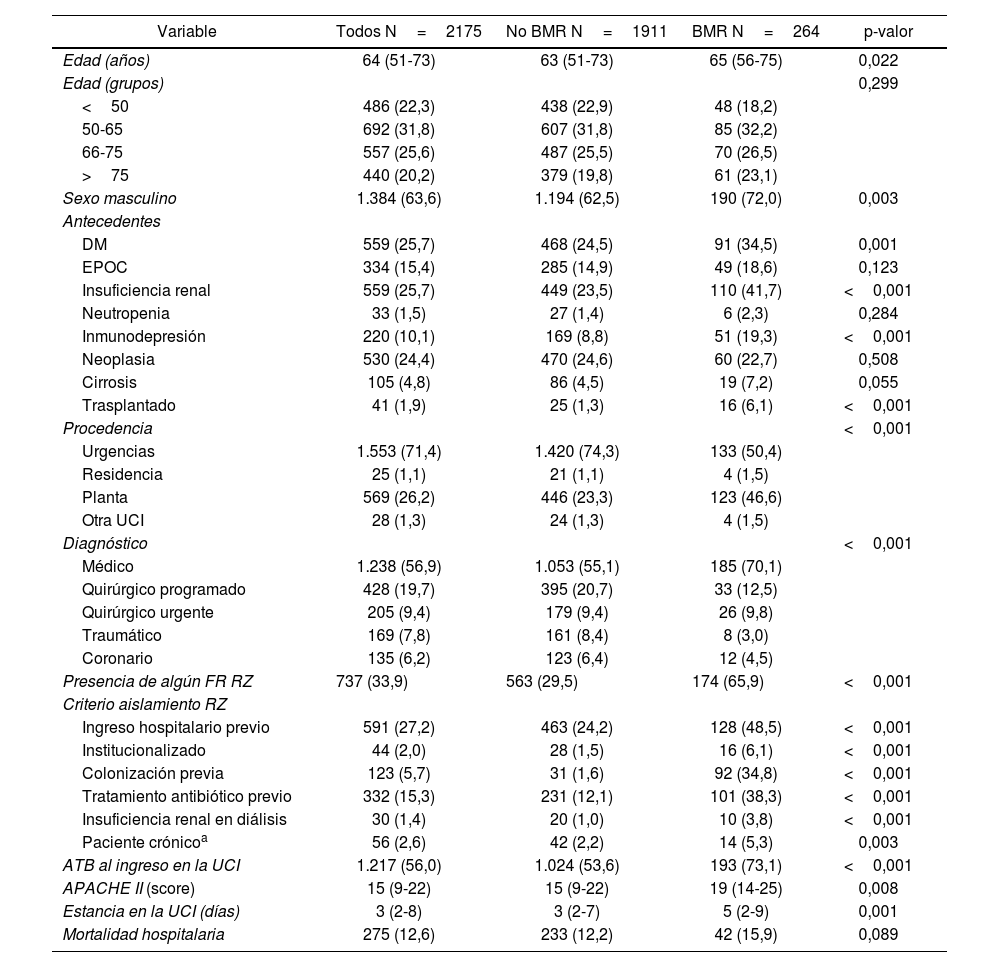
En esta fase se incluyeron 2.175 pacientes de 7 hospitales con 264 aislamientos de BMR en los cultivos realizados. En la tabla 3 se muestran sus características demográficas, comorbilidades, gravedad, procedencia, criterios de aislamiento y evolución del grupo total y diferenciando según la presencia de BMR.
Características demográficas de pacientes ingresados en las UCI (n=2.175). Según detección de portador de BMR
| Variable | Todos N=2175 | No BMR N=1911 | BMR N=264 | p-valor |
|---|---|---|---|---|
| Edad (años) | 64 (51-73) | 63 (51-73) | 65 (56-75) | 0,022 |
| Edad (grupos) | 0,299 | |||
| <50 | 486 (22,3) | 438 (22,9) | 48 (18,2) | |
| 50-65 | 692 (31,8) | 607 (31,8) | 85 (32,2) | |
| 66-75 | 557 (25,6) | 487 (25,5) | 70 (26,5) | |
| >75 | 440 (20,2) | 379 (19,8) | 61 (23,1) | |
| Sexo masculino | 1.384 (63,6) | 1.194 (62,5) | 190 (72,0) | 0,003 |
| Antecedentes | ||||
| DM | 559 (25,7) | 468 (24,5) | 91 (34,5) | 0,001 |
| EPOC | 334 (15,4) | 285 (14,9) | 49 (18,6) | 0,123 |
| Insuficiencia renal | 559 (25,7) | 449 (23,5) | 110 (41,7) | <0,001 |
| Neutropenia | 33 (1,5) | 27 (1,4) | 6 (2,3) | 0,284 |
| Inmunodepresión | 220 (10,1) | 169 (8,8) | 51 (19,3) | <0,001 |
| Neoplasia | 530 (24,4) | 470 (24,6) | 60 (22,7) | 0,508 |
| Cirrosis | 105 (4,8) | 86 (4,5) | 19 (7,2) | 0,055 |
| Trasplantado | 41 (1,9) | 25 (1,3) | 16 (6,1) | <0,001 |
| Procedencia | <0,001 | |||
| Urgencias | 1.553 (71,4) | 1.420 (74,3) | 133 (50,4) | |
| Residencia | 25 (1,1) | 21 (1,1) | 4 (1,5) | |
| Planta | 569 (26,2) | 446 (23,3) | 123 (46,6) | |
| Otra UCI | 28 (1,3) | 24 (1,3) | 4 (1,5) | |
| Diagnóstico | <0,001 | |||
| Médico | 1.238 (56,9) | 1.053 (55,1) | 185 (70,1) | |
| Quirúrgico programado | 428 (19,7) | 395 (20,7) | 33 (12,5) | |
| Quirúrgico urgente | 205 (9,4) | 179 (9,4) | 26 (9,8) | |
| Traumático | 169 (7,8) | 161 (8,4) | 8 (3,0) | |
| Coronario | 135 (6,2) | 123 (6,4) | 12 (4,5) | |
| Presencia de algún FR RZ | 737 (33,9) | 563 (29,5) | 174 (65,9) | <0,001 |
| Criterio aislamiento RZ | ||||
| Ingreso hospitalario previo | 591 (27,2) | 463 (24,2) | 128 (48,5) | <0,001 |
| Institucionalizado | 44 (2,0) | 28 (1,5) | 16 (6,1) | <0,001 |
| Colonización previa | 123 (5,7) | 31 (1,6) | 92 (34,8) | <0,001 |
| Tratamiento antibiótico previo | 332 (15,3) | 231 (12,1) | 101 (38,3) | <0,001 |
| Insuficiencia renal en diálisis | 30 (1,4) | 20 (1,0) | 10 (3,8) | <0,001 |
| Paciente crónicoa | 56 (2,6) | 42 (2,2) | 14 (5,3) | 0,003 |
| ATB al ingreso en la UCI | 1.217 (56,0) | 1.024 (53,6) | 193 (73,1) | <0,001 |
| APACHE II (score) | 15 (9-22) | 15 (9-22) | 19 (14-25) | 0,008 |
| Estancia en la UCI (días) | 3 (2-8) | 3 (2-7) | 5 (2-9) | 0,001 |
| Mortalidad hospitalaria | 275 (12,6) | 233 (12,2) | 42 (15,9) | 0,089 |
Valores expresados como n (porcentaje) o mediana (rango intercuartil).
ATB: antibiótico; BMR: bacteria multirresistente; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; FR: factor de riesgo; RZ: Resistencia Zero.
El porcentaje de BMR es del 6,4% en la población sin FR del proyecto RZ (1.438 pacientes), elevándose al 21,6% cuando sí los presentan. Setecientos treinta y siete pacientes presentaban FR del proyecto RZ (33,9% del total de ingresos), y de estos en 174 se aisló una BMR (sensibilidad del 65,9% y especificidad del 79,5%). Se objetivó que el aumento progresivo del número de criterios RZ se acompaña de un mayor porcentaje de detección de BMR: 16% en los que presentaban 1 FR (407 pacientes); 20% con 2 FR (240 pacientes); 64% con 3 FR (75 pacientes); 81,8% con 4 FR (11 pacientes) y el 100% de pacientes con 5 FR (4 pacientes) según la lista de verificación RZ.
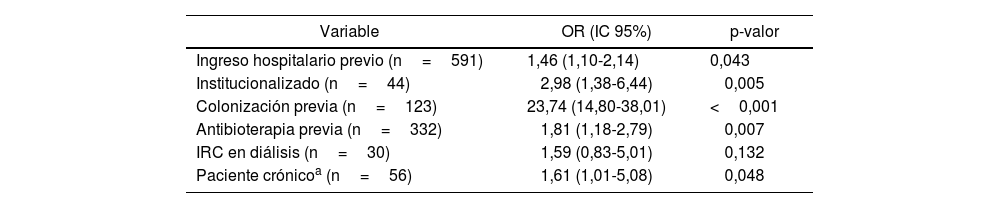
Al analizar los criterios de aislamiento RZ (tabla 4) se obtiene que el criterio de «colonización previa» es el que alcanza mayor valor de odds ratio (OR). El criterio de «insuficiencia renal» es el único que no alcanza significación estadística en el análisis multivariable, pero sí en el univariable.
Estudio de regresión logística multivariante de los distintos factores de aislamiento preventivo incluidos en el proyecto RZ
| Variable | OR (IC 95%) | p-valor |
|---|---|---|
| Ingreso hospitalario previo (n=591) | 1,46 (1,10-2,14) | 0,043 |
| Institucionalizado (n=44) | 2,98 (1,38-6,44) | 0,005 |
| Colonización previa (n=123) | 23,74 (14,80-38,01) | <0,001 |
| Antibioterapia previa (n=332) | 1,81 (1,18-2,79) | 0,007 |
| IRC en diálisis (n=30) | 1,59 (0,83-5,01) | 0,132 |
| Paciente crónicoa (n=56) | 1,61 (1,01-5,08) | 0,048 |
Modelo ajustado por edad y sexo.
IC 95%: intervalo de confianza del 95%; IRC: insuficiencia renal crónica; OR: odds ratio.
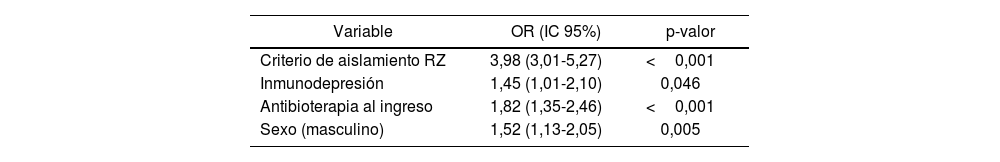
En el estudio para buscar nuevos FR (tabla 5), se observa que 3 factores alcanzan significación estadística en el análisis multivariable y se añaden al criterio de aislamiento RZ: inmunodepresión (10,1%), indicación de tratamiento antibiótico al ingreso en las UCI (56,0%) y sexo masculino (63,6%).
Modelo de regresión logística multivariante de factores que influyen en la presencia de BMR
| Variable | OR (IC 95%) | p-valor |
|---|---|---|
| Criterio de aislamiento RZ | 3,98 (3,01-5,27) | <0,001 |
| Inmunodepresión | 1,45 (1,01-2,10) | 0,046 |
| Antibioterapia al ingreso | 1,82 (1,35-2,46) | <0,001 |
| Sexo (masculino) | 1,52 (1,13-2,05) | 0,005 |
BMR: bacteria multirresistente; IC 95%: intervalo de confianza del 95%; OR: odds ratio; RZ: Resistencia Zero.
El análisis de pacientes con indicación de tratamiento antibiótico al ingreso en las UCI mostró que eran diferentes en el diagnóstico (mayor presencia de problemas médicos con 72,5 vs. 37,2% de quirúrgicos, coronarios o traumáticos, p<0,001), mayor presencia de criterios RZ (40,8 vs. 25,1%; p<0,001), más graves con puntuación de APACHE II (19 [13-25] vs. 11 [6-17]; p<0,001) y con mayor mortalidad hospitalaria (17,3 vs. 6,7%; p<0,001).
Los pacientes varones presentaban más antecedentes de EPOC (19,2 vs. 8,6%; p<0,001) y de cirrosis (5,7 vs. 3,3%; p=0,011), y diferente diagnóstico con menor porcentaje de ingresos programados (17,8 vs. 23,0%; p<0,001) y más traumáticos (6,9 vs. 4,9%; p=0,04).
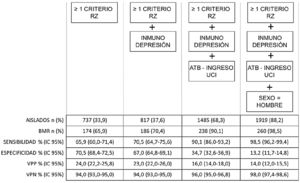
En la figura 1 se muestra que la inclusión progresiva de los FR encontrados consigue aumentar la sensibilidad en la detección de BMR. Analizando el rendimiento, se observa que para este aumento de la sensibilidad se debe aumentar el porcentaje de aislamientos preventivos (por ejemplo, para conseguir una sensibilidad del 90% debemos aislar al 68,3% de los pacientes al ingreso).
DiscusiónUno de los principales hallazgos de este trabajo es documentar que un 12% de pacientes críticos son portadores de BMR al ingreso en las UCI, similar al reportado en el informe anual del ECDC3. Este porcentaje se eleva hasta el 21,6% cuando existe la presencia de uno de los factores de riesgo incluidos en proyecto RZ. En España, Abella et al.10 observaron cifras similares de pacientes con criterios de aislamiento RZ (en torno a un 30%) con la presencia de BMR alrededor del 14% del total de pacientes ingresados en las UCI, y un 7% en los pacientes sin FR.
En nuestra serie, aunque la mortalidad es superior en el grupo con BMR, un 16% frente a un 12%, no alcanza significación estadística.
El screening de BMR al ingreso en las UCI es una de las recomendaciones del paquete de recomendaciones propuesto por el proyecto RZ. El estudio deja en evidencia que no todas las UCI que participan en RZ realizan cultivos de vigilancia a todos los pacientes al ingreso, algunas toman muestras de rutina solo a los que presentan los FR de la lista de verificación. En la literatura11 está descrito su escaso beneficio cuando la prevalencia de BMR es baja (<5%), aunque sí es útil como herramienta de control de trasmisión nosocomial cuando la prevalencia es más alta. También se observa variabilidad en los cultivos realizados en los distintos hospitales participantes. Un estudio reciente12 reportó que, cuando hay una incidencia aproximada del 4,5%, más de un tercio de los casos de SAMR se identifica en muestras de cultivos distintos al frotis nasal, mientras otros autores reportan que el frotis faríngeo aumenta la detección de BMR hasta en un 10%13.
En nuestro estudio, con una muestra de más de 2.000 pacientes, los criterios clínicos incluidos en la lista de verificación RZ como FR de ser portadores de BMR han demostrado ser útiles (solo la insuficiencia renal no alcanzó significación estadística por el número reducido de pacientes) identificando al 68% de los pacientes con BMR. El más importante, y coincidente con otras publicaciones, es el antecedente de portador de BMR10. La presencia simultánea de más de un FR incrementa la probabilidad de presentar BMR14. Menéndez et al.15 encontraron resultados similares estudiando FR de BMR en pacientes con bronquiectasias que necesitan ingreso hospitalario por exacerbación infecciosa, considerando como FR independientes la hospitalización el año previo al ingreso, la insuficiencia renal crónica y el antecedente de portador BMR.
Sin embargo, la estrategia seguida en el proyecto RZ tiene debilidades ya que las BMR aparecen en hasta el 31,8% de pacientes sin los FR incluidos en la lista de verificación y el 31,5% de los pacientes se aíslan de manera innecesaria, sin evidenciarse la presencia de BMR. Los FR del proyecto RZ por sí solos tienen una sensibilidad del 66% y una especificidad cercana al 80% que podría ser mejorable. Callejo-Torre et al.16 proponen la creación de una herramienta diagnóstica que utilice de manera combinada los FR con test rápidos de laboratorio, como la PCR en tiempo real, que es relativamente fácil de utilizar y coste-efectiva. Otros autores17 desde hace años abogan por el uso de algoritmos clínicos, que incluyen test diagnósticos rápidos y con elevado valor predictivo negativo, aunque todavía hoy no se ha conseguido un modelo universal en cuanto a microorganismos y geografía.
Como aportación a mejorar la predicción de BMR en pacientes críticos, en nuestro estudio se ha creado un modelo de riesgo para mejorar los criterios propuestos por el proyecto RZ añadiendo otras variables identificadas en el análisis de regresión logística multivariante: inmunodepresión, tratamiento antibiótico al ingreso en las UCI, y sexo masculino. El primer factor refuerza el concepto de paciente con enfermedad crónica al incorporar a los pacientes inmunodeprimidos, consiguiendo mejorar la sensibilidad en 5 puntos y debiendo aislar un 5% más del total de pacientes. Para conseguir mejorar la sensibilidad hasta el 90%, el factor que encontramos es la indicación de tratamiento antibiótico al ingreso en las UCI. Este factor puede explicarse por el hecho de que los pacientes que no reciben antibiótico están ingresados por causa no infecciosa (como enfermedad coronaria, intervenciones programadas y trauma), presentando menos FR y menor utilización de pruebas microbiológicas. Los que sí reciben antibióticos se caracterizan por su diagnóstico médico, ingreso urgente y mayor gravedad. La adición de este criterio exige el aislamiento, de forma preventiva, de dos tercios del total de ingresos. El último factor encontrado es el sexo masculino. Eso se podría explicar porque los varones tienen más antecedentes de EPOC y menor porcentaje de ingresos programados. Añadiendo este factor al modelo, se consigue una mejora en la sensibilidad hasta casi el 99%, pero con la exigencia de aislar casi al 90% de los pacientes que ingresan en las UCI. Otras publicaciones también han observado el sexo masculino como FR14.
Se debe seguir trabajando en buscar modelos que consigan mejorar este rendimiento e incorporar técnicas rápidas de identificación de BMR16,17. Buscar un equilibrio entre el número de aislamientos preventivos y el rendimiento de detección de BMR puede depender de la situación particular de cada UCI; unidades con mayor problema de BMR podrían beneficiarse de un aumento del número de aislamientos preventivos. También debemos señalar el problema que supone tener a un paciente aislado: dificulta su manejo y aumenta la carga asistencial18.
Nuestro estudio tiene varias limitaciones. Por una parte, siempre es deseable una mayor muestra que incluyera más aislamientos de BMR e hiciera posible un análisis específico según cada microorganismo, y queda pendiente la validación externa del modelo. No se han detectado Enterococcus spp resistentes a vancomicina, por lo que no se puede en este estudio validar los FR para ese germen. Otra limitación ha sido la no estandarización en la toma de muestras para cultivo de vigilancia; algunos centros utilizan frotis nasal y rectal, otros también incluyen el axilar, y eso depende, a pesar de las recomendaciones del proyecto RZ, de la política de cada hospital, así como de los recursos disponibles en sus laboratorios de microbiología.
Por otro lado, el punto fuerte está en que apenas hay publicaciones de estudios multicéntricos que agrupen a todos los grupos de BMR en pacientes en las UCI, siendo esta serie la más larga encontrada hasta ahora.
En resumen, en este estudio se han descrito los FR independientes para ser portador de BMR al ingreso en las UCI, corroborando parte de la lista de verificación del proyecto RZ e identificando otros potenciales. Los criterios de aislamiento basados en el programa RZ obtienen un rendimiento aceptable, pero no identifican a un tercio de las BMR. El criterio más importante es el antecedente de portador de BMR. Parece indiscutible que la acumulación de FR implica una probabilidad elevada de predecir la presencia de una BMR. Se podría mejorar ese modelo añadiendo el criterio de inmunodepresión. Para conseguir una sensibilidad del 90%, debemos incluir en el modelo el grupo de pacientes que requieren de tratamiento antibiótico al ingreso en las UCI, y eso lleva a aislar de forma preventiva a dos tercios de todos los pacientes que ingresan en las UCI. Los hospitales participantes presentan diferencias geográficas y epidemiológicas, tanto en la incidencia como en el tipo de BMR, pero también en la utilización de los medios diagnósticos. Observamos en esta serie la escasa rentabilidad de los cultivos de frotis axilar.
Basados en la evidencia disponible hasta el momento, cada UCI debería crear sus propios protocolos de aislamiento de contacto según las variables clínico-demográficas de sus pacientes al ingreso combinadas con la epidemiología local y potenciando la utilización de pruebas microbiológicas de manera eficiente y rápida.
FinanciaciónEn la realización de este trabajo no se ha contado con fondos públicos ni privados.
AutoríasConcepto y diseño del estudio realizado por Sulamita Carvalho-Brugger y Mercedes Palomar. Todos los autores han participado en la recogida de datos. Sulamita Carvalho-Brugger y Javier Trujillano ha realizado el análisis estadístico e interpretación de datos. Sulamita Carvalho-Brugger, Javier Trujillano, Francisco Álvarez Lerma y Mercedes Palomar han escrito el manuscrito. Revisión crítica del manuscrito: todos los autores han leído y revisado el manuscrito final.
Conflicto de interesesTodos los autores declaran no tener conflictos de intereses potenciales relacionados a este estudio.
AgradecimientosA Ana Ezpeleta, Cristina Climent, Manuel Solsona, Mercedes Catalán, Montserrat Ortiz, Javier Blanco, Francisco Javier González de Molina, Pedro Olaechea y Naia Más, por su participación en la recogida de datos.