En los pacientes ingresados en UCI, la administración semanal de 40.000 U de eritropoyetina humana recombinante se asocia con una reducción absoluta del 10% (23 unidades por 1.000 días) en la necesidad de transfusión de concentrados de hematíes en 28 días.
Artículo: Corwin HL, Gettinger A, Pearl RG, Fink MP, Levy MM, Shapiro MJ, et al, for the EPO Critical Care Trials Group. Efficacy of recombinant human erythropoietin in critically ill patients. A randomized controlled trial. JAMA 2002;288:2827-35.
Antecedentes: entre un 35 y un 50% de los pacientes ingresados en una UCI reciben una media de 5 concentrados de hematíes durante su estancia1. La transfusión de concentrados de hematíes supone un riesgo potencial de transmisión de enfermedades infecciosas, de reacciones alérgicas y de aloinmunización.
La anemia de los pacientes críticos se acompaña de incapacidad para aumentar de manera adecuada la concentración de eritropoyetina circulante en respuesta a estímulos fisiológicos, y de una limitación de la médula ósea morfológicamente normal para aumentar la eritropoyesis en respuesta a la eritropoyetina.
Un ensayo clínico aleatorizado realizado con 160 pacientes ingresados en diferentes UCI, demostró que la administración de eritropoyetina a dosis de 300 U/kg durante 5 días y posteriormente cada 48 h, con el fin de conseguir un hematocrito > 38%, se asoció con una disminución significativa en el número de concentrados de hematíes transfundidos (166 concentrados en el grupo de pacientes que recibieron eritropoyetina frente a 305 concentrados en el grupo de pacientes que recibieron placebo; p < 0,002)2.
Objetivo: determinar si la administración semanal de eritropoyetina recombinante humana a los pacientes ingresados en UCI es eficaz para reducir la necesidad de transfusión de concentrados de hematíes.
Diseño: ensayo clínico con asignación aleatoria.
Lugar: UCI médica, quirúrgica o medicoquirúrgica en 65 centros médicos de Estados Unidos.
Período de estudio: de diciembre de 1998 a junio de 2001.
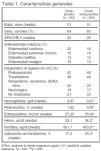
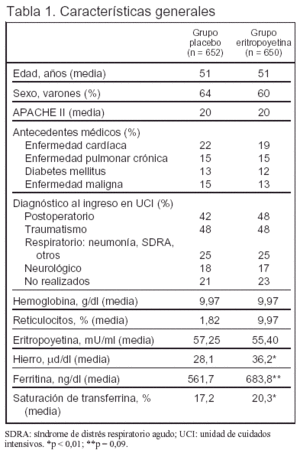
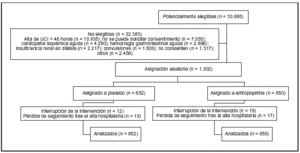
Pacientes (tabla 1 y figura 1):
Figura 1
Criterios de inclusión: 1. Edad > 18 años. 2. Estancia en UCI ≥ 3 días (el día 3 de estancia en UCI es el día 1 de estudio). 3. Hematocrito < 38%.
Criterios de exclusión: 1. Insuficiencia renal que requiere diálisis. 2. Hipertensión arterial no controlada. 3. Convulsiones de reciente comienzo o no controladas. 4. Quemados. 5. Embarazo o lactancia. 6. Enfermedad isquémica cardíaca aguda. 7. Hemorragia gastrointestinal aguda. 8. Tratamiento previo con eritropoyetina recombinante humana. 9. Participación en otro ensayo clínico. 10. Expectativa de alta de UCI en las siguientes 48 h cuando el paciente está en el segundo día de ingreso.
Intervenciones que se comparan:
Grupo eritropoyetina: administración por vía subcutánea de 40.000 unidades de eritropoyetina recombinante humana en el día 3 de estancia en UCI y una vez a la semana hasta un total de 3 dosis si el paciente permanecía ingresado en el hospital. Si el paciente permanecía ingresado en UCI en el día 21 de estudio, se administraba una cuarta dosis de eritropoyetina.
Grupo placebo: administración subcutánea de placebo con las mismas características que la eritropoyetina y con la misma frecuencia.
Los pacientes recibieron 150 mg/día de hierro por vía oral desde el primer día de estudio, salvo que no pudieran tolerar alimentación por vía oral. Los pacientes con una respuesta inadecuada a la administración oral de hierro (saturación de transferrina < 20% y ferritina sérica < 100 ng/ml) recibieron hierro por vía parenteral.
La guía recomendada para la transfusión fue: a) hemoglobina ≥ 9 g/dl o hematocrito ≥ 27%, no transfundir a menos que existiera otra indicación como sangrado activo, isquemia, etc.; b) hemoglobina < 9 g/dl o hematocrito < 27%, transfundir a discreción del médico a cargo del enfermo.
La práctica transfusional fue similar en ambos grupos. Un 21% de los pacientes en cada grupo recibió transfusión a pesar de tener una hemoglobina superior a 9 g/dl o un hematocrito superior al 27%.
Asignación aleatoria: sí. Estratificada por centro. No consta si se mantuvo oculta.
Enmascaramiento: sí.
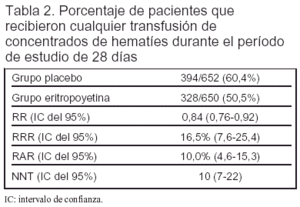
Desenlaces principales: proporción de pacientes que recibieron tranfusión de concentrados de hematíes entre el día 1 y el día 28 del estudio.
La guía recomendada para la transfusión fue: a) hemoglobina ≥ 9 g/dl o hematocrito ≥ 27%, no transfundir a menos de que exitiera otra indicación como sangrado activo, isquemia, etc.; b) hemoglobina < 9 g/dl o hematocrito < 27%, transfundir a discreción del médico a cargo del enfermo.
Análisis por intención de tratar: sí.
Resultados principales (tabla 2): la tasa de transfusión fue 98 unidades por 1.000 días en el grupo tratado con eritropoyetina y 121 en el grupo tratado con placebo (p < 0,001).
La tasa de administración de eritropoyetina fue 1.664 dosis de 40.000 unidades por 1.000 días.
La mortalidad a los 28 días fue del 14% en el grupo eritropoyetina y del 15% en el grupo placebo. Tampoco se observaron diferencias en la estancia media.
La frecuencia de efectos adversos fue del 38% en el grupo placebo y del 36% en el grupo tratado con eritropoyetina.
Información sobre costes: el coste estimado en este ensayo clínico fue 4,43 dosis de 40.000 unidades de eritropoyetina por unidad de concentrados de hematíes (1 dosis, 400 dólares).
Financiación del estudio: Ortho Biotech Products LP, fabricante de la eritropoyetina recombinante humana. La versión final del manuscrito fue revisada por el patrocinador.
Conclusiones de los autores: en los pacientes de UCI, la administración semanal de 40.000 unidades de eritropoyetina recombinante humana reduce la necesidad de transfusión de concentrados de hematíes y aumenta la hemoglobina. Son necesarios más estudios para determinar si esta reducción en la necesidad de transfusión sirve para mejorar otros desenlaces clínicos.
Conclusiones de los revisores: las conclusiones de los autores son acordes con los resultados del estudio.
Una limitación del estudio es el hecho de que un 73% de los pacientes que podrían haber sido incluidos no lo fueron porque no fue posible obtener el consentimiento en el momento adecuado. Puesto que no se dispone de información sobre las características de los pacientes no incluidos por este motivo, no se puede saber si el grupo estudiado es representativo o está sesgado.
Desde el punto de vista de la aplicabilidad clínica de los resultados, habría que tener en cuenta beneficios, costes y riesgos. Este estudio proporciona una estimación adecuada de la reducción promedio de las necesidades de transfusión en los enfermos críticos. Los riesgos relacionados con la transmisión de infecciones con las técnicas actuales se han estimado para la hepatitis C en uno por 1.935 millones de unidades y para el VIH en uno por 2.135 en los donantes repetidos y el doble en los donantes nuevos3. La eritropoyetina es un tratamiento económicamente costoso y, aunque es seguro, no está exento de riesgos4.
Es posible conseguir una reducción en la proporción de pacientes que reciben transfusión en UCI con otras prácticas que se han demostrado seguras, como disminuir el umbral para la transfusión a un valor de hemoglobina de 7 g/dl5.
Por tanto, la ausencia de beneficios clínicamente relevantes y de estudios de coste/efectividad hacen que la administración de eritropoyetina no esté actualmente indicada en la población general de enfermos críticos.
*Esta sección está financiada con la ayuda ISCIII-FIS 02/8115.