Editado por: Rosario Amaya Villar - Unidad de Cuidados Intensivos, Hospital Universitario Virgen del Rocio, Sevilla, España
Última actualización: Enero 2025
Más datosDescribir las características de los pacientes con síndrome de distrés respiratorio agudo por neumonía bilateral por COVID-19 en ventilación mecánica invasiva (VMI) y analizar el efecto del decúbito prono prolongado>24h (DPP) respecto al decúbito prono<24h (DP).
DiseñoEstudio observacional retrospectivo descriptivo. Análisis uni y bivariante.
ÁmbitoServicio de Medicina Intensiva del Hospital General Universitario de Elche.
ParticipantesPacientes con neumonía por SARS-CoV-2 (2020-2021) en VMI por síndrome de distrés respiratorio agudo moderado-severo.
IntervencionesVMI. Maniobras de DP.
Variables de interés principalesSociodemográficas; analgosedación; bloqueo neuromuscular; DP (duración), estancia y mortalidad en UCI, días de VMI; complicaciones no infecciosas; infecciones asociadas a la asistencia sanitaria.
ResultadosCincuenta y un pacientes precisaron DP y de ellos 31 (69,78%) requirieron DPP. No se encontraron diferencias en las características iniciales de los pacientes (sexo, edad, comorbilidades, gravedad inicial, o en el tratamiento antiviral y antiinflamatorio recibido). Los pacientes con DPP presentaron menor tolerancia a la ventilación en decúbito supino (61,29 vs. 89,47%, p=0,031), mayor estancia hospitalaria (41 vs. 30 días, p=0,023), más días de VMI (32 vs. 20 días, p=0,032), mayor duración del tratamiento con bloqueo neuromuscular (10,5 vs. 3 días, p=0,0002), así como un mayor porcentaje de episodios de obstrucción del tubo orotraqueal (48,39 vs. 15%, p=0,014).
ConclusionesEl DPP se asoció con mayor uso de recursos y complicaciones en pacientes con síndrome de distrés respiratorio agudo moderado-severo por COVID-19.
To describe the characteristics of patients with acute respiratory distress syndrome due to bilateral COVID-19 pneumonia on invasive mechanical ventilation (IMV) and analyze the effect of prolonged prone decubitus>24h (PPD) compared to prone decubitus<24h (PD).
DesignRetrospective observational descriptive study. Uni and bivariate analysis.
SettingDepartment of Intensive Care Medicine. General University Hospital of Elche.
ParticipantsPatients with SARS-CoV-2 pneumonia (2020–2021) in VMI for moderate-severe acute respiratory distress syndrome, ventilated in PD.
InterventionsIMV. PD maneuvers.
Main variables of interestSociodemographic; analgo-sedation; neuromuscular blockade; PD (duration), ICU stay and mortality, days of IMV; non-infectious complications; health care-associated infections.
ResultsFifty-one patients required PD and of these 31 (69.78%) required PPD. No differences were found in patient characteristics (sex, age, comorbidities, initial severity, antiviral and anti-inflammatory treatment received). Patients on PPD had lower tolerance to supine ventilation (61.29 vs. 89.47%, p=0.031), longer hospital stay (41 vs. 30 days, p=0.023), more days of IMV (32 vs. 20 days, p=0.032), longer duration of neuromuscular blockade (10.5 vs. 3 days, p=0.0002), as well as a higher percentage of episodes of orotracheal tube obstruction (48.39 vs. 15%, p=0.014).
ConclusionsPPD was associated with higher resource use and complications in patients with moderate-severe acute respiratory distress syndrome by COVID-19.
En diciembre de 2019 apareció en China una enfermedad desconocida secundaria a un nuevo virus de la familia Coronaviridae (SARS-CoV-2). En marzo de 2020, la Organización Mundial de la Salud declaró la pandemia mundial debido a su rápida progresión1. En España, hasta la fecha se han notificado 13.614.807 casos confirmados de COVID-19 y 116.108 fallecidos2. Un número importante de pacientes desarrolló síndrome de distrés respiratorio agudo (SDRA), necesitando ventilación mecánica invasiva (VMI) en una unidad de cuidados intensivos (UCI)3.
El SDRA se caracteriza por daño pulmonar inflamatorio agudo y difuso, que produce aumento de la permeabilidad vascular y del peso pulmonar, con disminución de la distensibilidad4. En pacientes con SDRA severo, la utilización temprana de la posición en decúbito prono (DP) durante al menos 16h consecutivas, asociada a ventilación protectora, ha demostrado reducir la mortalidad precoz5 debido a la mejora de la diferencia de presión transpulmonar ventral-dorsal y del cociente ventilación/perfusión, entre otros mecanismos6. Esta maniobra precisa personal experimentado y presenta riesgos, como desplazamiento de dispositivos invasivos (tubo orotraqueal [TOT], vasculares, sondas, drenajes, etc.) o inestabilidad hemodinámica5–7. Actualmente, se recomienda en pacientes con SDRA severo durante al menos 16h8,9. Durante la pandemia, el número de pacientes que requirieron VMI y DP se incrementó10, y bien por sobrecarga asistencial o por su mayor gravedad, algunos pacientes se mantuvieron en DP durante periodos más prolongados.
A diferencia del DP hasta 24h, los datos sobre el uso del DP prolongado (>24h; DPP) son limitados. Mientras que hay evidencia de que mantener DP durante menos de 24h es seguro y eficaz5, los datos sobre la eficacia y seguridad de mantener la maniobra 36-48h se basan en series descriptivas10–16. El objetivo de este trabajo es describir las características de los pacientes intubados con neumonía bilateral secundaria a COVID-19 con DPP en comparación con los pacientes en los que se mantuvo la postura de prono<24h.
Pacientes y métodosSe realizó un estudio observacional retrospectivo descriptivo de pacientes consecutivos ingresados desde el 15/03/2020 hasta el 31/12/2021 en el Servicio de Medicina Intensiva (SMI) del Hospital General Universitario de Elche, con 548 camas (2021). El SMI pasó de 12 camas a atender simultáneamente hasta 25 pacientes ubicados en diferentes espacios en el momento de pico asistencial. No todos los pacientes en VMI por neumonía por SARS-CoV-2 del departamento de salud fueron atendidos por el SMI; parte de los pacientes fueron atendidos por el Servicio de Anestesiología en función de la disponibilidad de espacios.
Se incluyeron de modo retrospectivo pacientes>18 años, con infección por SARS-CoV-2 confirmada por reacción en cadena de la polimerasa, ingresados en el SMI, en VMI por SDRA debido a neumonía bilateral por SARS-CoV-2. Se excluyeron aquellos pacientes con SARS-CoV-2 intubados por otra causa o contraindicación para el uso del DP.
El SMI no cuenta con un sistema de registro electrónico de la información, por tanto, los datos de recogieron de los registros clínicos. Se recogieron variables sociodemográficas (edad, sexo); tratamiento para la COVID-19 (inmunosupresores, antirretrovirales); comorbilidades (diabetes mellitus, hipertensión arterial, dislipidemia, enfermedad cardiovascular, etc.); escala Simplified Acute Phisiologic Score 3 al ingreso17, y uso de VMI y de maniobras de DP, considerándose DPP, además del número total de ciclos requeridos. También el intervalo entre la intubación y el primer ciclo de prono, la relación PaO2/FiO2 al inicio del primer ciclo como indicador de gravedad, el mismo valor tras la primera maniobra, el valor máximo de PEEP requerido y la tolerancia posterior a la ventilación en decúbito supino (DS), considerada como la capacidad de mantener PaO2/FiO2 en DS>150 en las siguientes 24h. La decisión de mantener en DPP no fue protocolizada, sino que dependió de la situación del paciente y las posibilidades del equipo de realizar la maniobra a tiempo y con seguridad. El resto del tratamiento, tanto médico como respecto a los protocolos adaptados de prevención de infección nosocomial y los parámetros de ventilación protectora, se realizó de acuerdo a los protocolos habituales (VT 6-8ml/kg peso ideal, P meseta≤30cmH2O), que incluyen la maniobra de DP en pacientes con relación PaO2/FiO2<150 con FiO2≥60% tras optimizar los niveles de PEEP9. Todos los pacientes fueron ventilados con sistemas de aspiración cerrados y sistemas de humidificación pasiva.
Los resultados analizados fueron: estancia hospitalaria y en UCI, días de VMI, mortalidad en UCI, uso de sedantes, analgésicos y bloqueantes neuromusculares (BNM), necesidad de medicación vasoactiva, traqueotomía, pérdida de dispositivos (catéteres, tubos, sondas, etc.), obstrucción del TOT, parada cardiorrespiratoria durante el DP, intolerancia a nutrición enteral, definida por un residuo gástrico>200ml, y desarrollo de infecciones asociadas a la asistencia sanitaria (IAAS)18. También se tuvieron en cuenta los diferentes periodos de la pandemia19.
El estudio fue aprobado por el Comité de Ética e Investigación con medicamentos del Hospital General Universitario de Elche, con código de registro PI 103/2021.
En el análisis estadístico descriptivo se calcularon las proporciones para las variables categóricas y las medianas, con percentiles 25 y 75 en el caso de variables continuas. Se compararon los resultados de los pacientes con DP respecto a los que recibieron DPP. Los contrastes de hipótesis sobre proporciones se realizaron mediante el test Ji al cuadrado. Las variables cuantitativas se contrastaron mediante pruebas no paramétricas (test de Mann-Whitney para 2 variables, test de Kruskal-Wallis en caso de 3 variables), con contrastes bilaterales, con un nivel de significación alfa del 5%. Se utilizó el software estadístico StatsDirect v 3.3.5 (StatsDirect Ltd., Wirral, Reino Unido, https://www.statsdirect.com/).
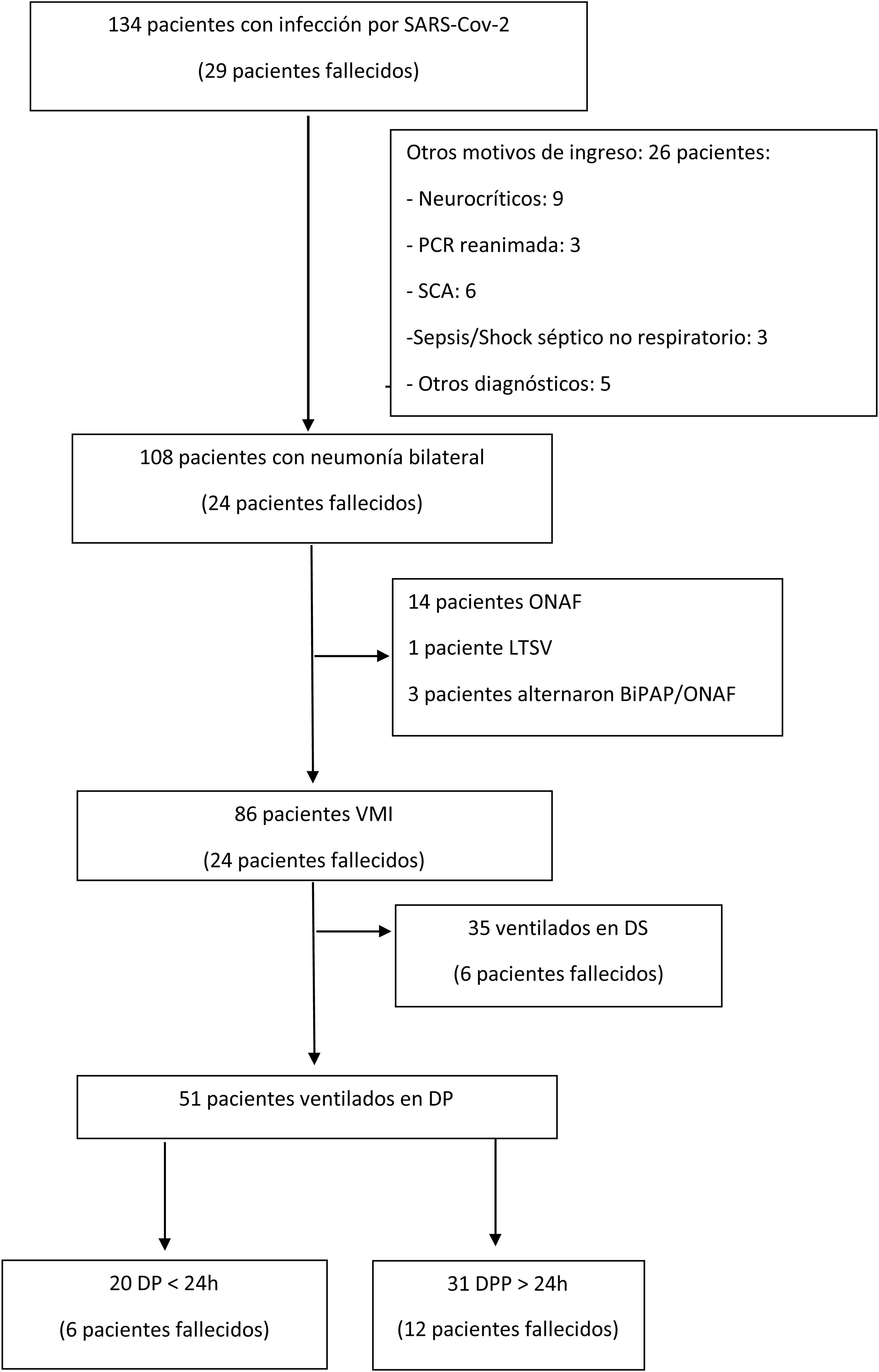
ResultadosSe analizaron 134 pacientes consecutivos atendidos en el SMI durante 2020 y 2021. El diagrama de flujo de los pacientes atendidos se resume en la figura 1. De ellos, 86 pacientes requirieron VMI. Fueron mayoritariamente varones (73,26%, 63 pacientes), con una mediana de edad de 65 años (p25-p75: 57-71 años). En total, 51 pacientes (60%) precisaron DP, todos ellos con SDRA severo, con ratio PaO2/FiO2<150mmHg. Sus características, en función de la duración del periodo en DP, se resumen en la tabla 1. La situación respiratoria inicial fue similar, con parámetros de SDRA grave (PaO2/FiO2 inicial de 103 en los pacientes con DP vs. 96 en los pacientes con DPP, p=0,885). Los pacientes con DPP recibieron más ciclos (hasta 3 ciclos, tabla 1) de modo precoz en ambos grupos. La mayoría de estas maniobras se llevaron a cabo durante la tercera ola de la pandemia (tablas 1 y 2).
Diagrama de flujo de los pacientes incluídos en el análisis. DP: decúbito prono; DPP: decúbito prono prolongado; DS: decúbito supino; LTSV: limitación de tratamientos de soporte vital; ONAF: oxigenoterapia de alto flujo; PCR: parada cardiorrespiratoria; SCA: síndrome coronario agudo; VMI: ventilación mecánica invasiva.
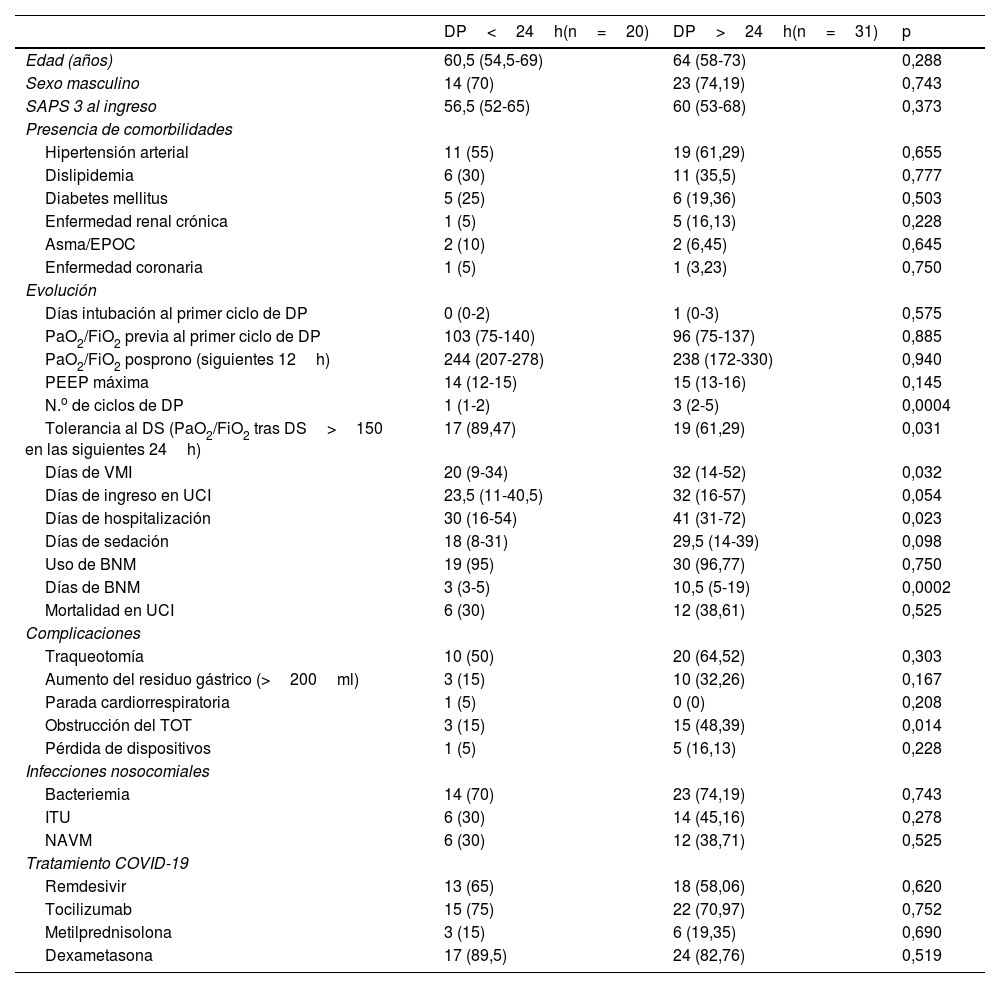
Características y desenlaces de los pacientes en ventilación mecánica invasiva con decúbito prono en función de su duración
| DP<24h(n=20) | DP>24h(n=31) | p | |
|---|---|---|---|
| Edad (años) | 60,5 (54,5-69) | 64 (58-73) | 0,288 |
| Sexo masculino | 14 (70) | 23 (74,19) | 0,743 |
| SAPS 3 al ingreso | 56,5 (52-65) | 60 (53-68) | 0,373 |
| Presencia de comorbilidades | |||
| Hipertensión arterial | 11 (55) | 19 (61,29) | 0,655 |
| Dislipidemia | 6 (30) | 11 (35,5) | 0,777 |
| Diabetes mellitus | 5 (25) | 6 (19,36) | 0,503 |
| Enfermedad renal crónica | 1 (5) | 5 (16,13) | 0,228 |
| Asma/EPOC | 2 (10) | 2 (6,45) | 0,645 |
| Enfermedad coronaria | 1 (5) | 1 (3,23) | 0,750 |
| Evolución | |||
| Días intubación al primer ciclo de DP | 0 (0-2) | 1 (0-3) | 0,575 |
| PaO2/FiO2 previa al primer ciclo de DP | 103 (75-140) | 96 (75-137) | 0,885 |
| PaO2/FiO2 posprono (siguientes 12h) | 244 (207-278) | 238 (172-330) | 0,940 |
| PEEP máxima | 14 (12-15) | 15 (13-16) | 0,145 |
| N.o de ciclos de DP | 1 (1-2) | 3 (2-5) | 0,0004 |
| Tolerancia al DS (PaO2/FiO2 tras DS>150 en las siguientes 24h) | 17 (89,47) | 19 (61,29) | 0,031 |
| Días de VMI | 20 (9-34) | 32 (14-52) | 0,032 |
| Días de ingreso en UCI | 23,5 (11-40,5) | 32 (16-57) | 0,054 |
| Días de hospitalización | 30 (16-54) | 41 (31-72) | 0,023 |
| Días de sedación | 18 (8-31) | 29,5 (14-39) | 0,098 |
| Uso de BNM | 19 (95) | 30 (96,77) | 0,750 |
| Días de BNM | 3 (3-5) | 10,5 (5-19) | 0,0002 |
| Mortalidad en UCI | 6 (30) | 12 (38,61) | 0,525 |
| Complicaciones | |||
| Traqueotomía | 10 (50) | 20 (64,52) | 0,303 |
| Aumento del residuo gástrico (>200ml) | 3 (15) | 10 (32,26) | 0,167 |
| Parada cardiorrespiratoria | 1 (5) | 0 (0) | 0,208 |
| Obstrucción del TOT | 3 (15) | 15 (48,39) | 0,014 |
| Pérdida de dispositivos | 1 (5) | 5 (16,13) | 0,228 |
| Infecciones nosocomiales | |||
| Bacteriemia | 14 (70) | 23 (74,19) | 0,743 |
| ITU | 6 (30) | 14 (45,16) | 0,278 |
| NAVM | 6 (30) | 12 (38,71) | 0,525 |
| Tratamiento COVID-19 | |||
| Remdesivir | 13 (65) | 18 (58,06) | 0,620 |
| Tocilizumab | 15 (75) | 22 (70,97) | 0,752 |
| Metilprednisolona | 3 (15) | 6 (19,35) | 0,690 |
| Dexametasona | 17 (89,5) | 24 (82,76) | 0,519 |
Datos expresados como mediana (p25-p75) o n (%).
BNM: bloqueantes neuromusculares; DP: decúbito prono; DS: decúbito supino; EPOC: enfermedad pulmonar obstructiva crónica; FiO2: fracción inspirada de oxígeno; ITU: infección del tracto urinario; NAVM: neumonía asociada a ventilación mecánica; PaO2: presión parcial arterial de oxígeno; PEEP: positive end-expiratory pressure («presión positiva al final de la espiración»); SAPS 3: Simplified Acute Physiologic Score; TOT: tubo orotraqueal; UCI: Unidad de Cuidados Intensivos; VMI: ventilación mecánica invasiva.
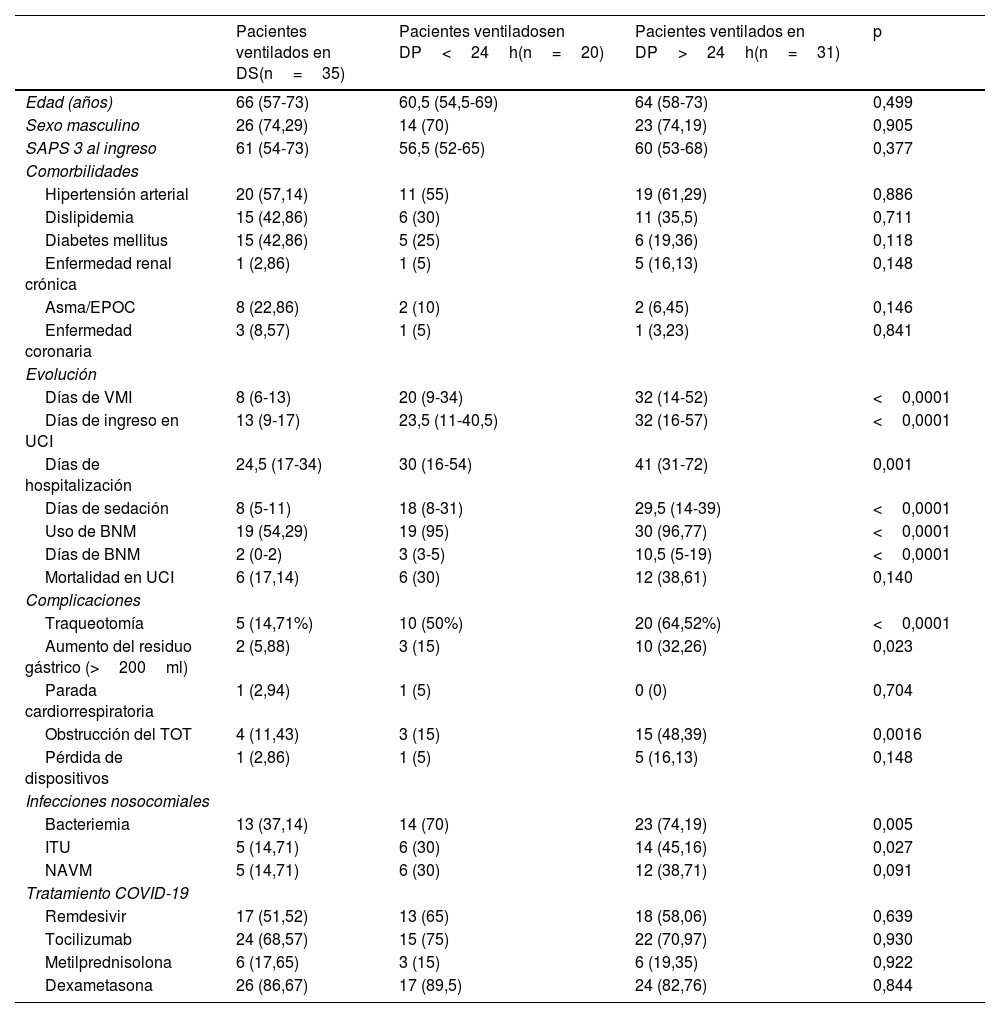
Características y desenlaces de los pacientes con neumonía por SARS-CoV-2 en ventilación mecánica invasiva
| Pacientes ventilados en DS(n=35) | Pacientes ventiladosen DP<24h(n=20) | Pacientes ventilados en DP>24h(n=31) | p | |
|---|---|---|---|---|
| Edad (años) | 66 (57-73) | 60,5 (54,5-69) | 64 (58-73) | 0,499 |
| Sexo masculino | 26 (74,29) | 14 (70) | 23 (74,19) | 0,905 |
| SAPS 3 al ingreso | 61 (54-73) | 56,5 (52-65) | 60 (53-68) | 0,377 |
| Comorbilidades | ||||
| Hipertensión arterial | 20 (57,14) | 11 (55) | 19 (61,29) | 0,886 |
| Dislipidemia | 15 (42,86) | 6 (30) | 11 (35,5) | 0,711 |
| Diabetes mellitus | 15 (42,86) | 5 (25) | 6 (19,36) | 0,118 |
| Enfermedad renal crónica | 1 (2,86) | 1 (5) | 5 (16,13) | 0,148 |
| Asma/EPOC | 8 (22,86) | 2 (10) | 2 (6,45) | 0,146 |
| Enfermedad coronaria | 3 (8,57) | 1 (5) | 1 (3,23) | 0,841 |
| Evolución | ||||
| Días de VMI | 8 (6-13) | 20 (9-34) | 32 (14-52) | <0,0001 |
| Días de ingreso en UCI | 13 (9-17) | 23,5 (11-40,5) | 32 (16-57) | <0,0001 |
| Días de hospitalización | 24,5 (17-34) | 30 (16-54) | 41 (31-72) | 0,001 |
| Días de sedación | 8 (5-11) | 18 (8-31) | 29,5 (14-39) | <0,0001 |
| Uso de BNM | 19 (54,29) | 19 (95) | 30 (96,77) | <0,0001 |
| Días de BNM | 2 (0-2) | 3 (3-5) | 10,5 (5-19) | <0,0001 |
| Mortalidad en UCI | 6 (17,14) | 6 (30) | 12 (38,61) | 0,140 |
| Complicaciones | ||||
| Traqueotomía | 5 (14,71%) | 10 (50%) | 20 (64,52%) | <0,0001 |
| Aumento del residuo gástrico (>200ml) | 2 (5,88) | 3 (15) | 10 (32,26) | 0,023 |
| Parada cardiorrespiratoria | 1 (2,94) | 1 (5) | 0 (0) | 0,704 |
| Obstrucción del TOT | 4 (11,43) | 3 (15) | 15 (48,39) | 0,0016 |
| Pérdida de dispositivos | 1 (2,86) | 1 (5) | 5 (16,13) | 0,148 |
| Infecciones nosocomiales | ||||
| Bacteriemia | 13 (37,14) | 14 (70) | 23 (74,19) | 0,005 |
| ITU | 5 (14,71) | 6 (30) | 14 (45,16) | 0,027 |
| NAVM | 5 (14,71) | 6 (30) | 12 (38,71) | 0,091 |
| Tratamiento COVID-19 | ||||
| Remdesivir | 17 (51,52) | 13 (65) | 18 (58,06) | 0,639 |
| Tocilizumab | 24 (68,57) | 15 (75) | 22 (70,97) | 0,930 |
| Metilprednisolona | 6 (17,65) | 3 (15) | 6 (19,35) | 0,922 |
| Dexametasona | 26 (86,67) | 17 (89,5) | 24 (82,76) | 0,844 |
Datos expresados como mediana (p25-p75) o n (%).
BNM: bloqueantes neuromusculares; DP: decúbito prono; DS: decúbito supino; EPOC: enfermedad pulmonar obstructiva crónica; ITU: infección del tracto urinario; NAVM: neumonía asociada a ventilación mecánica; SAPS 3: Simplified Acute Physiologic Score; TOT: tubo orotraqueal; UCI: Unidad de Cuidados Intensivos; VMI: ventilación mecánica invasiva.
Del total de pacientes, 31 requirieron, al menos, un ciclo de DPP (36% de 86 pacientes con VMI). Comparados con los que requirieron ciclos de DP<24h, no se encontraron diferencias significativas en edad, comorbilidad, gravedad al ingreso ni tratamiento antiinflamatorio o antiviral administrado. Sin embargo, presentaron menor tolerancia a la ventilación en DS en las siguientes 24h después de un ciclo de prono (61,29 vs. 89,47%, p=0,031). A pesar de una respuesta inicial al DP favorable similar en ambos grupos, 4 pacientes con DPP (12,90% de 31 pacientes) no mejoraron pese a extender la maniobra. Comparados con los pacientes que se trataron con ciclos de DP<24h, los pacientes con DPP presentaron mayor estancia hospitalaria (41 vs. 30 días, p=0,023), más días de VMI (32 vs. 20 días, p=0,032) y mayor duración del uso de BNM (10,5 vs 3 días, p=0,0002). En cuanto a las complicaciones, cabe destacar la mayor frecuencia de episodios de obstrucción del TOT (48,39 vs. 15%, p=0,014) en los pacientes con DPP comparados con los pacientes con DP<24h (tabla 1).
Comparando las 3 situaciones (DS, DP y DPP), los pacientes que recibieron DPP tuvieron más complicaciones: aumento del residuo gástrico (5,88% en DS, 15% en DP y 32,26% en DPP, p=0,023), obstrucción del TOT (11,43% en DS, 15% en DP y 48,39% en DPP, p=0,0016), más uso de BNM (54,29% en DS, 95% en DP y 96,77% en DPP, p<0,0001) en periodos más prolongados, sobre todo aquellos con DPP (2 días en DS, 3 en DP y 10,5 días en DPP, p<0,0001), mayor duración de la VMI y de los días de hospitalización (tabla 2).
Respecto a las IAAS, fueron más frecuentes entre los pacientes que requirieron DP y DPP comparados con los que se ventilaron en DS: las bacteriemias (37,14% en DS, 70% en DP, 74,19% en DPP, p=0,005) y las infecciones del tracto urinario (14,71% en DS, 30% en DP, 45,16% en DPP, p=0,027).
En conjunto, la mortalidad en UCI de todos los pacientes con COVID-19 fue del 21,66% (29/134). La mortalidad de los pacientes con neumonía bilateral ingresados en el SMI fue del 22,22% (24/108); todos ellos precisaron VMI. Finalmente, la mortalidad de los pacientes que se ventilaron en DP y DPP fue del 30 y el 38,61%, respectivamente (p=0,525) (tabla 1; fig. 1).
DiscusiónLas circunstancias especiales que se dieron durante la pandemia en las UCI dieron lugar a modificaciones en el tipo de atención prestada a los pacientes, entre las que destaca el uso de la ventilación en DP en periodos prolongados. Este hecho ha suscitado gran interés sobre sus resultados, como el impacto en la oxigenación de los pacientes11,12,14,15, la carga de trabajo15,16, el desarrollo de úlceras por presión10,11,14,16, las lesiones neuropáticas a largo plazo16 y la pérdida o disfunción accidental de dispositivos invasivos10.
Este estudio describe los desenlaces de 108 pacientes ingresados por SARS-CoV-2 atendidos por el SMI desde marzo de 2020 a diciembre de 2021. Como en otros estudios, la mayoría de los pacientes con VMI por neumonía bilateral secundaria a la COVID-19 fueron varones (73%) en la sexta década (mediana de 63,5 años)10–16. Hasta un 60% requirieron DP, en contraste con estudios publicados antes de la pandemia, donde el uso del DP se situaba en torno al 16% en el SDRA grave20. El número de ciclos de prono requerido por los pacientes fue similar a otros estudios10,11,13,14 (mediana de 2 ciclos), aunque los pacientes con DPP recibieron un número significativamente mayor de ciclos. Con respecto a la gravedad, considerando la ratio PaO2/FiO2 previa al inicio del primer ciclo de DP, los pacientes presentaron similar nivel de gravedad, y similar respuesta inicial. Los pacientes que recibieron ciclos de DPP presentaron peor tolerancia al DS (posibilidad de mantener PaO2/FiO2>150 en supino en las siguientes 24h tras la maniobra de prono), mayor duración de la VMI, más ciclos de DP, mayor estancia hospitalaria y en UCI, y mayor prevalencia de complicaciones (tabla 1), pero no mayor número de IAAS. Comparados con los pacientes ventilados en DS, se mantuvieron estas diferencias, y se asoció también con un mayor número de infecciones urinarias y bacteriemias (tabla 2). Se observa un efecto progresivamente más acusado (tabla 2) en estos desenlaces entre los pacientes ventilados en DS, DP<24h y DPP.
En la literatura existe mucha variabilidad en cuanto al uso de la ventilación en DPP durante la pandemia, en periodos de hasta 5 días y en uno14 o varios ciclos10,15,16. Entre los beneficios descritos destaca la mejoría sostenida en la oxigenación11,12,14,15 y la posibilidad de reducir las cargas de trabajo del personal10,12,15,16. En este estudio destaca el mayor uso de recursos como el BNM o la necesidad de traqueotomía, mayor periodo en VMI, mayor estancia hospitalaria, y la incidencia, progresivamente mayor en función de la necesidad de DP prolongado, de eventos adversos como la obstrucción del TOT y las IAAS (tablas 1 y 2).
Respecto al uso de BNM, se ha descrito un mayor uso en relación con los pacientes ventilados con SDRA grave inducido por COVID-1911,21. Las directrices de tratamiento actuales evidencian su uso sólo en pacientes en los que no se puede aplicar un protocolo de ventilación de protección pulmonar, debido a la asincronía o aumento de los esfuerzos respiratorios, en periodos no superiores a 48h22. En nuestros pacientes ventilados en DP también se utilizaron en mayor proporción comparado con datos prepandemia20 y en duración mayor a lo recomendado en las guías de práctica clínica22, pero no en los pacientes ventilados en DS. En los pacientes ventilados en DP<24h, este tratamiento se prolongó 24h más de lo recomendado (hasta 3 días, tablas 1 y 2), pero fue en los pacientes ventilados en DPP en los que se alargó de modo significativo este tratamiento (3 vs. 10,5 días, p=0,0002; tabla 1). Una posibilidad es que la mayor duración de la VMI se relacione con este uso prolongado más que por el DPP o el número total de ciclos de DP, aunque pueden haber influido muchos otros factores de confusión no considerados en este estudio, como otros datos de fracaso orgánico, o pautas de sedación más profundas.
En cuanto al resto de las complicaciones asociadas al DP, destaca la obstrucción del TOT, sobre todo en los pacientes que recibieron DPP (tablas 1 y 2). Se observó un aumento progresivo del riesgo (11,43% en pacientes ventilados en DS, 15% en pacientes ventilados en ciclos de DP, 48,39% en pacientes ventilados en DPP; p=0,0016). Ese hecho ya está descrito como potencial complicación asociada a la VMI en DP, aunque en menor porcentaje (hasta un 6,4% en el estudio de González-Seguel et al.7 y hasta un 5% en el estudio PROSEVA5). La obstrucción del TOT por material mucosanguinolento es una complicación que se ha asociado a los pacientes con neumonía por SARS-CoV-2, en el contexto del estado de hipercoagulabilidad característico de esta enfermedad23, y se ha descrito en los pacientes ventilados en DP una mayor retención de secreciones respiratorias, hasta en el 12% de los pacientes16. Cabe destacar que en todos los pacientes analizados se utilizó el mismo tipo de dispositivo de humidificación (pasivo), que no parece afectar a la prevalencia de oclusión de la vía aérea comparado con los sistemas de humidificación activa de acuerdo con la evidencia actual24. Estas 3 circunstancias han podido influir en el elevado número de complicaciones en los pacientes con DPP.
En cuanto a la dificultad para la nutrición enteral, se ha descrito un incremento del volumen residual gástrico en DP25. Se ha postulado que el uso de BNM podría influir, pero se ha visto que estos fármacos no tienen un efecto paralizante en la musculatura intestinal, por lo que este hecho se relaciona con la enfermedad subyacente y el uso concomitante de vasopresores o altas dosis de sedación25. En este estudio, se observa también el mismo efecto, progresivamente mayor en los pacientes ventilados en DS, DP<24h y DPP (5,88% en DS, 15% en DP<24h, 32,26% en DPP, p=0,023; tabla 1), aunque cabe destacar que se utilizó un volumen de residuo gástrico inferior a los valores actualmente recomendados de 500ml26.
En relación con las IAAS, fueron más frecuentes en los pacientes que requirieron DP comparados con los que se ventilaron en DS (tabla 2), pero no se encontraron diferencias en función de la duración de la maniobra (tabla 1), en probable relación con la maniobra y no con la duración de la misma. Los protocolos adaptados de prevención de infección nosocomial9 se llevaron a cabo dentro de las dificultades que el gran recambio de personal de enfermería supuso y dentro de las posibilidades de entrenamiento que el contexto permitió. Como en otro estudio español, las infecciones más frecuentes fueron las bacteriemias y las infecciones del tracto urinario, y también los pacientes que precisaron DP y mayor uso de BNM presentaron mayor porcentaje de IAAS27.
Estos resultados deben ser interpretados dentro de las limitaciones de un estudio retrospectivo y de tamaño limitado. No es un estudio de intervención, sino descriptivo de las características y desenlaces de los pacientes de un único centro. Las características basales y su punto de partida al inicio de la enfermedad (Simplified Acute Phisiologic Score 3 3) y la ratio PaO2/FiO2 de los pacientes fueron similares, lo que nos hace pensar que fue la sobrecarga asistencial la que impidió realizar los cuidados habituales de enfermería (higiene, cambio de sistemas de humidificación) o los cambios posturales a tiempo. También pudieron haber influido en los peores desenlaces de los pacientes ventilados en DPP otros factores (como sedación más profunda), además de una mayor gravedad evolutiva de los pacientes que requirieron DPP (peor tolerancia al DS).
Otra limitación es que no hemos incluido entre las complicaciones las lesiones articulares ni las úlceras por presión, hecho extensamente descrito. Tampoco se incluye un seguimiento a largo plazo, que sería interesante para valorar con perspectiva temporal estos efectos, sobre todo a nivel neuromuscular. Pese a todo ello, pensamos que señala potenciales puntos de mejora en el complejo manejo de estos pacientes.
ConclusionesEl DPP se asoció a mayor consumo de recursos (estancia en UCI, en el hospital, un mayor periodo en VMI) y mayor número de complicaciones y procedimientos (uso de traqueotomía, BNM, dificultad para la nutrición enteral), pero sin diferencias en la supervivencia de estos pacientes.
AutoríaEva de Miguel-Balsa: Conceptualización, análisis de datos y revisión bibliográfica y del manuscrito.
Teresa Blasco-Ruso: Recogida y análisis de datos, redacción del manuscrito.
Norma Gómez-Medrano: Conceptualización, revisión del manuscrito.
María Mirabet-Guijarro: Recogida de datos, revisión del manuscrito.
Alba Martínez-Pérez: Conceptualización, revisión bibliográfica y del manuscrito.
Adoración Alcalá-López: Gestión de los datos, revisión del manuscrito.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que declarar.