Evaluar la eficacia del protocolo Start to move comparado con el tratamiento convencional en sujetos mayores de 15 años hospitalizados en la UCI sobre una mejoría en funcionalidad, disminución de debilidad adquirida en la UCI (DA-UCI), incidencia de delirio, días de ventilación mecánica (VM), estadía en la UCI y mortalidad a los 28 días.
DiseñoEnsayo clínico controlado aleatorizado.
ÁmbitoUnidad de paciente crítico.
ParticipantesIncluye adultos mayores a 15 años con VMI mayor a 48h, asignación aleatoria.
IntervencionesProtocolo «Start to move» y tratamiento convencional.
Variables de interés principalesSe analizó funcionalidad, incidencia DA-UCI, incidencia delirio, días VM, estadía UCI y mortalidad-28 días, ClinicalTrials.gov número, NCT05053724.
ResultadosSesenta y nueve sujetos fueron ingresados al estudio, 33 al grupo Start to move y 36 a tratamiento convencional, comparables clínico y sociodemograficamente. En el grupo Start to move la incidencia DAUCI al egreso de la UCI fue de 35,7 vs. 80,7% grupo tratamiento convencional (p=0,001). La funcionalidad (FSS-ICU) al egreso de la UCI corresponde a 26 vs. 17 puntos a favor del grupo Start to move (p=0,001). La diferencia en Barthel al egreso de la UCI fue del 20% a favor del grupo Start to move (p=0,006). No hubo diferencias significativas en incidencia de delirio, días de VM, estadía UCI y mortalidad-28 días. El estudio no reportó eventos adversos, ni suspensión de protocolo.
ConclusionesLa aplicación del protocolo Start to move en la UCI se asoció reducción en la incidencia DA-UCI, aumento en funcionalidad y menor caída en puntaje Barthel al egreso.
To evaluate the efficacy of the Start to move protocol compared to conventional treatment in subjects over 15 years of age hospitalized in the ICU on an improvement in functionality, decrease in ICU-acquired weakness (IUCD), incidence of delirium, days of mechanical ventilation (MV), length of stay in ICU and mortality at 28 days.
DesignRandomized controlled clinical trial.
SettingIntensive care unit.
ParticipantsIncludes adults older than 15 years with invasive mechanical ventilation more than 48h, randomized allocation.
InterventionsStart to move protocol and conventional treatment.
Main variables of interestFunctionality, incidence of ICU-acquired weakness, incidence of delirium, days on mechanical ventilation, ICU stay and mortality-28 days, ClinicalTrials.gov number, NCT05053724.
ResultsSixty-nine subjects were admitted to the study, 33 to the Start to move group and 36 to conventional treatment, clinically and sociodemographic comparable. In the “Start to move” group, the incidence of IUCD at ICU discharge was 35.7% vs. 80.7% in the “conventional treatment” group (P=.001). Functionality (FSS-ICU) at ICU discharge corresponds to 26 vs. 17 points in favor of the “Start to move” group (P=.001). The difference in Barthel at ICU discharge was 20% in favor of the “Start to move” group (P=.006). There were no significant differences in the incidence of delirium, days of mechanical ventilation, ICU stay and 28-day mortality. The study did not report adverse events or protocol suspension.
ConclusionsThe application of the “Start to move” protocol in ICU showed a reduction in the incidence of IUCD, an increase in functionality and a smaller decrease in Barthel score at discharge.
Los individuos hospitalizados en unidades de cuidados intensivos (UCI) se encuentran sometidos a un estado de reposo prolongado, y a diversos factores que afectan directa o indirectamente la estructura muscular y orgánica, lo que puede resultar en debilidad adquirida en la UCI (DA-UCI)1,2 y una limitación en el desempeño funcional3.
Estos factores se pueden dividir en metabólicos, farmacológicos y orgánicos, donde destaca la hiperglicemia sostenida, el uso de corticoides, la sedo-analgesia, el bloqueo neuromuscular (BNM) y la falla multiorgánica asociados a sepsis o shock séptico4. Este estado se traduce en una pérdida directa de masa muscular, específicamente de fibras tipo II, fisiológicamente explicado por un aumento del proceso de degradación proteica de la miosina, disminución de la síntesis de proteínas y aumento de células proinflamatorias que favorecen a la debilidad del paciente crítico4.
Según Brower et al.5, los efectos del reposo prolongado producen un desacondicionamiento y atrofia de la musculatura. Después de 14 días de inmovilización, jóvenes y adultos están expuestos a una pérdida de masa muscular del cuádriceps del 9%, lo que se traduce en una pérdida de fuerza muscular de hasta un 27%6,7. En sujetos sometidos a ventilación mecánica invasiva (VMI) se ha evidenciado que el área de sección transversal del músculo cuádriceps puede disminuir hasta un 12,5% en la primera semana de su estadía en la UCI, lo cual puede incrementar hasta un 15,7% si presentan falla multi orgánica vs. un 3% de pérdida en sujetos con falla orgánica única8.
La DA-UCI y la pérdida de funcionalidad, también se relacionan directamente con el uso prolongado de sedoanalgesia, bloqueo-neuromuscular y una mayor incidencia de delirio en la UCI9. La presencia de delirio se relaciona con una baja participación en terapias físicas, ya sea por disminución de cooperación y/o agitación psicomotora, por lo tanto, influye directamente sobre el estado muscular y la recuperación funcional posterior9.
Brummel et al.10, reportan que el delirium es común en la UCI afectando entre el 60-80% de los sujetos sometidos a VMI y entre un 20-50% de los sujetos que se encuentran en ventilación mecánica no invasiva (VMNI), aumentando el riesgo de remoción de elementos invasivos, extubaciones accidentales y necesidad de contenciones físicas que pueden retardar el comienzo de la recuperación funcional27,28.
Para evidenciar las consecuencias del reposo prolongado y cuantificar la DA-UCI, se utiliza la escala de valoración Medical Research Council (MRC), una herramienta validada la cual mide de manera analítica la fuerza de 6 grupos musculares de manera bilateral con un puntaje de 30 puntos por hemicuerpo, obteniendo un total de 60 puntos. Un puntaje menor o igual a 48 puntos determina la presencia de DA-UCI11,29.
Por otro lado, para valorar la funcionalidad del paciente crítico, comúnmente se utiliza la escala validada Functional Status Scale - Intensive Care Unit (FSS-ICU), la cual mide hitos funcionales con un puntaje entre 0 y 35 puntos12.
El objetivo de nuestro estudio es evaluar la eficacia del protocolo Start to move comparado con tratamiento convencional en sujetos mayores de 15 años hospitalizados en la UCI sobre una mejoría en funcionalidad, DA-UCI, incidencia de delirio, días de ventilación mecánica (VM), estadía en la UCI y mortalidad a los 28 días, Clínica Ensenada 2018-2019.
Materiales y métodosDiseño metodológicoEnsayo clínico controlado aleatorizado, simple ciego. Asignación aleatoria computacional de la intervención mediante sobres cerrados (1:1), muestreo no probabilístico, consecutivo de los sujetos que ingresaron en la UCI de Clínica Ensenada entre enero de 2018/julio de 2019 y que cumplieron con criterios de selección, ClinicalTrials.gov número, NCT05053724, Protocolo N.° 010/2018, Servicio de Salud Metropolitano Occidente.
ParticipantesSe reclutaron a todos los sujetos ingresados en la UCI de la Clínica Ensenada de mediana complejidad estabilizados en otro centro de urgencias y trasladados a la clínica dado que esta no cuenta con unidad de urgencias; que sean adultos mayores de 15 años con requerimiento de VMI mayor a 48h, aceptación de participar del estudio mediante la firma del consentimiento informado por el tutor legal. Cabe destacar que en la clínica ingresan pacientes de leve a mediana complejidad con un promedio de APACHE II es cercano a los 20 puntos, dado que requieren estabilización clínica para ser trasladados al lugar.
Se excluyeron a los sujetos con enfermedad neuromuscular; antecedentes psiquiátricos (intento de autolisis, esquizofrenia, demencia senil u otros, que por su condición no son capaces de seguir una órden lógica secuencial, pudiendo sesgar la evaluación y tratamiento funcional); amputación de extremidades; embarazo; paro cardiorrespiratorio con daño hipóxico-isquémico cerebral severo; dependencia total previo a la hospitalización, según índice de Barthel (<20 puntos).
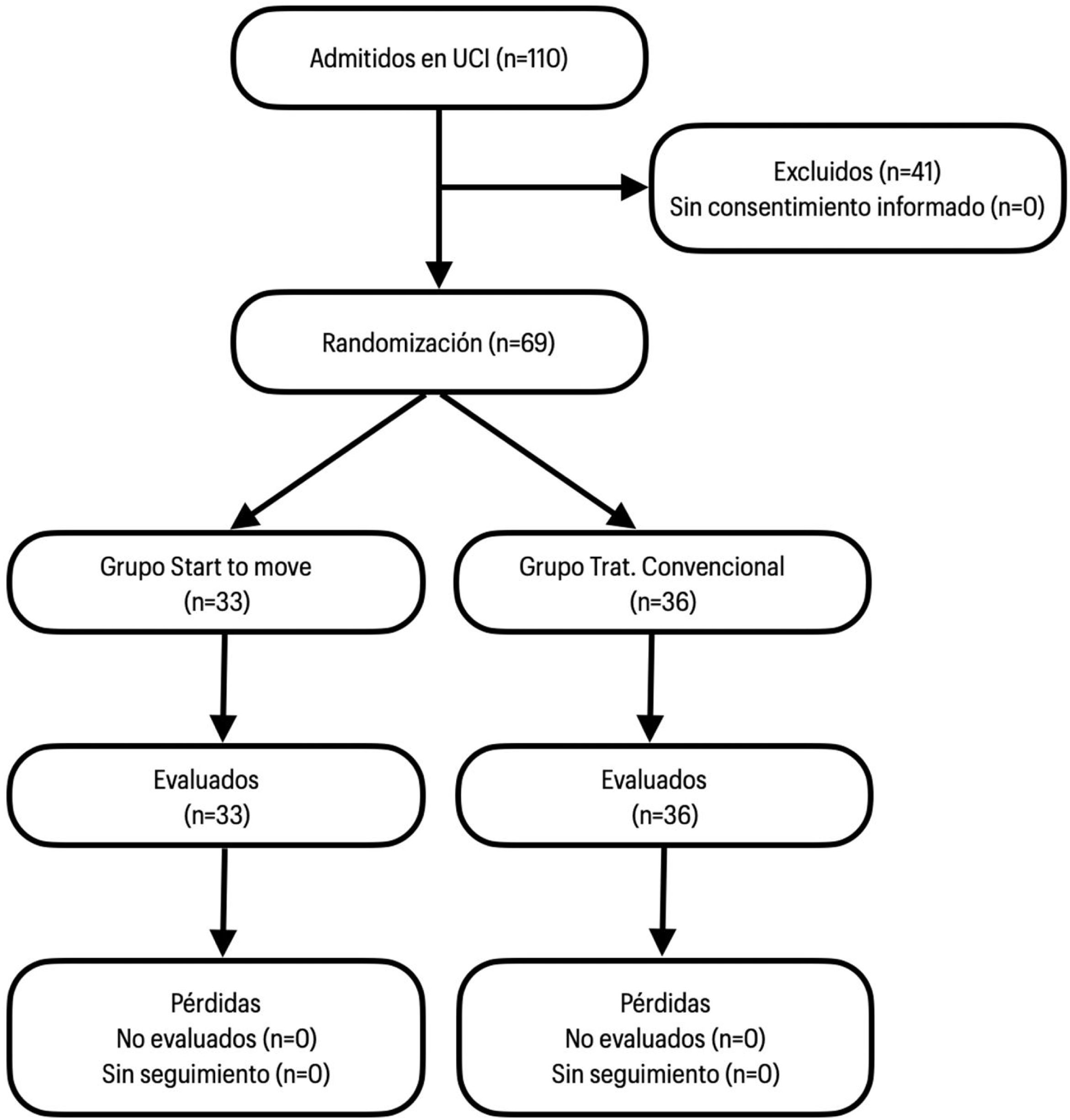
Reclutamiento y aleatorizaciónEl estudio se llevó a cabo en un solo centro clínico de 12 camas en la UCI, durante el año 2018-2019. A los sujetos que cumplieron con los criterios de inclusión, se le solicitó consentimiento informado al tutor responsable y posteriormente fueron asignados aleatoriamente (1:1) en el grupo Start to move y tratamiento convencional. Para la asignación se utilizó sobres sellados numerados secuencialmente a los que solo accedió el personal de investigación no participante en el ensayo clínico (fig. 1).
ProcedimientoEn ambos grupos de intervención, el kinesiólogo asignado evaluó el estado de vigilia y cooperación definido por la escala De Jonghe3,13 donde, el sujeto deberá obedecer al menos 3 de 5 órdenes propuestas por la escala y además, se valora el nivel de agitación psicomotora según la escala de Riker (SAS, entre 3 y 5), para ubicar al sujeto en uno de los 6 niveles de tratamiento kinésico establecidos tanto en el grupo Start to move de Gosselink et al.3 como en el del tratamiento convencional (Anexo 1 y 2).
En ambos grupos de tratamiento la intervención comenzó dentro de las primeras 48h de admisión en la UCI, y continuó hasta el egreso de la unidad.
En el grupo de tratamiento convencional, se incluyó movilización pasiva, activo-asistida y ejercicios contra resistencia, facilitación de posiciones funcionales altas como sedente, bípedo y marcha, según protocolo de tratamiento convencional donde la duración total de la terapia fue de 45min por sesión (Anexo 1).
En el grupo Start to move, se incluyó terapia kinésica según el protocolo de Gosselink et al.3, el cual establece 6 niveles de atención divididos según estabilidad de sistemas, estado cognitivo asociado a sedación, debilidad muscular y objetivos funcionales propuestos. En el nivel 0 no se aplica terapia kinésica de movilización por labilidad sistémica. Desde el nivel 1 al 5, se progresa de movilizaciones pasivas, uso de estimulación neuromuscular (EMS), movilizaciones activas y ejercicios contra resistencia, aplicación de cicloergómetro convencional, hasta marcha con asistencia si el sujeto se encuentra en condiciones para realizarlo donde la duración total de la terapia fue de 45min por sesión (Anexo 2).
Para el uso de EMS se aplicarán 4 electrodos de superficie en cuádriceps bilateral y 4 en tibial anterior, músculos asociados a la deambulación26; la intensidad de la estimulación muscular se administró a un nivel capaz de generar contracciones musculares visibles o palpables. La configuración del electroestimulador tuvo una intensidad de hasta 140mA, duración de pulso de 300-400μs (Rise time 0,8 a 2s, inicio 2 a 15s, pausa de 0,7 a 1s y pagado 4 a 10s)26; frecuencia entre 30 y 50Hz; 60min por día14,15; mientras que, para el uso de cicloergómetro, se solicitará una cadencia entre 30 y 45rpm15.
Una vez que el sujeto despertó con un S5Q 3 de 5 puntos13, se aplicaron escalas de evaluación de fuerza muscular (MRC)11, funcionalidad (FSS-ICU)12, delirio (CAM-ICU)9 y funcionalidad previa a la hospitalización (índice de Barthel consultado al tutor). Si el sujeto no logra despertar durante el periodo de seguimiento se eliminará del estudio.
Valoración inicial de la muestraSe registraron y analizaron características sociodemográficas como sexo, edad, motivo de ingreso, gravedad de la enfermedad (APACHE II), comorbilidades (Índice de Charlson)16 e índice de masa corporal (IMC). Características clínicas como FMO, uso de corticoides, uso de fármacos vasoactivos (DVA), uso de BNM, uso de sedo-analgesia, hiperglicemias con requerimiento de insulina, terapia de reemplazo renal (TRR) crónica y aguda. Además, resultados clínicos como relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno (PaO2/FiO2) e índice de oxigenación (IOX), falla de extubación y requerimiento de traqueostomía. Dentro de los outcomes primarios se analizó funcionalidad mediante índice de Barthel, FSS-ICU, DA-UCI, mediante la escala MRC y delirio a través de la escala CAM-ICU, mientras que, los outcomes secundarios analizados fueron días de VMI, días de estadía en la UCI y mortalidad a los 28 días.
Se establecieron protocolos de seguridad para la detención del tratamiento en ambos grupos descritos en anexo 3.
MuestraEl tamaño muestral se calculó en base a la independencia funcional al alta hospitalaria (59% grupo tratamiento vs. 35% grupo control; p=0,02; Schweickert et al.)17. El tamaño de efecto fue del 24% a favor de intervención con respecto al grupo control. Para un error alfa del 5% y una potencia del 80% se requieren 67 sujetos por grupo (n.° total=134). Sin embargo, este estudio se detuvo anticipadamente por razones internas de la institución relacionadas con cambio en el personal, por lo que se calculó potencia post hoc en variable DA-UCI para un error alfa del 5% fue del 95,8%; mientras que, para la variable FSS-ICU al egreso de la unidad comparado con el despertar fue del 90,5%.
Análisis estadísticoSe realizó un análisis descriptivo de las características basales de los sujetos por grupo de intervención según naturaleza de las variables. La normalidad de las variables se realizó mediante prueba de Shapiro-Wilks (p<0,05). La comparación de grupos se llevó a cabo con prueba exacta de Fisher, Mann-Whitney Wilcoxon o la t de Student según corresponda.
La funcionalidad se evaluó a través del cambio de puntaje de la escala FSS-ICU, mediante regresión ordinal cruda y ajustada, al igual que, días de VM e índice de Barthel. El análisis de DA-UCI, delirio y mortalidad a los 28 días se evaluó con regresión logística cruda y ajustada. Se realizó un análisis interno de variables de seguridad, donde cada evento reportado involucró la revisión de causales para la detención del protocolo.
La significación estadística se estableció en p<0,05 a dos colas en todos los análisis, y en los modelos de regresión se reportaron odds ratio (OR) con intervalo de confianza al 95% (IC 95%) para los modelos ordinal y logístico.
El análisis fue por intención de tratar. El registro de datos se realizó mediante formulario en Epidata y el análisis de datos en Stata® 14.2 SE (StataCorp LLC, College Station, TX. EE. UU.).
ÉticaEste estudio, consentimiento informado y el protocolo fue aprobado por el Comité de Ética del Servicio de Salud Metropolitano Occidente, N.° 010/2018.
ResultadosSe incluyeron 69 participantes de una muestra calculada de 134 sujetos. Ningún sujeto abandonó o rechazó la participación en el estudio o fue eliminado del estudio por incumplimiento de los criterios establecidos. Se asignaron 33 sujetos al grupo Start to move (47%) y 36 al grupo de tratamiento convencional (52%), sin diferencia significativas en características sociodemográficas y clínicas. En el grupo Start to move, la media de edad fue de 60 años, APACHE II de 22 puntos (41% de mortalidad) e índice de Charlson de 3 puntos (77% de sobrevida a los 10 años) (tabla 1).
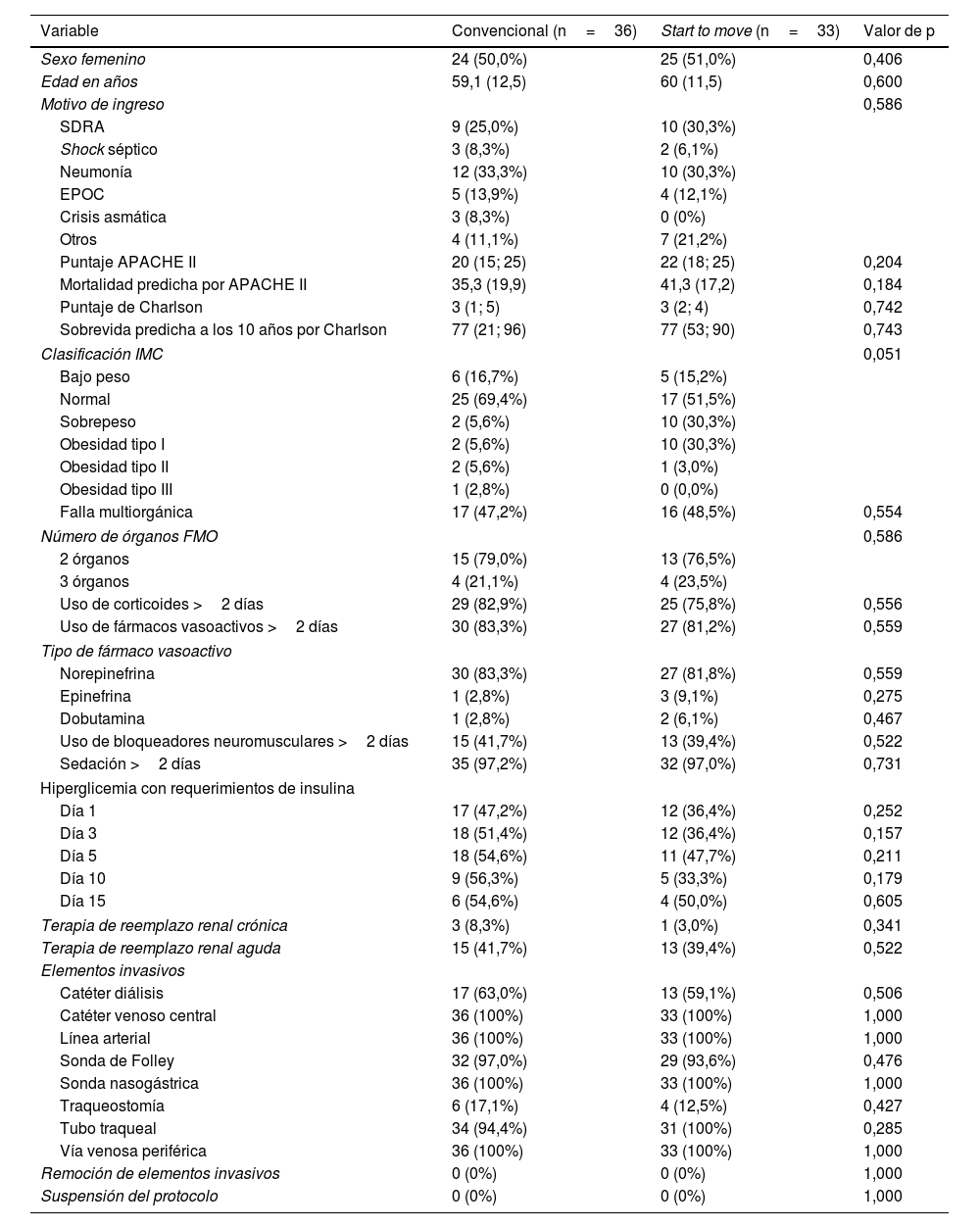
Características sociodemográficas entre grupo de tratamiento convencional y grupo Start to move
| Variable | Convencional (n=36) | Start to move (n=33) | Valor de p |
|---|---|---|---|
| Sexo femenino | 24 (50,0%) | 25 (51,0%) | 0,406 |
| Edad en años | 59,1 (12,5) | 60 (11,5) | 0,600 |
| Motivo de ingreso | 0,586 | ||
| SDRA | 9 (25,0%) | 10 (30,3%) | |
| Shock séptico | 3 (8,3%) | 2 (6,1%) | |
| Neumonía | 12 (33,3%) | 10 (30,3%) | |
| EPOC | 5 (13,9%) | 4 (12,1%) | |
| Crisis asmática | 3 (8,3%) | 0 (0%) | |
| Otros | 4 (11,1%) | 7 (21,2%) | |
| Puntaje APACHE II | 20 (15; 25) | 22 (18; 25) | 0,204 |
| Mortalidad predicha por APACHE II | 35,3 (19,9) | 41,3 (17,2) | 0,184 |
| Puntaje de Charlson | 3 (1; 5) | 3 (2; 4) | 0,742 |
| Sobrevida predicha a los 10 años por Charlson | 77 (21; 96) | 77 (53; 90) | 0,743 |
| Clasificación IMC | 0,051 | ||
| Bajo peso | 6 (16,7%) | 5 (15,2%) | |
| Normal | 25 (69,4%) | 17 (51,5%) | |
| Sobrepeso | 2 (5,6%) | 10 (30,3%) | |
| Obesidad tipo I | 2 (5,6%) | 10 (30,3%) | |
| Obesidad tipo II | 2 (5,6%) | 1 (3,0%) | |
| Obesidad tipo III | 1 (2,8%) | 0 (0,0%) | |
| Falla multiorgánica | 17 (47,2%) | 16 (48,5%) | 0,554 |
| Número de órganos FMO | 0,586 | ||
| 2 órganos | 15 (79,0%) | 13 (76,5%) | |
| 3 órganos | 4 (21,1%) | 4 (23,5%) | |
| Uso de corticoides >2 días | 29 (82,9%) | 25 (75,8%) | 0,556 |
| Uso de fármacos vasoactivos >2 días | 30 (83,3%) | 27 (81,2%) | 0,559 |
| Tipo de fármaco vasoactivo | |||
| Norepinefrina | 30 (83,3%) | 27 (81,8%) | 0,559 |
| Epinefrina | 1 (2,8%) | 3 (9,1%) | 0,275 |
| Dobutamina | 1 (2,8%) | 2 (6,1%) | 0,467 |
| Uso de bloqueadores neuromusculares >2 días | 15 (41,7%) | 13 (39,4%) | 0,522 |
| Sedación >2 días | 35 (97,2%) | 32 (97,0%) | 0,731 |
| Hiperglicemia con requerimientos de insulina | |||
| Día 1 | 17 (47,2%) | 12 (36,4%) | 0,252 |
| Día 3 | 18 (51,4%) | 12 (36,4%) | 0,157 |
| Día 5 | 18 (54,6%) | 11 (47,7%) | 0,211 |
| Día 10 | 9 (56,3%) | 5 (33,3%) | 0,179 |
| Día 15 | 6 (54,6%) | 4 (50,0%) | 0,605 |
| Terapia de reemplazo renal crónica | 3 (8,3%) | 1 (3,0%) | 0,341 |
| Terapia de reemplazo renal aguda | 15 (41,7%) | 13 (39,4%) | 0,522 |
| Elementos invasivos | |||
| Catéter diálisis | 17 (63,0%) | 13 (59,1%) | 0,506 |
| Catéter venoso central | 36 (100%) | 33 (100%) | 1,000 |
| Línea arterial | 36 (100%) | 33 (100%) | 1,000 |
| Sonda de Folley | 32 (97,0%) | 29 (93,6%) | 0,476 |
| Sonda nasogástrica | 36 (100%) | 33 (100%) | 1,000 |
| Traqueostomía | 6 (17,1%) | 4 (12,5%) | 0,427 |
| Tubo traqueal | 34 (94,4%) | 31 (100%) | 0,285 |
| Vía venosa periférica | 36 (100%) | 33 (100%) | 1,000 |
| Remoción de elementos invasivos | 0 (0%) | 0 (0%) | 1,000 |
| Suspensión del protocolo | 0 (0%) | 0 (0%) | 1,000 |
EPOC: enfermedad pulmonar obstructiva crónica; FMO: falla multiorgánica; IMC: índice de masa corporal; SDRA: síndrome de distrés respiratorio agudo.
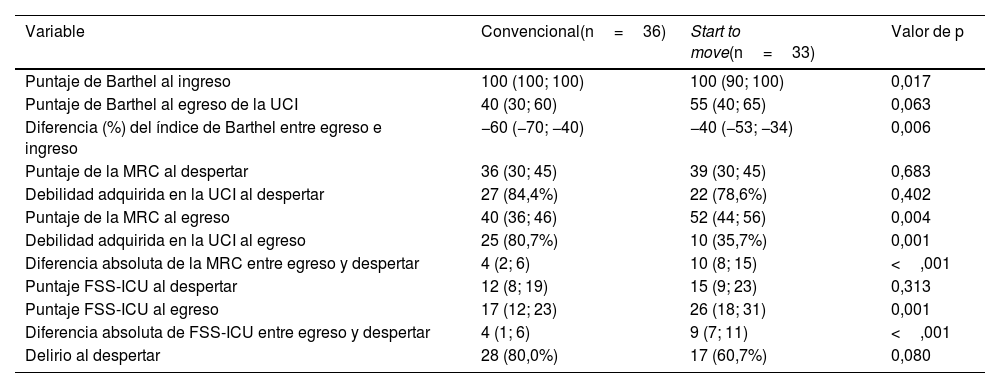
La incidencia de DA-UCI al egreso en grupo tratamiento convencional fue del 80,7% (IC 95%: 62,5-92,6%) vs. grupo Start to move 35,7% (IC 95%: 18,6-55,9%; p=0,001); Con un OR de 0,44 (IC 95%: 0,26-0,75; p<0,001). La diferencia del puntaje MRC al despertar vs. MRC al egreso fue de 4 puntos (rango: 2-6) para el grupo de tratamiento convencional y de 10 puntos (rango: 8-15) para el grupo Start to move (p<0,001).
La funcionalidad en escala FSS-ICU al egreso de la unidad en grupo tratamiento convencional fue de 17 puntos (IC 95%: 12-23) vs. grupo Start to move con 26 puntos (IC 95%: 18-31; p=0,001). La diferencia absoluta de FSS-ICU entre el periodo de despertar y egreso en grupo tratamiento convencional fue de 4 puntos (IC 95%: 1-6) mientras que, en el grupo Start to move la diferencia fue de 9 puntos (IC 95%: 7-11; p<0,001).
La independencia funcional según diferencia porcentual de índice de Barthel en grupo tratamiento convencional fue del 60% (rango −70; −0), mientras que el grupo Start to move 40% (−52,5; −34,2; p=0,006) (tabla 2).
Resultados comparativos de funcionalidad previa e intrahospitalaria, fuerza muscular y delirio entre entrenamiento habitual y Start to move
| Variable | Convencional(n=36) | Start to move(n=33) | Valor de p |
|---|---|---|---|
| Puntaje de Barthel al ingreso | 100 (100; 100) | 100 (90; 100) | 0,017 |
| Puntaje de Barthel al egreso de la UCI | 40 (30; 60) | 55 (40; 65) | 0,063 |
| Diferencia (%) del índice de Barthel entre egreso e ingreso | −60 (−70; −40) | −40 (−53; −34) | 0,006 |
| Puntaje de la MRC al despertar | 36 (30; 45) | 39 (30; 45) | 0,683 |
| Debilidad adquirida en la UCI al despertar | 27 (84,4%) | 22 (78,6%) | 0,402 |
| Puntaje de la MRC al egreso | 40 (36; 46) | 52 (44; 56) | 0,004 |
| Debilidad adquirida en la UCI al egreso | 25 (80,7%) | 10 (35,7%) | 0,001 |
| Diferencia absoluta de la MRC entre egreso y despertar | 4 (2; 6) | 10 (8; 15) | <,001 |
| Puntaje FSS-ICU al despertar | 12 (8; 19) | 15 (9; 23) | 0,313 |
| Puntaje FSS-ICU al egreso | 17 (12; 23) | 26 (18; 31) | 0,001 |
| Diferencia absoluta de FSS-ICU entre egreso y despertar | 4 (1; 6) | 9 (7; 11) | <,001 |
| Delirio al despertar | 28 (80,0%) | 17 (60,7%) | 0,080 |
FSS-ICU: escala de evaluación de la funcionalidad; MRC: escala de evaluación de fuerza muscular; UCI: unidad de cuidados intensivos.
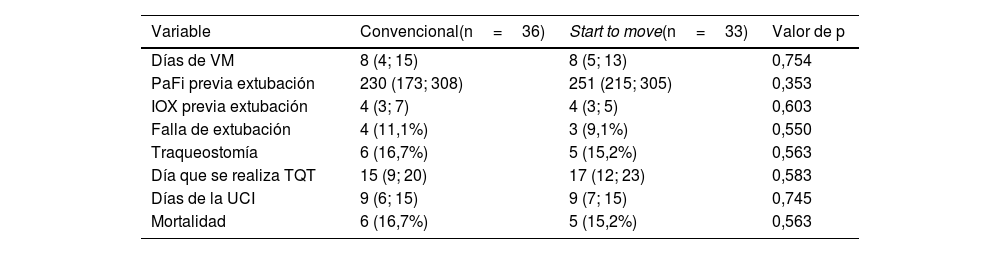
La incidencia de delirio, los días de VMI, días de estadía en la UCI y mortalidad a los 28 días, no hubo diferencia significativa entre ambos grupos (tabla 3).
Resultados de las variables clínicas y outcomes secundarios entre el tratamiento convencional y Start to move
| Variable | Convencional(n=36) | Start to move(n=33) | Valor de p |
|---|---|---|---|
| Días de VM | 8 (4; 15) | 8 (5; 13) | 0,754 |
| PaFi previa extubación | 230 (173; 308) | 251 (215; 305) | 0,353 |
| IOX previa extubación | 4 (3; 7) | 4 (3; 5) | 0,603 |
| Falla de extubación | 4 (11,1%) | 3 (9,1%) | 0,550 |
| Traqueostomía | 6 (16,7%) | 5 (15,2%) | 0,563 |
| Día que se realiza TQT | 15 (9; 20) | 17 (12; 23) | 0,583 |
| Días de la UCI | 9 (6; 15) | 9 (7; 15) | 0,745 |
| Mortalidad | 6 (16,7%) | 5 (15,2%) | 0,563 |
IOX: índice de oxigenación; PaFi: relación presión arterial de oxígeno y fracción inspirada de oxígeno; TQT: traqueostomía; UCI: unidad de cuidados intensivos; VM: ventilación mecánica.
En este estudio, se evidencia una reducción significativa en la incidencia de DA-UCI en el grupo Start to move con una diferencia del 45% respecto al grupo de tratamiento convencional al egreso de la unidad, lo cual es similar a lo reportado en la literatura en la UCI de similares características18–20,30–33. La ganancia en fuerza, entre el periodo de despertar y egreso de la unidad en el grupo Start to move fue de 10 puntos, con una diferencia relativa de 6 puntos respecto al grupo de tratamiento convencional. Tal resultado es congruente con el estudio de Kayambu et al.21, con una diferencia de 4,6 puntos entre grupos y Zang et al.22 (2019), con una diferencia de 4,5 puntos en la escala MRC. Sin embargo, la alta tasa de DA-UCI objetivada en el grupo convencional puede estar influida por un n.° muestral pequeño, se debe corroborar con tamaños muestrales mayores.
Nuestros resultados muestran un incremento en la funcionalidad al egreso en el grupo Start to move con una diferencia absoluta de 9 puntos respecto al grupo de tratamiento convencional. Actualmente, no existen puntajes de clasificación de la escala FSS-ICU para determinar el grado de pérdida o ganancia en funcionalidad para contrastar nuestros resultados. Existe escasa evidencia que compare tales resultados en la UCI de las mismas características.
El índice de Barthel evidencia que el grupo Start to move presenta un 20% menos de caída en su funcionalidad respecto al grupo de tratamiento convencional (60 vs. 40%; p=0,006). Nuestros resultados son similares a lo reportado por Symeonidou et al.23, con una diferencia porcentual del 48%, sin embargo, varios estudios no muestran una diferencia significativa en la caída del puntaje Barthel17,22, por lo tanto, estos resultados podrían traducirse en un mejor desempeño en las actividades de la vida diaria al egreso de la unidad.
La incidencia de delirio fue del 20% menos en el grupo Start to move respecto al grupo de tratamiento convencional, tal diferencia no fue significativa. Cabe destacar que, para este outcome la muestra evaluada fue insuficiente para lograr una potencia estadística aceptable, subestimando la capacidad de la prueba para detectar diferencias entre grupos cuando estas están presentes, por lo tanto, se requieren nuevos estudios con mayor tamaño muestral que permitan evidenciar esta diferencia.
En relación con los días de VMI, ambos grupos tuvieron una media de 8 días y una diferencia absoluta de 0 días, sin significación estadística. Estudios recientes como Zhang et al.24, establecen resultados similares con una diferencia absoluta de −0,33 días de VM sin diferencia estadística24, sin embargo, cabe destacar que el protocolo Start to move posee un enfoque de rehabilitación motora, que no necesariamente tiene efecto directo sobre la rehabilitación respiratoria y una mejoría sobre este outcome, por ende, se sugiere incorporar nuevos estudios con terapias combinadas que incorporen fortalecimiento muscular respiratorio.
En ambos grupos, los días de estadía en la UCI fueron en promedio de 9 días con una diferencia absoluta de 0 días, similar a lo reportado por Morris et al.25; Kayambu et al.21, quienes concluyen una diferencia absoluta de 0,5 días sin significación estadística (p=0,68 y p=0,43, respectivamente).
La mortalidad a los 28 días post-UCI fue ligeramente menor en el grupo Start to move con un 15,2 vs. 16,7%, sin significación estadística. Estudios recientes como los de Schwickert et al.17, Kayambu et al.21 y Zang et al.22, valoran la mortalidad post-UCI en distintos periodos de tiempo, con diferencias favorables al grupo tratamiento, pero sin significación estadística.
En ambos grupos de tratamiento no existieron eventos adversos relacionados con la terapia kinésica similar a lo reportado por Morris et al.25.
Nuestro estudio posee limitaciones en el tamaño muestral no alcanzado por efectos administrativos del centro, sin embargo, se hicieron los ajustes estadísticos necesarios según potencia post hoc, además, se incluyó solo un centro el cual no posee ingresos derivados desde unidades de emergencias. Es necesario continuar con estudios que logren incorporar estos puntos. Dentro de las fortalezas, se destaca que es el único estudio local, randomizados que logra evidenciar potentes resultados físicos y funcionales en la UCI.
ConclusiónLa aplicación del protocolo Start to move como medio de rehabilitación precoz en la UCI se asoció con una mayor funcionalidad en la escala FSS-ICU, menor incidencia de DA-UCI y mayor independencia funcional con Barthel al egreso de la UCI. El protocolo Start to move no demostró utilidad en reducción de delirio, días de VM, estadía en la UCI, ni mortalidad a los 28 días. La aplicación del protocolo resultó ser seguro, sin eventos adversos reportados en ambos grupos de tratamiento.
FinanciaciónLos autores declaran no haber recibido financiación.
AutoríasSebastián Soto: Concepción del estudio, adquisición de datos y borrador del artículo,
Paulina Vivanco: Análisis e interpretación de datos y borrador del artículo.
Rodrigo Adasme: Diseño del estudio, análisis e interpretación de datos y aprobación definitiva de la versión.
Paola Figueroa: Aprobación definitiva de la versión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.