En la actualidad existe una preocupación creciente por el uso de opiáceos. Se estima que casi el 40% de los ciudadanos de EE. UU. no hospitalizados recibieron al menos una prescripción de opiáceos en 20151. Aunque en España el problema no llega a estas dimensiones, sí existe un interés cada vez mayor en usar alternativas a estos fármacos.
En los Servicios de Medicina Intensiva, aunque se comparte esa inquietud, el problema es más complejo. Debido a las características de los pacientes, muchos de ellos con patologías complejas, disfunción multiorgánica o con volúmenes amplios de distribución, la analgesia sin el uso de opiáceos constituye un verdadero reto2. En la actualidad, y debido a la pandemia COVID-19, el problema ha tomado una mayor relevancia. El ingreso de una ingente cantidad de pacientes con distrés respiratorio grave con necesidad de sedación profunda durante largos periodos de tiempo y gran consumo de opiáceos, supone una dificultad añadida no sólo para la retirada de éstos sino también para el uso de la analgesia multimodal.
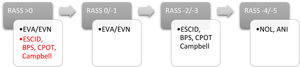
Según los datos publicados en las unidades de cuidados intensivos (UCIs) españolas3 el 29% de los pacientes ingresados tienen prescritos opioides, cifra que asciende al 70% en el caso de pacientes en ventilación mecánica invasiva. Sin embargo, sólo algo más del 52% de las Unidades emplean escalas de valoración del dolor en su práctica rutinaria, cifra muy por debajo de los estándares recomendados. Por lo tanto, si se pretende realizar un abordaje adecuado del dolor es fundamental llevar a cabo una valoración de este con las escalas diseñadas para ello, tanto para paciente comunicativo como para el no comunicativo (fig. 1), y plantear un tratamiento individualizado donde el desarrollo de estrategias de analgesia multimodal constituya la base (tabla 1).
Monitorización del dolor en función del RASS.
RASS: Richmond agitation sedation scale; EVA: escala visual analógica; EVN: escala visual numérica; ESCID: escala de conductas indicadoras de dolor; bps: behavioral pain scale; CPOT: critical care pain observation tool; NOL®: nociception level; ANI®: analgesia nociception index.
Analgésicos no-opioides para analgesia multimodal
| Analgésico | Dosificación | Particularidades | Efectos secundarios |
|---|---|---|---|
| Paracetamol | 1 g IV/VO cada 6-8 h | Evitar en la insuficiencia hepática. Metabolismo a través de p450. | Hipotensión, náuseas, vómitos, cefaleas, daño hepático. |
| Metamizol | 2 g IV cada 6-8 h575 mg VO cada 6-8h | Incidencia agranulocitosis: < 10 casos/millón | Agranulocitosis, edema de glotis, shock anafiláctico |
| Dexmedetomidina | 0,2 - 0,8 μg/kg/h IVMáximo 1,4 mcg/kg/h | Agonista α-2 | Bradicardia, hipotensión arterial |
| Ketamina | Pauta IV:Bolo: 0,125 - 0,25 mg/kgInfusión: 0,1 - 0,3 mg/kg/hPauta SC:0,1 - 0,5 mg/kg/h | Antagonista no competitivo del receptor NMDAEfectos psicomiméticos poco frecuentes usada a dosis analgésicasÚtil en la hiperalgesia asociada a opiáceos | Rara vez usado a dosis analgésicas: ensoñaciones, alucinaciones y efectos disociativos.Hipertensión arterialTaquicardia |
| Ibuprofeno | 400 mg/6 h | No es considerado fármaco de primera línea en UCI. | Sangrado gastrointestinal, ulceraciones, sangrado, fracaso renal. |
| Ketorolaco | 10 mg/IV/6 h | No es considerado fármaco de primera línea en UCI. | Sangrado gastrointestinal, ulceraciones, sangrado, fracaso renal. |
| Dexketoprofeno | 50 mg/IV/8-12 h. | Estaría indicado para pacientes con dolor de características inflamatorias (politraumatizados) | Sangrado gastrointestinal, ulceraciones, sangrado, fracaso renal. |
| Lidocaína | Pauta IV:Bolo: 1,5 mg/kgInfusión: 1-2 mg/kg/h | Bloqueante de los canales de Na+ | Agitación, tinnitus, sabor metálico, convulsiones, coma, arritmias, parada cardiorrespiratoria. |
| Magnesio | Dosis única (prevención):30 - 50 mg/kg/IV.Pauta continua IV:Bolo: 50 mg/kgInfusión: 10 - 25 mg/kg/h | Antagonista no competitivo del receptor NMDA. Disminuye la dosis necesaria de opioides. | |
| Gabapentina | 1.200 – 3.600 mg/día VO repartidos en 2-3 dosis | Unión a canales de Ca2+ voltaje-dependientes. Útil en el dolor neuropático. | Inicio lento de acción. Titulación progresiva de la dosis.Vértigos, somnolencia, confusión, edema |
| Pregabalina | 300 - 600 mg/día VO repartidos en 2-3 dosis | Unión a canales de Ca++ voltaje-dependientes.Útil en el dolor neuropático. | Inicio lento de acción. Titulación progresiva de la dosis.Vértigos, somnolencia, boca seca, visión borrosa, edema. |
Si se siguen las recomendaciones actuales, tanto las Guías Pain, Analgesia, Delirium, Inmobility and Sleep (PADIS) publicadas por la Sociedad Americana en 20182 como las Guías publicadas en 2019 por la Sociedad Panamericana4, los opiáceos han de ser considerados como la base de la analgesia en los pacientes críticos. Sin embargo, ambas guías hacen gran hincapié en los efectos secundarios que éstos presentan y que en el paciente crítico pueden generar problemas graves (íleo, depresión respiratoria, delirium, inmunosupresión) y conllevar un aumento de la morbimortalidad y de la estancia en UCI. En ambas publicaciones, se recomienda su uso a la menor dosis posible para conseguir el objetivo terapéutico marcado y por el menor tiempo necesario. Para ello es fundamental realizar una monitorización rutinaria del dolor haciendo uso de las escalas adecuadas.
La analgesia multimodal engloba tanto el uso de una combinación de fármacos analgésicos con distinto mecanismo de acción como la aplicación de distintas técnicas anestésicas locoregionales, todo ello buscando una analgesia óptima empleando la menor dosis posible de fármacos y una disminución de los efectos secundarios. Sin embargo, este es un abordaje complejo en el enfermo crítico tanto porque la patología responsable de su ingreso suele conllevar al menos la disfunción de un órgano, como por las interacciones farmacológicas que pueden surgir entre los distintos analgésicos dando lugar a limitaciones en su uso5. En cualquier caso, resulta evidente que el manejo correcto del dolor es un desafío en los pacientes críticos, obligando a una valoración rigurosa del mismo y al uso de una combinación de analgésicos que minimicen en lo posible el uso de opiáceos6. Aunque en el paciente crítico, la primera elección son los opiáceos, la analgesia multimodal se puede iniciar cuando queramos disminuir la dosis de opioides y evitar sus efectos secundarios, además de ser una opción para pacientes estables que al ingresar en nuestras unidades presentan un dolor leve-moderado.
Frente a los analgésicos más usados (paracetamol, metamizol o AINEs), se pueden emplear otros fármacos menos habituales. En el caso de fármacos como la dexmedetomidina, la ketamina, la lidocaína o el magnesio, aunque la experiencia clínica con su uso como analgésicos en pacientes críticos dista de ser amplia, pueden ser útiles en el control del dolor postoperatorio, sobre todo como parte de una estrategia de tipo opioid free anesthesia5. En dolores de tipo neuropático o en cefaleas de difícil control como puede ser la asociada a la hemorragia subaracnoidea, la pregabalina y la gabapentina son dos fármacos para considerar, teniendo en cuenta que por su perfil farmacodinámico sus efectos pueden tardar días en aparecer.
Finalmente, en lo que respecta a las técnicas anestésicas locoregionales, son fundamentales la analgesia epidural y los bloqueos paravertebrales, que pueden ser tremendamente útiles en pacientes posquirúrgicos o politraumatizados permitiendo una clara disminución del uso y de la dosis de los fármacos analgésicos7.
Sin embargo, uno de los grandes retos en la analgesia en los Servicios de Medicina Intensiva lo constituyen los pacientes críticos crónicos, que son aquellos con estancias prolongadas y con dolor no sólo relacionado con el motivo de ingreso sino con procedimientos, manipulaciones o movilizaciones, donde el uso y abuso de analgésicos puede constituir un verdadero problema, obligando a una rotación de estos para evitar los efectos secundarios asociados a su empleo continuado en el tiempo8. En estos pacientes, la metadona está emergiendo como un fármaco a considerar, tanto por sus propiedades analgésicas como a modo de estrategia de liberación de otros opiáceos, siendo un fármaco para tener en cuenta (tabla 2). Sería un fármaco importante para aquellos pacientes con tratamientos prolongados con opiáceos dentro de una terapia de retirada de éstos últimos.
| Opioide | Características generales | Dosis orientativas |
|---|---|---|
| Remifentanilo | 100 veces más potente que la morfina.Inicio y fin de acción rápidos (< 5 minutos).Metabolizado por esterasas plasmáticas. No acumula en la insuficiencia renal y/o hepática.Su rápido fin de acción puede dar lugar a fenómenos de dolor/deprivación por lo que se recomienda la administración de un opioide de vida media más prolongada previo a su suspensión.Evitar su administración en bolo (depresión respiratoria). | Dosis analgésica IV: 0,5 – 3 μg/kg/hDosis sedante IV: 3 – 12 μg/kg/h |
| Fentanilo | 100 veces más potente que la morfina.Inicio de acción: 1 – 3 min.Vida media: 30 – 60 min. Fármaco muy lipofílico. Su administración en infusión continua prolonga su vida media.De elección para el control del dolor agudo en pacientes en ventilación espontánea.Metabolismo hepático dando lugar a metabolitos inactivos. Ajustar dosis en la insuficiencia hepática. No acumula en la insuficiencia renal. | Bolo IV: 30 – 150 μgPerfusión IV: 30 – 150 μg/h |
| Morfina | Inicio y pico de acción más tardío que los anteriores.Vida media: 4 – 6 h. Es el mejor opioide para pautas intermitentes.Metabolismo hepático dando lugar a metabolitos activos que se eliminan por vía renal. A evitar en casos de insuficiencia renal.Se asocia a liberación de histamina por lo que debe de emplearse con precaución en pacientes con inestabilidad hemodinámica. | Bolo IV: 0,05 – 0,1 mg/kgPerfusión IV: 0,5 – 7 mg/h |
| Metadona | Triple acción analgésica:Agonista del receptor μ opiáceos.Antagonista del receptor NMDA.Inhibidor de la recaptación de serotonina y noradrenalina.Tarda días en alcanzar una concentración estable. Inicialmente se recomienda su administración en conjunción con otro opioide.Valorar su uso en:Pacientes que requieren dosis altas de opioides.Pacientes con dolores susceptibles de prolongarse en el tiempo.Consumidores crónicos de opioides.Metabolismo hepático dando lugar a metabolitos inactivos. Evitar su administración en la insuficiencia hepática.Evitar su administración con fármacos inhibidores de la recaptación de serotonina y noradrenalina y aquellos que prolongan el QTc. | Dosis oral/enteral: 0,1 – 0,4 mg/kg administrados cada 8 – 12 h según respuesta. |
| Tramadol | Doble acción analgésica:Agonista del receptor μ opiáceos.Inhibe la recaptación de noradrenalina y serotonina.Metabolismo hepático en una primera fase por O-demetilación a metabolitos activos. Se debe tener en cuenta la dosificación en caso de insuficiencia hepática. Excreción urinaria.Posee importantes efectos secundarios que limitan su uso:Síndrome serotoninérgico.Actividad pro-convulsivante.Posee importantes interacciones farmacológicas.Debe evitarse la retirada brusca del fármaco. | Dosis enteral/parenteral:50-100 mg/6-8 h |
Tanto la valoración del dolor como la consecución de una analgesia adecuada deben de constituir una prioridad en el paciente crítico. En palabras de Chamorro et al., la correcta analgesia no debe ser una asignatura pendiente del intensivista sino una asignatura de obligado cumplimiento9. La aparición de cuadros de dolor crónico tras el paso de los pacientes por los Servicios de Medicina Intensiva, recientemente incluidos dentro del Síndrome Post-UCI, implican una merma en la calidad de vida y un retraso en la incorporación a las rutinas habituales, por lo que deben de ser evitados10. El empleo de una estrategia de analgesia multimodal que minimice el uso de opiáceos, buscando disminuir los efectos secundarios de este grupo de fármacos y futuras dependencias, deberá de combinarse con una adecuada monitorización que garantice una buena analgesia. Sólo de esta forma se evitará que el dolor sea uno de los recuerdos más desagradables y perdurables tras el paso de los pacientes por los Servicios de Medicina Intensiva y se posibilitará la vuelta de los enfermos críticos a una vida de calidad.