La implementación de ventilación mecánica invasiva (VMI) en pacientes críticos implica dos momentos cruciales: la fase control total, afectada entre otras cosas por el uso de analgésicos y sedantes, y la fase de transición a la ventilación espontánea, que busca acortar los tiempos de VMI y en la cual optimizar la interacción paciente-ventilador es uno de los principales retos. Los esfuerzos inspiratorios inefectivos (EII) surgen cuando no hay coordinación entre el esfuerzo del paciente y el soporte del ventilador. Los EII son comunes en diferentes modos ventilatorios y están asociados con peores resultados clínicos: disnea, aumento de los requerimientos de sedantes, aumento de días de VMI y mayor estancia en la unidad de cuidados intensivos (UCI) y en el hospital. Los mismos se manifiestan gráficamente como una disminución abrupta del flujo espiratorio, siendo más frecuentes durante la espiración. Si bien, y teniendo en consideración que aún se desconoce si esta asociación es causal o más bien un marcador de severidad de la enfermedad, reconocer las potenciales consecuencias fisiológicas, repasar los métodos de diagnóstico, e implementar estrategias de detección y tratamiento que puedan limitarlos, parece razonable.
The implementation of invasive mechanical ventilation (IMV) in critically ill patients involves two crucial moments: the total control phase, affected among other things by the use of analgesics and sedatives, and the transition phase to spontaneous ventilation, which seeks to shorten IMV times and where optimizing patient-ventilator interaction is one of the main challenges. Ineffective inspiratory efforts (IEE) arise when there is no coordination between patient effort and ventilator support. IIE are common in different ventilatory modes and are associated with worse clinical outcomes: dyspnea, increased sedation requirements, increased IMV days and longer intensive care unit (ICU) and hospital stay. These are manifested graphically as an abrupt decrease in expiratory flow, being more frequent during expiration. However, and taking into consideration that it is still unknown whether this association is causal or rather a marker of disease severity, recognizing the potential physiological consequences, reviewing diagnostic methods and implementing detection and treatment strategies that can limit them, seems reasonable.
Luego de que se resuelva la causa por la que una persona haya necesitado ventilación mecánica invasiva (VMI) (luego de haber superado la fase inicial de la VMI) debe iniciarse, tan pronto como sea posible, el proceso de desvinculación. Aquí, durante la fase de salida, el objetivo se debe focalizar en acortar los tiempos de VMI y, para ello, es indispensable conseguir coordinación y una adecuada interacción entre el paciente y el ventilador1–3. Cuando eso no sucede, aparecen las disincronías.
En VMI el término «disincronía» hace referencia a la falta de coordinación entre el esfuerzo inspiratorio del paciente, determinado por sus necesidades ventilatorias y el soporte ofrecido por el ventilador. Existen diferentes tipos de disincronías y se pueden agrupar de diferentes formas4,5: pueden suceder durante el tiempo inspiratorio, durante la transición entre la inspiración y la espiración, y/o durante la fase espiratoria6. La más prevalente, en todos los modos ventilatorios y durante todo el tiempo de VMI, son los esfuerzos inspiratorios inefectivos (EII) (aproximadamente el 68-70% del total)7,8. Se trata de un esfuerzo muscular inspiratorio que no logra activar el ventilador. Ocurre cuando el intento del paciente de iniciar una respiración no alcanza el umbral necesario para activar al equipo e iniciar un nuevo ciclo respiratorio6.
Las consecuencias, cuando se analizan las disincronías como un todo, incluyen un sin número de efectos adversos. Conllevan interpretaciones erróneas y decisiones equivocadas, con escenarios clínicos desfavorables3,9–12. Sin embargo, cuando el enfoque se limita exclusivamente a los EII, los resultados son contradictorios8.
Por este motivo, el objetivo de esta revisión es describir la frecuencia de aparición, métodos de diagnóstico y potenciales consecuencias fisiológicas de los EII. Además, se proponen estrategias clínicas para su manejo.
La estrategia de búsqueda utilizada incluyó los términos MeSH «Mechanical Ventilation» combinando con el operador booleano AND con «others terms»: «Asynchronies»; «ineffective triggering»; «patient ventilator asynchrony»; «patient ventilator interaction»; «dysynchrony»; «ineffective effort» y con el operador NOT para excluir estudios relacionados con «animals OR non-invasive mechanical ventilation». La búsqueda se llevó a cabo en la base PubMed, abarcando publicaciones entre 2000 y 2024, con el objetivo de incorporar estudios recientes y relevantes. De esta manera la búsqueda quedó tal como se detalla a continuación: (((«respiration, artificial»[MeSH Terms] AND «Asynchronies»[Other Term] OR «ineffective triggering»[Other Term] OR «patient ventilator asynchrony»[Other Term] OR «patient ventilator interaction»[Other Term] OR «dysynchrony»[Other Term] OR «ineffective effort»[Other Term] AND (2000:2024[pdat]))) NOT (animals[Other Term])) NOT (non-invasive positive pressure ventilation[MeSH Terms]) AND (2000:2024[pdat]). De esta manera se registraron 114 resultados.
Inicialmente, se revisaron títulos y resúmenes para identificar aquellos estudios centrados en la asincronía paciente-ventilador en VMI, con especial énfasis en el esfuerzo ineficaz. Se excluyeron artículos que involucraran ventilación no invasiva o investigaciones en animales, ya que el foco de la revisión es la ventilación invasiva en humanos. Además, se completó con la revisión de referencias bibliográficas de los artículos seleccionados. Tras una primera fase de lectura crítica, finalmente se incluyeron 62 estudios en la revisión final, conformados por ensayos clínicos, estudios observacionales (cohortes y casos y controles), así como revisiones sistemáticas y metaanálisis. Se aplicaron criterios a consideración de los autores en relación con la calidad metodológica y relevancia clínica para asegurar que los estudios seleccionados proporcionaran un análisis sólido de las asincronías ventilatorias y sus implicaciones clínicas. Se excluyeron estudios que no cumplían con los criterios de inclusión, así como aquellos con limitaciones metodológicas significativas o sin datos cuantitativos robustos sobre los desenlaces clínicos relacionados con la asincronía (ver diagrama de búsqueda en material adicional 1).
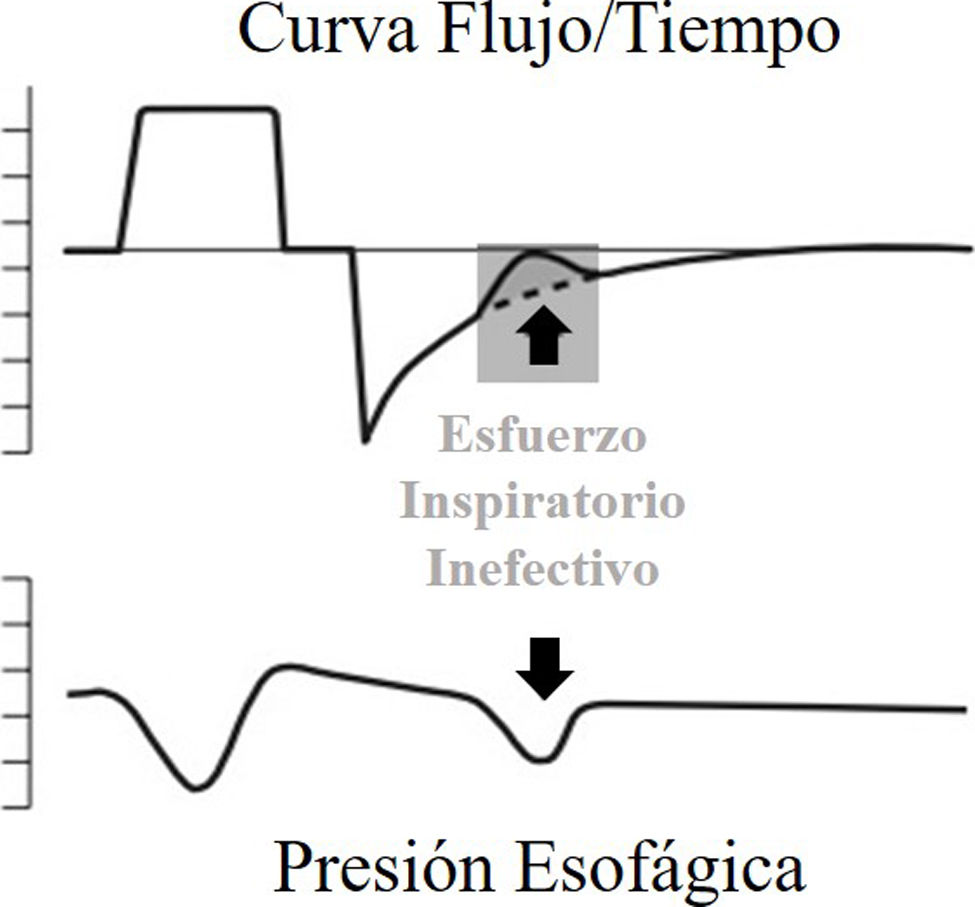
Esfuerzos inspiratorios inefectivosEl disparo ineficaz se refiere al esfuerzo muscular inspiratorio que no logra activar el ventilador. Básicamente, esto ocurre cuando el intento del paciente de iniciar una respiración no alcanza el umbral necesario para activar al equipo. En términos fisiológicos, esto significa que el ventilador no detecta los esfuerzos inspiratorios del paciente, los cuales se caracterizan por un aumento en la presión transdiafragmática y/o en la actividad eléctrica del diafragma6. Desde un punto de vista gráfico, los EII se manifiestan en las curvas del ventilador como una disminución súbita en el flujo espiratorio (se hace menos negativo). Pueden presentarse en modos controlados o asistidos, y si bien pueden producirse durante la fase inspiratoria, son mucho más frecuentes durante la espiración1. Cuando sucede durante la fase espiratoria, reestablecen el volumen pulmonar al final de la espiración a un nivel más bajo y, por ende, disminuye la auto-PEEP5,13.
Durante la VMI, la variable que inicia el ciclo ventilatorio depende del modo ventilatorio y el nivel de participación del paciente. En modos controlados, la variable que gatilla la inspiración es el tiempo y para ello se programa en el ventilador una frecuencia respiratoria (FR) mínima. En modos asistidos las variables más utilizadas son el flujo instantáneo y la presión. El esfuerzo inspiratorio del paciente acelera el flujo desde la línea de base del ventilador y/o disminuye la presión a un nivel preestablecido (sensibilidad de disparo programada) y comienza la inspiración. Se considera que la activación por flujo representa menos trabajo para el paciente14, aunque la evidencia expone mínimas y no significativas diferencias entre ambas formas de activación15.
Si el esfuerzo inspiratorio comienza antes de que se haya alcanzado la situación de equilibrio en el sistema (de que las presiones a nivel alveolar y en la vía aérea sean iguales), la primera parte del esfuerzo se consume en que esto suceda (debe vencer la carga elástica umbral). Si, además, el esfuerzo ulterior es insuficiente para superar ésta y luego llegar al umbral de activación, se produce el EII16 (fig. 1).
Prevalencia de los esfuerzos inspiratorios inefectivosLas disincronías se han estudiado a lo largo de los años generalmente como un todo, en forma de índice y más recientemente como «clusters», o sea, agrupados (período de 3 minutos de VMI con 30 EII o más) entre períodos prolongados sin eventos. Esto debido a la variedad de factores que intervienen en su desarrollo, y a que los mismos pueden variar durante el curso de la VMI17,18.
Los EII constituyen uno de los tipos de disincronía paciente-ventilador más frecuente. Ocurren en la mayoría de las poblaciones de pacientes, en distintos modos ventilatorios y durante diversos momentos del día15. Un índice de disincronías (IA) mayor del 10% (más del 10% de todas las respiraciones en VMI con algún tipo de disincronía), al igual que un índice de EII mayor del 10%, se consideran graves y se asocian a peores desenlaces en los pacientes: aumento de días en VMI [(duración de la VMI IA<10 vs. IA>10: 7 vs. 25 días, respectivamente; p=0,005) (VMI>7 días IA<10 vs. IA>10: 49% vs. 87%, respectivamente; p=0,01)]9. Similarmente, la presencia de al menos un evento de tipo cluster de EII se constituye como un factor independiente de resultados clínicos desfavorables: la presencia del evento el primer día se asoció con un mayor riesgo de permanecer en ventilación mecánica durante más de 8 días [OR 6,4; IC 95% (1,07-38,28): p=0,042] y también de mortalidad hospitalaria [OR 20; IC 95% (2,28-175,23): p=0,007]17.
En el estudio más grande publicado, que surge del análisis de casi 9 millones de respiraciones, la ocurrencia de EII se asoció a pacientes con obstrucción al flujo aéreo y al modo presión de soporte (PC-CSV, del inglés Pressure Control Continuous Spontaneous Ventilation): fue significativamente mayor que durante los modos presión control (PC-CMV, del inglés Pressure Control Continuous Mandatory Ventilation) y volumen control (VC-CMV, del inglés Volumen Control Continuous Mandatory Ventilation) y se asoció de manera directamente proporcional al nivel de presión de soporte utilizado: a mayor presión de asistencia, más posibilidades de desarrollar un IA y un índice de EII grave, con peores resultados clínicos: tendencia a aumento de días en VMI y mayor mortalidad en UCI y en el hospital [(mortalidad en UCI IA<10 vs. IA>10 23% vs. 67%, respectivamente; p=0,044) (mortalidad en hospital IA<10 vs. IA>14% vs. 67%, respectivamente; p=0,011)]7.
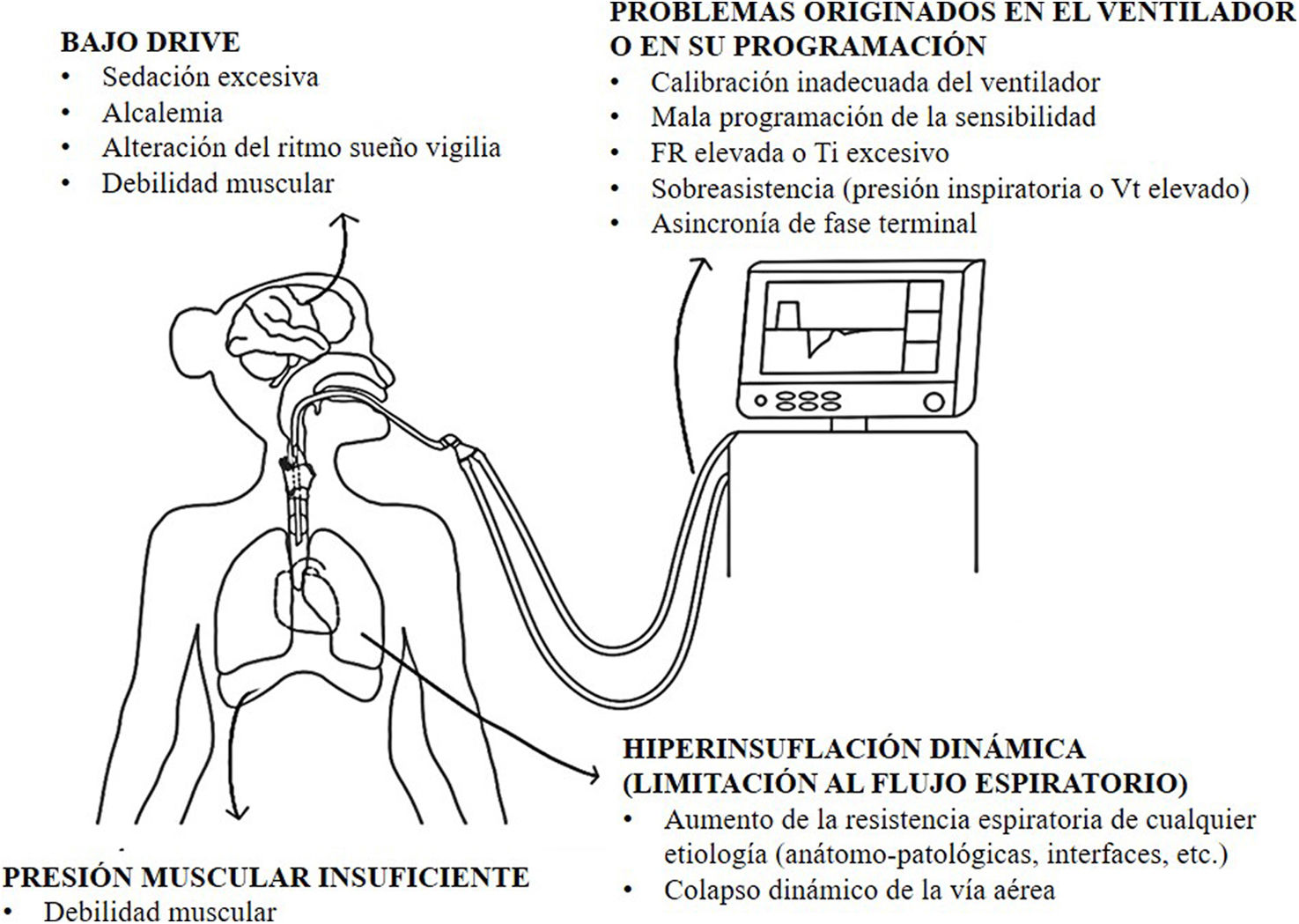
Fisiopatología de los esfuerzos inspiratorios inefectivosLa presencia de EII puede deberse a varias causas (fig. 2), algunas determinadas por factores predisponentes (propios de los pacientes) y otras por factores precipitantes (determinados por la programación ventilatoria y por el tiempo que lleva el paciente en VMI): la hiperinsuflación dinámica (HD) generada por obstrucción al flujo espiratorio, por colapso dinámico (observada en pacientes obstructivos, fundamentalmente) y la presión muscular insuficiente por debilidad son factores predisponentes. Por su parte, el bajo drive (a consecuencia de analgesia/sedación excesiva) y la programación de parámetros ventilatorios que predispongan a ganancia de grandes volúmenes corrientes y tiempo espiratorio insuficiente, entre otros, son factores precipitantes.
- •
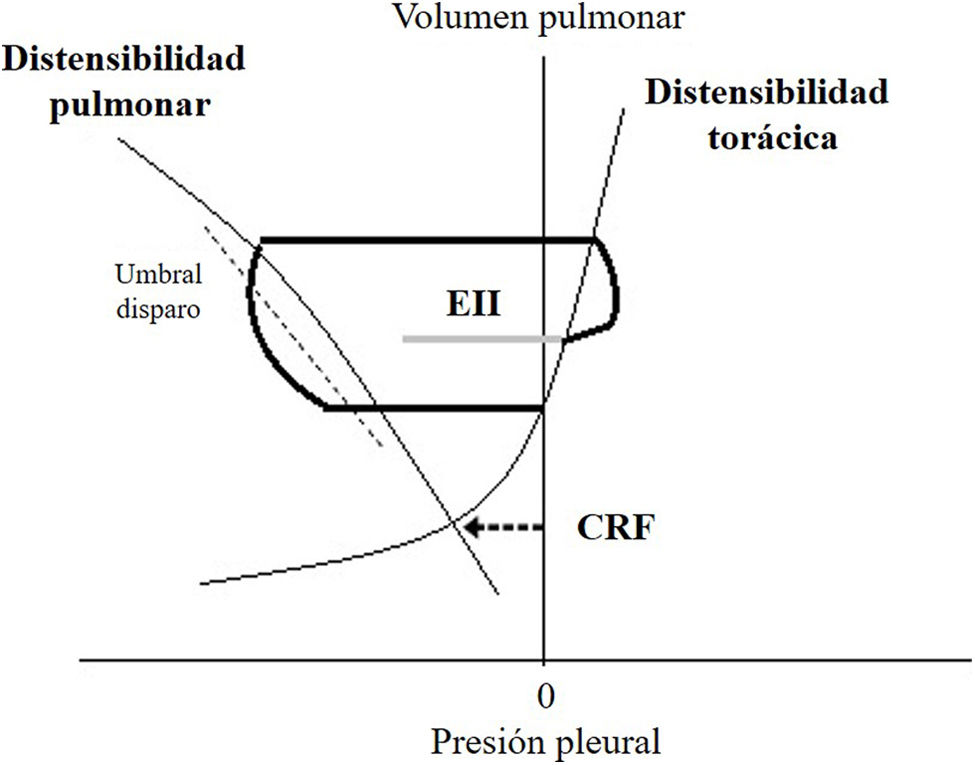
HD- limitación al flujo espiratorio: en pacientes con constantes de tiempo espiratorio prolongado (que necesitan tiempos espiratorios prolongados para el «vaciado» pulmonar) y colapso dinámico de la vía aérea, el sistema no alcanza la situación de equilibrio al final de la espiración. Si el paciente empieza a inspirar en volúmenes pulmonares por encima del EELV (volumen pulmonar al final de la espiración —eso sucede cuando la presión a nivel alveolar es mayor que en la vía aérea—) y el esfuerzo no es suficiente para superar la carga elástica impuesta por el atrapamiento, igualar las presiones (a nivel alveolar y en la vía aérea) y luego llegar al umbral de activación, se produce el EII. Esto se puede visualizar con un diagrama de Campbell, el cual permite hacer un análisis gráfico del trabajo respiratorio (ciclo a ciclo) a partir de la relación entre la presión pleural (estimada mediante manometría esofágica), la elastancia del pulmón y la de la caja torácica19 (fig. 3).
- •
Bajo drive y presión muscular insuficiente: la disminución de la presión muscular puede estar asociada a sedación excesiva, a alteración del ritmo sueño-vigilia y/o a debilidad muscular20,21. En este contexto, el esfuerzo inspiratorio del paciente es menor que el necesario para generar la aceleración del flujo y/o la disminución de la presión en la vía aérea al nivel preestablecido, determinado por la variable de trigger (programada en el ventilador) para que se inicie la siguiente inspiración.
- •
Parámetros ventilatorios: la programación ventilatoria puede agudizar la condición de atrapamiento aéreo e inclusive, por sí sola, generar también auto-PEEP aún en ausencia de obstrucción al flujo aéreo: FR elevadas, disincronías en la transición entre la fase inspiratoria y la espiratoria (que predisponen a mayores VT al final de la inspiración, como el doble trigger) y situaciones de sobreasistencia por presiones inspiratorias/VT excesivos (en PC-CMV y VC-CMV, respectivamente) contribuyen de manera directamente proporcional al desarrollo de EII por atrapamiento aéreo18,22,23. El mecanismo descripto para esta situación es el mismo que en pacientes con auto-PEEP por limitación al flujo espiratorio, por colapso dinámico de la vía aérea.
Determinar la cantidad de trabajo «ideal» que deben realizar los músculos respiratorios durante la falla respiratoria aguda representa una situación difícil de resolver24. En ese contexto, la disfunción diafragmática inducida por el ventilador probablemente sea el resultado del soporte ventilatorio aplicado de manera inapropiada. El término miotrauma diafragmático, que incluye atrofia por desuso, aumento de la carga por asistencia insuficiente, acortamiento excesivo y contracciones excéntricas (CCEE), se presenta en el 50% de los pacientes que reciben VMI25–27. La mayoría de estos mecanismos han sido revisados en los últimos años y están asociados a resultados desfavorables28. Sin embargo, poco se conoce sobre las CCEE y su efecto sobre la función del diafragma29. Por definición, contracción excéntrica es aquella en la que un determinado músculo experimenta activación y genera fuerza durante el alargamiento de sus fibras musculares30. Una de las situaciones más frecuentes en la UCI en las que el diafragma se contrae durante el alargamiento son los EII y la asincronía de «trigger reverso»31. Durante el «trigger reverso», los esfuerzos inspiratorios del paciente comienzan después de la insuflación pasiva (respiración iniciada por el ventilador, por tiempo) y se deben a un mecanismo fundamentalmente reflejo32. Esto, el hecho de tratarse de un mecanismo fundamentalmente reflejo, podría hacer que no deban considerarse como EII propiamente dichos. En el caso de que sí (y en función de la magnitud del esfuerzo que se haya desarrollado), pueden asociarse a cambios adaptativos beneficiosos que contribuyen a limitar el daño muscular33. Pese a esto, en general se asume que la lesión del músculo esquelético es más pronunciada luego de CCEE y que la fuerza se ve rápidamente disminuida debido a lesiones estructurales y alteraciones metabólicas34–37. Sin embargo, por el otro, y en el contexto de un mecanismo reflejo, las CCEE pueden asociarse (dependiendo de la magnitud del esfuerzo inspiratorio desarrollado) a cambios adaptativos beneficiosos a nivel de las fibras musculares, que pueden limitar y prevenir el desarrollo de atrofia por desuso37. La evidencia es escasa y los resultados, contradictorios. Gea et al. evaluaron los efectos funcionales de series repetidas de CCEE sobre el diafragma de un modelo experimental canino38. Observaron disminución significativa de la contracción del músculo y de la presión generada por estos. Los autores sostuvieron que se produjeron tanto lesiones metabólicas como estructurales, debido a factores mecánicos (rotura de sarcómeros y disrupción de los sarcolemas) y biológicos: estrés oxidativo, respuesta inflamatoria local, depleción de glucógeno y daño muscular mediado por citoquinas39,40 Sin embargo, agregaron que las CCEE no son necesariamente negativas para el músculo y que pueden promover, en determinadas situaciones, cambios adaptativos que generan fibras mayores y con más sarcómeros, que aportan beneficios en términos de fuerza y resistencia ante futuras lesiones14,41.
Esfuerzos inspiratorios inefectivos y desenlaces clínicosSi bien los desenlaces clínicos parecen estar influidos por múltiples factores, e inclusive parece determinante la forma en que se cuantifican las disincronías (IA o presencia de clusters), los pacientes con mayor cantidad de EII tienen evoluciones menos favorables9,17,18 (tabla 1). Aún resta definir si se trata solamente de un marcador de gravedad de enfermedad o si los EII por sí solos se asocian al desarrollo de dichos resultados13,29. Existen argumentos fisiológicos que podrían sostener esta relación de causalidad20,44,45. Sin embargo, la heterogeneidad de la evidencia disponible y algunos resultados contradictorios no permiten responder con certeza a esa pregunta.
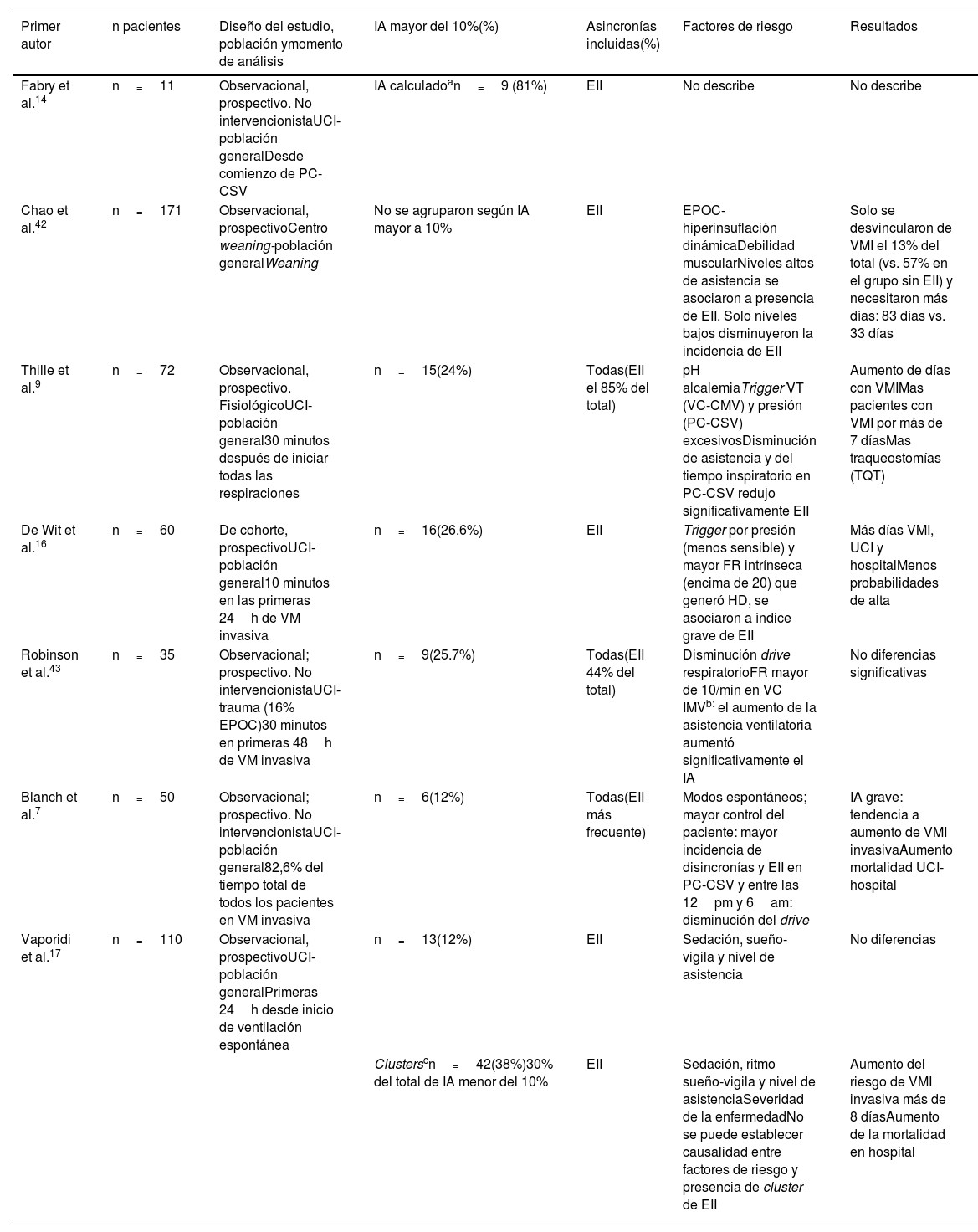
Prevalencia de los esfuerzos inspiratorios inefectivos según diferentes autores
| Primer autor | n pacientes | Diseño del estudio, población ymomento de análisis | IA mayor del 10%(%) | Asincronías incluidas(%) | Factores de riesgo | Resultados |
|---|---|---|---|---|---|---|
| Fabry et al.14 | n=11 | Observacional, prospectivo. No intervencionistaUCI-población generalDesde comienzo de PC-CSV | IA calculadoan=9 (81%) | EII | No describe | No describe |
| Chao et al.42 | n=171 | Observacional, prospectivoCentro weaning-población generalWeaning | No se agruparon según IA mayor a 10% | EII | EPOC-hiperinsuflación dinámicaDebilidad muscularNiveles altos de asistencia se asociaron a presencia de EII. Solo niveles bajos disminuyeron la incidencia de EII | Solo se desvincularon de VMI el 13% del total (vs. 57% en el grupo sin EII) y necesitaron más días: 83 días vs. 33 días |
| Thille et al.9 | n=72 | Observacional, prospectivo. FisiológicoUCI-población general30 minutos después de iniciar todas las respiraciones | n=15(24%) | Todas(EII el 85% del total) | pH alcalemiaTrigger’VT (VC-CMV) y presión (PC-CSV) excesivosDisminución de asistencia y del tiempo inspiratorio en PC-CSV redujo significativamente EII | Aumento de días con VMIMas pacientes con VMI por más de 7 díasMas traqueostomías (TQT) |
| De Wit et al.16 | n=60 | De cohorte, prospectivoUCI-población general10 minutos en las primeras 24h de VM invasiva | n=16(26.6%) | EII | Trigger por presión (menos sensible) y mayor FR intrínseca (encima de 20) que generó HD, se asociaron a índice grave de EII | Más días VMI, UCI y hospitalMenos probabilidades de alta |
| Robinson et al.43 | n=35 | Observacional; prospectivo. No intervencionistaUCI-trauma (16% EPOC)30 minutos en primeras 48h de VM invasiva | n=9(25.7%) | Todas(EII 44% del total) | Disminución drive respiratorioFR mayor de 10/min en VC IMVb: el aumento de la asistencia ventilatoria aumentó significativamente el IA | No diferencias significativas |
| Blanch et al.7 | n=50 | Observacional; prospectivo. No intervencionistaUCI-población general82,6% del tiempo total de todos los pacientes en VM invasiva | n=6(12%) | Todas(EII más frecuente) | Modos espontáneos; mayor control del paciente: mayor incidencia de disincronías y EII en PC-CSV y entre las 12pm y 6am: disminución del drive | IA grave: tendencia a aumento de VMI invasivaAumento mortalidad UCI-hospital |
| Vaporidi et al.17 | n=110 | Observacional, prospectivoUCI-población generalPrimeras 24h desde inicio de ventilación espontánea | n=13(12%) | EII | Sedación, sueño-vigila y nivel de asistencia | No diferencias |
| Clusterscn=42(38%)30% del total de IA menor del 10% | EII | Sedación, ritmo sueño-vigila y nivel de asistenciaSeveridad de la enfermedadNo se puede establecer causalidad entre factores de riesgo y presencia de cluster de EII | Aumento del riesgo de VMI invasiva más de 8 díasAumento de la mortalidad en hospital |
En el estudio de Thille et al.9, al igual que en otros17,18, los EII representaron el 85% del total de las disincronías. Aquí los pacientes con alto IA y de esfuerzos inefectivos tuvieron más días de ventilación mecánica y menos probabilidades de ser dados de alta. Los EII también fueron la disincronía más frecuente en pacientes críticos crónicos fuera de la UCI: solo 3 de 19 pacientes que habían tenido un alto índice de EII lograron desvincularse de la VMI42 (tabla 1).
Blanch et al.7, a partir del análisis de casi 9 millones de respiraciones, observaron, en quienes tenían un IA mayor del 10%, aumento de la mortalidad en UCI y hospitalaria, junto con tendencia hacia una mayor duración de la VMI.
Pareciera que la forma mediante la cual se cuantifican los EII influye en los resultados. A partir del índice de gravedad de disincronías propuesto por Fabry y el utilizado por De Wit para EII, la mayoría de los estudios que dividieron a su población dicotómicamente (IA-EII mayor del 10% vs. menor) revelaron evoluciones más desfavorables en quienes tuvieron un porcentaje más alto de respiraciones con disincronías17,18. Sin embargo, hace algunos años, Vaporidi y Georgopoulos15 propusieron e incorporaron su concepto de clusters (al menos un período de 3 minutos de VM con 30 EII o más) de EII. Los autores argumentaron que los índices que utilizan como punto de corte el 10% no derivan de una muestra representativa. Además, sugirieron que los EII tienden a ocurrir en clusters, debido a que los factores de riesgo para el desarrollo de EII (sedación, los estados de vigilia, el nivel de asistencia y drive ventilatorio) pueden variar durante el curso de la VMI14. De esta manera, sostuvieron que, por tratarse de fenómenos biológicos no lineales, las evaluaciones deberían ser esporádicas y dispersas. Diseñaron un modelo matemático para detectarlos y utilizaron el concepto de cluster o evento. Analizaron a 110 pacientes durante las primeras 24 horas de respiración asistida y en total tuvieron 2931 horas y aproximadamente 4 millones y medio de respiraciones. Luego del análisis multivariado, encontraron que la presencia del evento en el primer día de observación se asoció con aumento significativo del riesgo de VMI por más de 8 días y de mortalidad hospitalaria y que, a mayor potencia y duración del evento (como mínimo 3 minutos), más días de VMI a partir del primer registro. Como contrapartida, cuando dividieron a la población según índice de EII (mayor o menor del 10%) y analizaron los resultados de los pacientes que tuvieron índice grave, no encontraron asociación significativa con ningún resultado.
Esfuerzos inspiratorios inefectivos y tratamientoLos EII pueden ser secundarios a múltiples causas y se deben a la combinación de factores predisponentes y precipitantes, determinados por la programación ventilatoria y por el tratamiento farmacológico46. Controlar los factores de riesgo y llevar a cabo intervenciones para disminuir la HD, evitando la sobreasistencia y el uso excesivo de sedantes, en pos de una adecuada interacción entre el paciente y el ventilador, surgen como las intervenciones adecuadas21,47. Además, disminuir la sensibilidad de disparo del ventilador y programar PEEP externa, en situaciones específicas, podría contribuir a mejorar los resultados. Disminuir la presión de soporte ha mostrado ser un método muy eficaz para evitar los EII en el estudio de Chao, y por la misma línea, Thille et al. observaron que niveles más bajos de presión de soporte disminuyeron significativamente los EII, sin aumento en el costo metabólico de la respiración22,48.
Utilizar sedantes y bloqueantes neuromusculares aumenta los problemas tanto durante la fase de soporte total como durante la de soporte parcial22. Ante esa situación, los modos de asistencia proporcional parecen ofrecer grandes beneficios. Debido a sus principios fisiológicos de funcionamiento (entrega de gas que sigue el patrón respiratorio del paciente, en amplitud y sincronización) tanto PAV+ (del inglés Proportional Assist Ventilation) como NAVA (del inglés neurally adjusted ventilatory assist) favorecen la sincronía entre el paciente y el ventilador (entre los tiempos inspiratorios neural y mecánico) y minimizan el riesgo de sobreasistencia, ya que disminuyen la ganancia de volumen en cada ciclo respiratorio49,50. PAV+, a partir de mediciones de flujo y volumen y del cálculo de compliance y resistencia, conoce la presión de trabajo de cada ciclo respiratorio y aporta un determinado porcentaje de asistencia, en función de la «ganancia» programada por el operador en el ventilador. Los ciclos se inician con el esfuerzo del paciente (genera variaciones en el flujo que detecta el ventilador) y finalizan, también, con el cese del mismo. Tanto presión como flujo varían con el esfuerzo del paciente y ello plantea 2 ventajas conceptuales importantes: sincronía de flujo y de ciclado y limitación del VT, ya que depende exclusivamente de la magnitud del esfuerzo del paciente. NAVA requiere la colocación de una sonda nasogástrica con electrodos que detectan la actividad del diafragma (EAdi, del inglés electrical activity of the diaphragm). Los sensores envían información sobre el inicio, la intensidad y la finalización de los esfuerzos. Al igual que PAV+ (y a partir de la programación de una ganancia determinada en cmH2O/mV) entregan flujo y presión en proporción a la señal electromiográfíca del diafragma. Por dicho motivo presenta los mismos beneficios conceptuales que PAV+: sincronía en todas las fases del ciclo respiratorio y mejoría en la variabilidad del VT, impulsado por el esfuerzo del paciente.
En un estudio de diseño cruzado ningún paciente en NAVA, comparado con PC-CSV (el 36% del total), tuvo EII superior al 10%. Se registraron parámetros respiratorios y clínicos y se utilizaron diferentes niveles de asistencia, en ambos modos, que se aplicaron al azar. En los niveles de asistencia más altos, los pacientes durante PC-CSV tuvieron, de manera estadísticamente significativa, VT más altos y esfuerzos respiratorios más bajos, medidos en forma de EADI pico51. En otro estudio de diseño cruzado, en pacientes en proceso de destete durante la realización de una prueba de respiración espontánea (PRE), NAVA en relación con PC-CSV redujo significativamente el IA (mediana de11,5% vs. 24,3%), pero sin diferencias en los parámetros ventilatorios: VT y FR52. En pacientes en VMI, sin sedantes y en su gran mayoría EPOC (estudio cruzado en el que utilizaron 2 niveles de asistencia tanto en PC-CSV como en NAVA), el uso de NAVA disminuyó significativamente la incidencia de EII y mejoró la sincronía paciente-ventilador. En el nivel más alto de asistencia, NAVA respecto a PC-CSV eliminó de manera estadísticamente significativa los EII y redujo las disincronías al inicio de la inspiración y en la transición entre la fase inspiratoria y la espiratoria53. Resultados similares arrojaron estudios en los que se utilizó PAV+. En un estudio aleatorizado en 208 pacientes críticos que habían estado, al menos, 36 horas en VMI controlada, la ventilación asistida proporcional disminuyó significativamente el número de EII cuando se comparó con PC-CSV54 y demostró una disminución significativa en el porcentaje de IA (5,6% del total en PAV+ y 29% en PC-CSV). Los pacientes fueron seguidos durante 48 horas, a excepción de que cumplieran criterios para volver a modos controlados o que estuviesen en condiciones de respirar sin asistencia. Si bien la proporción de pacientes que cumplieron los criterios para respirar espontáneamente no difirió entre los grupos, la tasa de fracaso (necesidad de volver a modos controlados) fue significativamente menor en PAV+ que en PC-CSV (11,1% vs. 22%, respectivamente)55. Sin embargo, y pese a esto, aún no existe evidencia que permita asociar estos beneficios (en términos de efectos fisiológicos) a mejores resultados clínicos.
Como describimos, con los sistemas convencionales de activación y ciclado, un gran número de pacientes experimentan disincronías, especialmente EII. Los softwares desarrollados para solucionar este problema (IE Sync™ de Puritan Bennett, IntelliCycle de Mindray, o IntelliSync, por ejemplo) han demostrado efectividad disminuyendo el desarrollo de disincronías cuando se compararon con criterios fijos, sin cambios en los patrones respiratorios56. Los mismos están diseñados para que cada respiración del paciente sea efectiva, sin sumarle invasividad al método ya que no requiere colocación de catéteres ni sensores adicionales. En su lugar, utiliza las mediciones de presión y flujo que el ventilador ya está midiendo, para estimar los cambios en la presión intrapleural como medio para reconocer el inicio y el final del esfuerzo inspiratorio de un paciente. Estos softwares de activación y ciclado no invasivo pueden ser especialmente valiosos para proporcionar una adecuada sincronía, especialmente, en aquellos pacientes con esfuerzos inspiratorios débiles57–59. En esta situación, debido a que el sistema de ajuste automático analiza el flujo y la presión en la vía aérea miles de veces por segundo (mediante el análisis en tiempo real de las formas de onda y la pendiente), el esfuerzo inspiratorio del paciente no necesita movilizar el flujo hasta un valor predeterminado (por ejemplo 1L/min). Aquí, el algoritmo activará la fase inspiratoria del ventilador cuando detecte un aumento repentino en el flujo (o derivada en la pendiente de la onda del flujo) que refleja el esfuerzo inspiratorio. Esta tecnología puede, de esta manera, reducir el retraso en el disparo inspiratorio y la incidencia de EII.
El diagnóstico clínico de las disincronías es engorroso, propenso al subdiagnóstico y está atravesado, incluso, por el grado de experiencia del evaluador60. Diversos estudios han demostrado que la implementación de entrenamiento específico en el tema con intervenciones sobre el personal que se ocupa del cuidado del paciente mejora los resultados61. Además, las dificultades en el reconocimiento y tratamiento de las disincronías transforman al campo en un lugar sumamente propicio para la intervención de la inteligencia artificial, a través de algoritmos que puedan identificar cambios en las curvas del ventilador en tiempo real (fundamentalmente las de presión y flujo) y que activen intervenciones que permitan influir sobre estos. El estudio de De Haro et al. demuestra que la inteligencia artificial —en particular las redes neuronales recurrentes— podrían ser una herramienta excelente para identificar cambios en la presión de la vía aérea durante la VC-CMV con flujo constante, permitiendo minimizar los períodos no reconocidos de interacción inadecuada entre el paciente y el ventilador62.
A la luz de la evidencia disponible, los EII se asocian a resultados clínicos y desenlaces, muchas veces, contradictorios8,11,14. A partir de esto, la duda sobre si conviene tratarlos (para eliminarlos), o permitir su presencia con el objetivo de generar entrenamiento para el diafragma, permanece latente. Probablemente, estratificarlos (según presencia o no de clusters), identificar el fenotipo y, fundamentalmente, medir el esfuerzo durante las contracciones se constituye como la mejor estrategia. Si esto no resulta factible en la práctica de rutina, identificar a los pacientes con factores de riesgo de HD, evitar el uso excesivo de sedantes/analgésicos/BNM y favorecer la sincronía entre el paciente y el ventilador con el uso de modos de asistencia proporcional durante la fase de salida de la VMI podrían ser una opción.
ConclusionesLos esfuerzos inefectivos constituyen uno de los tipos de disincronías paciente-ventilador más frecuentes durante la ventilación mecánica. Más allá de pacientes susceptibles (con HD, por obstrucción al flujo espiratorio en contexto de compresión dinámica de la vía aérea), la sobreasistencia ventilatoria, la debilidad muscular, los niveles de sedación excesivos y una inadecuada programación de la sensibilidad inspiratoria podrían ser los principales mecanismos para la ocurrencia de estos. En la actualidad, existe evidencia que asocia la alta incidencia de EII con peores resultados clínicos. Sin embargo, aún se desconoce si esta asociación es causal o más bien un marcador de severidad de la enfermedad. Por lo pronto, implementar estrategias de detección y tratamiento que puedan limitarlos parece razonable. Futuras investigaciones son necesarias para comprender el potencial rol de la activación muscular excéntrica durante este tipo de interacción.
Declaración sobre el uso de la IA generativa y de las tecnologías asistidas por la IA en el proceso de redacciónDeclaramos no haber utilizado ningún tipo de inteligencia artificial (IA) para la elaboración del manuscrito ni de las imágenes.
FinanciaciónNo.
Conflicto de interesesGAP recibió financiación para programas de enseñanza por parte de Medtronic LATAM y recibió financiación para programas de enseñanza por parte de Vapotherm Inc. USA. LFD ha recibido financiamiento por consultorías y para programas de enseñanza por parte de STIMIT AG y Vyaire. GM recibió financiación para programas de enseñanza por parte de Medtronic LATAM.