El riesgo de eventos trombóticos está incrementado en pacientes con neumonía por coronavirus 2019 (COVID-19)1,2. Guías clínicas y sociedades científicas difieren en las recomendaciones para la prevención de estos eventos; la Sociedad Española de Medicina Intensiva y Unidades Coronarias (SEMICYUC) propuso ajustar la dosificación de heparina de bajo peso molecular (HBPM) mediante la obtención de niveles de factor anti-Xa3,4. Si bien justificaron esta recomendación por el alto riesgo de eventos trombóticos/hemorrágicos y la incidencia de infra/sobredosificación (23 y 46%), el nivel de evidencia fue C-III (apoyo ligero a la recomendación de su uso basada en opinión de expertos o estudios descriptivos). La utilidad de esta estrategia para la reducción de estas complicaciones, así como en la determinación de los niveles adecuados es controvertida3,5-7. Los objetivos de nuestro estudio fueron evaluar el ajuste de enoxaparina profiláctica por factor anti-Xa, los niveles obtenidos y la presencia de posibles factores de riesgo relacionados con la sobredosificación en pacientes ingresados con neumonía COVID-19 en una UCI.
Iniciamos un estudio observacional y retrospectivo en una UCI de un hospital de tercer nivel durante el período de julio del 2020 a febrero del 2021. Se evaluó a pacientes críticos con neumonía COVID-19 consecutivos, en los que se dirigió la dosis de enoxaparina profiláctica por niveles de factor anti-Xa. Los criterios de inclusión fueron: 1) pacientes con neumonía COVID-19 (presencia de infiltrados radiológicos y test PCR positivo para SARS-CoV-2 en muestras respiratorias); 2) necesidad de soporte respiratorio (oxigenoterapia de alto flujo, soporte no invasivo o ventilación mecánica invasiva), y 3) ajuste de dosificación de enoxaparina profiláctica dirigido por factor anti-Xa. Se excluyeron los casos que inicialmente tenían indicación terapéutica. En pacientes que modificaron su régimen de profiláctico a terapéutico durante el ingreso se incluyeron las dosis y niveles, así como complicaciones trombóticas/hemorrágicas durante el período de profilaxis.
El protocolo de nuestro centro para las dosis iniciales de enoxaparina consistía en: 1) dosis estándar 40mg/24h; 2) dosis de 60mg/24h en pacientes con índice de masa corporal (IMC)>30 o elevación de reactantes de fase aguda (D-dímero>1.500 ng/ml y proteína C reactiva>150mg/l), y 3) dosis de 80mg/24 h si se presentaban ambos factores de riesgo (IMC+reactantes elevados). En caso de insuficiencia renal se redujo la dosificación en función del aclaramiento de creatinina. Posteriormente se ajustó la dosis según niveles de anti-Xa; dado el elevado riesgo de trombosis publicado se acordaron multidisciplinarmente rangos objetivo a 0,30-0,59 UI/ml, similares a otros estudios publicados1,6,7. La medición se realizaba en estado de equilibrio de tratamiento de enoxaparina (48-72h sin cambios en la dosificación) y en fase pico, tras 3-5 h de la administración. Se repitieron periódicamente cada 2-3 días según situación clínica y respuesta al tratamiento.
Se recogieron variables demográficas, relacionadas con comorbilidad, gravedad al ingreso en UCI, estudios analíticos, tratamiento y necesidad de soporte. También se recogieron los eventos resultado «eventos trombóticos» durante la estancia en la UCI (trombosis venosa profunda o tromboembolia pulmonar agudo diagnosticados por estudios de imagen y solicitados a criterio del facultativo) y «hemorrágicos» (grave: localización crítica, reducción de Hb 2g/dl o transfusión de 2 concentrados de hematíes) y mortalidad durante la estancia en la UCI. Para el análisis estadístico, las variables categóricas se describieron con valor absoluto y proporción comparándose mediante test de la chi cuadrado o test de Fisher. Las variables continuas se representaron con su mediana y percentiles 25-75 comparándose mediante prueba t de Student o U de Mann-Whitney cuando las variables no cumplían la normalidad. Se analizaron los factores relacionados con las variables dependientes «niveles de factor anti-Xa ≥ 0,60 UI/ml» (valores superiores al rango objetivo) y «eventos trombóticos», mediante estudios de regresión logística multivariable. Se exploraron las variables con p<0,2 o con mayor interés clínico. El punto de corte de las variables continuas se ajustó por el método de Youden.
Se incluyó a 160 pacientes críticos con neumonía COVID-19 en profilaxis con enoxaparina ingresados en la UCI, realizándose un total de 589 determinaciones de factor anti-Xa. Los pacientes presentaban una mediana de edad de 63 años, siendo la comorbilidad más frecuente la obesidad (67%, N 107/160) y mostrando un aclaramiento de creatinina<30ml/min al ingreso del 6% (10/160). La mediana de dímero D al ingreso fue del 1242 ng/ml (p25-75, 704-3765), requiriendo ventilación mecánica invasiva en el 58% (94/160). La mortalidad durante la estancia en la UCI fue del 28% (45/160), con una incidencia de eventos trombóticos diagnosticados del 9% (15/160) y sangrado grave del 4% (7/160) (tabla 1).
Características clínicas de pacientes
| n | 160 |
| Demográficos | |
| Edad (años), mediana (p 25-75) | 63 (54-69) |
| Género, varón. n (%) | 107 (66,9) |
| Antecedentes | |
| Sin comorbilidades, n (%) | 41 (25,6) |
| Obesidad (IMC ≥ 30), n (%) | 108 (67,5) |
| Peso | 82,5 (76,5-100) |
| Hipertensión, n (%) | 92 (57,5) |
| Diabetes mellitus, n (%) | 43 (26,9) |
| Fumador, n (%) | 4 (2,5) |
| Insuficiencia cardíaca crónica, n (%) | 14 (8,8) |
| Insuficiencia respiratoria crónica, n (%) | 29 (18,1) |
| Insuficiencia renal crónica, n (%) | 7 (4,4) |
| Enfermedad tromboembólica previa, n (%) | 4 (2,5) |
| Antecedentes oncológicos, n (%) | 14 (8,8) |
| Trasplante de órgano sólido, n (%) | 1 (0,6) |
| Gravedad al ingreso | |
| Escala APACHE II, mediana (p25-75) | 9,5 (7-13) |
| Escala SOFA, mediana (p25-75) | 4 (3-4) |
| Estudios de laboratorio | |
| Plaquetas ×103/μl, mediana (p25-75) | 285 (224-350) |
| Aclaramiento de creatinina ml/min, mediana (p25-75) | 103 (70-125) |
| Aclaramiento de creatinina<30 ml/min, mediana (p25-75) | 10 (6,3) |
| Dímero D ng/ml, mediana (p25-75) | 1242 (704-3765) |
| Proteína C reactiva mg/l, mediana (p25-75) | 58 (24-127) |
| Tratamiento | |
| Oxigenoterapia alto flujo, n (%) | 138 (86,3) |
| Ventilación mecánica invasiva, n (%) | 94 (58,8) |
| Prono, n (%) | 77 (48,1) |
| Vasoactivos, n (%) | 74 (46,3) |
| Técnicas de sustitución renal, n (%) | 18 (11,3) |
| ECMO, n (%) | 6 (3,8) |
| Bolos de corticoides, n (%) | 109 (68,1) |
| Resultados | |
| Eventos hemorrágicos, n (%) | 17 (10,6) |
| Hemorragia grave, n (%) | 7 (4,4) |
| Eventos trombóticos, n (%) | 15 (9,4) |
| Tromboembolia pulmonar, n (%) | 12 (7,5) |
| Mortalidad durante la estancia UCI, n (%) | 45 (28,1) |
APACHE: Acute Physiology And Chronic Health Evaluation; COVID-19: coronavirus 2019; ECMO: extra corporeal membrane oxygenation; IMC: índice de masa corporal; SOFA: Sequential Organ Failure Assessment; UCI: Unidad de Cuidados Intensivos.
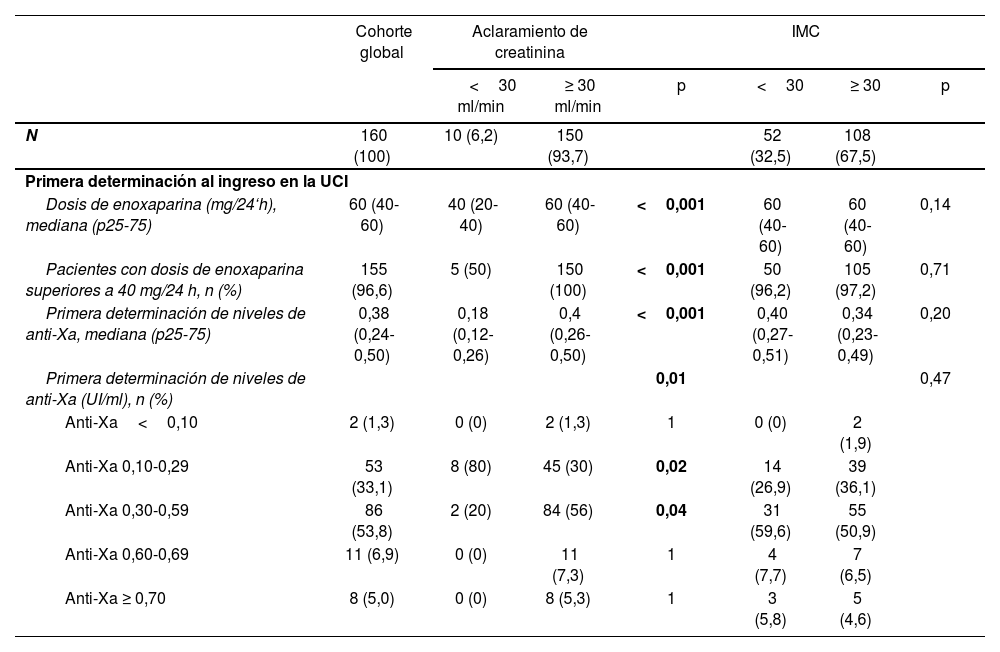
La tabla 2 refleja las dosis de enoxaparina recibida y los valores de factor anti-Xa obtenidos en su primera determinación y durante la estancia en UCI. Cuando se realizó la primera determinación, la mediana de dosis de enoxaparina administrada fue de 60mg/24h (p25-75, 40-60). En relación con estas dosis, la primera determinación de niveles de factor anti-Xa presentaba una mediana de 0,28 UI/ml (0,34-0,50): el 53% (85/160) se encontraba en rango objetivo 0,30-0,59 UI/ml.
Dosis de enoxaparina profiláctica y niveles de factor anti-Xa en pacientes críticos con neumonía COVID-19
| Cohorte global | Aclaramiento de creatinina | IMC | |||||
|---|---|---|---|---|---|---|---|
| <30 ml/min | ≥ 30 ml/min | p | <30 | ≥ 30 | p | ||
| N | 160 (100) | 10 (6,2) | 150 (93,7) | 52 (32,5) | 108 (67,5) | ||
| Primera determinación al ingreso en la UCI | |||||||
| Dosis de enoxaparina (mg/24‘h), mediana (p25-75) | 60 (40-60) | 40 (20-40) | 60 (40-60) | <0,001 | 60 (40-60) | 60 (40-60) | 0,14 |
| Pacientes con dosis de enoxaparina superiores a 40 mg/24 h, n (%) | 155 (96,6) | 5 (50) | 150 (100) | <0,001 | 50 (96,2) | 105 (97,2) | 0,71 |
| Primera determinación de niveles de anti-Xa, mediana (p25-75) | 0,38 (0,24-0,50) | 0,18 (0,12-0,26) | 0,4 (0,26-0,50) | <0,001 | 0,40 (0,27-0,51) | 0,34 (0,23-0,49) | 0,20 |
| Primera determinación de niveles de anti-Xa (UI/ml), n (%) | 0,01 | 0,47 | |||||
| Anti-Xa<0,10 | 2 (1,3) | 0 (0) | 2 (1,3) | 1 | 0 (0) | 2 (1,9) | |
| Anti-Xa 0,10-0,29 | 53 (33,1) | 8 (80) | 45 (30) | 0,02 | 14 (26,9) | 39 (36,1) | |
| Anti-Xa 0,30-0,59 | 86 (53,8) | 2 (20) | 84 (56) | 0,04 | 31 (59,6) | 55 (50,9) | |
| Anti-Xa 0,60-0,69 | 11 (6,9) | 0 (0) | 11 (7,3) | 1 | 4 (7,7) | 7 (6,5) | |
| Anti-Xa ≥ 0,70 | 8 (5,0) | 0 (0) | 8 (5,3) | 1 | 3 (5,8) | 5 (4,6) | |
| N | 160 (100) | 22 (13,7) | 138 (86,2) | 52 (32,5) | 108 (67,5) | ||
| Durante la estancia en la UCI | |||||||
| Media de dosis de enoxaparina (mg/24 h), mediana (p25-75) | 60 (53-73) | 60 (40-66) | 60 (53-73) | 0,10 | 60 (40-70) | 60 (55-80) | 0,01 |
| Media de niveles de anti-Xa, mediana (p25-75) | 0,48 (0,39-0,59) | 0,48 (0,35-0,57) | 0,48 (0,39-0,60) | 0,80 | 0,47 (0,39-0,57) | 0,49 (0,39-0,6) | 0,90 |
| Media de niveles de anti-Xa (UI/ml), n (%) | 0,48 | 0,93 | |||||
| Anti-Xa<0,10 | 2 (1,3) | 1 (4,5) | 1 (0,7) | 1 (1,9) | 1 (0,9) | ||
| Anti-Xa 0,10-0,29 | 18 (11,3) | 3 (13,6) | 15 (10,9) | 6 (11,5) | 12 (11,1) | ||
| Anti-Xa 0,30-0,59 | 100 (62,5) | 13 (59,1) | 87 (63) | 33 (63,5) | 67 (62) | ||
| Anti-Xa 0,60-0,69 | 29 (18,1) | 3 (13,6) | 26 (18,8) | 7 (13,5) | 22 (20,4) | ||
| Anti-Xa ≥ 0,70 | 11 (6,9) | 2 (9,1) | 9 (6,5) | 5 (9,6) | 6 (5,6) | ||
| Número de determinaciones de niveles de anti-Xa/paciente, mediana (p25-75) | 3 (2-5) | 4 (3-9) | 3 (2-5) | 0,02 | 3 (1,5-4) | 2 (3-5,5) | 0,31 |
COVID-19: coronavirus 2019; IMC: índice de masa corporal.
Los valores en negrita indican que el resultado es estadísticamente significativo; se consideran como tal aquellos valores de p < 0,05.
Durante el resto de la estancia, se ajustó la dosis de enoxaparina profiláctica según niveles de factor anti-Xa con objetivo (0,30-0,59 UI/ml). La media de niveles de factor anti-Xa fue de 0,48 UI/ml (0,39-0,59): el 62% (100/160) se encontraban en rango objetivo (0,30-0,59 UI/ml) y el 25% (24/160) en rango ≥ 0,60 UI/ml. Las dosis de enoxaparina>60mg/24h (OR 4,57; IC del 95%, 3,17-6,60; p<0,001) y los niveles de proteína C reactiva<175mg/dl (OR 2,30; IC 1,28-4,11; p=0,002) se asociaron de forma independiente a un incremento del riesgo de obtener valores de factor anti-Xa ≥ 0,60 UI/ml (superiores al objetivo) en el análisis multivariante (anexo tabla suplementaria 1). La mediana de dosis de enoxaparina ajustada durante la estancia fue de 60 (53-73) mg/24h, significativamente superior en pacientes con IMC>30 de 60 (55-80) vs. 60 (40-70) mg/24h (p=0,01). No se objetivaron variables relacionadas de forma independiente con el desarrollo de eventos trombóticos (anexo tabla suplementaria 2).
En la actualidad continúan publicándose nuevos estudios relacionados con la prevención de la trombosis en los pacientes COVID-19 (p, ej., INSPIRATION, REMAP-CUP, ATTACC, ACTIV-4a, etc.), pero aún no han sido aclarados aspectos clave como la dosis adecuada de HBPM y la posible optimización mediante niveles de factor anti-Xa2,3. En esta experiencia observamos que si bien al dirigir la dosis de enoxaparina profiláctica el 62% de los pacientes se encontraba con media de niveles de anti-Xa en rango objetivo, el 25% presentaba rangos superiores (≥ 0,60 UI/ml). Mayores dosis de heparina (enoxaparina>60mg/24h) y menores niveles de proteína C reactiva (< 175mg/dl) se asociaban de forma independiente a un mayor riesgo de sobredosificación. Bösch et al. han objetivado cómo valores elevados de proteína C reactiva puede influir en una resistencia a la actividad de la HBPM, lo que pudiera explicar que pacientes con valores más bajos en nuestro estudio estuvieran más expuestos a una sobredosificación8. A pesar de que niveles superiores al rango objetivo pueden suponer potencialmente un mayor riesgo de complicaciones, únicamente el 6% tenía niveles ≥ 0,70 UI/ml y la incidencia de hemorragias graves fue del 4%, no superior a la descrita en la literatura 2-6%6,7,9.
En este estudio la dosis enoxaparina administrada durante la estancia fue de 60mg/24h (p25-57, 50-73mg). Estas dosis son similares a la de otros estudios (mediana 60, 50-80mg/24h) que utilizaron monitorización con similares niveles objetivo (0,4-0,5 UI/ml)6. Mohamed et al. encuentran una elevada incidencia de sobredosificación (48%) cuando se administran dosis intermedias (0,5mg/kg/12h), una de las estrategias recomendadas en la literatura, y se monitorizan niveles de anti-Xa3,7. El riesgo de sobredosificación podría haber sido mayor de haber utilizado este régimen y no haber realizado monitorización, dada la alta incidencia de obesidad (67%) y niveles elevados de reactantes de fase aguda en nuestra cohorte2,3,7.
Finalmente, el objetivo de dirigir la dosificación de enoxaparina según factor anti-Xa es reducir el riesgo de eventos trombóticos. Destaca que en nuestro estudio se objetivó una incidencia del 9%, límite inferior de lo publicado en la literatura (9-26%), pero este análisis queda limitado, pues no se realizó una búsqueda sistemática de los mismos pudiendo infra diagnosticarse algunos eventos2,3.
Somos conscientes de las limitaciones del estudio pues se trata de un estudio observacional, retrospectivo, con búsqueda no sistemática de eventos trombóticos y de tamaño muestral limitado. Además, el rango objetivo planteado, si bien es similar a otros estudios, es controvertido con importante variabilidad en las publicaciones (p. ej., pacientes quirúrgicos 0,1-0,3 vs. otros estudios COVID-19 0,3-0,7 UI ml)5-10. A pesar de ello, creemos que esta experiencia clínica puede ser útil en el planteamiento de futuros estudios.
En conclusión, en este estudio de pacientes críticos con neumonía COVID-19 los niveles de factor anti-Xa obtenidos durante la estancia en UCI permitieron ajustar las dosis de enoxaparina profiláctica, si bien existe un riesgo elevado de sobredosificación incrementado en pacientes con mayores dosis de enoxaparina y niveles más bajos de proteína C reactiva.
Ética de la publicación científicaEste estudio fue aprobado por el Comité de Ética del Hospital Universitario Reina Sofía (Código 010408), el cual eximia de la necesidad de consentimiento escrito dada la naturaleza observacional y retrospectiva del mismo.
FinanciaciónEste estudio no ha obtenido financiación para su realización.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses
Los autores agradecen al Prof. Manuel Rodríguez Peralvarez y al Dr. Rafael León López el apoyo en el análisis estadístico de los datos.