Editado por: Federico Gordo. Medicina Intensiva del Hospital Universitario del Henares (Coslada-Madrid)
Última actualización: Mayo 2025
Más datosLos supervivientes de la enfermedad crítica pueden presentar síntomas físicos, psicológicos o cognitivos tras el alta hospitalaria, que se engloban en lo que se conoce como síndrome post-cuidados intensivos (SPCI). Estas alteraciones son consecuencia tanto del propio proceso crítico como de las actuaciones sanitarias que ocurren en torno al mismo. Para su prevención se ha propuesto la aplicación del paquete de medidas Asses/treat pain, Breathing/awakening trials, Choice of sedatives, Delirium reduction, Early mobility and exercise, Family (ABCDEF) al que recientemente se han sumado otras: Good comunication, Handout materials, Redefined ICU architectural design, Respirator, Nutrition, agrupadas en las siglas GHIRN. Además de estas medidas de prevención durante el ingreso en la Unidad de Cuidados Intensivos (UCI), los pacientes de riesgo deben ser identificados para un posterior seguimiento mediante equipos multidisciplinares coordinados por los Servicios de Medicina Intensiva.
Survivors of critical illness may present physical, psychological, or cognitive symptoms after hospital discharge, encompassed within what is known as post-intensive care syndrome. These alterations result from both the critical illness itself and the medical interventions surrounding it. For its prevention, the implementation of the ABCDEF bundle of measures (Assess/treat pain, Breathing/awakening trials, Choice of sedatives, Delirium reduction, Early mobility and exercise, Family) has been proposed, along with additional strategies grouped under the acronym GHIRN (Good communication, Handout materials, Redefined ICU architectural design, Respirator, Nutrition). In addition to these preventive measures during the ICU stay, high-risk patients should be identified for subsequent follow-up through multidisciplinary teams coordinated by Intensive Care Medicine Departments.
Los supervivientes de la enfermedad crítica pueden presentar síntomas físicos, psicológicos o cognitivos, que, si se mantienen durante meses tras el alta, se pueden considerar secuelas o eventos adversos, muchos de ellos prevenibles, y que se enmarcan en lo que se conoce como síndrome post-cuidados intensivos (SPCI)1. Estas alteraciones son consecuencia tanto del propio proceso crítico como de las actuaciones sanitarias que ocurren en torno al mismo, por lo que las medidas preventivas son esenciales, se consideran prácticas seguras e implican la adherencia a las guías de buena práctica clínica basadas en la evidencia científica. El no llevar a cabo estas medidas supone errores que pueden provocar daños en el paciente crítico.
Desde que el término fuese acuñado en 2010, el interés y los estudios al respecto de estas medidas preventivas han aumentado de forma exponencial2,3. La calidad de vida y la capacidad funcional se encuentran íntimamente relacionadas con estas tres esferas, de ahí la importancia de la prevención del síndrome durante la estancia de los pacientes en las Unidades de Cuidados Intensivos (UCI) y el seguimiento de aquellos con riesgo de padecerlo.
PrevenciónLa prevención del SPCI se centra en aplicar un conjunto de medidas que aborda el cuidado integral y multiprofesional del paciente crítico y que se recogen en el paquete de medidas Asses/treat pain, Breathing/awakening trials, Choice of sedatives, Delirium reduction, Early mobility and exercise, Family (ABCDEF)4 al que recientemente se han sumado otras: Good comunication, Handout materials, Redefined ICU architectural design, Respirator, Nutrition, agrupadas en las siglas GHIRN5-7 y que se desarrollan a continuación:
Asses/treat pain: identificación, prevención y manejo del dolorEl dolor en los pacientes críticos puede ser causado por la lesión tisular del proceso primario, procedimientos invasivos, inmovilización y movilización. El dolor activa el sistema nervioso autónomo y puede causar disfunción hemodinámica, respiratoria, coagulopatía o del sistema inmunológico. Los estímulos dolorosos sostenidos pueden provocar hiperalgesia y una respuesta amplificada a estímulos mínimamente nocivos, causando dolor crónico. Si no se identifica, previene y trata, además de los efectos fisiológicos mencionados, puede conllevar efectos psicológicos. El recuerdo del dolor es un predictor independiente para el desarrollo de trastorno de estrés postraumático (TEPT)8.
El uso excesivo de analgésicos también puede derivar en efectos secundarios indeseados, como hipomotilidad gastrointestinal, hemorragia gástrica, disfunción renal, tolerancia o síntomas de abstinencia9.
Se debe realizar una valoración frecuente y protocolizada del dolor a través de escalas validadas, al menos cada cuatro horas. En pacientes comunicativos, se pueden emplear la escala numérica verbal (ENV) y la escala visual analógica (EVA)10 que gradúan el dolor de 0 a 10, mientras que, en sujetos no comunicativos, se deben usar escalas conductuales como la escala de conductas indicadores de dolor (ESCID)11 que puntúa de 0 a 10, la herramienta Critical-Care Pain Observation Tool (CPOT)12 que puntúa de 0 a 8 o la Behavioral Pain Scale (BPS)13 que puntúa de 3 a 12. En pacientes con niveles de sedación profundos y relajación neuromuscular, donde no se objetivan cambios conductuales ni gestuales, se pueden emplear métodos instrumentales objetivos que analizan los componentes del Sistema Nervioso Autónomo simpático y parasimpático, y que identifican el dolor con base en una puntuación numérica14,15.
La monitorización del dolor en el paciente comunicativo y en el no comunicativo es uno de los indicadores de calidad de la Sociedad Española de Medicina Intensiva Crítica y Unidades Coronarias (SEMICYUC) del enfermo crítico16.
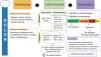
Para el tratamiento del dolor se deben emplear medidas no farmacológicas, como musicoterapia, técnicas de relajación (p. ej., mindfulness), masajes y frío local (cold-packs). Si estas fracasan se implementarán medidas farmacológicas adaptadas a la intensidad del dolor y situación clínica, con estrategias multimodales que combinen opiáceos (fentanilo, remifentanilo o cloruro mórfico) con analgésicos no opiáceos (paracetamol, antiinflamatorios no esteroideos), coadyuvantes (dexmedetomidina, corticoides o ketamina), analgésicos neuropáticos (gabapentina, carbamazepina o pregabalina) o analgesia regional (epidural, bloqueo muscular, etc.), con el objetivo de controlar el dolor y reducir la dosis de opioides y efectos secundarios (fig. 1).
Prevención, identificación y manejo del dolor.
ANI: Analgesia Nociception Index; BPS: Behavioral Pain Scale; CPOT: Critical-Care Pain Observation Tool; Cx: cirugías; ENV: escala numérica verbal; ESCID: escala de conductas indicadoras de dolor; EVA: escala visual analógica; NOL: índice integrado de nocicepción; VMI: ventilación mecánica invasiva.
Tomado de Hurtado et al.7 (con permiso).
Desde hace décadas, el uso de sedantes ha ayudado a reducir el dolor, el estrés y el disconfort de los pacientes críticos sometidos a ventilación mecánica (VM). Sin embargo, numerosos estudios han demostrado sus potenciales efectos deletéreos, tanto a corto como a largo plazo, como depresión respiratoria, inestabilidad hemodinámica y acidosis metabólica, además de prolongación del tiempo de VM, estancia en UCI y aumento del riesgo de delirium17,18. Por eso, actualmente se recomiendan estrategias de sedación ligera (Richmond Agitation Sedation Scale [RASS] de -2 a+1), excepto que haya una indicación absoluta de sedación profunda: síndrome de distrés respiratorio agudo (SDRA) grave, hipertensión intracraneal (HIC), estatus epiléptico, hipotermia o empleo de bloqueantes neuromusculares (BNM)19. Por tanto, las nuevas estrategias de sedación deben ir enfocadas a la búsqueda de la mínima dosis necesaria, que favorezca la colaboración y comunicación, la retirada del soporte respiratorio y la movilización precoz.
Algunos estudios han demostrado que las estrategias de interrupción diaria de sedantes son seguras y mejoran los resultados en términos de días libres de VM y de estancia en UCI20, aunque los protocolos de sedación ligera son igualmente eficaces y suponen menos riesgo19. De hecho, la valoración diaria de la interrupción de la sedación, la prueba de tolerancia a la ventilación espontánea, la monitorización de la sedación, la indicación adecuada y la monitorización del bloqueo neuromuscular, así como de la sedación durante el bloqueo neuromuscular son considerados indicadores de calidad por la SEMICYUC16.
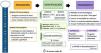
Para conseguir los objetivos de sedación es fundamental el empleo de escalas validadas que midan el nivel de sedación, como la RASS21 que puntúa de -5 a+4 o la Riker Sedation Agitation Scale (SAS)22 que puntúa del 1 al 7. En pacientes con nivel de sedación profunda o relajación neuromuscular, se deben emplear herramientas instrumentales objetivas como el Índice Biespectral (BIS)23 y el Train of four (TOF)24, respectivamente. Se considera sedación consciente o superficial cuando el paciente presenta RASS 0, -1 o -2, sedación profunda cuando presentan RASS -3,-4 o -5 y BIS entre 60 y 40. Niveles de BIS <40 se correlacionan con sobresedación. Se ha encontrado una incidencia de estos niveles de hasta el 35% de los pacientes críticos25, lo que debe tenerse en cuenta debido a sus efectos deletéreos y a que afecta a la seguridad del paciente (fig. 2).
Sedación-agitación. BIS: índice biespectral; BMNI: bloqueo neuromuscular; HIC: hipertensión intracraneal; RASS: Richmond Agitation Sedation Scale; SAS: Riker Sedation-Agitation Scale; SDRA: síndrome de distrés respiratorio agudo; VM: ventilación mecánica.
Tomado de Hurtado et al.7 (con permiso).
Desde la SEMICYUC y el grupo de trabajo de sedación, analgesia y delirium (GTSAD), en el marco de proyectos de calidad asistencial y seguridad del paciente, se propone incluir el proyecto «Sobresedación Zero» como herramienta docente, práctica y de concienciación colectiva de comodidad, seguridad y gestión para maximizar el resultado clínico y minimizar los efectos perjudiciales de la sedación excesiva26.
Choice of sedatives: elección de sedantesPara reducir el estrés y el disconfort de los pacientes sometidos a VM, se recomienda garantizar una adecuada analgesia, descartar y tratar el delirium y fomentar las medidas no farmacológicas citadas anteriormente, tales como medidas ambientales, posturales, relajación, musicoterapia, etc. Si a pesar de esto no se alcanzan los objetivos deseados, se pueden emplear medidas farmacológicas en función del objetivo de sedación, que debe ser determinado de forma individualizada y adaptado dinámicamente a la situación clínica.
Preferiblemente y excepto alguna indicación absoluta de sedación profunda19 debe realizarse una sedación superficial, ligera o consciente con fármacos como dexmedetomidina, propofol o remifentanilo.
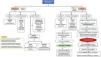
En los casos en que esté justificada la sedación profunda, se deben elegir fármacos de vida media corta como propofol o ketamina, o sedantes inhalados como isoflurano27, evitando benzodiacepinas por su asociación con el delirium, aumento de estancia en UCI y costes estimados28, estando estos indicados únicamente en deprivación alcohólica, estatus epiléptico refractario o en sedación difícil como segundo o tercer escalón en aquellas unidades en las que no se disponga de isoflurano o esté contraindicado su uso7 (fig. 3). Una sedación adecuada es un indicador relevante de calidad del enfermo crítico16.
Algoritmo de analgosedación en el paciente crítico.
ANI: Analgesia Nociception Index; BIS: índice biespectral; BMNI: bloqueo neuromuscular; BPS: Behavioral Pain Scale; BZD: benzodiacepinas; CAM-ICU: Confusion Assessment Method for the ICU; COPT: Critical-Care Pain Observation Tool; ENV: escala numérica verbal; ESCID: escala de conductas indicadoras de dolor; EVA: escala visual analógica; HIC: hipertensión intracraneal; ICDSC: Intensive Care Delirium Screening Checklist; NOL: Índice integrado de nocicepción; RASS: Richmond Agitation Sedation Scale; SAS: Riker Sedation-Agitation Scale; SDRA: síndrome de distrés respiratorio agudo.
Tomado de Hurtado et al.7 (con permiso).
El delirium, definido como una disfunción cerebral aguda caracterizada por alteraciones de la atención, la conciencia y la cognición con un curso agudo y fluctuante, ocurre con frecuencia en las UCI. Se asocia con factores de riesgo modificables, como el uso de benzodiacepinas, la sedación profunda o transfusiones sanguíneas, además de factores no modificables como la edad, demencia, situación previa, cirugía urgente o trauma, puntuaciones altas en escalas de gravedad, siendo por tanto la aparición de delirium un factor potencialmente modificable19.
Se ha demostrado una relación entre la aparición de delirium y una peor función cognitiva global y de las funciones ejecutivas a los tres y 12 meses tras el alta29 e incluso una asociación independiente entre la duración del delirium y las alteraciones cognitivas a largo plazo30. De ahí que su predicción, prevención, detección y tratamiento sean una garantía de calidad y seguridad. La identificación de delirium y su prevención no farmacológica son indicadores de calidad en el enfermo crítico, siendo el primero un indicador relevante16.
Existen modelos predictivos validados que pueden ayudar a identificar los pacientes con mayor riesgo de desarrollar delirium durante su estancia en las unidades, como son el Early prediction model for delirium (E- PRE-DELIRIC) en el momento de la admisión en UCI y el Prediction model of delirium (PRE-DELIRIC)31 en las primeras 24 horas del ingreso, facilitando el uso de estrategias preventivas de forma precoz.
Durante su estancia, siguiendo las recomendaciones de buenas prácticas de los grupos de trabajo de la SEMICYUC32, se debe evaluar regularmente la aparición de delirium mediante herramientas validadas en todos los pacientes, especialmente en aquellos con alto riesgo de desarrollarlo. De esta manera, se puede identificar precozmente e instaurar las medidas terapéuticas necesarias para reducir su duración y evitar el desarrollo de alteraciones a largo plazo. Entre las herramientas validadas que se pueden emplear, se encuentra el Confusion Assessment Method for the ICU (CAM-ICU)33 y el Intensive Care Delirium Screening Checklist (ICDSC)34.
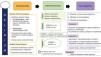
En las estrategias para prevención y tratamiento del delirium se pueden incluir intervenciones no farmacológicas35 basadas en el respeto del ciclo vigilia-sueño, la movilización precoz, visitas familiares prolongadas, herramientas tecnológicas que ayuden a su comunicación y desarrollo neurocognitivo, medidas orientativas como luz ambiental o uso de relojes y televisores, evitar restricciones mecánicas, etc. Además de ello, y si estas no son suficientes, se pueden emplear medidas farmacológicas preventivas como dexmedetomidina nocturna a dosis bajas o melatonina, para favorecer el ciclo vigilia-sueño, y evitar el uso de benzodiacepinas, especialmente a dosis altas y en infusión continua. Para el tratamiento farmacológico es de elección el uso de α-2-agonistas (dexmedetomidina o clonidina) y reservar el uso de antipsicóticos típicos (haloperidol) o atípicos (quetiapina, risperidona, olanzapina) en caso de agitación refractaria o síntomas psicóticos, a la menor dosis posible y ajustados al tiempo en el que duren estos síntomas de agitación. En casos de delirium refractario a estos fármacos se puede emplear ácido valproico7,36 (fig. 4).
Prevención, identificación y manejo del delirium.
BZD: benzodiacepinas; CAM-ICU: Confusion Assessment Method for the ICU; ICDSC: Intensive Care Delirium Screening Checklist.
Tomado de Hurtado et al.7 (con permiso).
Los supervivientes de la enfermedad crítica experimentan secuelas físicas a largo plazo, entre ellas, debilidad muscular adquirida en la UCI, que puede llegar a estar presente en el 25 – 50% de ellos, limitando su funcionalidad física y su calidad de vida37. El factor de riesgo más importante es el encamamiento y la inmovilización prolongada.
Entre los efectos beneficiosos de las estrategias de movilización se encuentran la prevención de la polineuropatía y la miopatía del paciente crítico, la mejora de la calidad de vida, la reducción de la estancia en UCI y hospitalización, además de la mortalidad intrahospitalaria. Entre las principales técnicas usadas para la movilización temprana se encuentra la kinesiterapia, entrenamiento de transferencia y locomoción, estimulación eléctrica neuromuscular y la cicloergometría38.
Para llevar a cabo estas medidas es esencial incorporar al fisioterapeuta a los equipos de las UCI que irá introduciendo ejercicios de forma progresiva, dependiendo del estado clínico del paciente, y que se clasifican en ejercicios en cama y fuera de la cama. Los ejercicios en cama incluyen movilizaciones pasivas (cuando el paciente no puede colaborar), cambios posturales (activos y pasivos), sedestación en cama y movilizaciones activas (el paciente colabora con ejercicios de resistencia y/o activos). Los ejercicios fuera de la cama se basan en ejercicios de control de tronco (sedestación en el borde de la cama), bipedestación, transferencia al sillón (activa o pasiva) y deambulación (con diferentes niveles de asistencia).
En los últimos años se han iniciado proyectos que van más allá de la rehabilitación y el ejercicio en las UCI, llevando a los pacientes de forma segura a espacios exteriores como jardines hospitalarios, demostrando mejoría tanto a nivel psicológico como físico39.
Family: inclusión y empoderamiento de la familiaLas familias de pacientes críticos se convierten en los interlocutores de sus deseos y necesidades. Además, la presencia de los familiares puede ayudar a mitigar la ansiedad, reduciendo así el riesgo de desarrollar delirium, minimizando el uso de contenciones y autorretirada de dispositivos, disminuyendo con todo ello el daño autoinfligido, y evitando retrasar su avance clínico y las secuelas a largo plazo. Por todo ello, desde hace tiempo se vienen instaurando planes para la integración de la familia con visitas no restringidas y fomentando la participación y preparación de esta en el plan de cuidados del paciente crítico.
Desde las Guías de Práctica Clínica basadas en la evidencia, existen recomendaciones fuertes sobre la necesidad de educación al paciente y a la familia acerca de las intervenciones que se van a realizar, así como sus indicaciones, alcances, ventajas, limitaciones y riesgos40.
Good comunication: buena comunicaciónLa incapacidad de comunicación de los pacientes críticos, especialmente aquellos ventilados mecánicamente puede suponer angustia, sensación de aislamiento y temor a no ver satisfechas sus necesidades, pudiendo derivar en ansiedad, depresión o TEPT41.
Se deben implementar métodos que garanticen una correcta comunicación, permitiendo al paciente expresar en cada momento sus necesidades físicas, emocionales y espirituales. Puede realizarse a través de métodos sencillos como gestos, escritura, tarjetas de letras, palabras, frases o imágenes o a través de herramientas más sofisticadas como los sistemas aumentativos y alternativos de comunicación6.
Handout materials and holistic and personalized care: material informativo y cuidado personalizadoEl aislamiento que pueden sufrir los pacientes, desconectados de su antigua vida, y la separación de su hogar y su entorno, puede favorecer la aparición de alteraciones psicológicas. Para prevenir estos aspectos, es importante integrar intervenciones no farmacológicas como musicoterapia adaptada a sus preferencias, permitir el uso de dispositivos electrónicos personales, utilizar los diarios de UCI, fotografías estratégicamente colocadas en el box y crear un entorno lo más parecido a su hogar6.
Redefined ICU architectural design: diseño arquitectónico redefinidoEn los últimos años han surgido estudios que proponen rediseñar los espacios en las UCI, enfocados a la prevención de delirium, la ansiólisis y reducción del estrés. Se proponen espacios amplios, con luz natural y separados de los ruidos y los equipos tecnológicos, que dispongan de espacios para familiares, pantallas de TV o medios de comunicación directa con familiares y componentes orientativos (relojes, calendarios, etc.). Además, se proponen dispositivos que magnifiquen los sentidos (gafas virtuales, altavoces, auriculares de reducción de sonidos, etc.) y protocolos de movilización precoz6.
Respirator: adaptación al ventiladorLa VM supone el mayor reto para la prevención de las secuelas, ya que es un procedimiento a menudo estresante y doloroso, por lo que es necesario el empleo de fármacos analgosedantes y, en algunas ocasiones, BNM. Además, la prolongación de la VM conlleva un mayor tiempo de encamamiento, debilidad muscular adquirida en la UCI e incapacidad para establecer una comunicación efectiva. Por último, la existencia de asincronías paciente-ventilador puede prolongar el tiempo en VM, con mayor riesgo de lesiones pulmonares y musculares que derivan en secuelas físicas como disnea o limitación de la capacidad pulmonar. Es importante corregir estas asincronías, adaptando el ventilador al paciente y no al contrario, para evitar sobresedación42.
Varios estudios analizaron las secuelas en los supervivientes de SDRA, evidenciando alteraciones persistentes en la capacidad de difusión de monóxido de carbono (DLCO) y limitación funcional al ejercicio medido por las escalas 36 item Short Form healthy survey (SF-36) o 12 item Short Form healthy survey (SF-12) y test de la marcha de seis minutos43–46. A corto plazo, las secuelas pulmonares sí parecen estar relacionadas con el daño pulmonar y la duración de la VM, pero a largo plazo las causas extrapulmonares (pérdida de masa muscular, debilidad muscular adquirida en UCI, etc.) son las que determinan el pronóstico funcional.
Para evitar estas secuelas, aparte de una adecuada estrategia ventilatoria, se deben utilizar otras medidas para prevenir periodos de VM prolongada, identificar y corregir asincronías, y asegurar un manejo adecuado de la analgosedación, garantizar una nutrición adecuada y rehabilitación precoz47.
Nutrition: nutriciónLa malnutrición en pacientes críticos se relaciona íntimamente con la debilidad muscular adquirida en la UCI, por lo que una estrategia fundamental para evitar secuelas físicas será garantizar una adecuada nutrición basándonos en los procesos catabólicos/anabólicos48. Las últimas guías clínicas de nutrición en las UCI49 consideran a cualquier paciente crítico ingresado más de 48 horas en riesgo de malnutrición. Aparte del índice de masa corporal (IMC) y la tasa metabólica basal (TMB), puede resultar de utilidad el empleo de los criterios Global Leadership Initiative on Malnutrición (GLIM)50, que es una herramienta útil y validada para ser aplicada en el ámbito hospitalario al momento del ingreso, y así establecer un diagnóstico de desnutrición precoz y posterior intervención.
Se recomienda iniciar nutrición preferentemente por vía oral sobre enteral o parenteral, en las primeras 48 horas de ingreso, de forma continua y garantizando la tolerancia mediante el uso de procinéticos si es necesario. En la fase precoz se recomienda nutrición hipocalórica, aumentando progresivamente los aportes calóricos tras el tercer día con aportes proteicos de 1,3g/kg al día, sin exceder los 5mg/kg/min de glucosa o carbohidratos, ni 1,5g/kg/día de aportes lipídicos49. Debe recordarse que la actividad física podría mejorar los efectos de la terapia nutricional.
Abordaje terapéutico del síndrome post-cuidados intensivosLos cambios conceptuales en la medicina intensiva han roto con el viejo modelo del intensivista encerrado en las paredes de la UCI. El nuevo modelo de enfermedad crítica no solo se centra en el periodo de ingreso en la UCI sino también en el previo (detección precoz de la enfermedad grave en planta) y en el posterior al alta del hospital51 (fig. 5), con un objetivo centrado no solo en la supervivencia, sino en la supervivencia con calidad de vida (reincorporación a las actividades laborales, sociales, familiares, etc., previas al ingreso). Por ello, a pesar de las medidas de prevención durante el periodo de ingreso en la UCI, los pacientes en riesgo deben ser identificados para una posterior valoración en consulta externa de medicina intensiva para la detección y el tratamiento de las secuelas.
Modelo de enfermedad crítica.
ABCDEF: Paquete de medidas (Assess/treat pain, Breathing/awakening trials, Choice of sedatives, Delirium reduction, Early mobility and exercise, Family); GHIRN: Paquete de medidas (Good communication, Handout materials, Redefined ICU architectural design, Respirator, Nutrition); SPCI: síndrome post-cuidados intensivos; UCI: Unidad de Cuidados Intensivos.
Adaptado de Angus et al.51.
Los factores de riesgo para la inclusión de pacientes en programas de seguimiento difieren entre los distintos protocolos y consensos1,52,53. A modo de resumen de lo publicado, podríamos agruparlos en los puntos que se exponen a continuación. En ellos quedan incluidas entidades concretas (p. ej., sepsis, SDRA, parada cardiorrespiratoria recuperada, etc.) que se recogen en algunos documentos53:
- 1.
Pacientes que reciben soporte ventilatorio durante más de 48 horas (VM invasiva, no invasiva o alto flujo).
- 2.
Pacientes con estancia en UCI superior a cinco días
- 3.
Pacientes que hayan presentado disfunción multiorgánica (disfunción de dos o más órganos).
- 4.
Pacientes que hayan desarrollado delirium durante su ingreso en UCI.
- 5.
Pacientes que a juicio del médico directamente responsable deban ser evaluados en consulta externa de Medicina Intensiva.
El seguimiento está orientado a pacientes con posibilidad de recuperación, es decir, se excluyen aquellos con secuelas tan graves que no se contemple su mejoría en el tiempo, y aquellos que previamente al ingreso tengan deterioro cognitivo o psiquiátrico graves, patología neurológica, neuromuscular o discapacidad grave. Esta diferenciación, aunque compleja, es vital para la adecuada selección de los pacientes.
Se deben tener en cuenta los antecedentes del ingreso en la UCI que deben quedar documentados. De acuerdo con la recomendación «la predicción de los problemas post-UCI y la anticipación es una tarea que los clínicos de la UCI deben intentar asumir»53 se debe obtener una evaluación de las capacidades funcionales previas al ingreso en la UCI que debe documentarse en la historia clínica y la exploración física, para que sirva de referencia en la valoración post-UCI, y debe comunicarse durante el traspaso de funciones cuando el paciente abandona la UCI.
Momento de la primera evaluaciónEl primer protocolo español52 de trabajo sobre el seguimiento de los pacientes en consulta externa de Medicina Intensiva establecía un «timing» de tres meses desde el alta hospitalaria. Recientes recomendaciones de otras sociedades sugieren que la evaluación se realice de forma más temprana (cuatro semanas después del alta hospitalaria), y no se establezca a priori un plazo de evaluaciones, sino que estas continúen a lo largo de la recuperación individualizando cada paciente53. Es decir, evaluaciones seriadas y sostenidas por subesferas con las herramientas recomendadas y que se expondrán a lo largo del documento estableciendo un orden de prioridades proporcional al nivel de gravedad de cara a la atención por parte del equipo post-UCI.
Equipo de seguimiento del síndrome post-cuidados intensivosEl equipo encargado del seguimiento estará coordinado por el médico especialista en medicina intensiva y, aunque las características de cada equipo pueden variar en función de las posibilidades de cada centro, existen servicios imprescindibles para garantizar la calidad de los cuidados tras el alta hospitalaria (por otra parte, también son cruciales para la aplicación de las medidas de prevención durante el ingreso). Es fundamental la integración de los servicios de Salud Mental (Psiquiatría y Psicología Clínica) y Rehabilitación, y es recomendable la incorporación de especialistas en endocrinología y nutrición, dado las alteraciones nutricionales que algunos pacientes pueden arrastrar tras el alta hospitalaria.
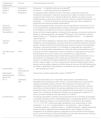
Valoración en consultaLas actividades a realizar en consulta se pueden resumir en: anamnesis (desde el alta hospitalaria), exploración física y evaluación de los dominios que constituyen el SPCI (tabla 1).
Herramientas a utilizar para la valoración del síndrome post-cuidados intensivos
| Cuestionarios/ herramientas | Dominio | Comentarios/puntos de corte |
|---|---|---|
| HADS-A | Psiquiátrico | Puntuación≥ 8 identifica síntomas de ansiedad54 |
| HADS-D | Psiquiátrico | Puntuación≥ 8 identifica síntomas de depresión54 |
| IES-R | Psiquiátrico | Los pacientes deben identificar el evento traumático y responder los 22 ítems recordando su percepción. Cada ítem se puntúa de 0 (nada) a 4 (extremo), dando una puntuación total mínima de 0 y máxima de 88 puntos. Además, se pueden calcular subescalas para los ítems que evalúan intrusión, evitación y estado de hiperalerta. Una puntuación≥ a 33 se ha utilizado como punto de corte para indicar la presencia significativa de síntomas de estrés postraumático55 |
| Escala de gravedad de síntomas-R | Psiquiátrico | Punto de corte global de 20 y unos puntos de corte parciales por encima de 3, 3, 5 y 5 en las subescalas de reexperimentación, evitación, alteraciones cognitivas/estado de ánimo negativo y aumento de la activación, respectivamente57 |
| Test de MoCA | Cognitivo | Evalúa la función cognitiva global, incluida la función ejecutiva, la atención/memoria de trabajo, la memoria episódica y el lenguaje58Puntuación 18-25: afectación cognitiva levePuntuación 10-17: afectación cognitiva moderadaPuntuación <10: afectación cognitiva grave53 |
| Test de la marcha | Físico | Evalúa, de manera integrada, la respuesta de los sistemas respiratorio, cardiovascular, metabólico, musculoesquelético y neurosensorial que el individuo desarrolla durante el ejercicio. Existen ciertas contraindicaciones para el test de la marcha como patologías cardiacas o coronarias recientes o no controladas o incapacidad de comprender la prueba. El resultado debe interpretarse con valores de referencia de población sana59 |
| Test Get up and Go | Físico | Evaluación funcional utilizada para medir la movilidad y la capacidad de una persona para levantarse de una silla, caminar una corta distancia, y luego sentarse nuevamente.El procedimiento típico del test implica que la persona:Se siente en una silla estándar con apoyabrazos.Se le indica que se levante de la silla sin ayuda y camine a una distancia corta (aproximadamente tres metros)La persona camina a paso normal o máximo seguro, sin correr, hasta el punto indicado.Al llegar al punto final, la persona se da la vuelta y regresa a la sillaSe sienta de nuevo en la sillaEl test evalúa la movilidad, la estabilidad, la coordinación y el equilibrio, así como el riesgo de caídas61 |
| Dinamometría | Físico/ neuromuscular | <85% de población sana62 |
| Espirometría (adicionalmente test DLCO) | Físico/ pulmonar | Alteraciones en patrón espirométrico según ATS/ERS63-66 |
| SF-12 | Calidad de vida | Dominios relacionados con la salud física: salud general, actividades físicas, actividades de rol habituales y dolor corporal. Los relacionados con la salud mental: vitalidad, actividades sociales, emoción influenciada por las limitaciones en las actividades de rol y salud mental general. Se calculan dos puntuaciones «resumen» (salud física y mental) utilizando las medias ponderadas de los ocho dominios. Una puntuación inferior a 50 indica una mala calidad de vida relacionada con la salud en relación con la población de referencia, mientras que una puntuación superior a 50 indica una buena calidad de vida relacionada con la salud68 |
| EuroQol-5D-5L | Calidad de vida | Formado por dos partes: la primera incluye evaluaciones de la movilidad, autocuidado, actividades habituales, dolor y ansiedad/depresión. Las respuestas generan un número de cinco dígitos que expresa el nivel seleccionado en cada dominio (por ejemplo, «11111» o «21123»), donde cada dígito representa el nivel seleccionado en cada dimensión (1, 2, 3, 4 o 5, correspondiendo a «sin problemas», «ligero problema», «moderado problema», «problema severo» y «problema extremo», respectivamente).Se puede consultar el estado de salud correspondiente a esos 5 dígitos (el índice) y compararlo con la población general.La segunda incluye una escala visual analógica que es una línea vertical en la que el paciente traza una línea horizontal en el nivel que él considera se encuentra su estado de salud actual69 |
ATS: American Thoracic Society; DLCO: Test de difusión de monóxido de carbono; ERS: European Respiratory Society; HADS: escala hospitalaria de ansiedad (HADS-A) y depresión (HADS-D); IES-R: Impact of Event Scale-Revised; MoCA: Montreal Cognitive Assessment test. SF-12: 12 item Short Form healthy survey.
Puesto que las alteraciones psiquiátricas asociadas al SPCI son ansiedad, depresión y TEPT se deberán utilizar herramientas de screening validadas para su identificación y, si procede, derivación al especialista correspondiente del equipo. Se describen a continuación las escalas más usadas.
- 1.
Ansiedad y depresión. Escala hospitalaria de ansiedad y depresión (Hospital Anxiety and Depression Scale [HADS])54. La escala HADS combina dos subescalas de siete ítems que evalúan los síntomas de depresión (subescala HADS-D) y ansiedad (subescala HADS-A).
- 2.
TEPT. Cualquiera de las siguientes escalas puede utilizarse para la valoración de síntomas de TEPT:
- •
Escala de impacto del evento-revisada (Impact of Event Scale [IES]-Revised)55, instrumento de detección de 22 ítems basada en criterios del Manual diagnóstico y estadístico de los trastornos mentales (DSM-IV). Se encuentra adaptada y validada en español, o la abreviada IES-656 cuya sensibilidad y especificidad es ligeramente inferior a la del IES-R original.
- •
Escala de gravedad de síntomas revisada (EGS-R) del TEPT57. Consta de 21 ítems en correspondencia con los criterios diagnósticos del DSM-V. Esta escala se ha validado en una población española y supone una versión modificada y actualizada de la EGS de 1997 que mostraba unas buenas propiedades psicométricas.
La evaluación de la función cognitiva es una tarea compleja y que requiere de la participación de especialistas entrenados en el área. Sin embargo, el screening de alteraciones cognitivas mediante herramientas sencillas resulta útil para adelantar la derivación oportuna a esos equipos especializados. El test de valoración cognitiva de Montreal (Montreal Cognitive Assessment [MoCA] test)58 es un cuestionario sencillo y que se recomienda para personal no especializado.
Valoración de la esfera físicaLa función física es una de las esferas más comprometidas tras el alta de la UCI. La evaluación clásica de la esfera física comprende la fuerza muscular y la función respiratoria. Para la evaluación de la primera se dispone de algunos tests (test de la marcha de seis minutos59,60 o test get up and go61 [levantarse y caminar]) y de dispositivos para una medida objetiva de la misma como la dinamometría (se deben comparar las medidas obtenidas con determinaciones en población sana; en nuestro medio disponemos de las valoraciones de Luna et al.62). La función respiratoria deberá evaluarse mediante espirometría y adicionalmente el test DLCO. El protocolo e interpretación de espirometría y DLCO deben basarse en la estandarización y directrices de la de la Sociedad Torácica Americana (ATS) y la Sociedad Respiratoria Europea (ERS)63–66. En los últimos años se ha ido incorporando la valoración nutricional puesto que la optimización nutrometabólica puede influir positivamente en la recuperación funcional. No existen escalas validadas para el tipo de pacientes que nos ocupa. La aparición de los criterios GLIM67 para malnutrición que valoran tres criterios fenotípicos (pérdida de peso, bajo BMI y masa muscular reducida) y dos criterios etiológicos (ingesta alimentaria reducida e inflamación) con la ayuda de la ecografía podrían ser de utilidad, pero el cribado y el diagnóstico de malnutrición en estos casos es una cuestión pendiente de resolver.
Calidad de vidaLos cuestionarios de calidad de vida relacionados con la salud son una herramienta para la medición del estado físico, social y mental propio de cada individuo. Existen diversos cuestionarios, pero quizá los más extendidos son el SF-1268, versión abreviada del SF-36 que explora la salud física y mental mediante diferentes ítems asociados en ocho dominios y el EuroQol-5D-5L69 que constituye un instrumento genérico y sencillo con respuestas de opción múltiple.
ConclusionesLas secuelas a las que frecuentemente se enfrentan los supervivientes de la enfermedad crítica se engloban actualmente en lo que se conoce como SPCI que comprende un conjunto de síntomas en las esferas física, cognitiva y psicológica. Su abordaje tiene como primera medida la prevención, por lo que se han propuesto paquetes de medidas dirigidas al manejo integrado e interprofesional de los síntomas durante la enfermedad crítica. Además de las medidas de prevención, los pacientes en riesgo deben ser identificados para una valoración tras el alta hospitalaria por el equipo de seguimiento post-UCI que realizará una valoración de las posibles secuelas para su detección y tratamiento.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.