La atención al paciente cardioquirúrgico requiere una aproximación integral y multidisciplinar para desarrollar estrategias que mejoren la seguridad y el pronóstico de los pacientes. En la fase preoperatoria destacan la implantación de medidas de prevención de las complicaciones postoperatorias más frecuentes, como la fibrilación auricular de novo o el sangrado, y la prehabilitación basada en ejercicio físico, fisioterapia respiratoria y terapia nutricional y cognitiva, especialmente en aquellos pacientes más frágiles. En la fase quirúrgica se han producido grandes avances como el desarrollo de procedimientos mínimamente invasivos, las mejoras en la preservación miocárdica, la perfusión sistémica durante la circulación extracorpórea y la protección cerebral, o la implantación de los protocolos de cirugía segura. En el postoperatorio se debe establecer un manejo hemodinámico guiado por objetivos, un correcto abordaje de los trastornos de la coagulación y el uso de analgesia multimodal que posibilite la extubación y movilización precoz de los pacientes. Por último, es clave un óptimo manejo de las complicaciones postoperatorias, entre las que destacan las arritmias, la vasoplejía, el sangrado posquirúrgico y el aturdimiento miocárdico que puede derivar en bajo gasto o, en su caso más extremo, en shock cardiogénico. Este enfoque global y el elevado nivel de complejidad hacen necesario el ingreso del paciente en unidades de alto nivel de asistencia, siendo clave el valor aportado a este proceso por los servicios de medicina intensiva para obtener unos resultados clínicos más eficaces y eficientes.
Cardio-surgical patient care requires a comprehensive and multidisciplinary approach to develop strategies to improve patient safety and outcomes. In the preoperative period, prophylaxis for frequent postoperative complications, such as de novo atrial fibrillation or bleeding, and prehabilitation based on exercise training, respiratory physiotherapy and nutritional and cognitive therapy, especially in fragile patients, stand out. There have been great advances, during the intraoperative phase, such as minimally invasive surgery, improved myocardial preservation, enhanced systemic perfusion and brain protection during extracorporeal circulation, or implementation of Safe Surgery protocols. Postoperative care should include goal-directed hemodynamic theraphy, a correct approach to coagulation disorders, and a multimodal analgesic protocol to facilitate early extubation and mobilization. Finally, optimal management of postoperative complications is key, including arrhythmias, vasoplegia, bleeding, and myocardial stunning that can lead to low cardiac output syndrome or, in extreme cases, cardiogenic shock. This global approach and the high degree of complexity require highly specialised units where intensive care specialists add value and are key to obtain more effective and efficient clinical results.
La cirugía cardiovascular es un procedimiento de alta complejidad que ofrece buenos resultados en los pacientes adecuadamente indicados, aumentando la calidad de vida y la supervivencia. En España, durante el año 20181, se registraron 34.318 procedimientos en 62 servicios de cirugía cardiovascular.
El manejo óptimo de estos pacientes debe tener un enfoque multidisciplinar, integral, centrado en el paciente y con protocolos adecuados2. La medicina intensiva desempeña un papel fundamental en este escenario clínico por sus aportaciones, valores y enfoque global del proceso3,4. El médico intensivista es una pieza clave por su conocimiento del procedimiento y por su capacidad de gestión de la calidad del proceso mediante el registro asistencial, la auditoría de resultados y la promoción de acciones de mejora. Es básico el ingreso precoz en unidades de cuidados intensivos (UCI) de aquellos pacientes que, por complejidad o inestabilidad, requieran optimización preoperatoria. Así mismo, es fundamental el control postoperatorio, tanto en UCI como en planta de hospitalización, para la detección precoz de posibles complicaciones.
La Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias, en su Plan estratégico 2018-20225, apuesta por la calidad del proceso quirúrgico, estableciendo acciones específicas dirigidas a mejorar la calidad asistencial del paciente quirúrgico y su familia y a trabajar de forma colaborativa con otras especialidades, con el fin de conseguir un proceso efectivo, eficiente y seguro.
Avances en cirugía cardiacaEn los últimos años la cirugía cardiovascular ha evolucionado notablemente con avances como la mejora en protección miocárdica, perfusión sistémica durante la circulación extracorpórea y protección cerebral en situaciones de parada circulatoria; la implantación de los protocolos de cirugía segura durante la intervención; la monitorización con ecocardiografía transesofágica de complicaciones técnicas; la incorporación de técnicas de cirugía mínimamente invasiva, el implante de válvulas transcatéter, sin suturas, y el desarrollo de la rehabilitación multimodal (ERAS) en cirugía cardiaca.
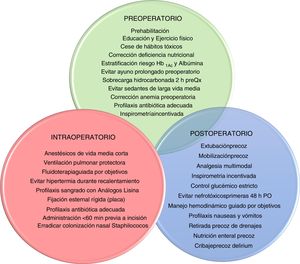
Enhanced recovery after surgery y cirugía fast trackLos protocolos ERAS tienen como objetivo reducir el impacto del estrés perioperatorio y acelerar la recuperación de los pacientes. Recogen tanto indicaciones preoperatorias como intra y postoperatorias; buscan una mayor información y preparación antes de la intervención, un empoderamiento del paciente, la estandarización de determinados procesos y la optimización de recursos para reducir complicaciones, tiempo de estancia y convalecencia. Estas recomendaciones6 se recogen en la figura 1.
Optimización preoperatoriaLa prehabilitación en pacientes frágiles7, con la corrección de déficits nutricionales8 y de la anemia preoperatoria9 y la suspensión de determinados fármacos (antiagregantes, anticoagulantes, inhibidores del sistema renina-angiotensina) mejoran los resultados postoperatorios y disminuyen las complicaciones hemorrágicas, hemodinámicas y renales10,11.
La profilaxis de la fibrilación auricular de novo con bloqueadores beta o amiodarona han demostrado disminuir su incidencia12. El preacondicionamiento con levosimendan en pacientes coronarios con disfunción sistólica moderada-grave es una estrategia útil para disminuir el síndrome de bajo gasto postoperatorio, demostrando ser coste-efectivo13,14.
Manejo habitual del postoperatorio no complicadoLa atención inicial de los pacientes en el postoperatorio de cirugía cardiaca (PCC) requiere una exploración física exhaustiva y, al menos, monitorización hemodinámica básica15–17(tabla 1). Posteriormente, debemos restablecer la homeostasis del medio interno, alcanzar la normotermia, asegurar el correcto funcionamiento del marcapasos epicárdico y continuar la pauta de profilaxis antibiótica. Es fundamental establecer una estrategia analgésica multimodal que, combinando diferentes familias de analgésicos, permita disminuir las dosis de opiáceos, lo que facilita la extubación, rehabilitación y movilización precoz del paciente. El destete de la ventilación mecánica debe iniciarse cuando se reúnan las condiciones adecuadas de estabilidad clínica. Como en la mayoría de los pacientes críticos, se mantendrá un adecuado control glucémico, se realizará detección y prevención del fracaso renal agudo, inicio precoz de tromboprofilaxis (mecánica y, cuando sea posible, farmacológica) y prevención del delirio.
Monitorización hemodinámica básica recomendada
| Presión arterial invasiva |
| Electrocardiograma continuo |
| Temperatura |
| Balance hídrico |
| Saturación venosa mixta (SvO2) o central (si no está monitorizado con catéter de arteria pulmonar): marcador del balance entre el aporte de oxígeno y el consumo |
| Gasometría: al ingreso, cada 4-8horas y siempre que se produzcan cambios en la situación clínica del paciente |
| Presión venosa central: se recomienda su monitorización por su utilidad al valorar la tendencia o cuando presenta valores extremos |
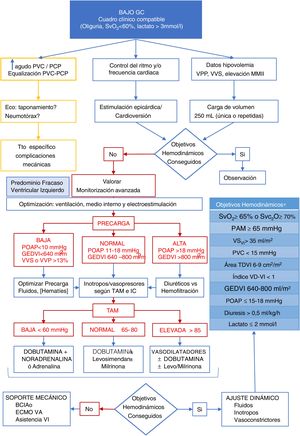
La resucitación y manejo hemodinámico deberá ser guiada por parámetros objetivos18 (fig. 2). La monitorización avanzada estará indicada en aquellos pacientes en los que exista inestabilidad, se precise profundizar en la fisiopatología del proceso o en aquellos pacientes que, por sus características basales, evolución intraoperatoria o por el tipo de intervención sean considerados de alto riesgo quirúrgico. Los sistemas de monitorización hemodinámica avanzada nos permiten, de forma continua, obtener información sobre el gasto cardiaco (GC) y sus determinantes: precarga o precarga-dependencia, contractilidad y poscarga.
Propuesta de algoritmo de manejo del síndrome de bajo gasto postoperatorio. GEDVI: volumen telediastólico global de ventrículo izquierdo; PAM: presión arterial media; POAP: presión de oclusión arterial pulmonar; PVC: presión venosa central; SvO2: Saturación venosa mixta de oxígeno; SvcO2: Saturación venosa central de oxígeno; TDVI: telediastólica de ventrículo izquierdo; VD: ventrículo derecho; VI: ventrículo izquierdo; VSVI: volumen sistólico de ventrículo izquierdo.
*Adaptado de Habicher M et al18.
La contractilidad disminuye en el postoperatorio de cirugía cardiaca inmediato respecto al preoperatorio. La magnitud y duración de esta fase dependen de la disfunción cardiaca previa, la existencia de eventos isquémicos, las complicaciones preoperatorias y la evolución intraoperatoria. Los elementos que más repercuten en la disfunción cardiaca en el PCC son el aumento de la masa ventricular izquierda, la hipotermia, el volumen y la vía de administración de la cardioplejía y el tiempo de CEC prolongado19.
En el postoperatorio debemos tener en cuenta la presencia de 2 patrones hemodinámicos, uno de sobrecarga de presión (hipertrofia izquierda y disfunción lusitrópica) que interfiere en la valoración de las presiones de llenado, pudiendo infraestimar las necesidades de volumen y en el que, además, existe intolerancia a la taquicardia; y otro de sobrecarga de volumen (típico en insuficiencia valvular) en el que también se altera la valoración de la precarga-dependencia y donde las variables dinámicas de respuesta a volumen no han sido validadas. En este contexto se requiere una valoración continua de la respuesta al volumen administrado y su repercusión en los parámetros objetivo para evitar una resucitación inadecuada.
El catéter de arteria pulmonar, además del GC y sus determinantes, es el único sistema que permite conocer la SvO2 y las presiones pulmonares. Como alternativa se han desarrollado sistemas basados en la termodilución transpulmonar capaces de aportar el GC (y otros parámetros de gran utilidad) de forma continua y que han sido validados en pacientes en shock cardiogénico20. No obstante, presentan limitaciones como la necesidad de recalibrado frecuente ante variaciones hemodinámicas importantes, o la pérdida de precisión en presencia de arritmias o esfuerzo respiratorio15-17. La ecocardiografía ha adquirido un papel central en el PCC hasta ser considerada una técnica indispensable. Su utilidad radica en la inmediatez de la información que provee, funcional y anatómica. Permite valorar la fracción de eyección, el GC mediante la estimación del volumen sistólico, la respuesta a líquidos, inotropos o fármacos vasoactivos, y agiliza el diagnóstico precoz de complicaciones (taponamiento, malfunción valvular…) facilitando la toma de decisiones terapéuticas apropiadas21.
ComplicacionesEl riesgo de complicaciones perioperatorias depende de la cardiopatía de base del paciente, de su reserva funcional, de la prevalencia de comorbilidades, del tipo y carácter de la cirugía y de la duración del procedimiento quirúrgico. Entre las complicaciones postoperatorias destacan:
Fibrilación auricular de novo y otras arritmiasLa fibrilación auricular (FA) es la arritmia más frecuente en el PCC22. Su pico de incidencia se sitúa entre las 48-72horas y suele revertir en las primeras 24horas espontáneamente o con tratamiento farmacológico. Los bloqueadores beta y la amiodarona son las piedras angulares, tanto de la profilaxis como del tratamiento de la FA postoperatoria de novo en la que es tan válida la estrategia de control de la frecuencia como la de control del ritmo. La terapia antitrombótica debe basarse en la valoración del riesgo individual de tromboembolia mediante escalas como la CHA2DS2-VASc y la HAS-BLED23. En presencia de inestabilidad en la FA deben emplearse choques sincronizados de onda bifásica, inicialmente con 100J (en obesos con 200J). En la taquicardia ventricular monomorfa sostenida se emplearán descargas sincronizadas de 50-100J, y en las desorganizadas o sin pulso descargas no sincronizadas a la máxima energía.
Los casos de bloqueo auriculoventricular completo postoperatorio varían entre un 4%24 y un 11%25, suelen tener carácter transitorio y las indicaciones de marcapasos definitivo son las mismas que en los pacientes no intervenidos.
Síndrome de bajo gasto cardiaco postoperatorioManejo fallo izquierdoSe define como aquella situación hemodinámica en la que el GC es insuficiente para satisfacer correctamente la demanda metabólica tisular. Sin embargo, los desencadenantes, modo de presentación, evolución y tratamiento son diferentes a la insuficiencia cardiaca de origen médico. Su incidencia varía entre un 3% y un 45% y se asocia a un aumento de la morbimortalidad, la estancia en UCI y el consumo de recursos26–29. Su expresión clínica es variable e incluye desde un aturdimiento miocárdico leve, que puede requerir inotropos transitoriamente con recuperación en 24-48h, hasta situaciones graves que cursan con shock cardiogénico, disfunción multiorgánica y muerte. La identificación precoz del cuadro clínico y su adecuado manejo son fundamentales para obtener buenos resultados.
En el manejo de estos pacientes, además de las medidas ya mencionadas, se debe considerar:
- 1.
Descartar causas mecánicas y/o reversibles: neumotórax, hemotórax, sangrado excesivo, taponamiento cardiaco, espasmo u oclusión de un injerto coronario, disfunción valvular protésica y arritmias (fig. 2).
- 2.
Un manejo escalonado, siguiendo secuencias progresivas de actuación. Primero se debe optimizar la precarga y controlar el ritmo, revirtiendo las taquiarritmias mediante cardioversión y/o sobreestimulación cuando exista repercusión hemodinámica. En caso de bradiarritmias, bradicardias relativas o bloqueo auriculoventricular, debemos realizar estimulación eléctrica mediante los cables epicárdicos. Posteriormente, se usarán fármacos inotrópicos, vasoconstrictores y/o vasodilatadores. Como último escalón se utilizarán los dispositivos de asistencia circulatoria, como el balón de contrapulsación, la membrana de oxigenación extracorpórea venoarterial u otro tipo de asistencia ventricular mecánica (fig. 2).
En el contexto de la cirugía cardiaca el fracaso del ventrículo derecho es más frecuente en30: enfermedad coronaria de alto riesgo con lesión de la coronaria derecha, valvulopatías —en especial mitral—, postoperatorio de trasplante cardiaco, cardiopatía congénita, postoperatorio de tromboendarterectomía pulmonar por hipertensión pulmonar (HTP) tromboembólica crónica y pacientes con asistencia ventricular izquierda.
Su abordaje requiere optimizar la precarga, poscarga, contractilidad, ritmo y frecuencia16 (tabla 2). El GC del VD está influido por la contracción del tabique interventricular, dependiente de la función del VI, por lo que si asocia disfunción izquierda asociaremos inotropos. Es fundamental evitar la hipotensión arterial para asegurar una correcta perfusión de ambos ventrículos.
Manejo del fracaso del ventrículo derecho, considerando la situación hemodinámica, la presencia de hipertensión pulmonar y la aparición de insuficiencia respiratoria aguda
| Optimización de precargaResucitación volumétrica en pacientes con sangrado o pérdida de fluidos francaValoración de la respuesta a volumen. Bolus de 250cc únicos o repetidosSi PAD elevada: diuréticos o técnicas de reemplazo renal |
| Optimización de ritmo y frecuencia cardíacaConservar ritmo sinusalSer agresivos con el tratamiento de las taquicardiasSi bloqueo auriculoventricular: uso de marcapasos |
| Optimización del acoplamiento ventrículo arterial y de la presión de perfusiónUso de fármacos vasoactivos para conseguir PAS>PSPNoradrenalina, adrenalina o vasopresinaInotropos o inodilatadores+vasodilatadores pulmonaresShock o SBGC→FVA+inotrópicosSBGC+HTP→FVA+inotrópicos+VDPs o VDPiSBGC+IRA→FVA+inotrópicos+VDPiShock+HTP→FVA+inotrópicos+VDPiShock por HTP→FVA+inotrópicos+VDPs+VDPiSi fracaso: considerar soporte mecánico (asistencia ventricular, ECMO VA)/trasplanteSi existe enfermedad pulmonar acompañante usar vasodilatadores pulmonares inhalados |
| Optimización respiratoriaAjustar PEEP. Evitar atelectasias e hiperinflaciónValorar uso de vasodilatadores pulmonares para mejorar insuficiencia respiratoriaEvitar: hipercapnia, hipoxemia y acidosis metabólicaSi fracaso: considerar membrana extracorpórea. ECMO VV |
ECMO VA/VV: oxigenador con membrana extracorpórea venoarterial/venovenoso; FVA: fármacos vasoactivos; HTP: hipertensión pulmonar; PEEP: presión positiva al final de la espiración; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PSP: presión sistólica pulmonar; SBGC: síndrome de bajo gasto cardíaco; VDPi: vasodilatadores pulmonares inhalados; VDPs: vasodilatadores pulmonares sistémicos.
Para intentar disminuir la poscarga del VD podemos utilizar fármacos vasodilatadores pulmonares (VDP), administrados de manera local (inhalada o nebulizada) o sistémica (oral e intravenoso) (tablas 3 y 4)31. La vasodilatación sistémica puede producir hipotensión arterial y generar insuficiencia respiratoria por alteración de la relación ventilación/perfusión (V/Q). Los VDP inhalados provocan menos hipotensión sistémica y mejoran la relación V/Q. Por tanto, son útiles para el tratamiento de la HTP crónica, la mejora de la relación V/Q y para disminuir la poscarga de un VD disfuncionante32.
Fármacos vasodilatadores pulmonares usados por vía inhalada
| Fármaco | Administración | Mecanismo | Dosis y sistemas de administración | Efectos adversos |
|---|---|---|---|---|
| Óxido nítrico | Inhalada | Aumento de GMPc (relajación fibra lisa muscular) | Dosis: 10-40ppm | MetahemoglobinemiaHTP de rebote tras retirada |
| Epoprostenol (Flolan®) | Inhalada | Análogo de prostaglandinas | Dosis 50-80ng/kg/minRequiere de sistema de nebulización ultrasónico | Mareo, dolor de cabeza, hipotensión |
| Iloprost | Inhalada | Análogo de prostaglandinas | Dosis: 2,5-5μg 6-9veces/díaAdministrar con un sistema propio o mediante nebulizador | Hipotensión y dolor de cabeza |
| Milrinona | Inhalada | Inhibidor de fosfodiesterasa que produce aumento de AMPc | 60mg/4ml cada 8horas mediante nebulizador ultrasónico | Hipotensión y dolor de cabeza |
GMPc: guanosín monofosfato cíclico.
Vasodilatadores pulmonares utilizados por vía sistémica
| Fármaco | Administración | Mecanismo | Dosis | Efectos adversos |
|---|---|---|---|---|
| Sildenafilo (Revatio®) | OralIntravenosa | Aumento de GMPc que produce relajación fibra lisa muscular | Dosis oral: 5-80mg cada 8hCuando se administra intravenosa usar a mitad de dosis | Hipotensión, dolor de cabeza |
| Teprostinil | Oral | Análogo de prostaglandinas | 0,25mg cada 12hSubir cada 4 días 0,25mg si presenta buena tolerancia | Mareo, dolor de cabeza, hipotensión |
| Epoprostenol (Veletri®) | Intravenosa | Análogo de prostaglandinasEfecto antiplaquetario | Inicial: 2ng/kg/minuto, con aumentos de 1ng/kg/min según tolerancia cada 15-20min | Cefalea, hipotensión, flushing, dolor mandibular |
| Riociguat | Oral | Estimulante directo de la guanilato-ciclasa | 1mg cada 8hAumentar 0,5mg cada 2 semanas hasta un máximo de 2,5mg cada 8h | Hipotensión, dolor de cabeza, mareo, molestias gastrointestinales |
GMPc: guanosín monofosfato cíclico.
El tipo de fármaco elegido dependerá del contexto clínico32–38. En pacientes con predominio de insuficiencia respiratoria y HTP residual se iniciarán fármacos de acción local (óxido nítrico inhalado [iNO] y/o prostaciclina inhalada) para tratar simultáneamente ambas entidades. En presencia de inestabilidad hemodinámica empezaremos con inodilatadores (dobutamina o milrinona) junto con VDP inhalados (iNO y prostaciclinas) para disminuir la poscarga y por su menor deterioro hemodinámico asociado. Si se estabiliza la situación (descenso significativo o retirada del soporte vasoactivo) se pueden iniciar, a dosis bajas y por vía intravenosa, los inhibidores de la fosfodiesterasa-5 o prostaglandinas y, según tolerancia, valorar la retirada de iNO y posteriormente de prostaciclinas (ya que esta última puede seguir administrándose en pacientes extubados).
En pacientes estables hemodinámicamente, sin deterioro respiratorio y que persisten con HTP residual significativa se puede introducir progresivamente la medicación domiciliaria.
En ocasiones, a pesar de tratamiento médico óptimo, el paciente persiste con bajo gasto, por lo que se hace necesario iniciar medidas de soporte mecánico.
Síndrome vasopléjico tras cirugía cardiacaEn el PCC hasta la mitad de los pacientes pueden desarrollar vasoplejía (bajas resistencias vasculares sistémicas con IC mayor de 2,2l/kg/min), presentando shock distributivo hasta el 5% de ellos39. La fisiopatología es similar al shock vasopléjico que objetivamos en la sepsis. Es importante el reconocimiento precoz de la situación y la instauración de tratamiento vasopresor para conseguir una adecuada perfusión orgánica. El fármaco más utilizado es la noradrenalina. En los casos en que se requieran dosis elevadas se puede asociar vasopresina40. El papel de la angiotensina ii parece prometedor en estos enfermos41.
Sangrado postoperatorio excesivoEl sangrado postoperatorio excesivo es una de las complicaciones más frecuentes de la cirugía cardiaca. Este puede definirse como aquel superior a 1l en las primeras 24horas, y su incidencia se sitúa alrededor de un 33%, precisando reexploración quirúrgica en un 3-7% de los casos42. Es prioritario el adecuado manejo de este escenario ya que, hasta en un 50% de los pacientes reintervenidos, no se observa una causa quirúrgica del sangrado, y la reexploración es un factor independiente de riesgo para la aparición de efectos adversos postoperatorios43. El sangrado en el PCC es multifactorial y se ve favorecido por ciertas características del paciente44,45, de los fármacos utilizados perioperatoriamente y de la cirugía46. La CEC provoca un estado procoagulante que favorece una situación prohemorrágica (al consumir factores de la coagulación y plaquetas) agravada por la hemodilución y la activación de la fibrinólisis. La transfusión de hemocomponentes está directamente relacionada con un aumento de la morbimortalidad en los pacientes sometidos a cirugía cardiaca, y debe individualizarse en función de parámetros clínicos y funcionales, como la oxigenación tisular, más que por la cifra de hemoglobina. No obstante, una hemoglobina de 7-8g/dl, sin datos de isquemia perioperatoria, es bien tolerada en el PCC46. Se recomienda la profilaxis del sangrado con tranexámico en toda cirugía cardiaca. El control de la hemorragia postoperatoria debe realizarse mediante algoritmos guiados por objetivos. El primer paso consiste en eliminar factores que potencian la coagulopatía (corregir la hipotermia y la acidosis), revertir la heparinemia residual mediante una dosis de recuerdo de protamina y optimizar la hemostasia primaria (plaquetas>100.000cél/cc). La terapia guiada por objetivos, basada en las pruebas viscoelásticas, indica corregir primero la hiperfibrinólisis (ácido tranexámico), después, la firmeza del coágulo (fibrinógeno) y, si posteriormente la síntesis de trombina persiste comprometida, administrar concentrados de complejo protrombínico.
ConclusionesEl óptimo manejo perioperatorio de los pacientes intervenidos de cirugía cardiovascular requiere un abordaje integral y multidisciplinar que incluye una adecuada capacitación médico-quirúrgica. La optimización preoperatoria, las técnicas mínimamente invasivas, la profilaxis de las arritmias y del sangrado postoperatorio, el manejo hemodinámico guiado por objetivos y una analgesia multimodal que permita la extubación y movilización precoz son elementos clave en la recuperación intensificada de estos pacientes. El alto nivel de complejidad hace de los servicios de medicina intensiva el lugar idóneo para alcanzar los mejores resultados.
AutoríaJJJR, CLJ, MJLG y JLPV han participado en la redacción y aprobación final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.