Evaluar los efectos de la monitorización de la presión esofágica en pacientes adultos con requerimiento de ventilación mecánica en la Unidad de Terapia Intensiva.
DiseñoRevisión sistemática (Registro PROSPERO CRD42018118583).
ÁmbitoTerapia intensiva. Cuidados críticos.
Pacientes o participantesAdultos con requerimiento de ventilación mecánica en la Unidad de Terapia Intensiva.
IntervencionesMonitorización de la presión esofágica.
Variables de interés principalesMortalidad en terapia intensiva, días de hospitalización en terapia intensiva, días de ventilación mecánica, eventos adversos.
ResultadosSe incluyeron 4 estudios con 301 participantes. La monitorización de la presión esofágica durante la ventilación mecánica produciría poco o ningún efecto sobre la mortalidad en terapia intensiva a los 28 días (RR 0,74; IC 95% 0,31 a 1,76; participantes 261; estudios 2; I2: 68%), poca o ninguna diferencia en los días de hospitalización en terapia intensiva (DM 0,48; IC 95% −1,90 a 2,85; participantes 284; estudios 3; I2: 7%) o los eventos adversos (RR 0,74; IC 95% 0,50 a 1,09; participantes 261; estudios 2; I2: 0%). Existe incertidumbre sobre si la monitorización de la presión esofágica reduce los días de ventilación mecánica.
ConclusionesLa evidencia de certeza baja o muy baja indica que la monitorización de la presión esofágica durante la ventilación mecánica produciría poco o ningún efecto sobre la mortalidad en terapia intensiva, los días de hospitalización en terapia intensiva o ventilación mecánica y los eventos adversos.
To evaluate the effects of esophageal pressure monitoring in adult patients with mechanical ventilation requirements in the Intensive Care Unit.
DesignA systematic review (PROSPERO Register CRD42018118583) was carried out.
SettingIntensive therapy. Critical care.
Patients or participantsAdults with mechanical ventilation requirement in the Intensive Care Unit.
InterventionsEsophageal pressure monitoring.
Outcomes of interestIntensive Care Unit mortality and length of stay, mechanical ventilation days, adverse events.
ResultsFour studies with 301 participants were included. Esophageal pressure monitoring during mechanical ventilation had little or no effect on mortality in intensive care at 28 days (RR 0.74; 95% CI 0.31 to 1.76; participants 261; studies 2; I2: 68%), with little or no differences in ICU length of stay (MD 0.48; 95% CI −1.90 to 2.85; participants 284; studies 3; I2: 7%) or impact upon adverse events (RR 0.74; 95% CI 0.50 to 1.09; participants 261; studies 2; I2: 0%). There is uncertainty about whether esophageal pressure monitoring reduces the duration of mechanical ventilation.
ConclusionsEvidence of low or very low certainty indicates that esophageal pressure monitoring during mechanical ventilation would produce little or no effect on Intensive Care Unit mortality, Intensive Care Unit length of stay, days on mechanical ventilation or adverse events.
La ventilación mecánica (VM) es uno de los procedimientos más utilizados y uno de los pilares terapéuticos de la medicina intensiva1,2. Con el objetivo de mantener el intercambio gaseoso y disminuir el trabajo respiratorio para reducir el consumo de oxígeno por parte de los tejidos, está indicada en una amplia variedad de condiciones que van desde procedimientos quirúrgicos programados a la insuficiencia respiratoria aguda3, las enfermedades neuromusculares o el coma, haciendo de la monitorización de la VM una de las funciones críticas en las unidades de terapia intensiva (UTI) modernas4 ya que, si bien la VM puede salvar la vida de los pacientes que la requieren, su uso inapropiado puede promover por sí mismo una lesión pulmonar5. El daño pulmonar asociado a la VM tiene un mecanismo causal diverso, aunque posiblemente dependa de la presión transpulmonar (Ptp)6, que es la presión en la vía aérea abierta menos la presión pleural. Las mediciones de la presión pleural, estimadas a partir de las presiones en el esófago (Pes) mediante la colocación de un catéter de globo conectado a un transductor de presión, permiten el análisis de la distensibilidad de la pared torácica y pulmonar, así como el trabajo de la respiración, la función de los músculos respiratorios y la presencia de parálisis del diafragma7. A su vez, los valores absolutos de la Pes pueden ser influidos por la mecánica respiratoria, el volumen pulmonar, el peso del mediastino, el abdomen, la posición y el tono de la pared del músculo liso esofágico6. Una estrategia de ventilación guiada por Pes permitiría reducir el estrés pulmonar y un ajuste individualizado de los parámetros del respirador, a través de la obtención de Ptp positivas durante la exhalación y evitando valores excesivos (menores de 27cmH2O) de la misma al final de la inspiración para evitar la sobredistensión alveolar y los ciclos repetidos de apertura y colapso alveolar asociados al daño pulmonar inducido por la VM8,9.
Existen diferentes tipos de catéteres esofágicos, dependiendo de su diámetro y longitud, y cada uno requiere un llenado específico con una cantidad de aire determinada para medir correctamente la Pes. Estos dispositivos pueden mantenerse por períodos de tiempo prolongados, siempre que se encuentren correctamente posicionados6. La medición de la Pes se ha utilizado con gran éxito en el último medio siglo para delinear la fisiología y las características mecánicas del sistema respiratorio. Si bien el uso de estas técnicas de medición se ha llevado a cabo principalmente en escenarios de laboratorio para mejorar la comprensión de los mecanismos fisiológicos básicos, también se ha aplicado en el contexto clínico4, aunque su aplicación clínica continúa siendo limitada, probablemente debido a dificultades técnicas y a la falta de conocimiento7.
Por el momento no se dispone de revisiones sistemáticas que hayan evaluado el efecto de la monitorización de Pes en los principales desenlaces en la UTI. Los resultados de una revisión sistemática sobre este tema podrían ser útiles para investigadores, decisores, profesionales de la salud y pacientes, ya que ampliaría el conocimiento sobre el impacto de la monitorización de Pes en diferentes desenlaces clínicos.
El objetivo de esta revisión sistemática es evaluar el efecto de la monitorización de Pes en pacientes adultos con requerimiento de VM sobre la mortalidad en UTI, los días de hospitalización en UTI, los días de VM y los eventos adversos, comparado con la monitorización estándar de la presión en la vía aérea.
MétodosPara la realización de la revisión se siguieron los lineamientos del Manual Cochrane de revisiones sistemáticas de intervenciones10 y las Expectativas metodológicas de las revisiones Cochrane de intervenciones11.
Los resultados se reportan con base en las recomendaciones de la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses –PRISMA–12. El protocolo de la presente revisión se registró en el International Prospective Register of Systematic Reviews –PROSPERO– (CRD42018118583).
Se incluyeron ensayos clínicos controlados aleatorizados y cuasialeatorizados. Se habrían incluido también estudios observacionales como evidencia complementaria o suplementaria a la de los ensayos clínicos, no obstante, esto se habría limitado a estudios de cohorte prospectivos con comparación simultánea de grupos13. No se aplicaron restricciones de idioma ni fecha o estatus de publicación. Se incluyeron estudios en los que se enrolaron hombres y mujeres mayores de 18 años de edad con requerimiento de VM en UTI en los que se haya aplicado la monitorización de Pes comparada con la monitorización estándar de la presión en la vía aérea y curvas de respirador. Los métodos para estudios no aleatorizados no fueron implementados, dado que no se han encontrado estudios observacionales que cumplieran los criterios de inclusión.
Se consideraron los siguientes desenlaces de interés1: mortalidad en UTI, días de VM, días de hospitalización en UTI, eventos adversos. Los desenlaces mencionados no fueron considerados como criterios de inclusión para la selección de estudios.
Se realizó una búsqueda incluyendo las principales bases de datos electrónicas (MEDLINE, EMBASE, LILACS, The Cochrane Library; ver Anexo A) y en la literatura gris hasta octubre de 2019. También se buscó en los registros de ensayos clínicos prospectivos (ClinicalTrials.gov, World Health Organization International Clinical Trials Registry Platform, ControlledTrials.com). Se revisaron las listas de referencias bibliográficas de los estudios incluidos y se consultó a expertos en la temática para identificar estudios que hubieran podido ser omitidos. Se revisaron manualmente las actas de conferencias de la Society of Critical Care Medicine, la American Academy for Respiratory Care y la European Respiratory Society.
Dos revisores evaluaron de forma independiente la elegibilidad de los estudios y extrajeron sus características. Dos revisores evaluaron de forma independiente el riesgo de sesgo para cada ensayo clínico aleatorizado incluido utilizando las recomendaciones de la Colaboración Cochrane10. Los desacuerdos en estos procesos fueron resueltos mediante la consulta a un tercer evaluador.
Los datos de resultados para cada estudio fueron ingresados en el software RevMan14, para calcular los efectos del tratamiento. Los resultados dicotómicos se presentaron utilizando el riesgo relativo con intervalos de confianza del 95% (IC 95%). Se utilizó la diferencia de medias y el IC 95% para la presentación de los resultados continuos. La heterogeneidad de los tamaños del efecto fue evaluada a través de la inspección visual de los forest plots para evaluar la cantidad de superposición de los intervalos de confianza y mediante la prueba de Chi2, considerando p<0,10 como un indicador de heterogeneidad potencialmente significativa10. También se utilizó el estadístico I2. Para su interpretación se utilizó la recomendación del Manual Cochrane de Revisiones Sistemáticas de Intervenciones10. En caso de heterogeneidad clínica los estudios no fueron combinados10. Se habría investigado el sesgo de publicación mediante la producción de funnel plots, pero el número de estudios fue insuficiente.
Para los estudios incluidos, se investigó el efecto de la intervención en los subgrupos según el diagnóstico subyacente (síndrome de distrés respiratorio agudo [SDRA] frente a pacientes sin SDRA, definido según la definición de la Conferencia de Consenso Americana-Europea15 o la definición de Berlín16) y la presencia de obesidad (definida mediante un índice de masa corporal igual o superior a 30kg/m2)17. El análisis de sensibilidad incluyó la evaluación del efecto en los resultados de interés, excluyendo cualquier estudio con riesgo de sesgo alto o incierto en los dominios de ocultamiento de la asignación y generación de secuencia de aleatorización. Dos revisores evaluaron la certeza de la evidencia, que fue evaluada mediante los 5 dominios de las consideraciones Grading of Recommendations Assessment, Development and Evaluation –GRADE–18, puntuándola como «alta», «moderada», «baja» o «muy baja» usando GRADEpro GDT19. Las discrepancias fueron resueltas mediante la consulta a un tercer evaluador.
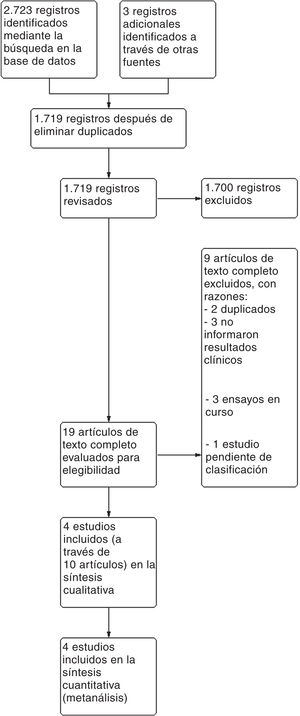
ResultadosSe recuperaron 2.726 referencias mediante la búsqueda electrónica en bases de datos y registros de ensayos. Se analizaron 1.719 luego de la remoción de duplicados mediante la inspección de títulos y resúmenes. Consideramos que 19 referencias eran potencialmente elegibles y fueron analizadas a texto completo, de las cuales se excluyeron 9. Se identificaron 3 estudios en curso y un estudio pendiente de clasificación (publicado solo como resumen) (ver tabla de características de los estudios excluidos, en curso y pendientes de clasificación en el Anexo B). Finalmente se incluyeron 4 estudios representados por 10 artículos (ver diagrama de flujo PRISMA en la figura 1).
Se incluyeron 4 ensayos clínicos provenientes de 10 artículos con 301 participantes, ya que encontramos referencias secundarias para los estudios de Talmor et al.20, Beitler et al.21 y Obi et al.22 y se utilizaron los registros de ensayos clínicos de los estudios mencionados para la extracción de datos (ver tabla 1 para el resumen de las características principales; en el Anexo B se encuentra el detalle de las características de cada estudio incluido). Los estudios fueron realizados principalmente en adultos con SDRA20,21,23, salvo un estudio que fue realizado en pacientes con obesidad22. La gravedad y el trastorno de la oxigenación de los pacientes incluidos fue altamente variable entre los estudios. Los tamaños muestrales fueron en su mayoría pequeños, con estudios como los de Obi et al.22 y Wang et al.23, que incluyen 25 y 23 participantes, respectivamente, o el estudio de Talmor et al,20, que incluye 61 participantes. Solo un estudio, el de Beitler et al.21, incluyó 200 participantes. La mayoría de los estudios utilizaron la monitorización de la Pes como herramienta para la titulación de la presión positiva al final de la espiración, con el objetivo de mantener una Ptp entre 0 y 10cmH2O al final de la espiración. Otros estudios también utilizaron como límite una Ptp menor de 20 o 25cmH2O al final de la inspiración. La mayoría de los estudios fueron llevados a cabo en países con niveles de ingresos altos, como son Estados Unidos y Canadá20–22. Solo un estudio se realizó en un país con un nivel de ingresos mediano-alto, como es China23. Dos de los estudios incluidos fueron financiados por el National Heart, Lung, and Blood Institute de los Estados Unidos20,21, otro estudio no recibió apoyo financiero para la investigación, autoría o publicación22, y el estudio restante no brindó información sobre la fuente de financiamiento23.
Características principales de los estudios incluidos
| Estudio | País | Participantes | Intervención | Comparador | Seguimiento |
|---|---|---|---|---|---|
| Beitler et al.21, 2019 | Estados UnidosCanadá | N=200SDRA | PEEP guiada por Pes para Ptp espiratoria entre 0-6cmH2O y Ptp inspiratoria≤a 20cmH2O | PEEP según tabla empírica de PEEP-FiO2 del estudio OSCILLATE | 28 días60 días |
| Obi et al.22, 2018 | Estados Unidos | N=25Obesidad mórbidaDependientes de VM | PEEP para mantener Ptp espiratoria entre 0 y 10cmH2O | PEEP según la mejor complacencia estática | 30 días |
| Talmor et al.20, 2008 | Estados Unidos | N=61SDRA | VM con ajustes determinados por las mediciones iniciales de Pes para mantener Ptp espiratoria entre 0 y 10cmH2O y Ptp inspiratoria<25cmH2O | VM según estrategia del estudio ARDSnet | 28 días180 días |
| Wang et al.23, 2019 | China | N=23SDRA secundario a trauma | PEEP se ajustó de acuerdo con la Pes para que la Ptp espiratoria mantenga el número positivo más pequeño dentro de 0-10cmH2O | VM según estrategia del estudio ARDSnet | No reportado |
FiO2: fracción inspirada de oxígeno; PEEP: presión positiva al final de la espiración; Pes: presión esofágica; Ptp: presión transpulmonar; SDRA: síndrome de distrés respiratorio agudo.
En la figura 2 puede verse la valoración individual del riesgo de sesgo de los estudios incluidos. La descripción detallada de los juicios que soportan la valoración del riesgo de sesgo se encuentra en la tabla de características de los estudios incluidos, en el Anexo B. Tres de los estudios incluidos no brindaban información suficiente en sus artículos como para emitir un juicio, por lo cual se obtuvo la información necesaria mediante contacto con los autores20,22,23. Solo uno de los estudios fue considerado con bajo riesgo de sesgo para todos los dominios evaluados con la herramienta Cochrane21.
Resumen del riesgo de sesgo: revisión de los juicios de los autores sobre cada elemento de riesgo de sesgo para cada estudio incluido. A: generación de la secuencia de aleatorización; B: ocultamiento de la asignación; C: cegamiento de participantes y personal; D: cegamiento de la evaluación de resultados; E: datos de resultados incompletos; F: reporte selectivo; G: otros.
La monitorización de Pes durante la VM en pacientes críticos adultos podría disminuir la mortalidad en la UTI a los 28 días de seguimiento (riesgo relativo 0,74; IC 95% 0,31 a 1,76; participantes 261; estudios 2; I2: 68%), sin embargo, el IC 95% indicaría que existe poca o nula diferencia entre los grupos. La certeza de la evidencia es baja debido a la imprecisión y el riesgo de sesgo (fig. 3). El resumen de los hallazgos puede consultarse en la tabla 2. Existe incertidumbre sobre si la monitorización de la Pes durante la VM en pacientes críticos adultos reduce los días de VM (diferencia de medias −4,13; IC 95% −8,87 a 0,61; participantes 301; estudios 4; I2: 68%), puesto que la certeza de la evidencia ha sido evaluada como muy baja, debido a la imprecisión, la inconsistencia y el riesgo de sesgo (fig. 4). La monitorización de la Pes durante la VM en pacientes críticos adultos podría producir poca o ninguna diferencia en los días de hospitalización en la UTI (diferencia de medias 0,48; IC 95% −1,90 a 2,85; participantes 284; estudios 3; I2: 7%). La certeza de la evidencia es baja debido a preocupaciones relacionadas con la imprecisión y el riesgo de sesgo (fig. 5). La monitorización de la Pes durante la VM en pacientes críticos adultos podría producir poca o ninguna diferencia en los eventos adversos (riesgo relativo 0,74; IC 95% 0,50 a 1,09; participantes 261; estudios 2; I2: 0%). La certeza de la evidencia es baja debido a la imprecisión y las preocupaciones relacionadas con el riesgo de sesgo (fig. 6). Ninguno de los estudios reportó el análisis de los costos emergentes relacionados con la intervención. Los análisis de subgrupo y de sensibilidad no evidenciaron diferencias en los análisis primarios (Anexo C).
Resumen de los hallazgos
| Monitorización de presión esofágica durante la VM comparada con monitorización estándar de la presión en la vía aérea y curvas de respirador para pacientes críticos adultos | |||||
|---|---|---|---|---|---|
| Paciente o población: pacientes críticos adultosIntervención: monitorización de la presión esofágica durante la VMComparación: monitorización estándar de la presión en la vía aérea y curvas de respirador | |||||
| Desenlaces | Número de participantes (estudios) | Calidad/certeza de la evidencia (GRADE) | Efecto relativo (IC 95%) | Efectos absolutos anticipados | |
| Riesgo con monitorización estándar de la presión en la vía aérea y curvas de respirador | La diferencia de riesgo con monitorización de presión esofágica durante la VM | ||||
| Mortalidad en terapia intensiva, seguimiento 28 días | 261 (2 ECA) | ⊕⊕○○ Bajaa,b,c | RR 0,74 (0,31 a 1,76) | 326 por 1.000 | 85 menos por 1.000 (225 menos a 247 más) |
| Días de VM | 301 (4 ECA) | ⊕○○○ Muy bajad,e,f | - | La media de días de VM oscila de 10,5 a 14,5 | DM 4,13 menor (8,87 menor a 0,61 más alto) |
| Días de hospitalización en terapia intensiva | 284 (3 ECA) | ⊕⊕○○ Bajaf,g | - | La media de días de hospitalización en terapia intensiva oscila de 9,5 a 20,9 | DM 0,48 más alto (1,9 menor a 2,85 más alto) |
| Eventos adversos | 261 (2 ECA) | ⊕⊕○○ Bajac,g | RR 0,74 (0,50 a 1,09) | 302 por 1.000 | 79 menos por 1.000 (151 menos a 27 más) |
| El riesgo en el grupo de intervención (y su IC 95%) se basa en el riesgo asumido en el grupo de comparación y en el efecto relativo de la intervención (y su IC 95%) | |||||
IC 95%: intervalo de confianza del 95%; DM: diferencia media; ECA: ensayo clínico aleatorizado; RR: razón de riesgo; VM: ventilación mecánica.
Se baja un nivel de evidencia por riesgo de sesgo alto en el dominio de reporte selectivo de resultados en uno de los estudios incluidos en el análisis.
Existe heterogeneidad sustancial que podría estar parcialmente explicada por las diferencias en el comparador entre ambos estudios incluidos en el análisis. Al no haber diferencias en la magnitud del efecto no se bajan niveles de evidencia.
Se baja un nivel de evidencia debido a la presencia de pocos eventos y la interrupción precoz de uno de los ensayos.
Se baja un nivel de evidencia por riesgo de sesgo incierto en el dominio de generación de la secuencia aleatoria y riesgo de sesgo alto e incierto en el dominio de ocultamiento de la asignación.
Se baja un nivel de evidencia al hallarse diferencias en la magnitud del efecto: existe heterogeneidad sustancial que podría estar parcialmente explicada por las diferencias en la población y los comparadores entre los estudios incluidos en el análisis (los análisis de subgrupos no han podido explicarla).
La evidencia analizada muestra que la monitorización de la Pes durante la VM produciría un efecto pequeño o nulo en la mortalidad, los días de hospitalización, los días de VM y los eventos adversos. Sin embargo, la cantidad de estudios fue limitada, imposibilitando el análisis de sesgos de publicación. Además, ciertas poblaciones específicas tuvieron mayor representación en los estudios, como los pacientes con SDRA, lo que limita la aplicabilidad de estos resultados en otras poblaciones o en la población general con requerimientos de VM. Estos resultados concuerdan con la práctica habitual, donde la monitorización de Pes suele reservarse para este tipo de pacientes que revisten mayor gravedad y mayores alteraciones de la mecánica del sistema respiratorio4,7.
Las principales limitaciones metodológicas de los estudios incluidos se relacionan con el riesgo de sesgo, dado que solo un estudio tuvo bajo riesgo de sesgo para todos los dominios evaluados. Los resultados fueron consistentes entre los estudios para la mortalidad en UTI, los días de hospitalización y los eventos adversos, sin embargo, hubo una inconsistencia seria entre los estudios para la duración de la VM, dado que uno de los estudios incluidos en el análisis mostró una tendencia hacia el beneficio para el grupo control21, mientras que el resto de los estudios la mostró para el grupo experimental. Dado que no pudimos explicar esta inconsistencia, decidimos bajar la certeza de la evidencia utilizando el enfoque GRADE.
Se evidenció imprecisión para todos los desenlaces de interés, ya que se incluyeron en el análisis estudios con pocos eventos. Particularmente, uno de los estudios incluidos fue interrumpido precozmente por beneficio20, lo que puede generar una sobrestimación en el tamaño del efecto de la monitorización de la Pes. Algunos modelos estadísticos evidencian que los ensayos clínicos que se interrumpen precozmente por beneficios sobrestiman sistemáticamente los efectos del tratamiento24, especialmente cuando el número de eventos en el estudio es menor de 20025,26. La tendencia de los ensayos interrumpidos precozmente a sobrestimar los efectos del tratamiento es particularmente peligrosa porque sus resultados aparentemente convincentes a menudo se publican rápidamente en revistas destacadas, se difunden velozmente en los medios de comunicación y se incorporan sin dilación a las guías de práctica clínica y las iniciativas de garantía de calidad, persuadiendo el desarrollo de nuevas investigaciones sobre el tema25,26.
La principal limitación de nuestra revisión es el escaso número de estudios encontrados para esta temática. Una documentalista experimentada en el proceso de revisiones sistemáticas realizó la búsqueda de la literatura, sin embargo, el número de estudios incluidos fue limitado, ya que la presente revisión basó su análisis en los principales desenlaces clínicos dentro de la UTI, mientras que la monitorización de la Pes continúa llevándose a cabo principalmente para mejorar la comprensión de los mecanismos fisiológicos básicos y su aplicación clínica permanece limitada7. Una fortaleza de nuestra revisión ha sido seguir un protocolo predefinido, documentando todos los cambios y métodos no implementados (Anexo D).
Esta es la primera revisión sistemática que aborda el efecto de la monitorización de la Pes en pacientes con requerimiento de VM en la UTI. Algunos de los estudios incluidos han motivado la adopción e implementación de la monitorización de la Pes en la UTI y guiado su aplicación en el contexto clínico. Sin embargo, el impacto de la monitorización de la Pes para guiar la VM ha sido escasamente estudiado fuera de las variables fisiológicas4,7. Un consenso de expertos apunta a la monitorización de la Pes y de volúmenes pulmonares como herramientas potencialmente importantes en pacientes con SDRA de mayor severidad para determinar el reclutamiento y la posibilidad de atelectrauma27. Además, concluye que es necesaria la integración de la monitorización de múltiples variables en el paciente crítico con insuficiencia respiratoria y que la monitorización de curvas de presión y volumen del respirador y de variables respiratorias estáticas provee información limitada en términos de trabajo respiratorio y reclutamiento, enfatizando la necesidad de la monitorización respiratoria dinámica, donde la monitorización de la Pes tiene un papel fundamental27.
La mayoría de los estudios incluidos analizaron parámetros de oxigenación como desenlaces primarios. Es posible que los cambios en la oxigenación surgidos por el tratamiento con VM guiada por la monitorización de Pes no produzcan ningún efecto en otros desenlaces clínicos de importancia, como son la mortalidad en la UTI, los días de VM o los eventos adversos, lo que convertiría a la oxigenación en un desenlace inadecuado. Probablemente aún no exista acuerdo sobre la relación causal entre los cambios en la oxigenación y los desenlaces clínicos de interés en la presente revisión28,29.
ConclusionesLa monitorización de la Pes en pacientes adultos con requerimiento de VM produciría poco o ningún efecto sobre la mortalidad, los días de hospitalización en la UTI, los días de VM y los eventos adversos. La adopción de la monitorización de la Pes podría brindar un mayor control a los profesionales implicados en la atención de los pacientes a la hora de guiar la VM, ya que brinda información adicional difícil de conseguir de otra manera, aunque no se haya demostrado beneficio con esta práctica y exista incertidumbre sobre la incidencia de eventos adversos y sus implicancias en el uso de recursos. Se necesitan más estudios que aborden la utilización de la monitorización de la Pes en pacientes con requerimiento de VM desde el inicio y en todo su curso, que incluyan pacientes de la población general en UTI, con diversidad de diagnósticos y gravedad, evaluando desenlaces importantes, como la mortalidad, los días de VM o los días de hospitalización.
FinanciaciónEste estudio recibió soporte del Instituto Universitario Hospital Italiano (IUHI): Beca de perfeccionamiento en Revisiones Sistemáticas y Medicina Basada en la Evidencia (Centro Cochrane Asociado-IUHI).
AutoríaLuis Ignacio Garegnani: concepción y diseño del estudio, adquisición de datos, análisis e interpretación de los datos, redacción del borrador del artículo, revisión crítica del contenido intelectual.
Pablo Rosón Rodriguez: adquisición de datos, análisis e interpretación de los datos.
Juan Victor Ariel Franco: borrador del artículo, revisión crítica del contenido intelectual, aprobación definitiva de la versión que se presenta.
Camila Escobar Liquitay: diseño y ejecución de la estrategia de búsqueda bibliográfica, adquisición de datos.
Conflicto de interesesLos autores declaran que no existen potenciales conflictos de interés con respecto a la investigación y/o autoría del presente manuscrito.
Al Lic. Sacha Virgilio y al Dr. Agustín Ciapponi por su asistencia en el desarrollo del protocolo de investigación.