Editado por: el Dr. Juan Antonio Llompart Pou
Médico especialista en Medicina Intensiva, Doctor en Ciencias de la Salud por la Universitat Illes Balears. Servicio de Medicina Intensiva, UCI Trauma y Neurocríticos, Hospital Universitari Son Espases. Palma, España.
Última actualización: Enero 2026
Más datos«Cambia lo superficial
Cambia también lo profundo
Cambia el modo de pensar
Cambia todo en este mundo»
Julio Numhauser
IntroducciónEl oxígeno (O2) es esencial para la supervivencia celular, de ahí que su contenido y suministro a los tejidos es de vital importancia1. El O2 viaja en el torrente sanguíneo impulsado por el gasto cardiaco de 2 maneras: a) disuelto (5%) y b) unido a su proteína transportadora (95%), la hemoglobina (Hb). Por otra parte, la cesión del O2 a los tejidos depende de la saturación y la curva de disociación O2/Hb1.
La anemia, según la definición de la OMS, es altamente prevalente en el paciente crítico, estimándose que el 60% presenta niveles de Hb<12g/dl al ingreso2. La etiología es multifactorial: desde pérdidas sanguíneas objetivables hasta la propia fisiología del eritrocito que sufre una serie de modificaciones en su estructura, metabolismo y producción que predisponen al desarrollo de la anemia3 (fig. 1).
Transfundir sangre total o concentrado de hematíes ha sido una de las herramientas más clásicas a la hora de intentar optimizar el transporte de O2 (TO2), sin embargo, aún persisten disparidades de opinión acerca de cuándo, cuánto y cuáles son los objetivos, sobre todo teniendo en cuenta los riesgos y beneficios de dicha practica4,5.
Hemoglobina y transfusión en el paciente criticoReseñar y conocer el pasado, permite entender mejor el presente y construir el futuro. En este contexto, Shoemaker marcó el punto de partida al establecer que la mortalidad de los pacientes postoperados de alto riesgo se incrementaba cuando los niveles de hematocrito eran inferiores al 32%, sobre todo cuando las reservas cardiovasculares estaban comprometidas6. En dichos individuos, transfundir hematíes se asociaba significativamente a una mejoría en el transporte y consumo de O2 (VO2)6. Más tarde, resurgen los conceptos de hipoxia tisular y deuda de oxígeno a raíz del análisis de las variables hemodinámicas de dichos pacientes7. Como consecuencia de ello, se desarrollaron diferentes estrategias de reanimación basadas en la optimización del TO2 y VO2, entre ellas la transfusión de concentrados de hematíes con niveles de Hb>10g/dl8. Dicha estrategia fue abandonada a raíz de estudios posteriores que evidenciaron más riesgos que beneficios9.
En 1998, se publican los resultados del TRICC, estudio canadiense multicéntrico, prospectivo y controlado que incluyó pacientes críticos con niveles de Hb<9g/dl en las primeras 72h de ingreso, transfundiéndose concentrados de hematíes cuando la Hb<7g/dl (grupo restrictivo) versus otro grupo (liberal) que fue transfundido con Hb<10g/dl10. Se objetivó menor mortalidad en el grupo restrictivo en individuos <55 años (p=0,02) y cuando el APACHE II era <20 (p=0,03) con la excepción de aquellos con función cardiaca comprometida (p=0,69)10, reproduciéndose datos similares en el estudio TRISS11.
Uno de los aspectos fundamentales a destacar de ambos estudios es que los pacientes con lesión cerebral aguda no están representados, de ahí que dicho subgrupo poblacional se encuentre excluido de la estrategia restrictiva transfusional en las recomendaciones de la Sociedad Europea de Cuidados Intensivos12.
Hemoglobina y transfusión en la lesión cerebral agudaFundamentos fisiológicos para mantener niveles adecuados de hemoglobinaDebido a su incesante trabajo, el cerebro consume, en condiciones fisiológicas, el 20-25% del total de O2 y glucosa del organismo. Durante la injuria, el cerebro, que carece de reservas de sustratos energéticos, se torna vulnerable al déficit de los mismos y aumenta su demanda13. En este sentido, cualquier alteración en la cadena de suministro del O2 (incluyendo a la Hb), podría ocasionar hipoxia tisular cerebral: uno de los mecanismos deletéreos de daño cerebral secundario14.
En lo que respecta a la fisiopatología de la hipoxia tisular relacionada con la Hb, destacan: a) anémica; ocurre cuando los niveles de Hb son insuficientes para transportar O2 de acuerdo a las demandas celulares (cada gramo de Hb transporta 1,34ml de O2); b) de alta afinidad; desencadenada por desequilibrios fisiológicos que desvían la curva de disociación del O2 hacía la izquierda, dificultando el aporte celular (hipotermia, hipocapnia, alcalosis metabólica, déficit de 2-3 difosfoglicerato en transfusiones de sangre que ha permanecido almacenada por periodos prolongados) y c) Hb de mala calidad, caracterizada por la incapacidad de transportar O2 (carboxihemoglobina, metahemoglobina)14,15.
Evidencia clínica preliminar: cuando la incertidumbre es la única certidumbreEl nivel óptimo de Hb en la lesión cerebral aguda se desconoce. Tanto la presencia de anemia como el acto transfusional han sido asociados a incremento de complicaciones, mortalidad y peores resultados funcionales16–20.
La evidencia clínica más robusta enfatiza las limitaciones y problemas metodológicos de los estudios analizados, concluyendo que la información disponible es incierta, confusa e inconclusa con respecto al efecto de la estrategia transfusional liberal vs. restrictiva sobre la mortalidad y los resultados funcionales21–26.
Trials recientes: ¿Hay luz al final del túnel?La respuesta es «tren en movimiento»: una sentencia alegórica que hace referencia a HEMOTION y TRAIN, dos estudios recientes que intentan iluminar las sombras existentes27,28. Las características principales, resultados, fortalezas y debilidades de ambos se resumen en la tabla 1. Las conclusiones son similares y señalan un «cambio de paradigma», al establecer que la estrategia liberal destinada a mantener Hb>9g/dl se asocia a mejores resultados funcionales27,28.
Características de los estudios HEMOTION y TRAIN
| HEMOTION30 | TRAIN31 | |
|---|---|---|
| Diseño | Multicéntrico, prospectivo, randomizado y controlado | Multicéntrico, prospectivo, randomizado y controlado. Fase 3. Etiqueta abierta |
| Población | TCE moderado, severo (GCS: 3-12) y Hb≤10g/dl | TCE; HSA; HIC (GCS≤13) yHb≤9g/dl |
| Número de pacientes | 736 | 820 |
| Randomización | Grupo liberal (n=369)Transfusión=Hb≤10g/dlGrupo restrictivo (n=367)Transfusión=Hb≤7g/dl | Grupo liberal (n=397)Transfusión=Hb <9g/dlGrupo restrictivo (n=423)Transfusión=Hb <7g/dl |
| Nivel de Hb medio (gr/dl) a la randomización | 9,1 en ambos grupos | 8,5 en ambos grupos |
| Tiempo medio admisión-randomización | 55h grupo liberal56h grupo restrictivo | 3 días |
| Intervención | Concentrado de eritrocitos leuco-deplecionados dentro de las 3h de randomización | Concentrado de eritrocitos al momento de randomización |
| Monitorización PIC (%) | 56,1 grupo liberal vs. 63,5 grupo restrictivo | Grupo liberal 70,6 vs. 69,1 grupo restrictivo |
| Monitorización oxigenación cerebral (%) | 4,6 grupo liberal vs. 6,3 grupo restrictivo | No especificado |
| Resultados primarios | GOS-E 180 días postadmisión. Resultados desfavorables) 68,4% (liberal) vs. 73,5% (restrictivo)Diferencia absoluta ajustada 5,4% (IC 95%: −2,9-13,7)aHallazgos permanecen consistentes en el análisis de subgrupos | GOS-E 180 días post admisiónResultados desfavorables 62,6% (liberal) vs. 72,6% (restrictivo)RR ajustado 0,86 (IC 95%: 0,79-0,9; p=0,002)Hallazgos consistentes al analizar subgrupos |
| Resultados secundarios | Sin diferencias significativas en mortalidad en la UCI (17,1 vs. 15,3%), hospitalaria (23 vs. 21,5%), o a los 6 meses (26,8 vs. 26,3%)Ninguna diferencia significativa en independencia funcional u otra medida de resultados funcionales | Eventos isquémicos cerebrales (al menos 1)8,8% (liberal) vs. 13,5% (restrictivo)RR (liberal) 0,65 (IC 95%: 0,44-0,97), sugiriendo menor riesgo |
| Limitaciones | Ausencia de doble ciegoNo se aportan datos de hipoxia tisular cerebralaTamaño de muestra calculado para detectar 10% de diferencia entre grupos con resultados desfavorablesSi bien el 5,4% fue la diferencia a favor estrategia liberal, ello es clínicamente significativoDiferencias en las características basales entre los grupos. Ajustando las diferencias puede que exista una reducción absoluta del riesgo de resultados desfavorables en el 13,7% para el grupo liberalAnálisis estadístico con un abordaje frecuentistaAusencia de análisis bayesiano | Ausencia de doble ciegoPoblación heterogénea con diferentes historias naturales y fisiopatologíaNo se registró el dato de transfusión previo a randomizaciónPoder muestral limitado para detectar diferencias entre subgruposDefinición no convencional de resultados desfavorablesDicotomización del GOS-EDoble ajuste del tamaño muestral durante la ejecución del estudioAusencia de datos acerca de retiro de soporte u ordenes de no resucitaciónAusencia de análisis bayesiano |
GCS: escala de coma de Glasgow; GOS-E: escala de resultados extendida de Glasgow; Hb: hemoglobina; HIC: hemorragia intracerebral; HSA: hemorragia subaracnoidea; IC: intervalo de confianza; PIC: presión intracraneal; RR: riesgo relativo; TCE: traumatismo craneoencefálico; UCI: unidad de cuidados intensivos.
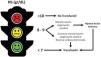
Transfundir conlleva beneficios y riesgos, que deberían sopesarse exhaustivamente. Transfundir debería ser una medida coste-efectiva y meditada, sin embargo, el solo empleo del nivel de Hb como guía para gatillar transfusión es insuficiente y hasta peligroso, ya que podría limitar u ocasionar transfusiones innecesarias. Cuando transfundir, continúa siendo una decisión empírica y arbitraria. Como monitorizar la eficacia de una transfusión es un tópico del que prácticamente no se habla (fig. 2).
Estudios fisiológicos con tomografía por emisión de positrones (PET), han evidenciado que la transfusión con niveles de Hb<10g/dl, incrementa el contenido arterial de O2 y disminuye la extracción de O2 celular, mientras que el flujo sanguíneo cerebral y el metabolismo permanecieron inalterables29,30.
Transfundir concentrados de hematíes (no almacenados por periodos prolongados), mejora la oxigenación cerebral invasiva (PtiO2), solo cuando la hipoxia tisular está presente31,32, sin embargo, sus efectos sobre el metabolismo cerebral son variables o nulos33–35.
La monitorización no invasiva de la oxigenación cerebral mediante espectroscopia cercana al infrarrojo (NIRS), aún no ha sido capaz de detectar impacto alguno de la transfusión de glóbulos rojos36,37.
Para finalizar, ¿cómo monitorizamos la calidad de la Hb suministrada? Sin dudas, esto no solo se trata de «un número a alcanzar», por lo que deberíamos repensar este aspecto e incluir sistemáticamente la valoración de variables fisiológicas básicas que nos permitan establecer si la Hb del paciente y la suministrada se encuentra apta a la hora de ceder o no el oxígeno a los tejidos.
Conclusión y opinión de los autoresLa anemia es un insulto secundario prevalente durante la lesión cerebral aguda. Su rol deletéreo radica en que compromete el TO2 cerebral, pudiendo desencadenar hipoxia tisular. El acto transfusional (con hematíes frescos leuco-seleccionados) requiere una evaluación previa de riesgos y beneficios. A la luz de la reciente evidencia pareciera prudente mantener niveles de Hb alrededor de los 10g/dl. Sin embargo, al transfundir debemos establecer la eficacia y esta no solo se valora analizando «un número».
Consideramos indispensable mantener variables fisiológicas básicas que aseguren un adecuado transporte y suministro de oxígeno a los tejidos, sobre todo en ambientes que carecen o tienen limitados los recursos de neuromonitorización avanzados. Cuando las técnicas de valoración de oxigenación cerebral, tanto invasivas como no invasivas, están disponibles, consideramos la necesidad de emplearlas como un elemento más y no el único para establecer la estrategia transfusional.