Editado por: Ana Ochagavía - Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat. Barcelona. Spain.
Última actualización: Febrero 2024
Más datosLa ecografía es un instrumento diagnóstico fundamental en el paciente crítico con membrana de oxigenación extracorpórea (ECMO). Con ella podemos hacer una evaluación anatómica y funcional (cardiaca, pulmonar y vascular) para plantear una adecuada configuración; además, guía su implante, ayuda en la monitorización clínica y la detección de complicaciones, facilita su retirada y completa la evaluación postimplante. En los pacientes con ECMO como soporte respiratorio (veno-venosa), la ecografía torácica permite monitorizar la evolución de la enfermedad pulmonar y la ecocardiografía la evaluación de la función biventricular, especialmente la derecha, y el gasto cardiaco para optimizar el transporte de oxígeno. En la ECMO como soporte circulatorio (veno-arterial), la ecocardiografía supone la guía de la monitorización hemodinámica, permite detectar las principales complicaciones y ayuda al destete del dispositivo. En los equipos ECMO, para un adecuado manejo de estos pacientes, debe haber intensivistas entrenados y con conocimientos avanzados sobre esta técnica.
Ultrasound is an essential diagnostic tool in critically ill patients with extracorporeal membrane oxygenation (ECMO). With it, we can make an anatomical and functional (cardiac, pulmonary and vascular) evaluation which allows us to execute an adequate configuration, guides implantation, helps clinical monitorization and detects complications, facilitates withdrawal and complete post-implant evaluation. In patients with ECMO as respiratory support (veno-venous), thoracic ultrasound allows monitoring pulmonary illness evolution and echocardiography the evaluation of biventricular function, especially right ventricle function, and cardiac output to optimize oxygen transport. In ECMO as circulatory support (veno-arterial), echocardiography is the guide of hemodynamic monitoring, allows detecting the most frequent complications and helps the weaning. In ECMO teams, for a proper management of these patients, there must be trained intensivists with advanced knowledge on this technique.
La membrana de oxigenación extracorpórea (ECMO) es un sistema de soporte mecánico cuyo objetivo es la estabilización cardiopulmonar total o parcial en un paciente con fracaso circulatorio y/o respiratorio. Aunque la ECMO tiene más de 50 años de historia desde la primera vez que se aplicó con fines terapéuticos1, no ha sido hasta las últimas décadas cuando se ha extendido su uso a nivel mundial. La aparición de nuevos dispositivos y materiales, los resultados obtenidos durante la pandemia de gripe A2,3 y la centralización de los pacientes en centros de referencia con equipos multidisciplinares son varios de los factores que han condicionado que la ECMO forme parte de las medidas terapéuticas para el manejo de la insuficiencia cardiorrespiratoria refractaria. Debido a las características de estos pacientes y a la complejidad de los procesos, la evidencia científica disponible es limitada4,5, pero existen múltiples estudios donde se demuestra su utilidad, y es por ello por lo que existen recomendaciones de diferentes sociedades científicas para su uso6–8.
El uso de los ultrasonidos en el paciente crítico es una realidad y supone un instrumento fundamental para la evaluación tanto general como específica de la enfermedad cardiovascular y respiratoria. Pese a la complejidad de la exploración y las necesidades técnicas, nos permite hacer una aproximación con una alta capacidad diagnóstica a pie de cama y de manera inmediata9,10. En el caso de los pacientes con ECMO, debido al aumento en sus indicaciones y configuraciones, la ecografía, y especialmente la ecocardiografía transtorácica (ETT) o transesofágica (ETE) en caso de mala ventana, se ha convertido en un instrumento fundamental11,12. Para su realización se recomienda que existan profesionales entrenados en su uso, ya que permite hacer una evaluación anatómica y funcional cardiopulmonar precisa, guía en la inserción y el posicionamiento de las cánulas, ayuda en la optimización del flujo, permite realizar seguimiento para detectar y resolver cambios clínicos, facilita su retirada y permite realizar una evaluación postimplante de posibles complicaciones13–15. En la tabla 1 se resumen los parámetros ecocardiográficos a evaluar y registrar en los pacientes con ECMO.
Parámetros ecocardiográficos a evaluar en pacientes con membrana de oxigenación extracorpórea
| Estructura | Parámetro | Referencia |
|---|---|---|
| Ventrículo izquierdo | ||
| Morfología | Tamaño y espesor miocárdico | |
| Posición septal | ||
| Presencia de autocontraste/trombos | ||
| Función sistólica | Fracción de eyección | |
| Movilidad segmentaria | ||
| Onda S mitral (TDI) | >6cm/s | |
| Velocidad y tamaño de la IVT de TSVI | >1m/s y >10cm | |
| Función diastólica | Relación E/A del flujo transmitral | <2 |
| TDE del flujo mitral | >150ms | |
| Relación E/e’ del anillo mitral | <8 | |
| Válvulas mitral y aórtica | Diagnóstico y gradación de posible insuficiencia y/o estenosis | |
| Aurícula izquierda | Tamaño y volumen | <35mL/m2 |
| Flujo de venas pulmonares | Onda S>D | |
| Ventrículo derecho | ||
| Morfología | Relación área telediastólica VD/VI | <0,6 |
| Posición y movimiento septal | ||
| Geometría ventricular | Triangular | |
| Índice de excentricidad | 1 | |
| Espesor miocárdico | <8mm | |
| Función sistólica | TAPSE | >16mm |
| Onda S’ tricuspídea (TDI) | >10cm/s | |
| Fracción de acortamiento | >35% | |
| Signo de McConnell | ||
| Función diastólica | Relación E/A del flujo tricuspídeo | <2 |
| Válvulas tricúspide y pulmonar | Insuficiencia tricuspídea para estimación de PAPs | <3m/s |
| Flujo pulmonar (Tac) | >120ms | |
| Aurícula derecha | Área | <20cm2 |
| Estructuras (válvulas, Chiari, seno coronario) | ||
| Integridad septal (foramen oval) | ||
| Shunt AD-AI (Doppler color±test suero agitado) | ||
| Venas cavas inferior/superior | Tamaño y variación respiratoria | <20cm |
| Posición de cánulas | ||
| Trombos | ||
| Aorta | Trombosis/ateromatosis/disección | |
| Pericardio/pleura | Derrame (características y gradación) |
AD-AI: aurícula derecha-aurícula izquierda; IVT: integral velocidad-tiempo; PAPs: presión sistólica de la arteria pulmonar; Tac: tiempo de aceleración; TAPSE: desplazamiento sistólico del anillo tricuspídeo; TDE: tiempo de desaceleración; TDI: Doppler tisular; TSVI: tracto de salida del ventrículo izquierdo; VD: ventrículo derecho; VI: ventrículo izquierdo.
Pese a su gran utilidad, el uso de ultrasonidos en los pacientes con ECMO tiene importantes limitaciones. A la hora de la evaluación bidimensional, tanto por la posición del paciente (decúbito supino o incluso prono) como por la presencia de ventilación mecánica invasiva o sistemas como catéteres vasculares, sondas o drenajes, la adquisición puede verse reducida. Además, en cuanto a la evaluación funcional e interpretación de los registros que van a guiar el ajuste de la ECMO, no los puede realizar cualquier explorador y es necesario un nivel avanzado de conocimientos tanto técnicos como clínicos. De ellos se derivan decisiones y ajustes que claramente pueden tener consecuencias en la evolución.
Aunque existen diferentes configuraciones16, la presente revisión se centra en la utilidad de la ecografía en el paciente con ECMO veno-venosa (VV) y veno-arterial (VA).
ECMO veno-venosaEvaluación pre-ECMO veno-venosaEl examen ecográfico preimplante de una ECMO VV se debe realizar de forma rutinaria, ya que existen diferentes condiciones que se deben valorar para elegir el tipo de asistencia y la configuración más adecuada.
La existencia de una disfunción del ventrículo izquierdo (VI) grave y refractaria a inotropos puede condicionar que precise un cambio de configuración de VV a VA o a veno-arteria-vena14. Además de la valoración ecocardiográfica (fracción de eyección de ventrículo izquierdo [FEVI]<30% y/o integral velocidad-tiempo [IVT] del tracto de salida del VI [TSVI]<10cm), la presencia de un lactato persistentemente elevado (>5mmol/L), una saturación venosa central<55%, un índice cardiaco<2,1, la presencia de una arritmia con compromiso hemodinámico, la parada cardiaca y/o un score de inotrópicos>50 puntos durante una hora o >45 puntos durante 8h son factores que pueden ser útiles para predecir la claudicación con ECMO VV17.
En la evaluación para el implante de una ECMO VV otro factor esencial es la función del ventrículo derecho (VD). Muchos pacientes con síndrome de distrés respiratorio agudo grave presentan hipertensión pulmonar y disfunción del VD en relación con la hipoxia, la hipercapnia, el aumento de la presión de las vías aéreas y la ventilación mecánica. La ECMO VV, al corregir la hipoxia y la hipercapnia, disminuye la poscarga y puede mejorar la función del VD de manera que se corrija la inestabilidad hemodinámica. En caso de presentar una disfunción ventricular derecha significativa será importante realizar un seguimiento ecocardiográfico y, si se perpetúa la situación de shock y no mejoran los parámetros ecocardiográficos a pesar de la ECMO VV, habría que plantear un cambio de estrategia a un VA o veno-arteria-vena. Para la evaluación de la disfunción del VD valoraremos: desplazamiento sistólico del plano del anillo tricuspídeo<16mm, onda S’<10cm/s, fracción de acortamiento<35%, relación área telediastólica VD/VI>0,6 significativa y >1 grave o aplanamiento/abombamiento (en forma de «D») del septo interventricular tanto en sístole como en diástole (suplementario 1). Esta interdependencia se puede cuantificar a través del índice de excentricidad ventricular, que es el cociente entre el diámetro septo-cara inferior y cara anterior-cara inferior en sístole y diástole, siendo su valor normal=118.
Por otro lado, valoraremos la presencia de enfermedades subyacentes o alteraciones anatómicas que puedan contraindicar su colocación14. La valvulopatía tricúspide grave (insuficiencia y/o estenosis) puede comprometer el flujo de sangre oxigenada procedente de la ECMO de aurícula derecha (AD) a VD. La existencia de un foramen oval persistente o una comunicación interauricular, durante el destete de la ECMO, podría aumentar la presión en las cavidades derechas y crear un cortocircuito derecha-izquierda que condicionase la oxigenación e incluso la retirada del dispositivo. Una red Chiari prominente puede dificultar el posicionamiento de la cánula y dirigirla hacia el tabique interauricular. La presencia de un seno coronario dilatado por una vena cava superior izquierda, si se canula accidentalmente para el retorno, puede drenar la sangre en vez de a la AD, al brazo izquierdo.
Por último, deberemos elegir la mejor estrategia de canulación según las características de los accesos vasculares, haciendo hincapié en la presencia de trombos o variantes/anomalías anatómicas (suplementario 2).
Canulación e inicio del soporte veno-venosoSe recomienda el uso sistemático de la ecografía durante las diferentes fases de la canulación19.
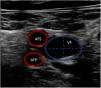
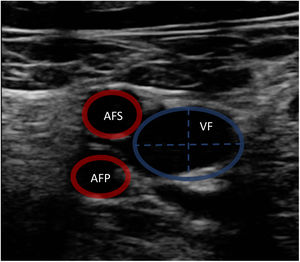
La ecografía vascular permite medir el diámetro vascular para elegir el tamaño óptimo de las cánulas (fig. 1). Para ello, se aplica la siguiente fórmula: tamaño cánula (French)=3×diámetro del vaso (mm). Se debe elegir el mayor tamaño de cánula tanto de drenaje como de retorno para proporcionar el mayor flujo posible. La punción vascular ecoguiada aumenta la seguridad y la tasa de éxito al primer intento, disminuyendo el riesgo de complicaciones locales (canalización arterial, canalización de la unión safeno-femoral o la transfijación del ligamento inguinal)11,20.
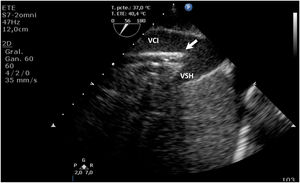
Durante la canulación, mediante la ecografía, podremos comprobar la inserción intravascular de las guías y posterior de las cánulas. En caso de uso de cánula de doble luz es indispensable la ETE, ya que puede haber complicaciones graves durante su implante (perforación de la AD o cava superior, migración al VD) y se debe comprobar una correcta orientación del flujo de retorno hacia la válvula tricuspídea21. En canulación con doble cánula simple, puede utilizarse la ETT o la ETE en ausencia de una buena ventana acústica. En la configuración fémoro-yugular, la cánula de drenaje debe quedar en la cava inferior por debajo de la vena suprahepática izquierda y el extremo de la de retorno a nivel de la AD (fig. 2) (suplementario 3). En la configuración fémoro-femoral, la cánula de drenaje debe quedar en la cava inferior y la de retorno en la AD. La distancia entre ambas cánulas debe ser al menos de 10cm para evitar la recirculación.
Manejo del paciente con ECMO veno-venosaDurante el soporte, la ecografía es una herramienta que nos ayuda a valorar la respuesta pulmonar a la terapia, monitorizar de forma dinámica los cambios hemodinámicos y detectar la aparición de complicaciones22. Para ello valoraremos:
- -
Cánulas: debemos monitorizar diariamente la correcta posición de las cánulas por ecocardiografía y apoyarla con el estudio radiológico simple de tórax-abdomen. Las movilizaciones de las cánulas pueden tener una repercusión en la oxigenación por incremento de la recirculación y además aumentan el riesgo de decanulación accidental. Los cambios en las presiones intracircuito nos pueden indicar posibles desplazamientos de las cánulas, y la realización de una ecografía nos permitirá la confirmación rápida de esta complicación. Por otro lado, valoraremos la aparición de trombos alrededor de las cánulas o intracánulas (suplementario 4). Esta complicación nos llevará a optimizar la anticoagulación, además de poder plantear el cambio de cánula y/o de ubicación.
- -
La función del VD puede verse deteriorada dentro del contexto del propio síndrome de distrés respiratorio agudo o por complicaciones concomitantes, como es el tromboembolismo pulmonar. La presencia de datos ecocardiográficos de disfunción ventricular grave junto con inestabilidad hemodinámica refractaria nos puede orientar a la necesidad de un cambio de configuración a VA o veno-arteria-vena.
- -
Mediante la ETT/ETE debemos evaluar la función del VI. La presencia de una FEVI<30%, una IVT del TSVI<10cm, una relación E/A>2 y/o un tiempo de desaceleración del flujo mitral<150ms nos debe hacer pensar en una disfunción de VI, el aumento de presiones izquierdas y la posible necesidad de un cambio de configuración.
- -
Trombos intracavitarios o en válvulas cardiacas: este hallazgo, al igual que los trombos pericanulares, nos obliga a optimizar la anticoagulación y nos alerta de la posible aparición de complicaciones hemodinámicas.
- -
La ecografía pulmonar monitoriza de forma dinámica, fácil y segura la respuesta pulmonar a la terapia y la evolución de la enfermedad primaria mediante el análisis Lung Ultrasound Score. Esta puntuación divide el área pulmonar en 12 regiones (6 por cada hemitórax) y asigna de 0 a 3 puntos a cada una de ellas, anotándose el peor valor observado de cada zona. Hablamos de patrón A (0 puntos) cuando presenta deslizamiento pleural con líneas A y≤2 líneas B aisladas por espacio intercostal, B1 (un punto) con la presencia de≥3 líneas B aisladas no coalescentes, B2 (2 puntos) con líneas B coalescentes o «pulmón blanco» con o sin consolidaciones subpleurales pequeñas, y C (3 puntos) al patrón de consolidación pulmonar extenso (se excluyen las pequeñas consolidaciones subpleurales)23,24.
La ecografía ayuda a diagnosticar la aparición de complicaciones durante la ECMO VV y en algunas de ellas nos ayuda en su tratamiento.
En caso de hipoxia refractaria, la ecografía nos permite valorar la posición de las cánulas como causa de recirculación y también evaluar el gasto cardiaco (GC) para valorar la relación entre el flujo de la ECMO y el GC del paciente o cociente QECMO/QGC. Si el cociente está reducido (≤60%) refleja un flujo de ECMO insuficiente para el GC, por lo que la primera opción será aumentar el flujo de la ECMO. Si no es posible, se podría plantear, además del control de la causa, otras medidas como el control de la temperatura o el uso de betabloqueantes para disminuir el GC. Por el contrario, cuando el flujo de la ECMO es adecuado al GC (>60%), en caso de hipoxemia, deberíamos pensar que existe un mayor flujo de sangre desoxigenada que no pasa por el circuito y deberíamos plantear medidas para optimizar su oxigenación, como el decúbito prono en ECMO8,25.
La ecografía, además, nos permite la detección de complicaciones pulmonares, de manera precoz y segura:
- -
Neumotórax: el diagnóstico se establece mediante la presencia de 2 signos:
- •
Deslizamiento pulmonar abolido con/sin presencia de líneas E.
- •
Punto pulmonar que corresponde al lugar de contacto entre el pulmón colapsado y la colección de aire del neumotórax. Es un signo dinámico con una especificidad del 100% que muestra alternancia entre el deslizamiento normal (signo de la orilla) en inspiración y abolido (signo estratosfera o en código de barras) durante la espiración en 2D y modo M (suplementario 5).
- -
Derrame pleural: se visualiza como espacio libre de ecos, generalmente anecoico por encima del diafragma. La presencia de una imagen heterogénea o con ecogenicidad aumentada puede orientar a sangre, y la aparición de septos en el derrame orienta a un derrame pleural organizado.
- -
Broncograma: se observa como una zona subpleural hipoecogénica con imágenes en su interior hiperecogénicas (broncograma aéreo) o de contenido hipoecogénico con paredes hiperecogénicas (broncograma líquido). Puede ser estático (atelectasias) o dinámico (neumonías) (suplementario 6).
- -
Hepatización/condensación: cuando la densidad ecográfica del pulmón se asemeja a la del hígado.
En los pacientes con mejoría respiratoria y en los que se plantee la retirada de la ECMO VV, la ecocardiografía nos ayuda a evaluar la respuesta del VD y los signos de hipertensión pulmonar al disminuir la asistencia. Por otro lado, antes de retirar las cánulas, la ecocardiografía permite evaluar la existencia de trombos intraauriculares que puedan demorar el destete mediante el aumento de la anticoagulación para intentar disminuir el tamaño de estos y evitar su migración durante la decanulación.
Tras la retirada de la ECMO, es necesario valorar la persistencia de trombos en la AD, la vena cava y/o en miembros inferiores (suplementario 7 y 8). Su uso es de gran utilidad en el seguimiento clínico para guiar el tiempo necesario de anticoagulación postasistencia y diagnosticar la aparición de trombosis venosas profundas en los vasos que han estado canulados o de tromboembolismo pulmonar, que puedan necesitar otros tratamientos coadyuvantes (trombectomía, filtros de cava)26.
ECMO veno-arterialEvaluación pre-ECMOExisten diferentes indicaciones (shock cardiogénico en infarto agudo de miocardio, miocarditis o intoxicaciones, shock poscardiotomía, tromboembolismo pulmonar, parada cardiorrespiratoria, etc.) por las que se puede implantar una ECMO como soporte circulatorio, y esta puede presentar diferentes configuraciones (periférica, central, híbrida)27. Debido a ello, salvo que exista contraindicación o la situación no lo permita, la ecografía debe ser una exploración imprescindible antes de su implante.
Debemos realizar un ETT/ETE basal que evalúe el tamaño, la función y la interdependencia tanto ventricular como auricular. Buscaremos la presencia de posibles defectos anatómicos (comunicaciones, trombos, válvulas prominentes, etc.) o de la aorta (disección, aneurismas) que puedan dificultar o incluso impedir la implantación del dispositivo. Además, debemos detectar la presencia de anomalías valvulares (insuficiencia mitral o aórtica) que sean susceptibles de empeorar tras la instauración de la terapia (suplementario 9), o incluso que requieran intervención quirúrgica previa.
Junto con la evaluación cardiaca, buscaremos la presencia de posibles derrames previos, sobre todo pericárdicos, o enfermedad vascular (arteriosclerosis, trombosis) que puedan empeorar o aparecer en relación con su implante. Su existencia puede condicionar el cambio de configuración (central o periférico) o acceso (derecho/izquierdo o femoral/subclavio)14,15.
Además de los signos ecográficos, es importante tener en cuenta y registrar la situación hemodinámica, las medidas de soporte (ventilación mecánica, balón de contrapulsación, etc.) y el tratamiento farmacológico (tipo y dosis de fármacos vasoactivos, inotrópicos o vasodilatadores) que puedan influir en la interpretación.
Canulación e inicio del soporte veno-arterialLa evaluación, la punción vascular y la colocación de guías es común a la VV y debemos seguir la misma sistemática. Respecto al posicionamiento de la cánula venosa, en la VA esta debe ser multiperforadora y se debe colocar a la altura de la AD con el extremo a nivel de la vena cava superior para tener el mayor drenaje posible (suplementario 10).
En la canulación arterial femoral percutánea, la ecografía vascular será de gran utilidad para una correcta evaluación del punto de inserción, evitando placas de ateroma o alteraciones vasculares. Para la inserción de la cánula de retorno, se debe puncionar e introducir las guías en dirección craneal, por encima de la bifurcación femoral28. Dado que la cánula puede ocluir por completo la luz arterial y, por tanto, comprometer el flujo de la extremidad canulada, con la ecografía se debe canular la arteria femoral superficial en dirección caudal para asegurar la perfusión de la extremidad7. Una vez insertada la guía a nivel arterial, la ETT/ETE permite reconocer su posición a nivel de la aorta descendente, confirmando el correcto acceso arterial de la guía. Esto es de utilidad en casos de muy bajo flujo o pulsatilidad, como es la PCR, donde la evaluación periférica puede ser dificultosa, y que requieren una canulación de urgencia29.
Al iniciar el soporte, la ETT/ETE nos permitirá evaluar la situación, el tamaño y el grado de descompresión de las cavidades cardiacas, la posición septal como expresión de la interdependencia ventricular, evaluar el estado de volemia/precarga que pueda comprometer el flujo de la ECMO y el desarrollo de posibles complicaciones precoces como es el desarrollo de derrame pericárdico, el cierre valvular aórtico o el aumento de insuficiencias valvulares por el aumento de la poscarga del VI que condiciona la ECMO30.
Manejo del paciente con ECMO veno-arterialDebemos tener en cuenta que la mayor parte de los sistemas de monitorización (termodilución transpulmonar, análisis de contorno de pulso) están artefactados por el efecto hemodinámico de la ECMO, por lo que debemos incluir la ETT/ETE en la evaluación diaria de estos pacientes. Mediante esta exploración podremos valorar y comparar con la exploración basal15:
- -
El tamaño y contractilidad biventricular que nos indique la evolución de la función cardiaca por la que se instauró la ECMO.
- -
La presencia de signos ecocardiográficos (relación E/A, pendiente de desaceleración de la onda E, relación E/e’) de altas presiones telediastólicas izquierdas que nos indique una inadecuada descarga ventricular.
- -
La aparición o progresión de una insuficiencia mitral por dilatación ventricular y/o por aumento de presiones (suplementario 11).
- -
La presencia de autocontraste que evidencie estasis sanguínea o incluso trombos intracavitarios que puedan condicionar un embolismo distal (suplementario 12).
- -
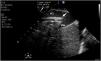
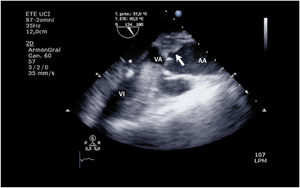
El aumento de la poscarga que condiciona la ECMO, junto con la baja contractilidad ventricular izquierda, puede comprometer la apertura valvular aórtica, pudiendo presentar un cierre precoz de la válvula (suplementario 13) e incluso permanecer cerrada (fig. 3 y suplementario 14).
- -
Aparición o progresión de una insuficiencia aórtica que impida la descarga del VI y perpetúe las altas presiones telediastólicas (suplementario 15).
- -
El volumen sistólico y el GC nativo mediante el uso de la IVT del TSVI que nos permita evaluar la evolución de la función ventricular. Debemos tener en cuenta que el volumen circulante por el territorio pulmonar que llegue a cavidades izquierdas puede variar en función de la presencia de colaterales aortopulmonares, circulación bronquial y sobre todo por el flujo de la ECMO.
- -
La presencia y características de un derrame pericárdico. En estos casos hay que tener en cuenta que los datos de colapso de las cavidades derechas pueden verse aumentados por la presión negativa que genera la ECMO, no así en cavidades izquierdas, y, por tanto, los signos de taponamiento habrá que correlacionarlos con la situación clínica y el comportamiento de la ECMO.
- -
La posición y el flujo de las cánulas: las movilizaciones del paciente pueden hacer que las cánulas cambien de posición, por lo que debemos evaluarlas diariamente, y valorar la aparición de trombos adheridos que puedan embolizar o incluso comprometer el flujo de la ECMO.
Además de la ecocardiografía, en la monitorización diaria podremos utilizar la ecografía pleuropulmonar para la evaluación tanto parenquimatosa pulmonar como diafragmática o pleural30,31. El Doppler transcraneal, pese a las limitaciones que tiene por verse artefactado por el flujo continuo de la ECMO y otros dispositivos (balón de contrapulsación intraaórtico [BCIAo], Impella®) (suplementario 16), también puede ser de utilidad en la evaluación de la hemodinámica cerebral e incluso en el diagnóstico de muerte encefálica32,33.
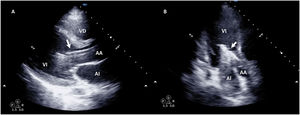
Por último, muchos de los pacientes con ECMO VA pueden tener algún otro dispositivo de asistencia ventricular izquierda (BCIAo, Impella®) como medida de descarga ventricular34 y de los que también deberemos controlar su posición y funcionamiento12. En el caso del BCIAo, mediante ETT/ETE podremos observar el inflado del balón a nivel de la aorta descendente con su extremo distal a nivel del nacimiento de la subclavia izquierda (suplementario 17). El Impella® se puede explorar tanto por ETT (paraesternal de eje largo o apical de 3 cámaras) como por ETE (mediesofágico 120°) y debemos observar el dispositivo entrando desde la aorta ascendente y el inlet o zona de succión a 3-4cm de la válvula aórtica35,36 (fig. 4 y suplementario 18).
Resolución de problemas de ECMO veno-arterialUna de las complicaciones más frecuentes en los pacientes con ECMO VA es la caída de flujo. Mediante el ETT/ETE podremos comprobar el posicionamiento de las cánulas con eventos de succión (suplementario 19), la presencia de trombos o la presencia de un derrame pericárdico que justifique la imposibilidad del llenado del dispositivo como causa de la caída de flujo (suplementario 20). Debemos tener en cuenta que si no hay un compromiso del flujo, la presencia de un derrame pericárdico no tiene porqué suponer una intervención, por lo que debemos monitorizar sus características y evolución dado que, en ocasiones, los signos de taponamiento cardiaco solo se ponen de manifiesto en el momento de la retirada.
El cierre aórtico es una complicación indeseada y que se debe resolver ya que, si se perpetúa, condiciona una estasis sanguínea a nivel intraventricular y un aumento de las presiones izquierdas que se traduce en una dilatación de cavidades izquierdas y, finalmente, en edema pulmonar persistente. En caso de que esto ocurra, en la ETT podremos ver humo o incluso trombos intraventriculares y signos de altas presiones (una relación E/A>2 y/o un tiempo de desaceleración del flujo mitral<150ms) izquierdas. Además de la utilidad diagnóstica/evolutiva, la ETT nos ayudará a guiar el tratamiento de esta complicación mediante la evaluación de la rentabilidad del uso/aumento del tratamiento inotrópico (suplementario 21) o guiando la implantación de dispositivos (BCIAo/Impella®) o intervencionismos (septostomía auricular, drenaje apical, ECMO veno-arterial de aurícula izquierda) para la descarga de presiones izquierdas12.
En casos con ECMO VA fémoro-femoral, cuando la función ventricular mejora y todavía no ha mejorado la función pulmonar, podemos observar un cuadro de hipoxemia diferencial, síndrome norte-sur o síndrome arlequín, debido a la perfusión del tronco superior con sangre poco oxigenada procedente de la circulación pulmonar y del inferior con sangre oxigenada procedente de la ECMO. Esta complicación se suele detectar mediante la determinación de la oxigenación (gasometría arterial, pulsioximetría) a nivel de la extremidad superior derecha o cerebral (espectroscopia cercana al infrarrojo), y nos obliga a optimizar la ventilación pulmonar nativa. En ese sentido, la ecografía pulmonar es de utilidad para evaluar tanto el patrón pulmonar como la posible respuesta a las medidas instauradas30.
Retirada y utilidad posdecanulación de la ECMO veno-arterialPara el destete de la ECMO VA el paciente debe presentar una situación de estabilidad clínica (láctico<2mmol/L, Pa/FiO2>200, mejoría de la disfunción orgánica) y hemodinámica (PAM>65mmHg, presión de pulso>20mmHg, SvO2>65%) que indique que la causa está controlada. Aunque no existe un protocolo ecocardiográfico validado ni una recomendación científica sobre cuándo y cómo retirar la ECMO, se acepta que el paciente debe tener signos ecocardiográficos de recuperación de la función biventricular (FEVI>25-30%, IVT del TSVI>10cm, S’ del anillo mitral>6cm/s, desplazamiento sistólico del plano del anillo tricuspídeo>16cm) y no presentar datos de altas presiones telediastólicas que puedan empeorar al retirar el soporte37. Al igual que en la VV, deberemos valorar la presencia de trombos pericanulares que puedan retrasar la retirada de la cánula o, al menos, continuar precozmente con el tratamiento anticoagulante una vez retirado.
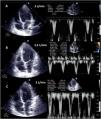
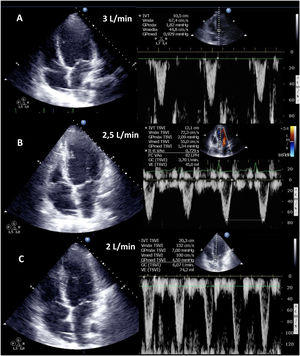
El destete supone un proceso de descenso gradual (500ml cada 15-20min) del soporte de la ECMO VA de manera que se restablece progresivamente la precarga en el corazón. Para ello el paciente debe estar adecuadamente anticoagulado. Evaluaremos la repercusión hemodinámica (PVC, PAM y diferencial, SvO2, SatO2) y ecocardiográfica (FEVI, IVT, onda E, onda E’ o S’ del anillo mitral lateral) que tiene hasta un nivel (normalmente 1-1,5l/min) que nos indique que el paciente puede tolerar la retirada de la asistencia. Durante esta, evaluaremos que mantiene e incluso aumenta la FEVI por encima del 25-30%, la IVT por encima de 10cm y la onda S’ de más de 6cm/s (fig. 5 y suplementario 22). Junto con ello, también evaluaremos el comportamiento de las cavidades derechas (desplazamiento sistólico del plano del anillo tricuspídeo>16cm, S’>10cm/s y tamaño VD) y la posible aparición de signos de hipertensión pulmonar (aumento de la velocidad pico de la insuficiencia tricuspídea) que predigan un fracaso de VD38–40.
Evaluación ecocardiográfica de destete de paciente con ECMO VA. Ecografía transtorácica e integral velocidad-tiempo (IVT) del tracto de salida del ventrículo izquierdo al reducir flujo (A: 3L/min, B: 2,5L/min, C: 2L/min) de ECMO VA. Obsérvese el aumento del tamaño de la IVT y consecuentemente del volumen sistólico y del gasto cardiaco.
Tras la retirada, realizaremos los mismos controles que en el caso de la VV, teniendo especial cuidado en el despistaje de trombos intracavitarios o intravasculares que obliguen a mantener el tratamiento anticoagulante, o que puedan migrar.
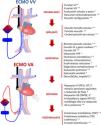
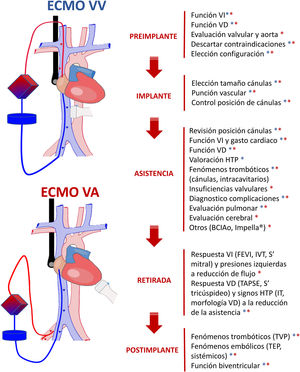
ConclusionesLa ecografía en los pacientes con ECMO es una herramienta fundamental en todas las fases del proceso de la asistencia. En la preimplantación, para valorar los vasos a canular y evaluar la función biventricular; durante la colocación, para asegurar una inserción segura y correcta de las cánulas; en la fase de asistencia, para detectar y tratar complicaciones y estudiar la evolución pulmonar y/o cardiaca y para hacer un destete seguro de la asistencia (fig. 6).
Papel de la ecografía en el paciente crítico con membrana de oxigenación extracorpórea (ECMO). BCIAo: balón de contrapulsación intraaórtico; FEVI: fracción de eyección del ventrículo izquierdo; HTP: hipertensión pulmonar; IT: insuficiencia tricuspídea; IVT: integral velocidad-tiempo; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda; VA: veno-arterial; VD: ventrículo derecho; VI: ventrículo izquierdo; VV: veno-venoso.
Asterisco azul: ECMO VV. Asterisco rojo: ECMO VA.
Teniendo en cuenta su utilidad, la ecografía debe ser un instrumento imprescindible en el manejo de estos pacientes y los intensivistas que la realicen deben tener conocimientos avanzados sobre aspectos anatómicos, técnicos y funcionales de esta técnica. Es necesaria una mayor investigación en este campo y el desarrollo de recomendaciones científicas que permitan una correcta formación y una mejora de los resultados de estos pacientes.
Conflicto de interesesLos autores declaran no presentar ningún conflicto de intereses.