En estudios experimentales realizados en animales y fisiológicos en humanos se ha demostrado que la ventilación mecánica es capaz de producir o agravar una lesión pulmonar preexistente1-10, así como de producir efectos deletéreos sobre otros órganos7,11-20, contribuyendo probablemente a la aparición del síndrome de disfunción múltiple orgánica. Los principales mecanismos fisiopatológicos implicados en la lesión pulmonar inducida por la ventilación mecánica son la sobredistensión pulmonar producida por el excesivo estiramiento, e incluso fractura tanto de los tejidos vasculares como del propio tejido pulmonar, y el cierre y apertura cíclico de unidades alveolares colapsadas. Estos mecanismos son inducidos por el excesivo estrés del tejido pulmonar, el uso de una presión transpulmonar excesiva y el mantenimiento de tejido pulmonar colapsado21.
Para evitar la aparición de este efecto secundario de la ventilación se han desarrollado en los últimos años estrategias ventilatorias protectoras del pulmón. Su diseño incluye el uso de un volumen circulante bajo, para controlar la presión transestructural, y el empleo de niveles de presión positiva al final de la espiración (PEEP) elevados para mantener abierta la mayor cantidad de tejido pulmonar posible. Recientemente diferentes ensayos clínicos y metaanálisis han puesto de manifiesto que el empleo de un volumen circulante (Vt) alrededor de 6 ml/kg y una Presión plateau (Pp) inferior a 30 cm de H2O reducen significativa-mente la mortalidad22-28.
Sin embargo, por el momento, no se conoce cuál es el nivel de PEEP óptimo para ventilar a los pacientes con lesión pulmonar aguda (LPA) o síndrome de distrés respiratorio agudo (SDRA). Estudios realizados mediante técnicas de imagen en humanos y en diferentes modelos experimentales sugieren que son necesarios niveles elevados de PEEP para mantener una apertura pulmonar significativa, sobre todo cuando se está empleando un volumen circulante bajo3,29-31, sin embargo el empleo de estos niveles de PEEP se podría asociar a la aparición de complicaciones (mala tolerancia hemodinámica, barotrauma, etc.)32-34.
El objetivo de la presente revisión sistemática y metaanálisis es comparar el efecto sobre la mortalidad en los pacientes LPA o SDRA de niveles altos de PEEP frente a niveles de PEEP convencionales, como estrategia ventilatoria protectora del tejido pulmonar.
MATERIAL Y MÉTODOSTipo de estudios
Ensayos clínicos controlados aleatorizados publicados tras la definición de LPA/SDRA publicada por la NAECC (1994)35.
Tipo de pacientes estudiados
Pacientes adultos críticos afectados por SDRA o LPA de cualquier causa; según la definición de la NAECC, intubados y con asistencia respiratoria.
Tipo de intervención
Empleo de dos brazos de tratamiento ventilatorio comparando el efecto de dos niveles diferentes de PEEP, independientemente de la estrategia ventilatoria empleada y del modo u objetivo que se emplee para determinar el nivel de PEEP adecuado.
Medidas de resultados
El desenlace primario considerado fue la mortalidad, por cualquier causa, registrada en el día 28 de la aleatorización. Si no se disponía de la mortalidad al día 28 se registró la mortalidad al alta de UCI, y si tampoco se disponía de ésta, la hospitalaria. El desenlace secundario fue la incidencia de barotrauma.
Estrategia para la identificación de estudios
Se incluyeron en la búsqueda las siguientes bases de datos electrónicas:
La estrategia general de búsqueda se realizó mediante los descriptores MESH «Respiration Artificial» y «Respiratory distress syndrome», «Adult», unidos por el operador «Y». Se emplearon los límites «Adult-all», «Human» y «Clinical Trial-all».
A partir de esta búsqueda inicial se realizó un método iterativo para buscar posibles términos descriptores MESH o en texto libre para ampliar la búsqueda («PEEP», «Expiratory pressure», etc.).
La búsqueda no tuvo limitaciones de idioma y fue llevada a cabo de forma independiente por dos de los investigadores. Las discrepancias, en caso de producirse, serían resueltas por un tercer investigador. La búsqueda electrónica se completó con la manual en las secciones de bibliografía de los artículos recuperados a partir de las fuentes anteriores.
Los artículos potencialmente elegibles se examinaron también por duplicado y de forma independiente, para comprobar la existencia de los siguientes criterios de exclusión:
Los artículos que superaron este primer filtro fueron examinados de forma más detallada, seleccionándose finalmente los que cumplían los criterios de inclusión.
Extracción de los datos
La extracción de los datos para la construcción de las tablas de contingencia y el análisis de calidad de los artículos seleccionados se llevó a cabo de forma independiente por dos investigadores; en caso de discordancia entre ambos ésta se resolvería mediante discusión y consenso dentro del grupo. Los datos de cada artículo fueron tabulados de forma estandarizada, incluyendo el cálculo del riesgo relativo (RR) de cada ensayo individual con intervalos de confianza (IC) al 95%.
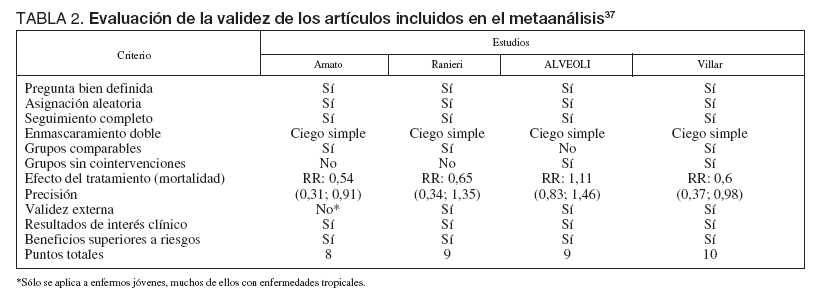
La calidad metodológica de los estudios se valoró mediante la escala de 5 puntos de Jadad et al36, estimando la calidad de la asignación aleatoria, del enmascaramiento del tratamiento y ausencia de pérdidas en el seguimiento. Se realizó una evaluación de la validez de los estudios mediante un cómputo del número de criterios positivos aplicados a cada estudio, según un cuestionario previamente publicado por Guyatt et al37.
Análisis de los datos
La concordancia entre observadores en la evaluación se examinó mediante el índice Kappa ponderado mediante pesos cuadráticos, ciñéndonos a la relevancia y calidad de los estudios.
A partir de los datos tabulados, para combinar los resultados de los estudios individuales seleccionados, se empleó un modelo de efectos fijos basado en el método de Mantel-Haenszel o de efectos aleatorios, en función de que exista o no heterogeneidad estadísticamente significativa (p < 0,05) en los resultados. Para estimar y cuantificar la heterogeneidad se emplearon el estadístico Q de Cochran y el estadístico I2.
La posible existencia de este «efecto de estudios pequeños»38 se evaluó visualmente mediante un gráfico de embudo, que enfrenta el efecto de los estudios (RR) con su precisión (error estándar) y, numéricamente, mediante la prueba de regresión de Egger39 y la prueba de correlación de rangos de Begg y Mazumdar40; en ambos casos se consideró significativa una p < 0,01. Éstas se completaron con la prueba de trim and fill41, que estima el número de estudios pequeños de signo opuesto que serían necesarios para contrarrestar el efecto de los incluidos en el análisis, y calcula los resultados que se producirían de incluirse en el metaanálisis dichos estudios. Adicionalmente, y como análisis de sensibilidad, para comprobar la influencia de los estudios individuales en el resultado global se repitieron los cálculos después de eliminar uno a uno todos los estudios incluidos.
Los análisis se realizaron empleando los programas: MIX (Bax L, Yu LM, Ikeda N, Tsuruta N, Moons KGM. MIX: Comprehensive Free Software for Meta-analysis of Causal Research Data - Version
1.54. 2006), G-stat 2.0, Review Manager 4.2 y StatsDirect (versión 2.6.2.).
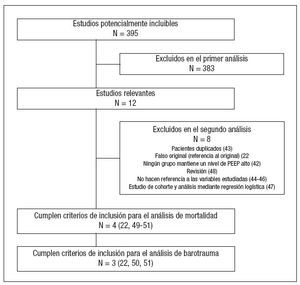
RESULTADOSSe identificaron 395 artículos potencialmente incluibles. De estos, 12 fueron considerados relevantes. De los mismos 8 no fueron incluidos en el análisis22,42-48 (fig. 1). El índice Kappa fue de 1 para todas las fases, no siendo preciso recurrir a una tercera opinión.
Figura 1. Número de estudios evaluados en cada fase de la revisión sistemática. PEEP: presión positiva al final de la espiración. Entre paréntesis figura la referencia bibliográfica.
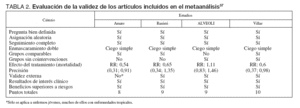
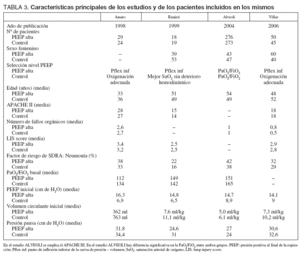
Los 4 artículos incluidos finalmente en el meta-análisis fueron Amato et al22, Ranieri et al49, Brower et 50 y Villar et al51. Los criterios de calidad de los 4 artículos se presentan en las tablas 1 y 2. Las características principales de los estudios y de los pacientes incluidos en los mismos se presentan en la tabla 3.
TABLA 1. Evaluación de calidad de los artículos incluidos en el metaanálisis. Escala de Jadad36
TABLA 2. Evaluación de la validez de los artículos incluidos en el metaanálisis37
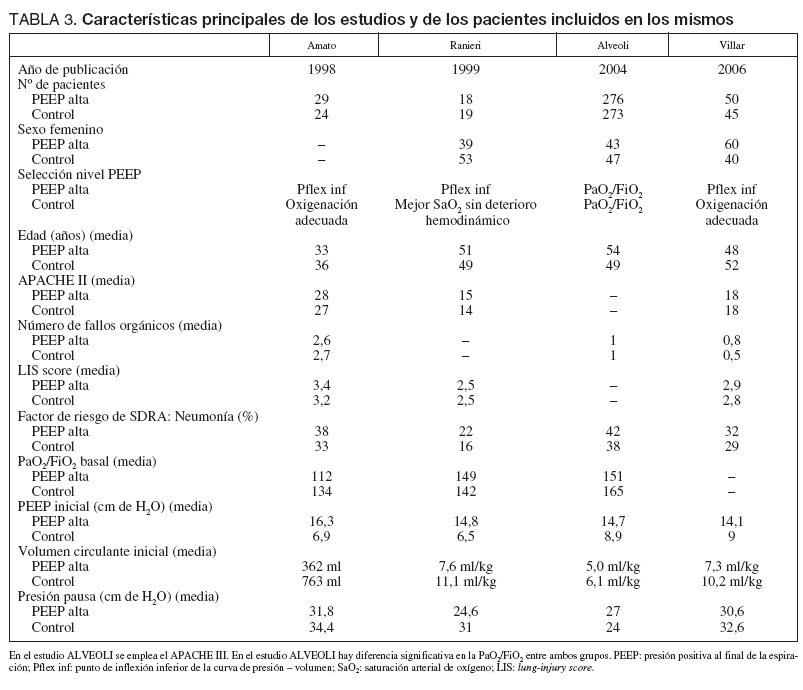
TABLA 3. Características principales de los estudios y de los pacientes incluidos en los mismos
Analizando cada estudio de forma individual el de Amato et al22 incluye 53 pacientes con SDRA, definido por un lung-injury score (LIS) de 2,5 o superior, y los aleatoriza a dos estrategias ventilatorias, un grupo convencional en el que emplea ventilación controlada por volumen, con un volumen circulante de 12 ml/kg y un nivel de PEEP para obtener una adecuada oxigenación. En el grupo «protector» se emplea ventilación controlada por presión, con un volumen circulante inferior a 6 ml/kg y limitando la presión pico a 40 cm de H2O y la diferencia entre presión pausa y PEEP a 20 cm de H2O, el nivel de PEEP se ajusta 2 cm de H2O por encima del punto de inflexión inferior de la curva pre-sión-volumen, o en 16 cm de H2O si no se encuentra dicho punto de inflexión. La PEEP empleada fue significativamente superior en el grupo intervención comparado con el control (PEEP media en los días 2 a 7: 13,2 ± 0,4 frente a 9,3 ± 0,5 cm de H2O; p < 0,01).
El estudio de Rainieri et al49 incluye a 37 pacientes con SDRA diagnosticado por los criterios de la NAECC, que son aleatorizados a una estrategia ventilatoria protectora consistente en el empleo de un volumen circulante entre 5 y 8 ml/kg y un nivel de PEEP ajustado 2 cm de H2O por encima del punto de inflexión inferior de la curva de presión-volu-men o en 15 cm de H2O si no se encuentra dicho punto de inflexión. El grupo control era ventilado con un límite de presión pausa de 35 cm de H2O y una PEEP ajustada en función de una adecuada PaO2. Este estudio fue diseñado para evaluar una diferencia en la concentración pulmonar y sistémica de marcadores inflamatorios a las 36 horas de la aleatorización.
El estudio ALVEOLI50 incluyó 549 pacientes con ALI según los criterios de la NAECC y que mantienen dichos criterios en los tres primeros días de evolución. Los pacientes fueron aleatorizados a dos grupos en los que se mantuvo la misma estrategia ventilatoria con una limitación del Vt a 6 ml/kg y un límite de presión pausa de 30 cm de H2O, en ambos grupos la PEEP se eligió según unas tablas predefinidas en función de la FiO2 necesaria para mantener una adecuada oxigenación. Durante la realización de este estudio hubo cambios en el protocolo, de modo que en los 80 primeros casos incluidos se emplearon maniobras de reclutamiento pulmonar que fueron suprimidas en los siguientes, al tiempo que se cambió la pauta de empleo de la PEEP. El estudio fue detenido antes de alcanzarse el tamaño muestral predefinido por una regla de futilidad en el tratamiento previamente definida. Se produjeron fallos en la aleatorización de modo que los pacientes del grupo de PEEP alta presentaron una mayor edad y una menor relación PaO2/FiO2 en el momento de la aleatorización. La PEEP empleada fue también significativamente superior en el grupo intervención (PEEP media en el día 3: 12,9 ± 4,5 frente a 8,5 ± 3,7 cm de H2O; p < 0,001).
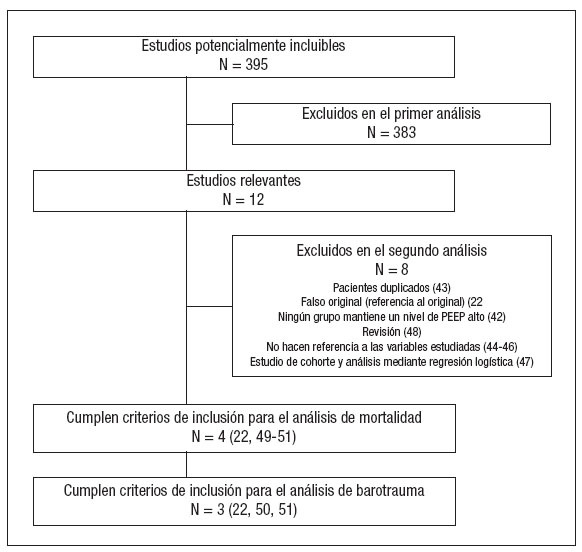
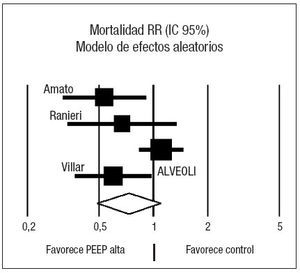
Figura 2. Metaanálisis sobre la mortalidad incluyendo todos los estudios seleccionados. Efecto sobre la mortalidad del empleo de presión positiva al final de la espiración (PEEP) alta frente a control. Total de eventos 110 (PEEP alta) frente a 120 (control). Test de heterogeneidad Chi cuadrado = 8,81, I2 65,9% (p = 0,03). Efecto no estadísticamente significativo (p = 0,13).
El estudio de Villar et al51 incluyó 103 pacientes con SDRA según los criterios de la NAECC, en los que la PaO2/FiO2 debía ser menor de 200 mmHg con unos parámetros estándar de ventilación con FiO2 superior a 0,5 y PEEP superior a 5 cm de H2O. Los pacientes fueron aleatorizados bien a un grupo control con un volumen circulante de 10 ml/kg, y PEEP ajustada en función de la PaO2, bien a un grupo protector con volumen circulante entre 5 y 8 ml/kg y PEEP 2 cm de H2O por encima del punto de inflexión inferior de la curva de presión-volumen, o 15 cm de H2O si no se identificaba dicho punto de inflexión. El estudio fue detenido antes de alcanzar el tamaño muestral estimado por una regla predefinida de disminución significativa de la mortalidad. El nivel de PEEP empleado fue significativamente superior en el grupo protector (PEEP media en el día 1: 14,1 ± 2,8 frente a 9,0 ± 2,7 cm de H2O; p < 0,001).
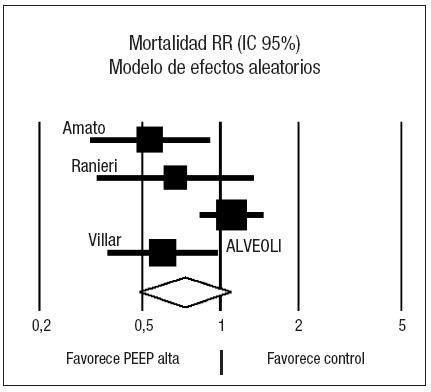
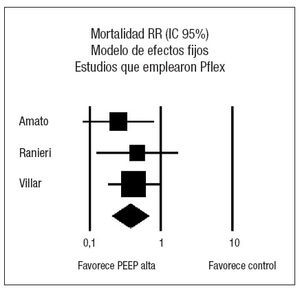
Los resultados sobre la mortalidad se muestran en la tabla 4. Dos de los ensayos clínicos22,48 demostraron una reducción significativa de la mortalidad asociada al empleo de PEEP elevada en relación con el grupo control. El análisis conjunto de los 4 estudios mediante un modelo de efectos aleatorios no muestra efecto sobre la mortalidad asociado al empleo de ninguna de las dos estrategias (RR 0,73, IC 95%: 0,49 a 1,10) (p = 0,13). El análisis de la heterogeneidad fue estadísticamente significativo (p = 0,03) (fig. 2). Los estudios de Amato et al22, Ranieri et al49 y Villar et al51 presentan la característica común de que, en el grupo en el que emplean PEEP elevada, calculan el nivel de PEEP en función de una estimación de la mecánica pulmonar de cada paciente, en función del punto de inflexión inferior de la curva de presión-volumen. Analizando de forma conjunta estos tres ensayos clínicos mediante un modelo de efectos fijos (fig. 3) se aprecia una reducción significativa del riesgo de muerte asociada al empleo de PEEP elevada (RR 0,59; IC 95%: 0,43 a 0,82) (p = 0,001) I2 65,9%. El número necesario para tratar (NNT) para prevenir un fallecimiento es de 5 (IC 95%: 3 a 11). No se objetivó heterogeneidad significativa en los estudios (p = 0,88). Al examinar la mortalidad, se observa que la del grupo control del estudio ALVEOLI (25%) es mucho menor que la de los estudios pequeños (que oscila entre un 53 y un 58%). Si hacemos un meta-análisis de proporciones comprobamos que existe una clara heterogeneidad en la mortalidad del grupo control (p < 0,0001, I2 = 91,6%) mientras que no existe heterogeneidad en la mortalidad del grupo experimental (p = 0,47, I2 = 0%).
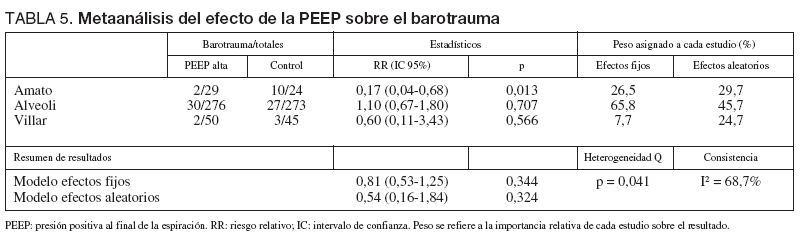
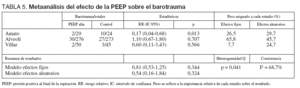
En cuanto al objetivo secundario de incidencia de barotrauma los resultados se muestran en la tabla 5.
TABLA 5. Metaanálisis del efecto de la PEEP sobre el barotrauma
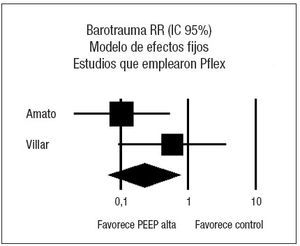
Figura 3. Metaanálisis sobre la mortalidad incluyendo los estudios en los que la presión positiva al final de la espiración (PEEP) en el grupo estudio se estima en función del punto de inflexión (Pflex). Efecto sobre la mortalidad del empleo de PEEP alta frente a control. Total de eventos 34 (PEEP alta) frente a 52 (control). Test de heterogeneidad Chi cuadrado = 0,27, I2 0% (p = 0,88). Efecto estadísticamente significativo (p = 0,001).
Figura 4. Metaanálisis sobre la incidencia de barotrauma incluyendo todos los estudios seleccionados. Efecto sobre la incidencia de barotrauma del empleo de presión positiva al final de la espiración (PEEP) alta frente a control. Total de eventos 34 (PEEP alta) frente a 41 (control). Test de heterogeneidad Chi cuadrado = 6,83, I2 70,7% (p = 0,03). Efecto no estadísticamente significativo (p = 0,27).
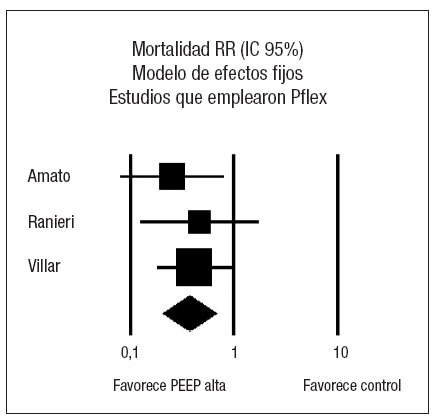
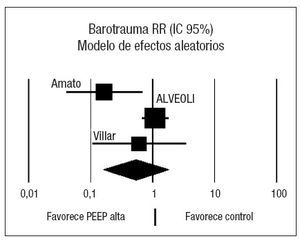
El estudio de Amato et al22 presenta una reducción significativa de la incidencia de barotrauma en el grupo protector, mientras que los estudios de Villar et al51 y el estudio ALVEOLI50 no presentan diferencias significativas en el riesgo de barotrauma asociado con el nivel de PEEP empleado. El análisis conjunto de los tres estudios mediante un modelo de efectos aleatorios no muestra efecto sobre la incidencia de barotrauma asociado al empleo de las dos estrategias (RR 0,50; IC 95%: 0,14 a 1,73) (p = 0,27). Se objetivó heterogeneidad significativa (p = 0,03) (fig. 4).
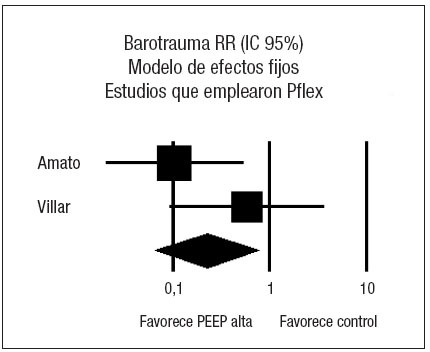
Analizando de forma conjunta, mediante un modelo de efectos fijos, los dos ensayos clínicos en los que la PEEP se estima en función de las características de la curva presión-volumen (fig. 5), se aprecia una reducción significativa del riesgo de barotrauma asociado al empleo de PEEP elevada (RR 0,24; IC 95%: 0,09 a 0,70) (p = 0,008). Observada más detenidamente, la heterogeneidad detectada responde concretamente a un riesgo de barotrauma sorprendentemente alto (42%) en el grupo control. En el metaanálisis de proporciones la heterogeneidad del riesgo de barotrauma en el grupo control es evidente (p = 0,0006, 2 = 86,5%) mientras que el riesgo de barotrauma en el grupo experimental es relativamente homogéneo (p = 0,2873, I2 = 19,8%).
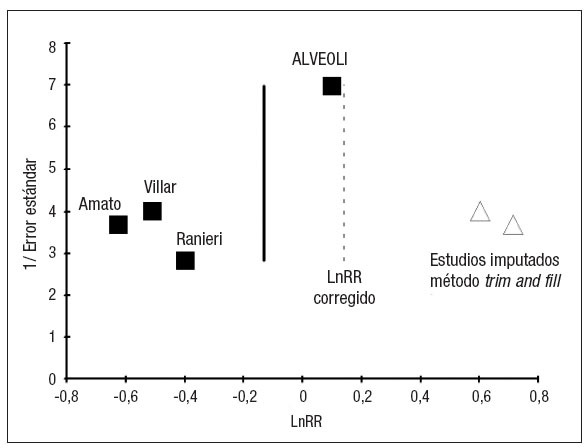
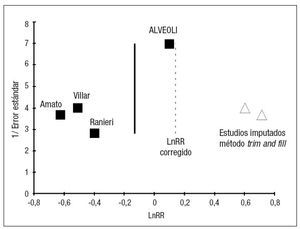
En cuanto al análisis del efecto de estudios pequeños se obtuvo un gráfico en forma de embudo (funnel plot) enriquecido con el método trim and fill y un gráfico del efecto del metaanálisis con la exclusión de cada uno de los estudios individuales (fig. 6).
Figura 5. Metaanálisis sobre la incidencia de barotrauma incluyendo los estudios en los que la presión positiva al final de la espiración (PEEP) en el grupo estudio se estima en función del punto de inflexión (Pflex). Efecto sobre la incidencia de barotrauma del empleo de PEEP alta frente a control. Total de eventos 4 (PEEP alta) frente a 14 (control). Test de heterogeneidad Chi cuadrado = 0,82, I2 0% (p = 0,37). Efecto estadísticamente significativo (p = 0,008).
Figura 6. Efecto de estudios pequeños. Gráfico funnel plot. Detecta visualmente la existencia de efecto de estudios pequeños (debido a sesgo de publicación o a otras causas). El gráfico se ha construido siguiendo las recomendaciones de Egger et al39, con el Ln OR en el eje horizontal y el error estándar en el vertical.
DISCUSIÓNEn los últimos años ha existido una importante controversia en relación con el nivel de PEEP adecuado para ventilar a los pacientes con SDRA, y se han propuesto diferentes alternativas52-57, aunque en el momento actual parece existir un consenso en cuanto a que el nivel de PEEP adecuado es aquel con el que se consigue una adecuada oxigenación, manteniendo el pulmón «abierto» con el fin de evitar el daño local y el biotrauma derivado de la apertura y cierre cíclico de alvéolos colapsados, sin que se produzca un aumento importante de la presión alveolar ni deterioro hemodinámico. Sin embargo, se han planteado diferentes estrategias y métodos para calcular este nivel de PEEP «óptimo»58-63. Estudios de imagen realizados con tomografía convencional y de impedancia indican que para mantener un alto porcentaje de tejido pulmonar aireado y asegurar una distribución homogénea de la ventilación, son precisos niveles de PEEP entre 18 y 26 cm de H2O64. Sin embargo, los niveles de PEEP empleados de forma habitual en los pacientes con SDRA están en el rango de entre 5 y 12 cm de H2.
El principal hallazgo de la presente revisión sistemática y metaanálisis es que, en el momento actual, el escaso número de estudios de calidad adecuada y la discrepancia entre los de pequeño tamaño muestral y el único con un tamaño muestral grande, hace que sea arriesgada cualquier recomendación sobre el efecto beneficioso de un determinado nivel de PEEP en pacientes con SDRA ventilados con una estrategia ventilatoria protectora del pulmón. Analizando conjuntamente los 4 estudios seleccionados en la revisión sistemática, no existe ningún efecto ni sobre la mortalidad ni sobre la incidencia de barotrauma del empleo de un nivel alto o bajo de PEEP. Sin embargo, si analizamos únicamente los tres estudios en los que el nivel de PEEP alto se selecciona en función de las características de mecánica pulmonar, obtenidas mediante la realización de curvas presión-volumen, el empleo de un nivel alto de PEEP se asocia con una significativa reducción de la mortalidad (RR 0,59; IC 95%: 0,43 a 0,82) y de la incidencia de barotrauma (RR 0,24; IC 95%: 0,09 a 0,70).
Es muy llamativa la discrepancia existente en los resultados de los estudios realizados por Amato22, Ranieri49 y Villar48 con el estudio ALVEOLI50. La principal diferencia entre éstos es el modo de estimación del nivel de PEEP en el grupo de PEEP alta, de modo que en los tres primeros estudios se plantea una estimación del nivel de PEEP adecuado en función de las características individuales de la mecánica pulmonar, estimando el punto de reclutamiento adecuado por el punto de inflexión (Pflex) de la curva pre-sión-volumen, mientras que en el estudio ALVEOLI se plantea un protocolo de empleo de PEEP basado en la PaO2/FiO2.
En principio los buenos resultados obtenidos en el estudio de Amato et al22 se achacaron a un aumento de mortalidad en el grupo control en relación con el empleo de un volumen circulante excesivo, sin embargo es llamativo cómo en el estudio de Villar et al48 estos resultados se repiten siguiendo una estrategia ventilatoria en el grupo control en la que se emplea un volumen circulante inferior a los 10 ml/kg, y con un límite de presión plateau de 30 cm de H2O, con lo que parece descartarse esta posible explicación de los resultados. Como se aprecia en la tabla 3, el volumen circulante empleado en el brazo control del estudio ALVEOLI es sensiblemente inferior al empleado en los otros estudios, sin embargo, la PEEP empleada, independientemente del método usado para seleccionarla, es muy parecido en los cuatro estudios. De modo que los estudios difieren en el volumen circulante empleado en el grupo control, aunque no en la presión plateau descrita en los mismos. El grupo de baja PEEP de este estudio emplea el protocolo de ajuste de PEEP habitual del SDRA network, sin embargo es muy importante recalcar que el nivel de PEEP es por tanto muy superior al empleado en la práctica clínica habitual. Esteban et al65 describen en una cohorte amplia de pacientes cómo en los pacientes diagnosticados de SDRA la PEEP empleada es de mediana 8 en el día uno de evolución, 10 en el tercer día y 9 en el séptimo día, mientras que únicamente un 25% de los pacientes recibe una PEEP superior a 10 cm de H2O. Thompsom et al66, en otra cohorte de pacientes diagnosticados de SDRA, describen cómo el 78% de los pacientes son ventilados con PEEP inferior a 11 cm de H2O. En el brazo de baja PEEP de este estudio se emplea por protocolo un nivel de PEEP entre 10 y 24 cm de H2O con FiO2 entre 0,6 y 1,0.
El empleo del Pflex de la curva presión-volumen para estimar el nivel de PEEP óptimo parece un método de aproximación más fisiológico, de modo que permite hacer una estimación individual de la mecánica pulmonar del paciente. El comportamiento de los pacientes con SDRA es distinto en relación con el origen pulmonar o extrapulmonar del SDRA o la fase de evolución del mismo, y por tanto, al igual que los hallazgos histológicos no son iguales67,68, la respuesta a las maniobras ventilatorias no tiene que ser la misma en todos los pacientes67,69-73. En contra de la curva presión-volumen está el que se ha planteado su mala reproductibilidad y se ha cuestionado su verdadero significado29,63,74-76.
El posible efecto beneficioso del empleo de niveles de PEEP altos, estimados por el Pflex de la curva presión-volumen, siempre que se emplee una estrategia ventilatoria protectora del pulmón en la que se limite la presión transestructural y la presión alveolar, está de acuerdo con lo objetivado por otros estudios.
Así Boussarsar et al77, en un análisis de la literatura que incluye 14 estudios y 2.270 pacientes, encuentran que cuando se mantiene una presión plateau < 35 cm de H2O, no hay relación entre los parámetros ventilatorios empleados y la incidencia de barotrauma. Anzueto et al78 encuentran en su estudio que en pacientes con SDRA la PEEP empleada no modifica el riesgo de barotrauma, y Ferguson et al47 describen cómo el empleo de niveles bajos de PEEP durante la primera semana de tratamiento de los pacientes con SDRA empeora su pronóstico.
Sin embargo, aunque la teoría del ajuste de la PEEP en función de las características de la mecánica pulmonar del paciente resulte muy atractiva, no se puede descartar, dadas las peculiaridades de los estudios, que el efecto en el metaanálisis se deba a un sesgo de publicación/estudio pequeño, como se puede apreciar en la figura 6. El tamaño de los estudios parece la principal fuente de heterogeneidad, dado que la calidad de los mismos es parecida. Se da la peculiaridad en este tema de que los estudios pequeños son los mismos que emplean la metodología de la Pflex para seleccionar el nivel de PEEP, por lo que en este caso no se pueden achacar las diferencias encontradas a una razón particular: las dos interpretaciones alternativas son que las diferencias se deban al método empleado para seleccionar la PEEP, o que las diferencias se deban a efecto de estudios pequeños (sesgo de publicación u otras causas).
Respecto al supuesto efecto protector del barotrauma es atribuible al estudio de Amato y, más concretamente, a un riesgo de barotrauma sorprendentemente alto (42%) en el grupo control.
Sería muy aconsejable realizar un estudio de tamaño muestral adecuado donde se comparen una estrategia de ventilación protectora en la que la PEEP se ajuste en función del Pflex, y por tanto basadas en las características de la mecánica pulmonar individual, con un grupo ventilado con el protocolo SDRA network que en la actualidad se considera el modo óptimo de ventilación en estos pacientes. Hay dos estudios en marcha en este momento que pueden contribuir a resolver esta controversia79,80.
Declaración de conflicto de interesesLos autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dr. F. Gordo Vidal. Unidad de Cuidados Críticos. Fundación Hospital Alcorcón. C/ Budapest, 1. 28922 Alcorcón. Madrid. Correo electrónico: fgordo@fhalcorcon.es / fgordo5@gmail.com
Manuscrito aceptado el 6-VII-2007.