INTRODUCCION
La sepsis de origen peritoneal es una causa de ingreso frecuente en las unidades de cuidados intensivos polivalentes.
La persistencia de un foco infeccioso intraabdominal ha sido evaluada a través de signos y síntomas locales y sistémicos cuyo valor predictivo es discutido y permanece en revisión. Una exploración negativa, generalmente, implica la ausencia de absceso o pus. Sin embargo, el hallazgo de un líquido turbio en un abdomen multioperado es frecuente y puede constituir el foco infeccioso persistente.
La mortalidad de los pacientes con disfunción multiorgánica (DMO) oscila entre el 50 y el 70% según diferentes autores1,2.
En un intento por mejorar la sobrevida de estos enfermos se han ensayado múltiples técnicas quirúrgicas: relaparotomía programada, relaparotomía a demanda, técnicas inmunomoduladoras3 y otras4.
Se han identificado como factores pronósticos: edad, Acute Physiology And Chronic Health Evaluation II, (APACHE II), hipoalbuminemia, insuficiencia cardíaca, DMO, peritonitis de origen colónico y la presencia de síntomas prolongados5-9.
Los trabajos existentes son difícilmente comparables dado que las poblaciones estudiadas son poco homogéneas incluyendo simultáneamente pacientes con peritonitis sin DMO1,10, peritonitis grave5, pacientes con sepsis y septicemia11, por lo cual no se han obtenido conclusiones definitivas acerca del manejo terapéutico de estos pacientes. Esto se acentúa aún más en los pacientes críticamente enfermos, que requieren un manejo medicoquirúrgico precoz y agresivo en el intento de mejorar su morbimortalidad.
Nos fijamos los siguientes objetivos: a) realizar un análisis descriptivo de las relaparotomías en la sepsis peritoneal; b) identificar si existe un grupo de síntomas y/o signos que orienten a realizar o no una relaparotomía y los hallazgos radiológicos concomitantes, y c) valorar la mortalidad, factores pronósticos y predictores de mortalidad.
Analizaremos exclusivamente a la población de pacientes graves que ingresan en un área de cuidados intensivos.
MATERIAL Y MÉTODOS
El estudio se realizó en el Centro de Terapia Intensiva (CTI) del Hospital Pasteur, unidad polivalente que cuenta con 22 camas, en 11 de las cuales existe la posibilidad de realizar asistencia respiratoria mecánica (ARM) invasiva.
Se realizó un estudio retrospectivo, en el período comprendido entre el 1 de febrero de 1994 y el 15 de agosto de 1999.
Se tomaron como criterios de inclusión a todos los pacientes con una edad mayor o igual a 15 años, con sepsis grave abdominal al ingreso o en la evolución y que requirieron, por lo menos, una relaparotomía. Los criterios de exclusión fueron los siguientes: a) pacientes con cirugía abdominal sin DMO; b) sepsis abdominal sin relaparotomías; c) sepsis pancreática; d) sepsis nefrourológica, y e) sepsis a punto de partida de pared abdominal.
La recolección de datos se realizó con un sistema de programación Visual Basic 5 con base de datos Access. Para cada paciente se confeccionó una planilla en la que se consignó: ficha patronímica, APACHE II a las 24 h del ingreso, motivo de ingreso, estancia en UCI, origen de la peritonitis, hallazgos intraoperatorios y descripción de procedimientos ealizados, número de disfunciones multiorgánicas al ingreso y agregadas en la evolución, síntomas y signos locales y sistémicos (SIRS, DMO) previos a cada intervención, presencia de shock en el preoperatorio o intraoperatorio, transfusión masiva, peritonitis fecaloidea, necesidad de anastomosis digestiva, síntomas prolongados (mayor a 24 h). Se identificó el número de relaparotomías realizadas y la estrategia quirúrgica. Además, se analizaron los estudios radiológicos y microbiológicos realizados, estado en el momento de la alta y causa de fallecimiento. El análisis sistemático de todas las historias fue realizado por los residentes de medicina intensiva de la unidad.
Definiciones
Se consideró síndrome de respuesta inflamatoria sistémica (SIRS), sepsis y sepsis grave según la reunión del Consenso publicado en el año 199212.
Consideramos DMO como la alteración de la funcionalidad de los órganos y/o sistemas en un paciente que no puede mantener la homeostasis sin tratamiento.
Se definieron las siguientes disfunciones:
Respiratoria, con una relación PaO2/FIO2 menor de 300, con imagen radiológica reticulonodular blanda en ausencia de insuficiencia ventricular izquierda.
Renal por insuficiencia renal aguda (IRA), con una creatinina sérica mayor de 2 mg/dl.
Circulatoria, al descenso de la presión arterial sistólica (PAS) de 30 mmHg a partir del valor basal previo y que requiere infusión de fármacos vasoactivos.
Hepática, si la bilirrubina total resultaba igual o superior a 2 mg/dl a predominio de bilirrubina directa.
Hematológica, con hematócrito menor del 30% y/o plaquetopenia menor de 100.000.
Neurológica, a la presencia de síndrome confusional y/o descenso en la escala de Glasgow.
Se denominó transfusión masiva al reemplazo de volemia del paciente en menos de 24 h por hemoderivados (que nosotros consideramos en 5.000 ml).
Definimos relaparotomía en blanco probable cuando en el acto quirúrgico no se identificó un proceso infeccioso intraabdominal o cuando se encontró un escaso exudado peritoneal, pero no se realizó cultivo.
Consideramos relaparotomía en blanco definitiva, si el cultivo del exudado resultaba estéril y/o el paciente mejoraba y era dado de alta.
Se valoró la mortalidad en forma porcentual de la siguiente manera:
(Número de fallecidos/Número total de pacientes) * 100.
Se consideró mortalidad cruda al total de pacientes fallecidos con sepsis peritoneal independientemente de la causa de su fallecimiento. Se llamó mortalidad relacionada a los pacientes fallecidos por la sepsis peritoneal y a los fallecidos sin una causa clara, excluyendo a los que fallecieron por una causa extraabdominal claramente identificable.
Se consideró relaparotomía programada cuando en cada intervención se definió la oportunidad de la siguiente, en un lapso variable entre 36 y 60 h. En este plan se utilizó la técnica de abdomen abierto.
Análisis estadístico
Las distintas variables continuas se expresaron como media y su desviación estándar (DE) y las discretas a través de la mediana y rango intercuartílico. Para la comparación de medias con variables intervalares se utilizó el test de la t de Student. Para comparar proporciones con variables nominales el test de la *2 con corrección de Yates, y para frecuencias esperadas pequeñas, el test exacto de Fisher. La relación entre variables nominales se realizó mediante la odds ratio (OR).
El grado de vinculación entre las variables se analizó por correlación de tipo lineal con prueba de hipótesis posterior.
Se consideró estadísticamente significativo un valor de p < 0,05 para un valor alfa del 5%.
RESULTADOS
Durante el período de estudio ingresaron en el CTI del Hospital Pasteur 6.120 pacientes, de los cuales 587 tuvieron sepsis grave. De este grupo, 92 pacientes (15,7%) presentaron sepsis abdominal.
Del total de los pacientes con sepsis abdominal, 55 (60%) requirieron al menos una relaparotomía. La edad media fue de 59 (18) años, la distribución por sexo fue de 41 varones (74%) y 14 mujeres (26%). La mediana y el rango intercuartílico del APACHE II fue de 16 (P25: 13, P75: 21). La estancia media de los pacientes incluidos en nuestro estudio fue de 14,7 (9,7) días, más prolongado que el de la población general de la UCI, que fue de 6,1 (4,8) días (p < 0,05).
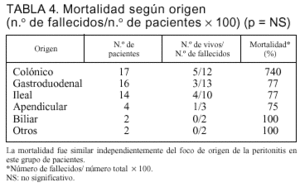
Los focos de origen de la peritonitis más frecuentemente identificados fueron: colónica (n = 17), ileal (n = 14), gástrica (n = 9), duodenal (n = 7), apendicular (n = 4) y otros (n = 4).
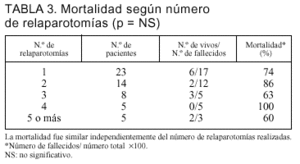
Considerando el número de relaparotomías, 23 pacientes (42%) tuvieron una relaparotomía, 14 pacientes (25%) tuvieron 2 intervenciones, 8 pacientes (15%) tuvieron tres, 5 pacientes (9%) tuvieron cuatro reintervenciones y 5 pacientes (9%) tuvieron cinco o más relaparotomías.
A los 55 pacientes analizados se les realizó un total de 121 relaparotomías, de las cuales 104 (86%) fueron positivas y 17 (14%) fueron en blanco. Estas últimas correspondieron a 13 pacientes. Se identificaron 15 relaparotomías en blanco probable y 2 en blanco definitiva.
La proporción de relaparotomías en blanco no se modificó considerando el número de relaparotomías realizadas: para la primera 9% (5 en 55 reintervenciones), en la segunda 35% (8 en 32), en la tercera 13% (2 en 17), en la cuarta 28% (2 en 9), en la quinta ninguna (0 en 5). No hubo diferencias significativas (*2 = 3,42; p = 0,33), por lo que el hallazgo de una relaparotomía en blanco fue independiente del número de reintervenciones.
Se analizó el plan de relaparotomía a demanda y programada considerando 2 ítems: el número de relaparotomías promedio y la estancia media en la unidad de los pacientes (excluyendo a los que ha-
bían tenido plan de relaparotomía mixtos). El número de reintervenciones (media) en el plan a demanda fue de 1,9 (1,7) frente a 3,0 (2,7) en la programada (p = NS). El tiempo de estancia media fue de 14,6 (9) días en el plan a demanda y 17,6 (14) en el plan programada (p = NS).
Análisis de las manifestaciones clínicas
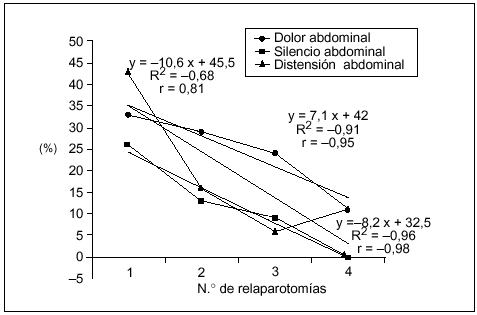
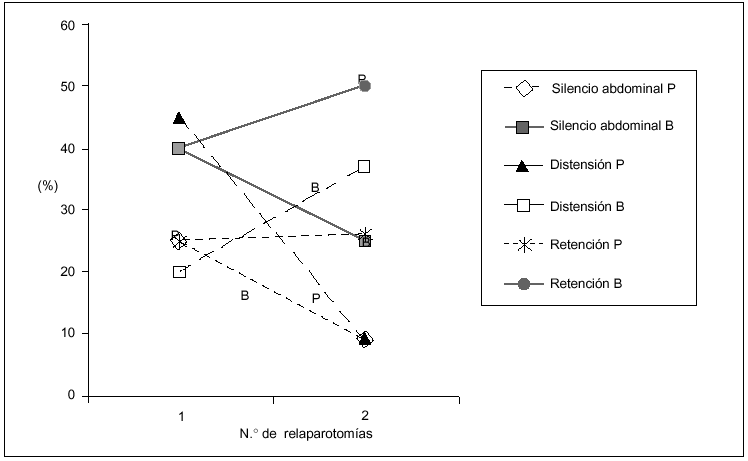
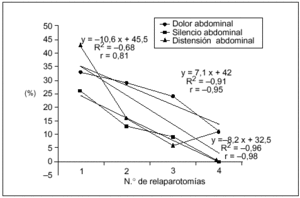
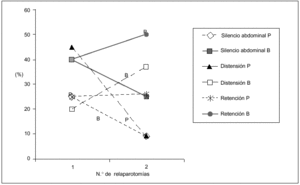
Los hallazgos físicos locales analizados resultaron ser poco frecuentes, disminuyendo aún más su presencia a mayor número de relaparotomías. En particular la distensión, el dolor y el silencio abdominal tuvieron una correlación lineal negativa significativa con el número de relaparotomías (fig. 1).
Fig. 1. Síntomas locales según número de relaparotomías. Se indica la frecuencia (en porcentaje) de síntomas y signos clásicos locales observados en el preoperatorio de cada una de las reintervenciones. Resultaron ser poco frecuentes con tendencia a disminuir a mayor número de reintervenciones. Se establece la curva de correlación lineal y el correspondiente coeficiente de correlación, en los tres casos en que el número de reintervenciones se asoció en forma negativa (y significativa) con la frecuencia de los mismos. No se consideran el drenaje positivo ni la retención por sonda nasogástrica, que no tuvieron correlación significativa.
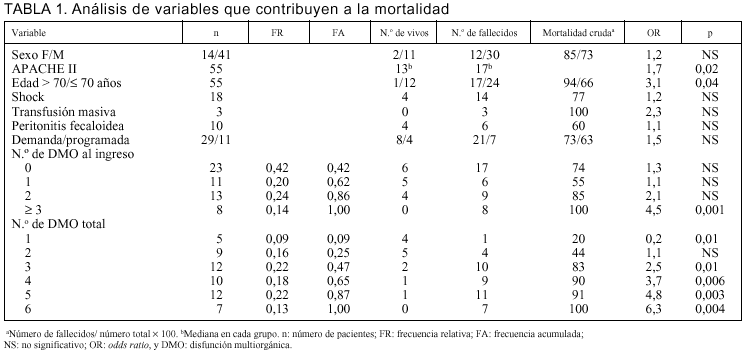
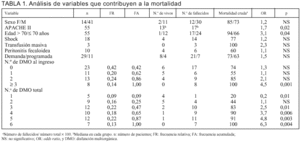
Un 58% (n = 32) de nuestros pacientes presentaban DMO al ingreso y el resto la desarrollaron en la evolución. Cuando se consideró el total de disfunciones durante la estancia en UCI, 41 pacientes (75%) tuvieron 3 o más disfunciones, 9 tuvieron dos disfunciones y 5 solamente una (tabla 1).
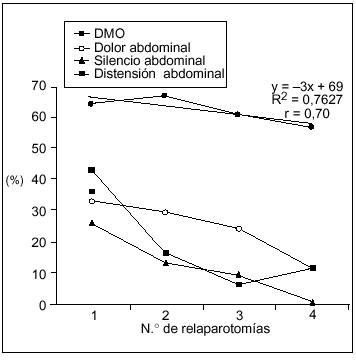
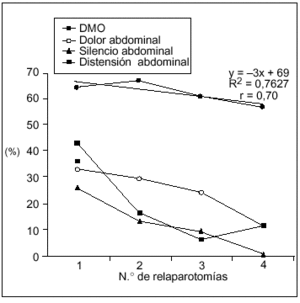
La DMO fue más frecuente que los síntomas locales y se mantuvo en los pacientes multioperados (fig. 2), a diferencia de los síntomas locales que se hicieron progresivamente menos frecuentes a mayor número de relaparotomías.
Fig. 2. Manifestaciones sistémicas y locales según número de relaparotomías. Se establece en forma comparativa la frecuencia de disfunción multiorgánica (DMO) frente a las manifestaciones locales al momento de cada reintervención. La DMO resultó ser más frecuente que los síntomas locales y se mantuvo en los pacientes con múltiples intervenciones (tres o más) a diferencia de aquellos que se hacen cada vez más infrecuentes.
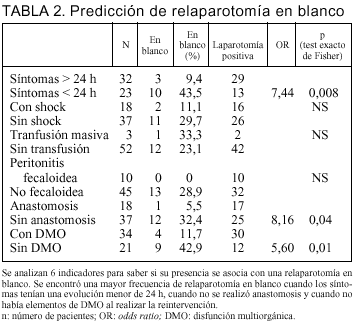
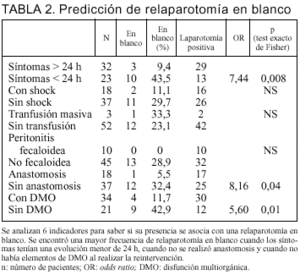
Con el objetivo de valorar si existe algún indicador que nos oriente a la oportunidad de reintervenir a un paciente estudiamos la presencia o ausencia de: síntomas prolongados (mayor a 24 h) previo a la consulta, la existencia de shock en el preoperatorio o en el intraoperatorio, transfusión masiva, peritonitis fecaloidea, anastomosis y DMO. Observamos con qué frecuencia se asociaba una relaparotomía en blanco con estos factores (tabla 2).
El hallazgo de una relaparotomía en blanco fue estadísticamente menos frecuente en presencia de síntomas prolongados (9,4%), frente al 43,5% cuando los síntomas tenían menos de 24 h (p = 0,008; OR = 7,4). La necesidad de anastomosis se asoció a sólo un 5,5% de relaparotomía en blanco, mientras su ausencia tuvo un 32,4% (p = 0,04; OR = 8,16). Con DMO en el momento de la reintervención hubo un 11,7% de relaparotomías en blanco, frente al 42,9% cuando no la tenía (p = 0,01; OR = 5,6) (tabla 2).
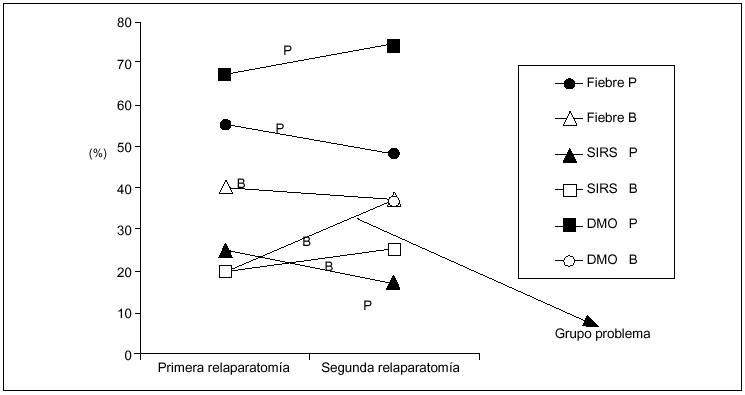
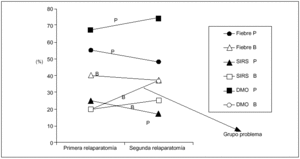
Sin embargo, al analizar los elementos sistémicos (fiebre, SIRS, DMO), se puede comprobar que este último tiene una incidencia mayor al 65% en la primera y segunda relaparotomías positivas (p = 0,04; OR = 8,7), diferenciándose claramente como predictor. También podemos constatar que hay enfermos que se reoperan por la presencia de DMO y sin embargo el resultado es en blanco, lo cual constituye un grupo problema de difícil solución (fig. 3). No hubo diferencias en la frecuencia de signos físicos locales en relación con los hallazgos intraoperatorios (relaparotomía en blanco frente a positiva) (fig. 4).
Fig. 3. Frecuencia de manifestaciones sistémicas según el hallazgo intraoperatorio. P: relaparotomía positiva, y B: relaparotomía en blanco. Se representa la frecuencia de las manifestaciones sistémicas (fiebre, SIRS y DMO) según el hallazgo intraoperatorio (positivo o en blanco) considerando la primera y segunda relaparotomía.
Fig. 4. Frecuencia (en porcentaje) de manifestaciones clínicas locales en el preoperatorio de la primera y segunda reintervención, según el hallazgo intraoperatorio. La frecuencia de la semiología local fue similar independientemente del hallazgo, por lo que no se encontraron predictores clínicos locales del hallazgo quirúrgico.
En cuanto a los estudios radiológicos, la tomografía computarizada (TC) se realizó en 12 pacientes. Reveló colecciones intraabdominales en 8 casos, confirmándose quirúrgicamente en 7, con una relaparotomía en blanco. No hubo falsos negativos. Cuatro relaparotomías en blanco fueron precedidas en dos casos por TC normal y en los dos restantes los hallazgos tomográficos fueron un escaso exudado en la gotera parietocólica y en el otro una colección en el fondo de saco de Douglas.
Se realizó ecografía abdominal en 6 ocasiones. En 3 casos el resultado fue concordante con los hallazgos intraoperatorios. En los 3 casos restantes, siendo la ecografía informada como normal, las relaparotomías fueron positivas.
Se realizó cultivo en 16 ocasiones de un total de 104 relaparotomías positivas (15%).
Los gérmenes más frecuentes fueron: Pseudomonas sp. (n = 5), Staphylococcus aureus resistente a la meticilina (n = 4), otros (n = 5).
Mortalidad, variables determinantes y factores pronósticos
La mortalidad cruda fue del 76% (42/55), pero la mortalidad relacionada llegó al 55% (30/55). Esto se debe a que 12 pacientes fallecieron por causas extraabdominales: neumonía asociada a la ventilación (NAV) (n = 7), sepsis por catéter (n = 2), sepsis urinaria (n = 1), hemorragia digestiva (n = 1) e infarto agudo de miocardio con shock cardiogénico (n = 1).
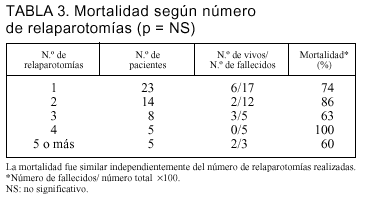
Clasificando a los pacientes según el número de relaparotomías realizadas a cada uno, no encontramos diferencias en su mortalidad (tabla 3).
La edad fue un determinante claro de mortalidad. En el grupo menor de 70 años, fue del 55% frente al 91% en mayores de 69 años (p < 0,05) (tabla 1). Discriminando por la edad, los pacientes menores de 40 años tuvieron una mortalidad de 33%, claramente diferente del resto (p = 0,007).
La puntuación APACHE II realizado a las 24 h del ingreso fue significativamente mayor en el grupo de fallecidos que tuvieron una mediana de 17 (P25: 14; P75: 24) frente a 13 (P25: 7; P75: 16) de los sobrevivientes (p = 0,02). De 24 pacientes con APACHE II mayor a 17, fallecieron 22 (mortalidad del 91%), mientras que de 16 pacientes con menos de 13 puntos fallecieron 8 (mortalidad del 50%; p < 0,05). De este modo sólo el 19% (8/42) de los fallecidos presentaba una puntuación menor a 13, mientras que sólo un 15% (2/13) de los sobrevivientes tuvo un APACHE II mayor a 17, sin aparecer entre los pacientes vivos un APACHE II superior a 21.
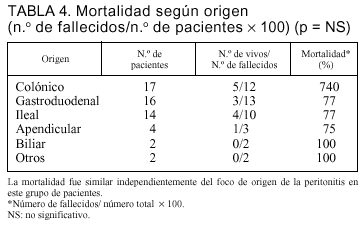
No encontramos diferencias en la mortalidad según el origen de la peritonitis (tabla 4). La mortalidad de los pacientes con peritonitis de origen gastroduodenal (13 fallecidos en 16 pacientes [77%]) fue similar al origen colónico (12 en 17 [70%]). En los pacientes que presentaron una relaparotomía en blanco, la mortalidad relacionada fue del 38% (5/13) frente al 59% (25/42) de los pacientes con relaparotomía positiva (p = NS).
No encontramos que la sola presencia de DMO desde el ingreso determine una mayor mortalidad (81% frente al 69% en los que no tenían; p = NS). Sin embargo, la discriminación por número de disfunciones al ingreso sí ofrece diferencias. La presencia de 3 o más disfunciones tiene una mortalidad mayor que los que tenían dos o menos (p < 0,05) (tabla 1). De acuerdo con el análisis con técnica "acumulativa", sumando las disfunciones a medida que aparecen en la evolución, la acumulación de 3 o más disfunciones determina una mortalidad mayor al 80% frente al 20% cuando hay una sola disfunción y un 44% cuando hay dos (tabla 1).
Según la modalidad quirúrgica no se encontraron diferencias; la mortalidad relacionada fue del 54% (6 fallecidos sobre un total de 11) en el plan de reintervención programada, frente al 55% (16/29) en el plan de reintervención a demanda. Aquí sólo se incluyeron en la comparación pacientes tratados exclusivamente con uno de los planes. La mortalidad cruda tuvo una tendencia (no significativa) superior en la relaparotomía a demanda del 73% (21 fallecidos de 29 pacientes) frente al 63% en la programada (7 en 11).
Factores pronósticos
Se analizó la contribución relativa a la mortalidad de 17 variables clínicas con escala nominal por medio de odds ratio (tabla 1). Encontramos que la edad mayor a 70 años, una puntuación APACHE II mayor de 17 y la presencia de tres o más disfunciones al ingreso o acumuladas se asocian significativamente a una mayor mortalidad.
Diferenciando la mortalidad según el sexo, fallecieron 30 varones de un total de 41 (73%) y 12 mujeres de un total de 14 (85,7%) (p = NS).
La presencia en la primera cirugía de shock, la transfusión masiva, el origen de la peritonitis, la peritonitis fecaloidea y el número de relaparotomías realizadas no se asocian a mayor mortalidad. Los planes de relaparotomía programada o a demanda tampoco se diferencian en la mortalidad (tablas 1 y 3).
DISCUSION
Nuestros criterios de inclusión buscaron lograr un grupo de pacientes homogéneo con alto riesgo de desenlace adverso y con tratamiento similar; por ellos, excluimos pacientes con cirugía abdominal sin sepsis severa, sepsis nefrourológica, sepsis con punto de partida de pared abdominal y pacientes con pancreatitis aguda. Siguiendo a Bohnen et al13, las infecciones localizadas, generalmente, tienen un desenlace favorable y la pancreatitis una etiología y anatomía diferentes de la peritonitis secundaria, con tratamiento específico1.
La sepsis peritoneal constituyó el 15,7% de la sepsis en nuestro servicio, lo que está por debajo de la citada por otros autores14, debido seguramente al tipo de enfermos ingresados en cada unidad.
El 59,8% de los pacientes con sepsis grave de origen peritoneal requirieron, por lo menos, una relaparotomía, porcentaje mayor que el considerado por otros autores5,10. Christou et al5 incluyeron a pacientes con infección abdominal y APACHE II mayor de 10 con un 35% de relaparotomizados, y Pusajó et al con un porcentaje cercano al 17%10.
La etiología más frecuente de la peritonitis secundaria es por perforación apendicular y gastroduodenal, mientras que en los relaparotomizados que desarrollaron una sepsis grave el origen colónico fue el más frecuente (31%).
Encontramos un 14% de relaparotomías en blanco (17/121), correspondientes al 23% de los pacientes (13/55), similar al encontrado por Ferraris (20%)1 y Pusajó et al (9%)10.
En cuanto al plan quirúrgico, predominó la utilización de un plan de relaparotomía a demanda (72%) similar a la encontrada por el estudio multicéntrico de Hau et al11. Esta tendencia disminuyó a mayor número de relaparotomías.
Los hallazgos físicos no fueron buenos indicadores de infección intraabdominal, por lo que los signos locales no resultaron buenos predictores de cuándo reoperar. El análisis discriminado de síntomas y signos demostró que tenían una frecuencia menor al 40% en todos los casos y éstos disminuían aún más a mayor número de relaparotomías (fig. 1).
Ferraris1 reportó en su serie, en concordancia con nuestros datos, que sólo 15 de 29 pacientes con DMO (51%) tenían abdomen agudo antes de la cirugía. De los 14 pacientes restantes, sin clínica evidente, 11 (79%) tenían una infección persistente intraabdominal, confirmando que los síntomas locales no son buenos indicadores. Esto se debe a que éstos son difíciles de interpretar en pacientes multioperados que ingresan a UCI, que requieren frecuentemente plan de sedación y analgesia continua; a diferencia de los pacientes valorados en el servicio de emergencia, no críticamente enfermos.
En este grupo, las disfunciones sistémicas pasan a ocupar un lugar preponderante como indicador de infección intraabdominal persistente. A diferencia de los síntomas locales, la DMO tiende a mantenerse a mayor número de relaparotomías y está presente en más del 60% de los casos (fig. 2). Sólo un 11,7% de los pacientes con relaparotomía en blanco presentaban DMO. La presencia de DMO es indicador de infección persistente y, por ende, de relaparotomía positiva (tabla 2).
Todas las relaparotomías positivas fueron precedidas de hallazgos tomográficos concordantes y las tomografías normales se correspondieron con relaparotomías en blanco, tendiendo a demostrar que la TC es un procedimiento de elevada sensibilidad, aunque esto debe validarse con un mayor número de casos. Por otra parte, la ecografía reveló falsos negativos en 3 de 6 veces. McCrory y Crowley15 no encontraron que la TC y la ultrasonografía fueran mejores predictores de una relaparotomía positiva que los hallazgos clínicos.
La mortalidad elevada de nuestro grupo (76%) es comparable con otros trabajos que consideraron pacientes con DMO, en un rango del 521, 742 y 57%12, y considerablemente mayor de los que incluyeron pacientes sin DMO5,10. La mortalidad relacionada de nuestro grupo fue del 55% (30/55). Doce pacientes que murieron por causas extraabdominales tuvieron complicaciones propias de una estancia prolongada, como NAV y sepsis por catéter, entre otras.
El número de relaparotomías no estuvo relacionado con una mayor mortalidad, incluso en los pacientes con una única relaparotomía, como constataron también Christou et al5. A diferencia de esto, Hau et al11 reportaron que una única relaparotomía se asociaba a menor mortalidad. Esta diferencia es explicable por el perfil de gravedad de nuestros pacientes.
La puntuación APACHE II en pacientes sobrevivientes de una unidad de cuidados intensivos polivalente está en un rango entre 9 y 1516-18. La mediana del total de pacientes incluidos en nuestro estudio fue de 16 con un P25 de 13 y un P75 de 21, lo cual los define como de elevada morbimortalidad. Esto es explicable porque el 75% de los pacientes presentó 3 o más disfunciones orgánicas acumuladas (tabla 1).
De acuerdo con Bohnen et al13, el APACHE II resultó un buen predictor de mortalidad: 9 de cada 10 pacientes con APACHE II superior a 17 fallecieron.
La edad fue un determinante de mortalidad, como han señalado otros autores1,5,11,19.
Tal como señala Ferraris1, los pacientes que presentaron una relaparotomía en blanco tuvieron una mortalidad menor. Queda pendiente demostrar que la relaparotomía en blanco no agrega mortalidad a nuestros enfermos, para lo que se debe realizar un estudio caso-control con grupos pareados.
El origen de la peritonitis pierde valor como indicador de mortalidad en nuestros pacientes, lo cual está de acuerdo con otros autores5,11,20. Si bien la peritonitis de origen colónico tiene una aceptada mayor mortalidad en el total de pacientes con peritonitis aguda (incluyendo enfermos no críticos), en un grupo seleccionado de enfermos con DMO como el nuestro, la mortalidad fue similar para cada origen considerado, indicando que la DMO pasa a ser determinante en el pronóstico.
Al analizar la mortalidad según la DMO, ya sea al valorar el número de disfunciones al ingreso o acumuladas, la presencia de 3 o más disfunciones parece iniciar un camino sin retorno con una mortalidad mayor del 80%. El hecho de tener una o dos disfunciones acumuladas tuvo una mortalidad similar a la reportada por otros autores (20%)21. Por tanto, hay que aumentar los esfuerzos para reoperar a los pacientes cuando tienen una o dos disfunciones, ya que siempre será dificultoso encontrar un beneficio en pacientes "demasiado" graves, como también encontraron Koperna y Schulz para pacientes graves con APACHE II mayor o igual a 26, en un reciente trabajo19.
La relaparotomía programada ha sido una estrategia alternativa de tratamiento en el intento de disminuir la morbimortalidad de los pacientes. Hau et al11, al igual que nosotros, no encontraron diferencia en la mortalidad entre ambos grupos e incluso reportaron una mayor frecuencia de complicaciones postoperatorias, incluyendo DMO. Esto nos lleva a plantear que sería importante identificar el subgrupo de enfermos que se beneficiará de un plan de relaparotomía programada.
La edad, la puntuación APACHE II y el número de disfunciones de órganos fueron las variables que encontramos determinantes de una mayor mortalidad. De acuerdo con Christou et al5, incluso se cumple cuando sólo considera la puntuación de fase aguda del APACHE II, omitiendo edad y enfermedad crónica. Esto se corresponde con el concepto de que la mortalidad puede resultar de una respuesta exagerada del paciente a la infección22.
La relaparotomía en blanco fue poco frecuente, una cada 8 realizadas y no empeoró el pronóstico del paciente. Sería importante poder identificar un predictor más temprano que la DMO. Godin et al han realizado una propuesta alternativa de su patogenia, basada en que el desacople de osciladores biológicos (órganos) puede ser causa de DMO. Esto generaría un aumento de regularidad que podría medirse por variabilidad de frecuencia cardíaca23,24.
Concluimos que la relaparotomía es un hecho frecuente en la sepsis grave abdominal, con elevada mortalidad, con síntomas locales poco orientadores, donde identificamos como elementos predictores de relaparotomía positiva a los síntomas prolongados, la anastomosis y la DMO al ingreso. Por tanto, dada la alta mortalidad de los pacientes con 3 o más disfunciones, una estrategia para mejorar la mortalidad es reoperar en forma precoz a los pacientes con una o dos disfunciones, en particular los que presentan síntomas prolongados y/o anastomosis gastrointestinal. Quedan pendientes estudios caso-control con reintervención programada en pacientes con menos de 3 disfunciones sistémicas.
Agradecimientos
A los residentes del CTI del Hospital Pasteur, que colaboraron en la recolección de datos.
Al Prof. Dr. Humberto Correa, Director de la Cátedra de Medicina Intensiva, de la Facultad de Medicina, Montevideo, por sugerencias realizadas.
Al Prof. Dr. Raúl Morelli, de la Clínica Quirúrgica, Facultad de Medicina de Montevideo, por las sugerencias realizadas.
Al ingeniero Alejandro Perchman, por el desarrollo del software para la base de datos.