INTRODUCCIÓN
El traumatismocraneoencefálico (TCE) es una lesión prevalente en lainfancia y adolescencia. Los accidentes son la causa másfrecuente de muerte en niños entre 1 y 5 años de edady aproximadamente el 30% son atribuibles a lesionescefálicas1.
El abordajediagnóstico y terapéutico del TCE grave ha cambiadoen la última década pero continúa siendo unaentidad con elevada mortalidad y secuelas. Por estos motivos, sesiguen buscando sistemas de monitorización (mediciónde la presión intracraneal, determinación de lasaturación de hemoglobina en el bulbo de la yugular,ecografía Doppler cerebral, SPECT, electrodos depO2 tisular, sondas de microdiálisis,etc.)2-5 que permitan conocer la dinámicacerebral así como nuevos predictores pronósticos. Latomografía axial computarizada (TAC) es uno de los avancesque más ha aportado al diagnóstico y ha permitido adiversos autores crear una serie de patrones que otorgan ciertasignificación pronóstica a las lesionesintracraneales en el período postraumático inmediatoen pacientes adultos6-8.
Los objetivosdel estudio han sido conocer las característicasclínicas y evolución de los niños con TCEgrave ingresados en nuestro hospital y determinar si los criteriosclínicos y de neuroimagen utilizados en individuosadultos8 pueden ser aplicados a nuestra poblaciónpediátrica como predictores pronósticos de morbilidady mortalidad.
MATERIAL YMÉTODOS
Se estudiaronlos pacientes con TCE ingresados en la unidad de cuidadosintensivos entre enero de 1995 y junio de 1998, sometidos amonitorización invasiva de la presión intracraneal(PIC). Nuestra unidad pertenece a un hospital universitariopediátrico de 334 camas, que atiende a poblacióninfantil hasta los 18 años. Durante este período seatendieron en urgencias 2.274 TCE, 242 precisaron ingreso en launidad de cuidados intensivos y en 64 se monitorizó la PICmediante un catéter de fibra ópticaCamino® intraparenquimatoso.
Se analizaronlas siguientes variables: edad y sexo, causa del traumatismo,puntuación de la escala del coma de Glasgow (GCS), hallazgosen la TAC inicial y sucesivos controles, tiempo derealización de las tomografías respecto altraumatismo, terapia precisada, PIC inicial máxima ypresión de perfusión cerebral (PPC) mínima enlas primeras 2 h de monitorización y evoluciónclínica posterior.
Para ladescripción de los hallazgos de neuroimagen se ha utilizadola clasificación propuesta en 1991 por el grupo de trabajodel TCDB (tabla 1) por ser la más aceptada y utilizada enpacientes adultos8,9. Los criterios utilizados paraindicar la monitorización de la PIC han sido clínicos(GCS inferior o igual a 8, incluso con primera TAC normal) y deneuroimagen (lesión encefálica difusa [LED] igual osuperior a III, y I o II si se asocia hipotensión aguda o enla segunda TAC empeora el patrónradiológico)10. La valoración de laevolución se ha establecido según el seguimiento delos pacientes realizado por los servicios de rehabilitación,neurocirugía, psiquiatría y psicología. Aunquelos pacientes han seguido controles posteriores en nuestro centroincluso hasta 3 años tras el traumatismo, hemos consideradola evolución a los 3 meses del TCE con la finalidad deestablecer un criterio homogéneo que permita comparar entresí todos los casos recogidos, incluso los másrecientes. Se han diferenciado cuatro categorías evolutivassegún los criterios de la escala de GOS (Glasgow OutcomeScale)11 más utilizada en la bibliografía(alta sin secuelas, secuelas menores, secuelas incapacitantes yfallecimientos)12,13. La evolución se considerasin secuelas en aquellos niños sin déficitneurológicos ni cambios aparentes en la personalidad orendimiento escolar respecto a la situación previa a lalesión traumática. Las denominadas secuelas menores(psicológicas y/o motoras) no imposibilitan una actividadautónoma física, intelectual y de personalidad delpaciente en contraste con las secuelas incapacitantes que motivancuidados especiales domiciliarios e incluyen el estado vegetativoque citan otras publicaciones12,13.
Los datos fueronprocesados utilizando el programa informático MicrosoftAccess® 7.0 y el análisis estadísticose realizó con SPSS 6.1 para Windows®. Losresultados referentes a variables cuantitativas se analizaronutilizando la prueba de la t de Student. Las variables cualitativasse estudiaron mediante la prueba de *2 de Pearson y se utilizó el test deMantel-Haenszel para establecer la existencia de unaasociación lineal entre los parámetros. Seaceptó un nivel de significación de p <0,05.
RESULTADOS
De los 64pacientes incluidos el 25% tenía menos de 9 años, el17,2% entre nueve y 13 años y el restante 57,8% estaba porencima de esta edad. La edad osciló entre tres y 18años (media [DE]: 12,5 [4,5] años) y el 64% fueronvarones. La estancia media (DE) en cuidados intensivos fue de 9,8(6,8) días con rango entre uno y 35 días. En 39 casos(60,9%) la causa fue el accidente de tráfico (19 en coche y20 en motocicleta), el 23,4% por atropello, el 9,5% por actividadesdeportivas, el 4,7% precipitados y en un caso tuvo lugar en elpropio domicilio.
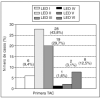
La primera TACse realizó en las primeras 4 h posteriores al traumatismo enel 84,4% y en 10 niños con posterioridad. El intervalo detiempo medio (DE) fue de 3,37 (1,94) h con rango entre una y 12 h.El patrón de neuroimagen más frecuente fue LED II(43,8%) seguido de III (29,7%), VI (12,5%) y I (9,4%) (fig 1). Nohemos encontrado diferencias significativas en ladistribución de los diferentes patrones radiológicossegún las edades.
Fig. 1.Patrones de neuroimagen en la primera tomografía axialcomputarizada (TAC).
En 47niños la puntuación inicial de la GCS fue grave(inferior a nueve) y en el resto estuvo entre nueve y 15 con undeterioro a cifras inferiores que motivó laintubación endotraqueal y el ingreso en cuidados intensivos.Para relacionar esta escala con el resto de parámetros hemosconsiderado el valor mínimo del mismo en cada paciente (GCS)y no hemos hallado relación del mismo con los patrones deneuroimagen.
Todos lospacientes con GCS entre nueve y 13 tenían una LED II en laprimera TAC y los patrones de la primera neuroimagen fueronmás graves en el grupo con puntuación inferior a 9Sin embargo, tener un GCS más alto (9-13) no garantiza queen la segunda TAC no puedan aparecer también patrones degravedad (tabla 2).
La PIC inicialmáxima que presentaron nuestros pacientes en las primeras 2horas tras colocación del sensor intraparenquimatoso fueinferior a 20 mmHg en el 42,4% de los casos, entre 21 y 40 en el35,6% y superior a 40 en el resto (22%). Tener la PIC monitorizadapermitió conocer la PPC mínima en este mismoperíodo, que fue inferior a 60 mmHg en el 55,9% de losniños. Los pacientes con GCS entre 9 y 13 presentaron unamedia (DE) de PIC máxima de 28 (17,1) mmHg con PPCmínima de 57,5 (12,2) mmHg en las primeras 2 horas demonitorización sin diferencias con los niños con GCSinferior a nueve. Los resultados obtenidos, en cambio, sonsignificativos al comparar estos patrones de PIC y PPC inicial conlos hallazgos de neuroimagen de la primera TAC (p = 0,04 y p =0,005, respectivamente) y existe una correlación linealentre estos parámetros.
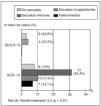
En referencia ala evolución clínica, la mortalidad fue del 10,9% yel porcentaje de niños con secuelas incapacitantes del15,6%. La mayoría (73,5%) tuvo una evoluciónfavorable, sin secuelas (17,7%) o con trastornospsicológicos o motores menores (fig. 2). Todos losfallecimientos y las secuelas incapacitantes se produjeron enpacientes con GCS inferior a 8 y hemos encontrado unaasociación lineal entre GCS y evoluciónclínica (fig. 3).
Fig. 2.Evolución clínica de los pacientes pediátricoscon traumatismo craneoencefálico grave.
Fig. 3.Relación entre la evolución clínica y lapuntuación de la escala de coma de Glasgow (GCS).
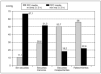
Enrelación con la primera TAC, 6 de los 8 pacientes con LED VI(75%) fallecieron en los siguientes 4 días. Presentósecuelas incapacitantes el 50% de los niños conpatrón de neuroimagen V y el 100% de los que teníanLED IV. El alta sin secuelas y las secuelas menores sedistribuyeron entre el LED I, II y III (fig. 4). El 50% de nuestrospacientes con LED I en la primera neuroimagen fue dado de alta sinsecuelas, el 33,3% con secuelas psicológicas y/o motorasmenores y un caso con secuelas incapacitantes (LED III en lasegunda TAC). Los resultados obtenidos son significativos alcomparar la distribución de los patrones de neuroimagen enla primera y segunda TAC con la evolución clínica (p< 0,001 y p = 0,004, respectivamente), aunque solamente existeuna asociación lineal entre los parámetros con laprimera neuroimagen (p < 0,001) (fig. 4).
Fig. 4.Relación entre los patrones de neuroimagen en la primeratomografía y la evolución clínica.
En losfallecidos se observaron PIC muy elevadas (media [DE]: 56 [24]mmHg) con PPC muy bajas (media [DE]: 22,8 [6,4] mmHg) y contrastacon los pacientes sin secuelas al alta (PIC media [DE]: 11,1 [5,9]mmHg y PPC media: 67,1 [11,6] mmHg) (fig 5). Los resultados son muysignificativos al relacionar la PIC inicial máxima y la PPCinicial mínima con la evolución (p < 0,001 y p =0,02, respectivamente) con marcada asociación lineal entreestos parámetros y el curso evolutivo.
Fig. 5.Valores medios de presión intracraneal (PIC) máxima yde presión de perfusión cerebral (PPC) mínima(primeras 2 h de monitorización) en los diferentes grupos deevolución clínica.
DISCUSIÓN
El TCE grave escausa importante de discapacidad y muerte en niños yadolescentes. Diversas publicaciones han demostrado unaevolución más favorable en niños que enadultos con mortalidad entre el 6 y el 33%12-16. Ennuestra casuística, la mortalidad fue del 10,9%, porcentajeinferior al de otras series publicadas14-16 considerandoque solamente incluye los TCE graves y abarca pacientes hasta 18años con lesiones importantes por accidentes detráfico. En cambio, la mortalidad en los menores de 8años es más elevada (25%) con cifras similares a laspublicadas por Alberico et al12. Al igual que Berger etal14, no hemos encontrado diferencias significativasrespecto a la evolución en los diferentes gruposetarios.
Lapuntuación del GCS no nos permite predecir el patróntomográfico de neuroimagen que presentará cadaniño en su curso evolutivo y tampoco parece ser útilpara predecir la PIC y PPC que tendrán los pacientes conTCE. Sin embargo, el GCS sigue siendo una herramienta válidaen el diagnóstico de la gravedad inicial del TCE y paraindicar la necesidad de realización inmediata o demorada deTAC craneal así como del nivel de monitorización. Ennuestra serie se pone de manifiesto la existencia de unaasociación significativa del GCS con la evoluciónclínica aunque en ausencia de otros datos no deberíaser utilizado como único factor pronóstico por subajo valor predictivo16.
Marshall etal8 demostraron la existencia de una relacióndirecta entre evolución y TAC inicial en pacientes adultosque también se cumple en edad pediátrica, comodemuestra nuestra revisión. Estos autores8hallaron un fuerte vínculo entre evolución, grado deswelling cerebral y milímetros de desviaciónde la línea media, y fueron el LED IV y LED VI los patronescon mayor mortalidad (el 56,2% y el 52,8%, respectivamente). Laneuroimagen con mayor mortalidad en nuestra revisión fue LEDVI (75%).
Elswelling hemisférico postraumático cerebral seasocia en adultos con elevada mortalidad, entre el 29 y el 87,2,según diferentes autores13,17-19. Este tipo deswelling es diferente al swelling generalizado,más común en niños y adolescentes debido ahiperemia transitoria que suele cursar con elevaciones moderadas dePIC generalmente controlables con hiperventilación moderada.En nuestra casuística, la LED III se observó en laprimera TAC en 19 niños y en 12 (63,1%) la PIC inicial fuesuperior a 20 mmHg. Sólo en un caso se asoció ahematoma subdural y se produjo un fallecimiento (5,2%).
La incidencia deTAC inicial normal en el TCE grave oscila entre un 10 y un 44% (un9,5% en nuestra serie) con diferencias debidas especialmente alintervalo postraumático en que se realiza elexamen6,20. Tres de nuestros pacientes con primera TACnormal (50%) presentaron PIC inicial máxima superior a 20mmHg en las primeras 2 h de monitorización y en un casosuperior a 40 mmHg. Estos datos contrastan con los obtenidos porotros autores6 que describen valores de PIC inferiores a15 mmHg en el 90% de estos pacientes, aunque los datos del TCDBofrecen para la LED I una mortalidad del 9,6%, con estadovegetativo en el 9,6, el 19,2% con secuelas graves, el 34,6% consecuelas moderadas y buen curso en el resto13.Además, en nuestra revisión el 66,6% de losniños con LED I inicial presentó patrones másgraves en el segundo TAC (LED II en un caso y LED III en tres)contradiciendo las cifras más bajas publicadas por Lobato etal6. La TAC nos ofrece una imagen estática de lasituación intracraneal, en un momento concreto, susceptiblea cambios dinámicos que se suceden en la evolución.Por este motivo, la presencia de un LED I en la primera TAC nodescarta la posterior aparición de lesiones secundarias,HTEC y secuelas, y está indicada la monitorización dela PIC si el GCS ha sido inferior o igual a 8 incluso con primeraTAC normal16.
CONCLUSIONES
La estrecharelación encontrada entre patrones tomográficos delTCDB, cifras de PIC y curso evolutivo en nuestros pacientes indicaque la TAC es un fuerte indicador pronóstico del riesgo deHTEC, fallecimiento y secuelas posteriores en el TCE grave en edadpediátrica. La PIC máxima y PPC mínima en lasprimeras 2 h tras el inicio de la monitorización serelacionan también de forma significativa con elpronóstico reforzando los datos aportados previamente porotros autores en pacientes adultos21-23.
Laclasificación del TCDB hace posible una descripciónmás detallada de las lesiones intracraneales, unaidentificación precoz de los pacientes con riesgo de HTEC yuna intervención también precoz del neurocirujanopara monitorizar la PIC o realizar un tratamiento quirúrgicosi están indicados. Junto con la monitorización de laPIC, el TCDB permite hacer predicciones evolutivas de la gravedaddel TCE con un papel importante en la detección de aquellospacientes con más riesgo de fallecimiento o de desarrollarsecuelas graves y una aplicación también factible enedad pediátrica.