INTRODUCCIÓN
El sistema nervioso central tiene un alto contenido en sustancias procoagulantes, siendo la principal el factor tisular1-6. Cuando se produce un daño encefálico se induce una rápida respuesta hemostática. Diversos trabajos han descrito la aparición de coagulopatía tras producirse una lesión aguda encefálica6-14.
En diversos estudios se ha analizado la relación existente entre los parámetros de la coagulación y el pronóstico de los pacientes con traumatismo craneoencefálico (TCE), difiriendo en cuanto al valor predictivo de los parámetros hemostáticos. Parece existir acuerdo sobre la correlación entre el aumento de los productos de degradación de la fibrina (PDF) en suero con la extensión de tejido encefálico destruido9,15-18. En este sentido, un estudio reciente de Takanashi et al19 corrobora esta relación, encontrando que en los pacientes con TCE los niveles más altos de PDF se asociaban con la presencia de múltiples lesiones hemorrágicas y con un peor pronóstico.
Cuando se analizan otros parámetros de la coagulación los resultados son más divergentes. Así Kumura et al17 encontraron que el parámetro tiempo de tromboplastina parcial activado se correlacionaba con la supervivencia. Sin embargo, Stein et al20 encontraron que el tiempo de protrombina y el recuento plaquetario eran los mejores predictores pronósticos. Olson et al9 evaluaron en 269 pacientes con TCE la relación de diversos parámetros de la coagulación con la supervivencia, encontrando que valores más elevados se asociaban a mayor mortalidad. Selladurai et al10 apoyan estos hallazgos en su serie de enfermos con TCE.
Estudios con nuevos marcadores de hipercoagulabilidad y fibrinólisis como el de Sorensen et al11, realizado en 14 pacientes con TCE, no encontraron relación entre los niveles del complejo trombina-antitrombina (TAT) y los fragmentos de la trombina F1+2 (F1+2) y el Glasgow Coma Score (GCS)21, mientras que sí encontraron correlación entre los niveles de TAT, F1+2 y el Injurity Severity Score22. Bredbacka et al23 realizaron un estudio en 20 pacientes con TCE, y encontraron que los niveles de fibrina soluble y D-dímeros extraídos precozmente se correlacionaban con el GCS y la fibrina soluble con el Glasgow Outcome Score (GOS)24. Nuestro grupo25 realizó un estudio en pacientes con TCE, y encontramos que los que fallecían de forma precoz presentaban más frecuentemente D-dímeros elevados.
Las conclusiones son diferentes debido a la variabilidad en el diseño de los estudios; así los pacientes incluidos en los estudios tenían diferente gravedad, las técnicas empleadas para la determinación de los marcadores hemostáticos han sido diferentes y no se han empleado las mismas escalas para valorar los resultados. Nuestro objetivo es estimar en pacientes con TCE los valores de determinados marcadores de la coagulación y su relación con la gravedad del TCE y su pronóstico.
PACIENTES Y MÉTODOS
Durante un período continuado de 28 meses realizamos un estudio prospectivo de los pacientes ingresados por presentar un TCE aislado con menos de 6 horas de evolución en el momento del ingreso. Los criterios de exclusión se muestran en la tabla 1.
Previamente a la inclusión en el estudio se obtuvo el consentimiento por parte de los familiares.
A todos los pacientes se les realizó historia clínica y exploración física a su ingreso y se les sometió a similares medidas terapéuticas, de acuerdo con el protocolo de asistencia a esta patología usado en nuestro Servicio. La valoración clínica de la gravedad la realizamos mediante el GCS al ingreso en la Unidad, y la escala de gravedad de pacientes críticos SAPS II26.
Clasificamos la gravedad de los TCE según Kalsbeck et al27 en: TCE grave (puntuación GCS < 9 puntos); TCE moderado-leve (puntuación GCS > 9 puntos).
Se realizó tomografía computarizada (TC) con el equipo Siemens Somaton 4, que fue informada por un neurorradiólogo.
A todos los pacientes incluidos en el estudio se les realizó dos extracciones sanguíneas de vena periférica del antebrazo. La primera en las primeras 6 horas de evolución y la segunda a las 24 horas. En dichas muestras realizamos la determinación de los marcadores de hipercoagulabilidad (fragmentos de la trombina 1+2 [F1+2] y TAT) y de la fibrinólisis (D-dímeros). La extracción fue de 4,5 cc de sangre y se depositó en un tubo con citrato trisódico al 3,8%, procediendo a su centrifugación a 3.600 ciclos/minuto a 4 °C durante 10 minutos para la obtención de plasma. El plasma así obtenido se almacenó en balines de plástico de 0,3 cc en congelador a 30 °C hasta el momento de su procesamiento. Previo al procesamiento se procedió a su descongelación.
Para las determinaciones hemos usado las siguientes pruebas:
1. TAT: ELISA 104 Enzygnost TAT micro de Behringwerke AG® Marburg-Alemania en el Sistema ELISA Processor II de Behring® (valores de referencia 1-4,1 μg/l).
2. F1+2: ELISA 144 Enzygnost F1+2 micro de Behringwerke AG® Marburg-Alemania en el Sistema ELISA Processor II de Behring® (valores de referencia 0,4-1,1 nmol/l).
3. D-dímeros: ELISA Vidas D-Dimer de BioMerieux®, Marcy-L'Etoile, Francia (valores de referencia entre 68 y 494 ng/ml).
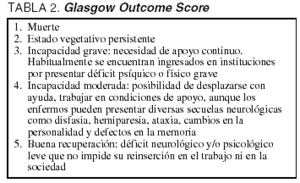
Para la valoración de resultados clínicos hemos empleado el GOS (tabla 2). Dicha valoración se ha realizado a los 6 meses de producirse la lesión encefálica, mediante encuesta telefónica con el paciente o con un familiar directo. Se consideró mala evolución (puntuaciones 1, 2, 3) las respuestas correspondientes a muerte, estado vegetativo persistente e incapacidad severa, y buena evolución (puntuaciones 4,5) las correspondientes a incapacidad moderada y recuperación total.
Los valores de las diferentes variables se expresan como media y desviación estándar (DE) o media e intervalo de confianza para el 95%. Se ha utilizado la prueba de ANOVA de dos vías para comparar las diferencias entre los valores de los marcadores hemostáticos según la gravedad del traumatismo y el momento de la extracción (ingreso y 24 horas), y según la evolución y el momento de la extracción. Para el análisis estadístico hemos empleado el paquete informático StatView SAS Institute Inc. Versión 5.0.1®.
RESULTADOS
Se incluyeron un total de 45 enfermos con TCE aislado. La edad de los enfermos fue de 46 años (DE 21,4), GCS 10 (4,4), SAPSII 32,5 (19,8). El 63% de los pacientes fueron varones. Los hallazgos más frecuentes en la TC fueron contusión (68,7%) y fractura craneal (44,8%).
En la tabla 3 se expresan los resultados de las pruebas hemostáticas en las dos determinaciones realizadas. Estos resultados muestran que en la determinación a las 6 horas todos los parámetros estudiados tuvieron unos niveles más altos que los alcanzados en la determinación realizada a las 24 horas.
Según los valores del GCS 26 pacientes presentaron TCE moderado-leve y 19 TCE grave. Según los valores del GOS 18 pacientes tuvieron mala evolución a los 6 meses y 27 buena evolución.
Los niveles de los marcadores de hipercoagulabilidad (F1+2 y TAT) fueron más altos en el subgrupo de pacientes con TCE grave, y esta diferencia fue estadísticamente significativa (p < 0,001). Esta diferencia también se observa entre la extracción al ingreso y a las 24 horas. Los valores del marcador de fibrinólisis D-dímeros también fueron más altos en los pacientes con TCE grave frente a los pacientes con TCE moderado-leve (p = 0,02) (tabla 4).
Los niveles de F1+2 y de TAT estaban más elevados de forma significativa (p = 0,001) en los pacientes con mala evolución frente a los que tuvieron buena evolución. La diferencia se observó al ingreso y a las 24 horas. Los niveles de D-dímeros fueron más altos de forma significativa en los enfermos que tuvieron peor evolución (tabla 5).
DISCUSIÓN
Limitaciones del estudio
Del tiempo de extracción
En nuestro estudio la determinación denominada "al ingreso" se ha realizado en el intervalo de las primeras 6 horas tras producirse la lesión encefálica aguda. Así pues, no todas las determinaciones han sido realizadas en el mismo tiempo. Esto ha sido debido a que por diversas circunstancias los pacientes no ingresan en el hospital en el mismo período de tiempo. La variabilidad del intervalo de tiempo transcurrido entre la lesión y el ingreso en la unidad de cuidados intensivos (UCI) depende de la logística de asistencia en los casos de accidentes de tráfico (lugar del accidente), en los casos de caídas casuales, accidentes de trabajo y agresiones puede haber otros factores que influyan en la rapidez de la asistencia al herido. Ante la gran variabilidad de situaciones que pueden influir en el intervalo de tiempo hasta el ingreso en la UCI, decidimos realizar la primera extracción sanguínea en el intervalo de las primeras 6 horas de evolución, de acuerdo con otros estudios previos10,11,23,28.
De los parámetros y marcadores realizados
Debido a las pruebas empleadas en la determinación de los marcadores de activación de la coagulación, el nivel máximo determinado en el fragmento F1+2 ha sido de 10 mmol/l y en el complejo TAT ha sido de 60 μg/l.
Relación de los marcadores de hipercoagulabilidad con Glasgow Coma Score y Glasgow Outcome Score
El hallazgo de niveles más altos en los pacientes con puntuaciones más bajas de GCS al ingreso implicaría que un mayor estado de activación del sistema de la coagulación se asociara con un mayor deterioro neurológico inicial, hecho que podría deberse a que las lesiones encefálicas fueran en estos pacientes más intensas. De igual modo, la asociación de valores más elevados de los marcadores de hipercoagulabilidad en los pacientes que presentan una mala evolución posterior indicaría que los pacientes que tienen un estado de hipercoagulabilidad más intenso evolucionan de forma desfavorable.
No existe unanimidad en la estimación de la relación entre los marcadores de hipercoagulabilidad y la gravedad del TCE o su pronóstico11,12. Los estudios sobre el tema son escasos en la literatura y, además, los diversos trabajos difieren en sus conclusiones. Probablemente esta diversidad de resultados pueda ser debida a que los estudios tienen un diseño distinto, con pocos pacientes, y a que las extracciones para la determinación de los marcadores se han realizado en diversos intervalos de tiempo tras la lesión encefálica aguda y de diferentes localizaciones. Nuestros resultados son concordantes con los comunicados por Sorensen et al11 quienes, en pacientes con TCE, encontraron que los niveles de F1+2 y TAT se correlacionaban con la gravedad de los pacientes, valorada mediante la escala de gravedad Injury Severity Score22. Por el contrario nuestros resultados difieren de los del grupo de Scherer12, cuyo estudio tiene un diseño muy diferente al nuestro, lo que hace difícil realizar una comparación de resultados. En el estudio de Scherer las determinaciones se realizaron de forma muy precoz en las primeras tres horas, y la extracción de sangre se realizó de vena cava superior y yugular. Además, solamente se incluyeron TCE graves con GCS < 8 y el número de casos estudiados fue bajo (n = 24).
Relación de los marcadores de fibrinólisis con Glasgow Coma Score y Glasgow Outcome Score
En este estudio la puesta en marcha de la fibrinólisis y su intensidad también guardan relación con la evolución de los pacientes tras sufrir una lesión encefálica aguda. En la literatura parece existir acuerdo en cuanto al valor pronóstico de los niveles de PDF en suero. En varios estudios se ha encontrado una correlación entre los niveles de PDF y la magnitud del tejido encefálico destruido7,9,15,17-19. Los estudios más recientes se han realizado con los niveles de D-dímeros, ya que este marcador es un indicador más directo que los PDF de la generación de fibrina y su disolución por la plasmina. Así, el estudio de Takanashi et al19 corrobora la relación entre niveles de D-dímeros y los resultados clínicos. Nuestros resultados coinciden con estos autores, ya que una mayor activación de la fibrinólisis valorada mediante la elevación de D-dímeros se correlaciona con unos peores resultados evolutivos; similares conclusiones han sido comunicadas por Bredbacka et al23.
Nuestros resultados apoyan la tesis sobre que estas alteraciones de la coagulación se asocian a una mayor gravedad de los pacientes. Interpretamos que los altos niveles de marcadores de hipercoagulabilidad y fibrinólisis se asocian a estados fisiopatológicos más alterados, debidos a lesiones traumáticas más graves a nivel encefálico.
De acuerdo con el consenso previo, si se decide realizar determinación de marcadores de hemostasia recomendaríamos la determinación de D-dímeros, aunque la elevación importante de cualquiera de los marcadores estudiados graves se asocia a TCE de mayor gravedad.