La hipoxia de la altitud (hipoxia hipobárica) no deja de ser una hipoxia celular similar a la que presentan los enfermos críticos. Estudiar a los alpinistas expuestos a la hipoxia extrema ofrece la ventaja de que es una población relativamente homogénea y sana, en contraste con la población heterogénea y generalmente menos saludable que suele observarse en las Unidades de Cuidados Críticos. El conocimiento de la fisiología y la enfermedad de la altitud abren caminos para comprender en qué medida afecta la hipoxia a los pacientes críticos. Los cambios comparables en la biogénesis mitocondrial entre ambos grupos pueden reflejar respuestas adaptativas similares y sugieren intervenciones terapéuticas basadas en la protección o estimulación de la biogénesis mitocondrial.
El predominio del alelo homocigótico de inserción (II) de la enzima de conversión de la angiotensina está presente tanto en las ascensiones exitosas sin oxígeno por encima de los 8.000 m como en la supervivencia de algunas enfermedades de los enfermos críticos.
High altitude sickness (hypobaric hypoxia) is a form of cellular hypoxia similar to that suffered by critically ill patients.
The study of mountaineers exposed to extreme hypoxia offers the advantage of involving a relatively homogeneous and healthy population compared to those typically found in Intensive Care Units (ICUs), which are heterogeneous and generally less healthy.
Knowledge of altitude physiology and pathology allows us to understanding how hypoxia affects critical patients.
Comparable changes in mitochondrial biogenesis between both groups may reflect similar adaptive responses and suggest therapeutic interventions based on the protection or stimulation of such mitochondrial biogenesis.
Predominance of the homozygous insertion (II) allele of the angiotensin-converting enzyme gene is present in both individuals who perform successful ascensions without oxygen above 8000 m and in critical patients who overcome certain disease conditions.
El ser humano ha sido capaz de alcanzar las cimas de montañas de más de 8.000 m sin la necesidad de oxígeno suplementario. El primer ochomil conquistado fue el Annapurna (8.091 m) en el año 1950: se consiguió respirando aire ambiente y en su planificación nunca pensaron en llevar oxígeno suplementario. El Everest (8.848 m) se logró 2años más tarde, pero con ayuda de oxígeno, y en 1978 se ascendió por primera vez respirando exclusivamente aire ambiental. Los escaladores Reinhold Messner y Peter Habeler rompieron las teorías fisiológicas que predecían que el ser humano sería incapaz de alcanzar esta mítica cima respirando aire atmosférico. Esas teorías, compartidas tanto por fisiólogos como por alpinistas de altitud, se basaban en la hipótesis de que una presión parcial de oxígeno inspirado máxima de 43mmHg hacía imposible la tolerancia humana a la hipoxia1.
Una expedición liderada por West, la American Medical Research Expedition to Everest (AMREE), que alcanzó la cima del Everest en 1981 sin oxígeno, marcó un antes y un después en este desafío fisiológico2. En esta expedición se encontraban importantes fisiólogos respiratorios y grandes alpinistas con Hackett y Milledge3. En un artículo reciente, West volvía a recordar esta investigación sobre la compresión de la tolerancia humana a la hipoxia extrema4. En el año 2007, una expedición británica conocida como la Caudwell Xtreme Everest Expedition (CXEE) volvería a aportar nuevos conocimientos sobre este desafío fisiológico5.
Estos estudios, que han servido para mejorar la comprensión de la fisiología y la enfermedad de la altitud, también abrieron caminos para ayudar y comprender como afecta la hipoxia a los pacientes críticos y a todos aquellos en los que la hipoxemia y la hipoxia celular están presentes6. No es aventurado decir que los mecanismos de adaptación a la hipoxia inducida por la gran altitud juegan un papel similar a la respuesta a la hipoxia que presentan los pacientes críticamente enfermos y, por lo tanto, que sería posible transferir conocimientos adquiridos en la medicina de montaña a la medicina crítica.
Los mecanismos de la adaptación a la hipoxia son todavía poco conocidos y su investigación en el enfermo crítico es difícil. Los alpinistas expuestos a la hipoxia extrema ofrecen la ventaja de ser una población de estudio relativamente homogénea y sana, en contraste con la población heterogénea y generalmente menos saludable observada en las Unidades de Cuidados Críticos. La reflexión principal de esta revisión sería: ¿qué nos puede enseñar el modelo de montañero sano en situación de hipoxia sobre la comprensión y manejo del enfermo crítico?
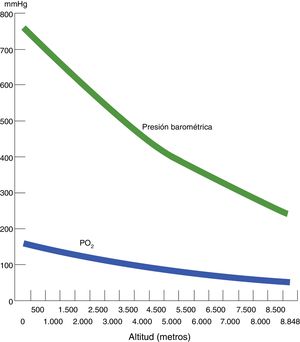
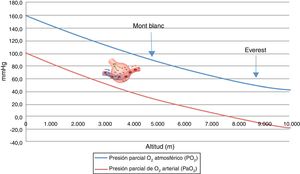
Hipoxia hipobárica e hipoxia tisularSe conoce como hipoxia hipobárica (HH) a la hipoxia consecutiva a la altitud, es decir, a la disminución de la presión atmosférica o barométrica (PB). La presión parcial del oxígeno en el aire atmosférico (PO2) se mantiene constante más allá de los 11.000 m y siempre está en una proporción del 21%. A nivel del mar, la PB es de 760mmHg y la PO2 es de 159,2mmHg. Pero, a medida que ascendemos, la PB disminuye y, consecutivamente, aunque el oxígeno continúe a la misma proporción, la PO2 también disminuye. Es decir, a mayor altitud, menor PB, menor PO2 y, consecuentemente, menor presión inspirada de oxígeno. Si en la cima del Mont Blanc (4.810 m) hay aproximadamente una PB de 405mmHg, la PO2 es de 84mmHg. De forma paralela, en la cima del Everest, la PB teórica es de 236,3mmHg y la PO2 de 49,5mmHg (tabla 1 y fig. 1).
Correlación entre altitud, presión barométrica, presión parcial de oxígeno atmosférico (ambiente seco) y presión parcial de oxígeno inspirado (con vapor de agua) y presión parcial de oxígeno arterial
| Altitud | Presión atmosférica o barométrica | Presión parcial O2 atmosférico (PO2) | Presión parcial O2 inspirada | Presión parcial O2 arterial (PaO2)* | |
|---|---|---|---|---|---|
| Metros | milibares | mmHg | mmHg | mmHg | mmHg |
| 0 | 1.013,2 | 760,0 | 159,2 | 149,3 | 99,7 |
| 500 | 954,6 | 716,0 | 150,0 | 140 | 90,5 |
| 1.000 | 898,8 | 674,2 | 141,2 | 131,4 | 81,7 |
| 1.500 | 845,6 | 634,3 | 132,9 | 123 | 73,3 |
| 2.000 | 795 | 596,3 | 124,9 | 115,1 | 65,3 |
| 2.500 | 746,9 | 560,2 | 117,4 | 107.5 | 57,7 |
| 3.000 | 701,2 | 526,0 | 110,2 | 100,3 | 50,4 |
| 3.500 | 657,8 | 493,4 | 103,4 | 93,5 | 43,7 |
| 4.000 | 616,6 | 462,5 | 96,9 | 87 | 37,2 |
| 4.500 | 577,5 | 433,2 | 90,7 | 80,9 | 31,1 |
| 5.000 | 540,5 | 405,4 | 84,9 | 75,1 | 25,2 |
| 5.500 | 505,4 | 379,1 | 79,4 | 69,5 | 19,7 |
| 6.000 | 472,2 | 354,2 | 74,2 | 64,3 | 14,5 |
| 6.500 | 440,8 | 330,6 | 69,3 | 59,4 | 9,4 |
| 7.000 | 411 | 308,3 | 64,6 | 54,7 | 4,8 |
| 7.500 | 383 | 287,3 | 60,2 | 50,2 | 0,4 |
| 8.000 | 356,5 | 267,4 | 56,0 | 46,2 | −3,8 |
| 8.500 | 331,5 | 248,7 | 52,1 | 42,2 | −7,8 |
| 9.000 | 308 | 231,0 | 48,4 | 38,5 | −11,4 |
| 9.500 | 285,8 | 214,4 | 44,9 | 35,1 | −14,9 |
| 10.000 | 265 | 198,8 | 41,6 | 31,8 | −18,3 |
La consecuencia de la HH no es otra que la hipoxia tisular. Y la hipoxia celular de la altitud es la misma que se genera en los enfermos críticos cuando la entrega de oxígeno a los tejidos está comprometida como causa o resultado de una serie de enfermedades sobradamente conocidas.
En la mayoría de los tejidos corporales la fuente primaria de energía celular, en forma de trifosfato de adenosina (ATP), es la fosforilación oxidativa, que tiene lugar en la membrana interna mitocondrial. La hipoxia plantea el reto, a la homeostasis energética y a la adaptación metabólica, de mantener la energía y funciones celulares7.
Muchos médicos se sorprenderían de saber que un alpinista en la cima del Mont Blanc tiene una PaO2 de unos 40mmHg y en la cima del Everest de unos 25mmHg, y con estas PaO2 realizan un ejercicio físico muy extenuante2,8.
Dos expediciones han logrado estimar el gas alveolar en la cima del Everest y sus valores en la sangre arterial (PaO2) (tabla 2). La primera corresponde a la AMREE de West3. En esta expedición, para estimar los datos, se tomaron muestras de sangre venosa y de gas alveolar espirado hasta una altitud de 8.050 m y en la cima solamente tomaron muestras de gas alveolar. La siguiente expedición fue la CXEE5,8. Esta expedición, a diferencia de la anterior, utilizó oxígeno a partir de los 7.100 m y la extracción de sangre fue mediante un catéter insertado en la arteria femoral. Los datos de la cima también son extrapolados, ya que las muestras se extrajeron a 8.400 m, una vez iniciado el descenso y tras 20 min sin oxígeno suplementario.
Valores estimados de los gases arteriales en la cima del Everest (ver texto)
| Expedicion | PB real (mmHg) | PaO2 (mmHg) | PaCO2 (mmHg) | SaO2 (%) | pH |
|---|---|---|---|---|---|
| AMREE3 | 253 | 28 | 7,5 | 70 | >7,7 |
| CXEE8 | 272 | 24,6 | 13,3 | 54 | 7,538 |
AMREE: American Medical Research Expedition to Everest; CXEE: Caudwell Xtreme Everest Expedition; PaCO2: presión parcial de anhídrido carbónico arterial; PaO2: presión parcial de oxígeno arterial; PB: presión barométrica.
Uno de los primeros investigadores sobre la tolerancia humana a la hipoxia fue Paul Bert, que en 1874 realizó la «Operación Everest» y consiguió que, durante una hora y 29 min, unos voluntarios permanecieran a una PB de 248mmHg. Estas y otras investigaciones las publicó en 1878 en su libro La presión barométrique. Recherches de physiologie experimentales. Animado por sus investigaciones, fue uno de los financiadores del globo aerostático Zénit, que alcanzó una altitud de 8.000 m, y pagó el precio de la muerte de 2de sus aeronautas.
La exposición aguda a una altitud por encima de los 6.000 m lleva en unos 10 min a la pérdida de consciencia y posteriormente a la muerte porque, sin aclimatación previa, a esa altitud es imposible el intercambio gaseoso (fig. 2).
En la exposición progresiva a la HH, el ser humano puede llegar a adaptarse mediante un proceso conocido como aclimatación: llega a ser capaz de realizar una serie de ajustes con resultado, a nivel celular, de un mejor suministro y una mejor utilización del oxígeno. Estos ajustes se producen a varios niveles: respiratorio, cardiaco, endocrinológico, hematológico, muscular y microcirculatorio. El componente más rápido e importante de la aclimatación es el aumento de la frecuencia respiratoria y de su profundidad, es decir, la capacidad de hiperventilación. El resto de los cambios se producen a lo largo de los días, incluyendo el aumento del hematocrito y la concentración de la hemoglobina. En AMREE, los 4alpinistas que alcanzaron la cima eran los que mejor respuesta ventilatoria tenían y llegaron a la cima siguiendo el orden de mayor a menor respuesta respiratoria9.
En la tabla 2, donde se muestra la estimación de los gases arteriales en la cima del Everest, además de observar la hiperventilación de los alpinistas, llama la atención la diferencia en la saturación de oxígeno obtenida entre las 2expediciones. La explicación está en la posible inhibición de la respuesta ventilatoria en la CXEE, que utilizó oxígeno y extrajo las muestras de sangre tras solamente 20 min sin él.
La exposición permanente a la HH puede llevar a una adaptación generacional. Las poblaciones indígenas tibetanas, que llevan más de 25.000 años viviendo en una altitud promedia de 4.000 m, tienen un metabolismo aeróbico normal, reducido nivel de hemoglobina, incremento de la ventilación en reposo y ejercicio, incremento en la síntesis de óxido nítrico (NO) y ausencia de respuesta hipertensiva pulmonar. Sin embargo, los indígenas andinos, que solo llevan viviendo en la altitud algo más de 12.000 años, todavía mantienen niveles altos de hemoglobina y en ellos persiste la hipertensión pulmonar10.
Hipoxia, mal agudo de montaña e inflamaciónLa falta de aclimatación a la altitud produce el llamado «mal agudo de montaña», que en su expresión más grave y aguda es el edema pulmonar o el edema cerebral de la altitud. La hipoxia cumple los criterios de agente causal11. Su incidencia y severidad están relacionadas con la velocidad de ascenso y la altitud máxima alcanzada, lo que indica una dosis-respuesta relacionada con la susceptibilidad individual12. Por otra parte, varios estudios señalan que la inflamación también puede contribuir a la patogénesis de esta enfermedad porque las personas con historial de enfermedades inflamatorias, como diarrea infecciosa o infección del tracto respiratorio superior, presentan un incremento de predisposición al mal agudo de montaña11,13–15.
Los lavados broncoalveolares realizados a personas con edema pulmonar de la altitud (EPA) muestran un marcado aumento en el número total de células, con un predominio de macrófagos junto a niveles elevados de citocinas, incluyendo las interleucinas 6 y 8, y el factor de necrosis tumoral α16. Se puede afirmar que el proceso inflamatorio tiene una magnitud y un patrón similar al que presentan los enfermos con síndrome de distrés respiratorio del adulto (SDRA) ingresados en las Unidades de Medicina Intensiva17.
Estudios realizados con voluntarios sanos que ascendían a gran altitud han arrojado nuevas luces para la comprensión de varias enfermedades relacionadas con la hipoxia, al demostrar la importancia del transporte de sodio en la eliminación del líquido alveolar en la patogénesis del EPA. En los individuos propensos a desarrollar EPA, el transporte de sodio respiratorio transepitelial es defectuoso y esta disfunción se agrava durante la hipoxia18. El estímulo farmacológico consecutivo a la inhalación de salmeterol, agonista β-adrenérgico utilizado como preventivo del EPA, disminuyó hasta un 50% la incidencia de EPA en individuos susceptibles18. Con base en estos estudios, el salbutamol por vía intravenosa se utilizó para acelerar la resolución del edema alveolar en pacientes hipóxicos con lesión pulmonar aguda y SDRA, ya que en la mayoría la capacidad de depuración del líquido alveolar está alterada19, y se comprobó que reducía la cantidad de agua pulmonar extravascular y mejoraba la ventilación mecánica20. No obstante, un estudio multicéntrico posterior con pacientes con SDRA se detuvo, después de un análisis intermedio, debido a que el tratamiento con salbutamol intravenoso fue poco tolerado y aumentó la mortalidad a los 28 días21. Sin embargo, a pesar de este retroceso, continúa el interés en las medidas que estimulan el transporte transepitelial de sodio y queda por dilucidar si tal estimulación mediante intervenciones alternativas (por ejemplo, agentes farmacológicos distintos del salbutamol) puede mejorar la resolución del edema pulmonar, del SDRA y de otras enfermedades en las que el edema pulmonar es una característica.
Maggiorini et al.22, insertando un catéter en la arteria pulmonar, estudiaron en una altitud de 4.559 m a montañeros susceptibles de EPA. La conclusión fue que un aumento agudo de la presión capilar pulmonar ≥ 20mmHg, por una excesiva respuesta vasoconstrictora pulmonar a la hipoxia, era el factor hemodinámico central en la fisiopatología de la formación de edema pulmonar. Un estudio reciente demuestra que el aumento solitario de la presión de la arteria pulmonar inducida por la altitud no justifica la formación de edema en una población susceptible de EPA23. Cuando la inflamación está presente, como en el SDRA, el aumento de la permeabilidad de la barrera alvéolo-capilar disminuye el umbral para la formación de edema y la extravasación del fluido pulmonar se produce frente a valores de presión capilar fisiológicamente normales.
Estudios recientes resaltan la importancia de una disfunción endotelial inducida por la hipoxia tanto en la circulación sistémica como pulmonar, con un desequilibrio entre vasoconstrictores (por ejemplo, endotelina 1) y vasodilatadores (por ejemplo, NO) y una mayor producción de especies reactivas de oxígeno (ROS)24–26. Estas sustancias, que también están implicadas en otras formas de hipertensión arterial pulmonar, indican que el estudio de las vías moleculares subyacentes a las enfermedades que presentan los individuos sanos en un ambiente hipóxico puede tener futuro.
Consumo de oxígeno e hipoxia hipobáricaBotella y Compte27 demostraron que los habitantes de las zonas de montaña tenían unas saturaciones de oxígeno (SaO2), medidas mediante pulsioximetría, superiores a las de los montañeros no aclimatados y estudiados en misma altitud, que la SaO2 aumentaba precozmente durante el periodo de aclimatación y que los sujetos ya aclimatados tenían unas SaO2 similares a las de los sujetos que viven permanentemente a la misma altitud.
Un estudio español28 calculó, a partir de los datos de la AMREE3, que la SaO2 disminuiría progresivamente con la altitud hasta llegar a un valor del 65% a 7.500 m, pero por encima de esta cota iría aumentando por acción de la hiperventilación, lo que facilitaría el aumento de la presión parcial de oxígeno alveolar. Estos mismo autores lo pudieron comprobar personalmente en una expedición Gasherbrum II (8.035 m)29.
A diferencia de la SaO2, el consumo máximo de oxígeno no se recupera con la aclimatación, ni en sujetos aclimatados que respiren oxígeno puro, cuyo resultado debería ser superior al obtenido a nivel del mar30.
Estos sorprendentes hallazgos demuestran que el transporte de oxígeno no es un factor limitante para el consumo de oxígeno en la altitud (la hemoglobina se eleva con la aclimatación), que la SaO2 se recupera respirando oxígeno y que el gasto cardiaco aumenta por un incremento de la frecuencia cardiaca y del volumen sistólico. Por ello, en los últimos años, se ha desplazado el interés de los procesos adaptativos del sistema cardiorrespiratorio y hematológico hacia los estudios sobre la microcirculación periférica y el proceso de producción de ATP en el interior de la mitocondria.
El factor inducible por la hipoxia 1La caída de la PO2 desde el aire inspirado hasta el interior de la mitocondria se conoce como cascada de oxígeno, por la similitud a una corriente fluvial que fluye a favor de la pendiente. La cascada de oxígeno se cumple con independencia del nivel de altitud. En la mitocondria, la presión del oxígeno puede ser cercana a cero, pero no puede interrumpirse en ningún momento; es imperceptible pero imprescindible.
El factor inducible por la hipoxia 1 (HIF-1) juega un papel fundamental en la homeostasis del oxígeno al facilitar este suministro a los tejidos en situaciones hipóxicas, como en la aclimatación a la HH31 o en la respuesta molecular hipoxemia/inflamación que prevalecen en la sepsis32.
El HIF-1 se encuentra en casi todos los tejidos corporales. Con la normoxia se degrada por hidroxilación, pero con la hipoxia no se degrada, sino que crece exponencialmente. Su presencia activa numerosos genes que ejercen una acción citoprotectora, facilitando un mayor aporte de oxígeno a los tejidos y una mejor utilización.
La hiperoxia es bien conocida por ser un factor de estrés oxidativo para la célula. La hipoxia, paradójicamente, también es factor estresante para la célula, tanto desde el punto de vista oxidativo como metabólico, y puede inducir alteraciones en la estructura y funcionamiento de las mitocondrias, deficiencias en el metabolismo oxidativo y aumento del ROS.
El tejido más especializado para monitorizar los niveles de oxígeno en la sangre periférica es el cuerpo carotídeo, ubicado bilateralmente en la bifurcación de la arteria carótida común. Su frecuencia de descarga sensorial es baja en la normoxia (PaO2 de 100mmHg), pero se incrementa con la caída del O2 arterial (PaO2 50-60mmHg), liberando rápidamente, al establecerse la hipoxia, una serie de neurotransmisores33. La respuesta aguda y crónica a la hipoxia depende de la capacidad de sensar el nivel de oxígeno34. Para mantener el aporte de oxígeno a los tejidos, la actividad del cuerpo carotídeo modula la respuesta respiratoria, vascular y cardiaca, e incrementa la ventilación y la presión arterial. Recientemente han sido publicados 2interesantes artículos que demuestran, una vez más, la relación entre hipoxia de la altitud e hipertensión arterial35,36. La actividad sensorial del cuerpo carotídeo es clave en la aclimatación ventilatoria y cardiovascular, y su disfunción está asociada a enfermedad37.
El HIF-1 mantiene un antagonismo funcional entre la HIF-1α y la HIF-2α. La expresión de enzimas dependientes del HIF-1α contribuye a un estado celular prooxidante y la expresión de los dependientes del HIF-2α a un estado antioxidante38. En la hipoxia, una alteración en el balance HIF-1α/HIF-2α aumenta el estrés oxidativo y desencadena alteraciones respiratorias como la apnea o cardiovasculares como la hipertensión arterial y arritmias39. Martínez Ferrer40, monitorizando el ECG con holter en la extrema altitud, encontró que, durante el sueño, se producían bloqueos A-V completos con pausas >3 s y pausas sinusales que llegaron hasta 8,3 s de duración. Duran et al.41, estudiando la polisomnografía del sueño en el Everest, encontraron que la exposición a la altitud extrema desencadena alteraciones en la SaO2, de la frecuencia cardiaca y en la ventilación, concordantes con el diagnóstico de síndrome de apnea del sueño. En un futuro, es posible que la manipulación en los cambios del estado reducción-oxidación (redox) intracelular, por modulación selectiva de la expresión HIF-1α o HIF-2α, pueda representar una herramienta importante para el tratamiento del síndrome de apnea del sueño38.
El HIF-1 y su expresión genéticaLa adaptación a la hipoxia induce un gran número de mecanismos reactivos y el HIF-1 es el maestro regulador de la expresión de genes implicados en estos mecanismos31,39,42. Como se puede comprobar en la tabla 3, está implicado en numerosas regulaciones.
Productos génicos de algunos de los genes regulados por el factor inducible por la hipoxia (HIF-1) y su función fisiológica
| Biología vascular. |
| Angiogénesis: factor de crecimiento vascular (VEGF), factor de crecimiento transformante β3, inhibidor del activador del plasminógeno 1 |
| Regulador del tono vascular: endotelina-1, óxido nítrico sintasa, hemooxigenasa 1, adrenomedulina, receptor adrenérgico α1B |
| Hierro/eritropoyesis |
| Eritropoyetina |
| Ceruloplasmina |
| Transferrina |
| Receptor de la transferrina |
| Metabolismo |
| Anhidrasa carbónica-9 (regulador del pH), adenilato cinasa 3 (metabolismo de los nucleótidos) |
| Metabolismo de la glucosa: transportador de la glucosa 1, transportador de la glucosa 3 |
| Enzimas glucolíticos: fosfofructocinasa, enolasa 1, fosfoglicerato cinasa 1, piruvato cinasa, gliceraldehído-3-P-deshidrogenasa, lactato deshidrogenasa A |
| Proliferación/supervivencia |
| Adrenomedulina |
| Eritropoyetina |
| Hemooxigenasa 1 |
| Óxido nítrico sintasa 2 |
| Proteína de unión a IGF 1 |
| Proteína de unión a IGF 2 |
| Proteína de unión a IGF 3 |
| p21 |
Existen 3importantes vasodilatadores relacionados con la hipoxia y el HIF-1: el NO, la adrenomedulina y la adenosina. Sus principales acciones se exponen en la tabla 4.
Principales efectos y acciones del NO, adrenomedulina y adenosina
| Óxido nítrico (NO)43,44 |
| Potente vasodilatador |
| Antiinflamatorio |
| Antimicrobiano |
| Antiagregante plaquetario |
| Favorece la biogénesis mitocondrial (mejora la producción de ATP) |
| Promueve la angiogénesis |
| Adrenomedulina47–49 |
| Polipéptido vasodilatador |
| Antiinflamatorio |
| Antimicrobiano |
| Estabilizador del endotelio vascular |
| Protector contra la neumonía durante la ventilación mecánica |
| Promueve la angiogénesis |
| Influencia positiva en enfermedades que cursan con hipoxia (tolerancia celular al estrés oxidativo y a la lesión hipóxica) |
| Adenosina51 |
| Nucleósido endógeno con acción vasodilatadora y antiinflamatoria |
| Es conocido como el ángel de la guarda contra el daño celular, al aumentar sus niveles en situaciones de isquemia/hipoxia aguda |
El NO es un ROS que tiene un efecto citotóxico cuando se combina rápidamente con el oxígeno, produce radicales libres y es un potente vasodilatador. Por su efecto vasodilatador, especialmente en el pulmón, se utiliza en el tratamiento del SDRA.
El NO no está incrementado exclusivamente en aquellos que viven en altitudes elevadas10, también se incrementa en los habitantes de tierras bajas cuando tratan de adaptarse a la extrema altitud45. Para los autores de esta investigación, estos hallazgos no solo son relevantes para los sujetos sanos expuestos a la HH, en los que la disponibilidad del oxígeno es baja, sino también para los enfermos críticos con enfermedades en los que la disponibilidad del oxígeno está limitada. En un futuro, podría anunciarse un cambio en el tratamiento de estos enfermos, en los que se aumentaría la tolerancia a la hipoxia mediante tratamientos que aumenten la producción de NO45. Quizá, por ello, un ensayo con un inhibidor de la síntesis del NO en pacientes con sepsis con menos de 24 h de evolución fue suspendido por registrar un aumento de la mortalidad a los 28 días46.
Recientemente, la región medial de la proadrenomedulina (precursor de la adrenomedulina) se ha propuesto como nuevo biomarcador para predecir la mortalidad en la sepsis50.
Nuevos estudios sobre el papel de la adenosina en la adaptación a la HH están abriendo campos importantes para nuevas aplicaciones terapéuticas que contrarresten el daño tisular inducido por la hipoxia. Estos estudios52,53 se basan en el papel de la adenosina eritrocítica para contrarrestar los efectos de la mala adaptación a la HH y como responsable de lo que definen como «memoria hipóxica». Siempre se ha dicho que los seres humanos se aclimatan con mayor facilidad cuantas más veces están en ella (memoria de la altitud). Esta memoria no tenía ninguna base científica hasta que las 2publicaciones referidas han podido demostrar que la exposición repetida a altitudes elevadas promueve una adaptación más rápida a la HH y que las bases moleculares de esta «memoria hipóxica» está en los eritrocitos, que además aumentan en la aclimatación.
El músculo esquelético en la aclimatación a la extrema altitudDesde hace muchos años se conoce que la densidad capilar aumenta con la aclimatación y su aumento es todavía mayor en los seres humanos que viven en altitud54. Recientemente, este hallazgo de biopsias musculares se ha vuelto a demostrar mediante videomicroscopio en los capilares labiales55.
Estudios realizados con alpinistas al regreso de expediciones a gran altitud han demostrado, además del aumento de la densidad capilar, una disminución del peso corporal, de la masa corporal y muscular, de las fibras musculares y de la densidad mitocondrial56.
El comportamiento de las mitocondrias en la gran altitud es inverso a la densidad capilar. Al regreso de las expediciones, se observa una disminución de la densidad mitocondrial, disminución que es todavía mayor en los nativos que viven en la altitud54, y un aumento de depósitos de lipofuscina en los subsarcolemas mitocondrales de las fibras musculares (expresión de pérdida mitocontrial)57.
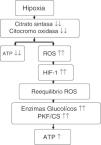
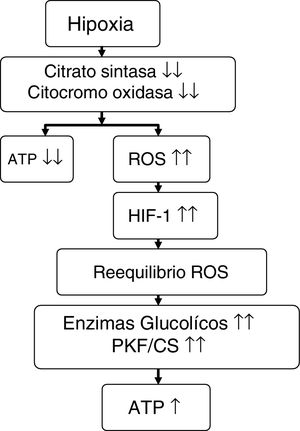
Comparando a montañeros que permanecieron 6 días (hipoxia inicial) en el campo base del Everest (5.300 m) con los que permanecieron 66 días (hipoxia sostenida) entre 5.300 y 8.848 m, a los primeros no se les objetivó pérdida mitocondrial, pero en los segundos hubo una reducción del 21% en la densidad mitocondrial y una pérdida del 73% de los subsarcolemas mitocondriales58. A estos mismos grupos se les estudió la aclimatación de las mitocondrias del músculo esquelético mediante la comparación de una serie de genes y proteínas (tabla 5) y se comprobó que, en el primer grupo, la mitocondria podría estar protegida contra el estrés oxidativo (aumento de UCP3), pero en el segundo grupo esta protección no solo desaparecía sino que existía una supresión de biogénesis mitocondrial (disminución del PGC1α y de la citrato sintasa) y del metabolismo oxidativo (disminución de la hexocinasa, del citocromo oxidasa y aumento del peroxisoma PPARα y de la relación fosfofructocinasa/citrato sintasa)7,56,58. Es como si la mitocondria en situación de hipoxia provocara su propia destrucción (autofagia), con la finalidad de asegurar el aporte de oxígeno a las mitocondrias restantes para generar ATP, modificar el metabolismo oxidativo y minimizar la producción de ROS58,59 (fig. 3).
Relación de genes, proteínas y enzimas relacionados con la aclimatación de las mitocondrias del músculo esquelético a la hipoxia de la altitud
| •UCP3: proteína desacoplante que protege a las mitocondrias de las especies reactivas de oxígeno (ROS) como superóxido, radicales libres, etc. Aumenta inicialmente en la exposición inicial a la hipoxia pero disminuye en la hipoxia sostenida |
| •PGC1α: gen que regula la biogénesis mitocondrial (a más alto, más biogénesis). Disminuye en la hipoxia sostenida |
| •Citrato sintasa (CS): se utiliza habitualmente como marcador enzimático cuantitativo para la presencia de mitocondrias intactas (actividad y densidad mitocondrial). Disminuye en la hipoxia sostenida |
| •PPARα: su activación favorece el aumento del catabolismo lipídico en el hígado. Aumenta en la hipoxia sostenida |
| •Hexocinasa: se relaciona con el metabolismo oxidativo mitocondrial (fosforilación oxidativa). Disminuye en la hipoxia sostenida |
| •Citocromo oxidasa (COX): enzima representativa de la cadena respiratoria de la mitocondria. Disminuye con la hipoxia sostenida |
| •Relación fosfofructocinasa/citrato sintasa (PFK/CS): relacionada con la glucólisis anaeróbica |
Propuesta sobre el efecto que ejerce la hipoxia en el metabolismo energético.
Fuente: adaptado de Raguso et al.7,42.
ATP: trifosfato de adenosina; HIF-1: factor inductible por la hipoxia-1; PKF/CS: relación fosfofructocinasa/citrato sintasa; ROS: especies reactivas de oxígeno.
El responsable fundamental de los cambios descritos es el HIF-1, que se eleva progresivamente con la altitud58. Estos mismos cambios también se producen en los nativos que viven en hipoxia crónica como tibetanos, sherpas e incas57, y en enfermos de EPOC pero, a diferencia de los anteriores, en la EPOC no hay aumento de la densidad capilar, lo que podría explicar la intolerancia de estos enfermos al ejercicio7.
La circulación cerebral y microcirculación en la adaptación a la gran altitudEl estudio de la circulación cerebral en la gran altitud, mediante doppler transcraneal en la arteria cerebral media, muestra un aumento progresivo del diámetro medio a partir de los 5.300 m (5,30mm a nivel del mar; 5,23mm a 5.300 m; 6,66mm a 6.400 m y 9,34mm a 7.950 m), comportamiento similar a otros parámetros cerebrales como la velocidad sanguínea, el flujo sanguíneo y la entrega de oxígeno. Sin embargo, estos cambios revirtieron rápidamente cuando se administró oxígeno a 7.950 m. Estos mismos autores realizaron un estudio con resonancia magnética a nivel del mar respirando en ambiente hipóxico durante 3h (fracción de O2 del 12%) y obtuvieron resultados similares60. Posiblemente la vasodilatación sea el mecanismo regulador para contrarrestar el aumento de la viscosidad sanguínea que produce la aclimatación y favorece la entrega de oxígeno.
El estudio de la microcirculación sublingual ha puesto de manifiesto que el aumento de la densidad capilar se produce a expensas de los vasos hasta 50 μ de diámetro. Los vasos con un tamaño inferior a las 25 μ aumentaron a partir de los 5.300 m y los de tamaño entre 25 y 50 μ aumentaron progresivamente a partir de los 3.500 m. Estos cambios se acompañaron de una caída del índice del flujo microcirculatorio sublingual (IFM), que da lugar a una microcirculación anormal muy evidente a partir de los 4.900 m y que parece interrumpirse con imágenes desenfocadas de los glóbulos rojos61,62. En la altitud, la curva de disociación de la hemoglobina está desviada hacia la izquierda (satura más pero cede menos oxígeno). Esta lentificación del flujo, unida a la viscosidad sanguínea y al aumento de la densidad, podría ser una adaptación beneficiosa a la hipoxia al facilitar la cesión del oxígeno a las mitocondrias. Al igual que sucede en la circulación cerebral, la administración de oxígeno a 7.950 m normalizó la saturación, pero produjo una caída importante del IFM con desviación de la circulación desde los vasos inferiores a 25 μ hacia los que tienen entre 25 y 50 μ62. Es posible que la producción del NO, potente vasodilatador dependiente del HIF-1, quede interrumpida bruscamente con la administración de oxígeno. Esta reversión de la hipoxemia predice que la hipoxia produce vasodilatación y la hiperoxia vasoconstricción61 y reducción de la perfusión microvascular63. Estos hallazgos pueden tener implicaciones en la administración de altas concentraciones de oxígeno de forma crónica a los enfermos críticos.
Genes, hipoxia y rendimientoHoy sabemos que hay factores genéticos que influyen sobre el rendimiento y la tolerancia a la altitud. Uno de los posibles factores implicados en estas diferencias es el polimorfismo del gen de la enzima de conversión de la angiotensina. Montgomery et al.64, comparando un grupo control de población con montañeros con historia de ascensiones por encima de los 7.000 m sin uso de oxígeno, vieron que estos últimos tenían un predominio del alelo homocigótico de inserción (II) de la enzima de conversión de la angiotensina sobre el grupo control. También se encontró al comparar a montañeros con ascensiones exitosas sin oxígeno por encima de los 8.000 m con los que no lo consiguieron65.
Este predominio no está solo asociado con el rendimiento a gran altitud, también está relacionado con la supervivencia de los enfermos críticos con SDRA66, sepsis meningocócica infantil67, trauma grave68 o incidencia de EPA69.
Modelo montañero sano y enfermo críticoA lo largo de la revisión ya hemos comentados algunos de los aspectos coincidentes entre los 2modelos. El HIF-1 juega un papel fundamental en la homeostasis del oxígeno, tanto en la aclimatación a la hipoxia de la altitud31 como en la respuesta molecular hipoxemia/inflamación que prevalecen en la sepsis32. La expresión genética del HIF-1 (NO, adrenomedulina y adenosina) facilita el aporte de oxígeno a los tejidos.
La expresión mRNA de HIF-1α está inversamente asociada con la gravedad de la sepsis. Esta alteración es mayor en los pacientes con shock séptico que en los sépticos sin shock, lo que puede significar una mala adaptación a la hipoxia o una depresión de la respuesta inmune. In vitro, la administración aguda de lipopolisacárido eleva los niveles de la expresión HIF-1α, mientras que la estimulación prolongada la suprime e incluso la reduce por debajo de los niveles basales. Además, la administración de dimetiloxalilglicina (molécula inhibidora del catabolismo de ciertos factores inducidos por hipoxia) en enfermos sépticos con varias horas de evolución no aumenta los niveles de HIF-1 y, en estos pacientes, el nivel de HIF-1 está muy disminuido cuando ingresan en una Unidad de Cuidados Intensivos33. Esto significa que cuando un enfermo en shock séptico ingresa en la Unidad de Medicina Intensiva ya lleva muchas horas con el proceso inflamatorio en marcha y su respuesta ante una estimulación continua de la endotoxina ya está agotada70,71.
Hay aspectos coincidentes entre la microcirculación sublingual anormal que se observa a partir de los 4.900 m61,62 y la observada en enfermos críticos. Boerma et al.72, al estudiar la reducción del IFM en enfermos críticos con sepsis abdominal entre el primer día del diagnóstico y el tercer día de tratamiento activo, demuestran la asociación entre la gravedad de la sepsis y un IFM sublingual alterado.
Los cambios comparables en la biogénesis mitocondrial entre montañeros aclimatados y enfermos críticos pueden reflejar respuestas adaptativas similares. La respuesta inicial en ambos grupos es un estado hiperdinámico con aumento del gasto cardiaco que facilita la llegada de oxígeno a los tejidos junto a una protección mitocondrial al estrés oxidativo para asegurar una mejor utilización59. Posteriormente, hay una reducción de la biogénesis mitocondrial, pero acompañada de un mejor aprovechamiento del oxígeno6,58,59. En la sepsis, esta reducción de la actividad mitocondrial y de la fosforilación oxidativa viene marcada por un defecto adquirido en la respiración celular que se conoce como «hibernación celular» o «hipoxia citopática», que inicialmente puede estar vinculada a la supervivencia celular, pero después puede desencadenar un fracaso multiorgánico73,74.
El papel de la disfunción bioenergética está adquiriendo protagonismo para explicar la paradoja entre la insuficiencia orgánica clínica y bioquímica de la sepsis y una supervivencia marcada por una mínima muerte celular (las células pueden entrar en un estado de «hibernación» ante una inflamación abrumadora), el mantenimiento de la oxigenación celular, de la función mitocondrial y la elevación de los marcadores de biogénesis74. Si bien no se puede establecer con claridad la causa y el efecto, estas observaciones señalan una nueva vía de intervención terapéutica centrada en la protección mitocondrial o en la aceleración del proceso de recuperación a través de la estimulación de la biogénesis mitocondrial, particularmente pertinente a la luz de los múltiples fracasos experimentales relacionados con las terapias inmunomoduladoras74.
La metformina es un importante activador de la AMP cinasa, considerada como detector de la energía celular, que promueve la actividad y biogénesis mitocondrial y que, además de elevar el lactato, posee efectos antiendotoxémicos y antiinflamatorios73. Un reciente estudio de Park et al.75 sobre el impacto de la metformina en pacientes con sepsis grave o shock séptico que la tomaban previamente demuestra que, a pesar del alto nivel del lactato, la supervivencia aumenta en casi un 30%, aunque este último dato hay que tomarlo con precaución, dado el número limitado de casos. Por otra parte, debemos pensar que hay intervenciones habituales en la medicina intensiva que afectan a la biogénesis mitocondrial o a su capacidad funcional, como son los bacteriostáticos, catecolaminas, corticoides, terapia tiroidea, tipo de nutrición o situaciones evolutivas como hiperglucemia, inmovilidad o ventilación mecánica76.
La hipoxia permisivaEl ser humano tiene una potencial tolerancia a la hipoxia al haberse expuesto a una hipoxia severa y sostenida en su vida fetal. Es importante resaltar que los mecanismos fisiológicos fetales que sirven para mantener el metabolismo oxidativo celular funcionan a través de la modificación del consumo de oxígeno77. Los mecanismos que diferencian a los montañeros que se aclimatan a la HH de los que no lo consiguen, a los nativos adaptados a la hipoxia crónica y a los supervivientes de los no sobrevivientes a una enfermedad crítica pueden estar, al menos en parte, en el control celular del consumo de oxígeno a través de las vías de señalización anteriormente expuestas6. No consiste en aumentar el suministro de oxígeno, sino en mejorar su utilización. En este enfoque terapéutico puede estar la base de la hipoxia permisiva. Hemos aceptado el concepto de hipercapnia permisiva y debemos aceptar el concepto de hipoxia permisiva. Estudios recientes así parecen aconsejarlo78–80.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.