La administración de dosis altas de aptiganel en las siguientes 6 h tras un ictus isquémico no mejora la recuperación neurológica a los 90 días y aumenta la mortalidad a los 120 días.
Artículo: Albers GW, Goldstein LB, Hall D, Lesko LM, for the Aptiganel Acute Stroke Investigators. Aptiganel hydrochloride in acute ischemic stroke. A randomized controlled trial. JAMA 2001;286:2673-82.
Antecedentes: el papel de los aminoácidos excitatorios en la patogenia de la muerte neuronal por isquemia ha ido adquiriendo un creciente interés a raíz de la demostración, mediante modelos experimentales, de que antagonizando la transmisión de los mismos se reduce el tamaño del infarto cerebral. El glutamato es el neurotransmisor excitatorio más abundante en el sistema nervioso central. Existen dos tipos de receptores postsinápticos del glutamato: los metabotrópicos y los ionotrópicos. De estos últimos, el mejor caracterizado es el receptor NMD (N-metil-D-aspartato), que regula la entrada de los iones calcio y sodio en la célula.
El aptiganel es un antagonista no competitivo del receptor NMDA que induce una reducción de más del 50% en el tamaño del infarto en el modelo de oclusión de la arteria silviana en la rata.
Los estudios de seguridad realizados en humanos han demostrado que la dosis máxima tolerable de aptiganel es de 5 mg en bolo intravenoso, seguido de una infusión de 0,75 mg/h durante 12 h.
Objetivo: analizar si la administración de aptiganel en las siguientes 6 h tras producirse un ictus isquémico produce mejoría en la recuperación neurológica sin aumentar la mortalidad.
Diseño: ensayo clínico con asignación aleatoria.
Lugar: 156 centros distribuidos por EE.UU., Australia, Canadá, Sudáfrica, Inglaterra y Escocia.
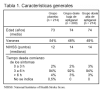
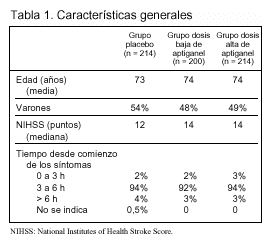
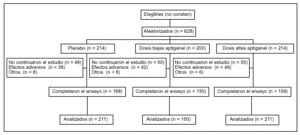
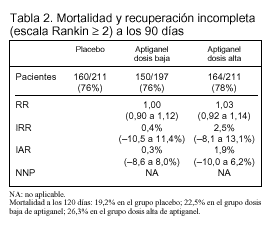
Pacientes(tabla 1 y fig. 1):
Criterios de inclusión: edad > 16 años y signos-síntomas de ictus isquémico < 6 h de evolución y sintomatología: a) presente > 30 min; b) con ausencia de mejoría rápida, y c) no producida por síncope, convulsión, migraña o hipoglucemia.
Criterios de exclusión:a) en la TAC craneal se aprecian hemorragia, ictus de tronco cerebral, tumor cerebral primario o metastásico; b) déficit mental grave; c) trastorno neurológico que podría interferir en la valoración de la capacidad funcional del paciente (demencia, demencia multiinfarto, esclerosis múltiple avanzada); d) síntomas ligeros de ictus (< 6 puntos en la escala NIHSS); e) estupor grave (¾ 2 puntos en la subcategoría de nivel de conciencia de la escala NIHSS); f) hipertensión arterial mantenida (sistólica >= 200 mmHg o diastólica >= 110 mmHg en dos mediciones separadas por 30 min); g) diagnóstico clínico de hipertensión maligna acompañada de signos-síntomas de afección cardíaca, renal, hepática o con encefalopatía hipertensiva; h) hipotensión arterial mantenida (sistólica ¾ 90 mmHg o diastólica ¾ 50 mmHg), e i) hipoglucemia clínicamente significativa (p. ej., glucemia ¾ 40 mm/dl).
Intervenciones que se comparan:
Grupo dosis alta de aptiganel: 5 mg de aptiganel en bolo intravenoso, seguido de infusión intravenosa continua de 0,75 mg/h durante 12 h hasta un máximo de 14 mg.
Grupo dosis baja de aptiganel: 3 mg de aptiganel en bolo intravenoso seguido de infusión intravenosa continua de 0,5 mg/h durante 12 h hasta un máximo de 9 mg.
Grupo control: placebo.
Asignación aleatoria: sí. No consta si se mantuvo oculta.
Enmascaramiento: sí. La valoración de las escalas sobre disfunción neurológica fue realizada por una persona que no conocía el grupo al que había sido asignado cada paciente.
Desenlaces principales: puntuación en la escala modificada de Rankin a los 90 días del ictus.
Análisis por intención de tratar: sí.
El estudio se interrumpió antes de conseguir el tamaño muestral prefijado porque en un análisis intermedio se demostró que el tratamiento con aptiganel no producía ningún beneficio sobre la recuperación neurológica a los 7 días y se asociaba con mayor mortalidad.
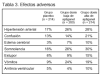
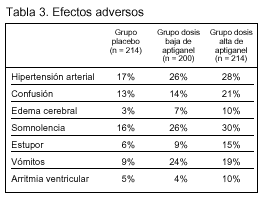
Resultados principales (tablas 2 y 3).
Información sobre costes: no consta.
Financiación del estudio: Boehringer Ingelheim Pharmaceutical Inc. y Boehringer Ingelheim.
Figura 1.
Conclusiones de los autores: el tratamiento con aptiganel no es eficaz en los pacientes con ictus a las dosis que se han utilizado en este estudio y puede ser perjudicial.
Conclusiones de los revisores: las conclusiones de los autores están adecuadamente sustentadas por los resultados del estudio. La aparición de edema cerebral como efecto adverso producido por el aptiganel coincide con los resultados de otro ensayo clínico sobre eficacia de otro antagonista de los receptores NMDA (selfotel) en pacientes con ictus (ASSIST) que también tuvo que ser interrumpido tempranamente. En el estudio ASSIST, la mortalidad debida a acontecimientos cerebrales (edema cerebral y progresión del ictus) fue del 13% en el grupo de selfotel y del 5% en el grupo de placebo.
Otras referencias
Davis SM, Albers GW, Diener HC, Lees KR, Norris J (ASSIST Steering Committee). Termination of acute stroke studies involving selfotel treatment. Lancet 1997;349:32.
Martínez-Vila E, Irimia-Sieira P, Gállego-Culleré J. Situación actual de la neuroprotección en el ictus. Rev Neurol 1999;29:526-36.
Glosario:
RR (riesgo relativo): es el cociente entre el riesgo de que ocurra un suceso en el grupo tratado dividido por el riesgo de que ocurra el suceso en el grupo control (habitualmente placebo).
RRR (reducción relativa del riesgo): es la reducción proporcional en el riesgo de que ocurra un hecho adverso (p. ej., muerte) expresada en porcentaje. Se calcula: (1RR)+ 100%.
RRA (reducción absoluta del riesgo): es la diferencia entre el riesgo de que ocurra un hecho adverso en el grupo control menos el riesgo en el grupo tratado expresada en porcentaje. Se calcula: (RcRt)* 100.
NNT (número necesario para tratar: es el número de pacientes que hay que tratar para prevenir un efecto adverso. Se calcula: 100/RRA.
IRR (incremento relativo del riesgo): es el incremento proporcional en el riesgo de que ocurra un hecho adverso (p. ej., muerte) expresada en porcentaje. Se calcula: (RR1)+ 100%.
IAR (incremento absoluto del riesgo): es la diferencia entre el riesgo de que ocurra un hecho adverso en el grupo tratado menos el riesgo en el grupo control, expresada en porcentaje. Se calcula: (RtRc)+ 100.
NNP (número necesario para perjudicar): es el número de pacientes que hay que tratar para provocar un efecto adverso. Se calcula: 100/IAR.
Sensibilidad: es la probabilidad de que una prueba dé resultado positivo entre los sujetos con enfermedad.
Especificidad: es la probabilidad de que una prueba dé resultado negativo entre los sujetos que no tienen la enfermedad.
Likelihood ratio (cociente de probabilidad): likelihood ratio es la probabilidad de que una prueba dé un resultado entre los sujetos que tienen la enfermedad dividida por la probabilidad de que dé el mismo resultado entre los sujetos que no tienen la enfermedad. La likelihood radio para un resultado positivo se calcula: LR + = sensibilidad (1 especificidad). La likelihood ratio para un resultado negativo se calcula: LR = (1 sensibilidad)/especificidad. Interpretación de likelihood ratio: > 10, muy positivo; 3 a 10, moderadamente positivo; 0,3 a 3, neutro; 0,1 a 0,3, moderadamente negativo; < 0,1 muy negativo.
Índice kappa: es un estimador de la variabilidad intra e interobservador cuando se califican variables cualitativas.