El shock cardiogénico (SC) es un síndrome heterogéneo con elevada mortalidad y creciente incidencia. Se trata de una situación en la que existe un desequilibrio entre las necesidades tisulares de oxígeno y la capacidad del sistema cardiovascular para satisfacerlas debido a una disfunción cardiaca aguda. Históricamente, los síndromes coronarios agudos han sido la causa principal de SC; sin embargo, los casos no isquémicos han aumentado en incidencia. Su fisiopatología implica el daño isquémico del miocardio, una respuesta tanto simpática como del sistema renina-angiotensina-aldosterona e inflamatoria, que perpetúan la situación de hipoperfusión tisular conduciendo finalmente a la disfunción multiorgánica. La caracterización de los pacientes con SC mediante una valoración triaxial y la universalización de la escala SCAI ha permitido una estandarización de la estratificación de la gravedad del SC que, sumada a la detección precoz y el enfoque Hub and Spoke, podrían contribuir a mejorar el pronóstico de los pacientes en SC.
Cardiogenic shock (CS) is a heterogeneous syndrome with high mortality and increasing incidence. It is a condition where there is an imbalance between tissue oxygen demands and the cardiovascular system's capacity to meet them due to acute cardiac dysfunction. Historically, acute coronary syndromes have been the primary cause of CS; however, non-ischemic cases have seen a rise in incidence. Its pathophysiology involves myocardial ischemic damage, a sympathetic, renin–angiotensin–aldosterone system, and inflammatory response, perpetuating the situation of tissue hypoperfusion, ultimately leading to multiorgan dysfunction. Characterizing CS patients through a triaxial assessment and the widespread use of the SCAI scale has allowed standardization of CS severity stratification, which, coupled with early detection and the “Hub and Spoke” approach, could contribute to improve the prognosis of CS patients.
El shock cardiogénico (SC) se erige como un síndrome potencialmente mortal, caracterizado por la disfunción cardiaca y la hipoperfusión sistémica. Esta condición, marcada por una incidencia en aumento y tasas de mortalidad persistentemente elevadas, plantea un desafío significativo para los intensivistas debido a su complejidad como síndrome clínico heterogéneo, en el que la atención individualizada y precoz se convierte en una necesidad apremiante.
En este contexto, este primer artículo de la serie «Puesta al día en shock cardiogénico» explora los aspectos epidemiológicos, fisiopatológicos, de estratificación de riesgo y las estrategias de detección precoz.
EpidemiologíaLa prevalencia del SC varía dependiendo de la definición utilizada, el entorno clínico y el periodo de recogida de datos. Basado en un registro nacional reciente1, el SC representa el 6% de los pacientes ingresados en las unidades de cuidados intensivos (UCI) españolas, con una mortalidad intra-UCI del 32%. Tanto la prevalencia como la mortalidad observadas en el ámbito nacional concuerdan con los datos recopilados en diversos registros europeos2–5, en los que la mortalidad se encuentra entre el 30% y el 60%.
Históricamente, los síndromes coronarios agudos (SCA) han sido la causa más común de SC (SC-SCA). La incidencia del SC-SCA entre los pacientes que han sufrido un evento isquémico se estima entre el 4% y el 12%6. Un registro francés reveló una tendencia a la disminución de la incidencia de SC-SCA en el período 2005-2015, descendiendo del 5,9% al 2,8%, con una mortalidad que no experimentó variaciones significativas, situándose entre el 40% y el 50%7. En contraste, en el ámbito español, durante un período similar (2003-2015), la incidencia de SC-SCA se mantuvo constante, oscilando entre el 5,7% y el 6,4%, existiendo, sin embargo, una mejoría significativa de la mortalidad, disminuyendo del 82% al 67,1%8.
De manera global, la contribución del SC-SCA ha disminuido en las últimas 2 décadas, de manera simultánea al aumento de casos de SC de otras etiologías. Entre las principales causas de SC no isquémico (SC-NoSCA) se incluyen miocardiopatías no isquémicas, arritmias y valvulopatías graves9. Los pacientes con SC-NoSCA exhiben una mayor carga de insuficiencia cardiaca preexistente, así como arritmias auriculares y ventriculares, hipertensión pulmonar y enfermedad renal crónica9. No obstante, los datos sobre la mortalidad comparativa entre SC-SCA y SC-NoSCA presentan ciertas discrepancias. En el registro CardShock10 los pacientes con SC-SCA no presentaron diferencias significativas en cuanto a mortalidad respecto a los pacientes SC-NoSCA (40% vs. 24%, p=0,06); sin embargo, el SCA como etiología del SC se reveló como un predictor independiente de mortalidad (OR: 7,4; IC 95%: 1,9-29,8%). Por otro lado, en un estudio alemán más reciente se identificó un riesgo de mortalidad a los 30 días significativamente mayor para los pacientes con SC-NoSCA con un hazard ratio de 1,14 (IC 95%: 1,04-1,24)11.
DefinicionesEl SC tradicionalmente se ha definido como una situación de bajo gasto cardiaco (índice cardiaco [IC]<2,2l/min/m2) en la que se observa hipotensión arterial mantenida (presión arterial sistólica [PAS]≤90mmHg o presión arterial media [PAM]≤60mmHg) en situación de euvolemia, con datos de hipoperfusión y congestión pulmonar (presión de oclusión de la arteria pulmonar≥15mmHg)12,13. Sin embargo, no existe consenso a la hora de establecer los criterios diagnósticos o la definición, pudiendo existir SC sin hipotensión arterial. Por otra parte, en ocasiones el diagnóstico se realiza únicamente mediante la identificación de parámetros clínicos, dado que no se dispone de sistemas de monitorización hemodinámica avanzada que permitan la obtención de los parámetros descritos13.
Por ello, la literatura y guías más recientes describen el SC como un síndrome clínico producido por un desequilibrio entre las necesidades tisulares de oxígeno y la capacidad del sistema cardiovascular para satisfacerlas debido a una disfunción cardiaca aguda12–16.
El SC debe ser entendido como un continuo que engloba desde la situación de preshock o shock compensado, hasta el SC refractario. El preshock ha sido descrito como una situación clínica en la que puede observarse hipotensión sin que se evidencien datos de hipoperfusión y que, sin un tratamiento adecuado, evolucionará a SC13,17. Por otra parte, el SC refractario es la manifestación más grave del SC y se caracteriza por la persistencia de los datos de hipoperfusión y disfunción multiorgánica, a pesar de la implementación del tratamiento etiológico y el soporte farmacológico y/o mecánico adecuados12,14,17.
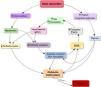
FisiopatologíaLa fisiopatogenia del SC (fig. 1) comienza con un evento índice que va a condicionar una disfunción cardiaca, ya sea por disminución de la contractilidad, complicación mecánica o alteración de la homeostasis en pacientes con cardiopatías crónicas y disfunción ventricular.
La primera causa de SC es la cardiopatía isquémica, de forma que la secuencia más frecuente es el fallo de bomba (reversible o no) secundario a la trombosis aguda de una arteria coronaria que perfunde una amplia extensión de territorio miocárdico, sin circulación colateral. Se estima que para desarrollar un SC-SCA se precisa una pérdida de masa miocárdica en torno al 40%, siendo la arteria más frecuentemente afectada la descendente anterior, aunque en un 60% de los pacientes puede existir una enfermedad multivaso18. La magnitud del miocardio infartado o recuperable, así como los mecanismos de compensación neurohormonales y metabólicos, van a influir en la velocidad en que el SC se instaure y progrese19.
En el SC-noSCA el evento índice no es tan claramente identificable como en la miocardiopatía con disfunción ventricular, donde una arritmia supraventricular, un aumento sutil de la congestión o una anemización pueden hacer evolucionar una IC crónica compensada hacia un SC.
En ambos casos, SC-SCA y noSCA, la disminución del potencial contráctil miocárdico por debajo del umbral necesario para mantener el gasto cardiaco de acuerdo con los requerimientos fisiológicos condiciona cambios a nivel cardiaco y sistémico para mantener el gasto cardiaco que, si no son efectivos, provocan la entrada en un círculo vicioso que conduce al fracaso multiorgánico y al fallecimiento del paciente.
Respuesta simpática y sistema renina-angiotensina-aldosteronaCuando el gasto cardiaco disminuye lo suficiente la perfusión sistémica y coronaria se reducen. Esta última cae por un doble mecanismo, ya que, además, existe un aumento de la presión diastólica intraventricular. La caída de la presión de perfusión miocárdica induce o empeora la isquemia, generando un círculo vicioso de mayor disfunción cardiaca y disminución del gasto cardiaco.
A nivel sistémico, desde los barorreceptores se activa una respuesta simpática con liberación de catecolaminas que aumenta la frecuencia cardiaca, el tono venoso y la vasoconstricción arterial, con el objetivo de incrementar la perfusión periférica y coronaria. Sin embargo, esto provoca un aumento de la poscarga, con el consiguiente incremento de las presiones de llenado y sobrecarga del miocardio ya dañado16,19. Además, debido al aumento de la vasoconstricción arteriolar y venosa existe un gradiente que condiciona un movimiento de líquido desde el compartimento no estresado al estresado, generando un aumento de la congestión.
La hipoperfusión renal conllevará la activación del eje renina-angiotensina-aldosterona15. La angiotensina produce vasoconstricción periférica contribuyendo al aumento de la poscarga cardiaca. A su vez, la aldosterona provoca retención de agua y sodio intentando aumentar el volumen circulante, efecto que se suma al de la secreción de hormona antidiurética, empeorando la congestión.
Metabolismo anaerobio y respuesta inflamatoria sistémicaCuando estos mecanismos son sobrepasados y el gasto cardiaco es incapaz de satisfacer las demandas metabólicas y de oxígeno de los tejidos, estos entran en metabolismo anaerobio, generando acidosis láctica y consumo de las reservas de adenosín trifosfato (ATP), lo que conlleva a su vez un empeoramiento del gasto cardiaco, que puede verse mermado además por arritmias o complicaciones mecánicas.
La isquemia se va instaurando y se pone en marcha un estado proinflamatorio en forma de síndrome de respuesta inflamatoria sistémica. En este estado se liberan citoquinas, factor de necrosis tumoral alfa, radicales libres y óxido nítrico sintetasa, lo que produce vasodilatación por resistencia microvascular a las catecolaminas20 y mayor depresión de la función miocárdica por disminución en la expresión de receptores beta. Otra sustancia liberada en el contexto de hipoperfusión es la interleuquina 6, que se asocia de forma independiente con la mortalidad precoz de los pacientes con infarto agudo de miocardio21.
MicrocirculaciónEl estado proinflamatorio produce una disfunción endotelial, provocando una fuga capilar, que contribuye a la disfunción multiorgánica22. En situación de normalidad el glicocálix cubre la pared luminal del endotelio preservando su integridad y evitando la agregación plaquetaria y coagulación. Cuando el glicocálix pierde su integridad se produce activación endotelial con adhesión plaquetaria y leucocitaria y activación de la cascada de coagulación, lo que produce trombosis y oclusión microvascular23.
Estas alteraciones de la microcirculación pueden producirse desde estadios iniciales del SC, cuando aún no han aparecido alteraciones macrocirculatorias, conllevando peor pronóstico24.
La activación de leucocitos y monocitos segrega elevadas cantidades de mieloperoxidasa, que a su vez genera especies reactivas de oxígeno, dañando las células miocárdicas y alterando el tono vascular20. Por otro lado, el ADN mitocondrial de las células dañadas que circula en la sangre induce una potente respuesta inflamatoria mediante receptores tipo Toll 9 (TLR-9), que lo identifican como material extraño, similar a la respuesta que se produce en el shock séptico cuando detectan material bacteriano25.
Disfunción multiorgánicaConforme se generaliza la hipoperfusión y se instaura el metabolismo anaerobio surgen las diferentes disfunciones orgánicas, inicialmente reversibles. La hipoxia y la acidosis metabólica de origen láctico producen disminución de las resistencias a nivel arteriolar, empeorando la vasoplejía y amplificando la respuesta inflamatoria12.
La disfunción hepática y renal que se produce por hipoperfusión y congestión conllevan alteraciones metabólicas, iónicas, hídricas y coagulopatía. La exploración neurológica puede mostrar somnolencia y coma, o por el contrario agitación psicomotriz. En los pulmones la congestión favorece la aparición de edema, y por tanto la hipoxia, que afectará tanto al miocardio, ya isquémico, como al resto de órganos. La hipoperfusión gastrointestinal facilita la traslocación bacteriana, favoreciendo la aparición de sepsis y la hemorragia.
La disfunción cardiaca inicial, la hipoperfusión tisular y la disfunción multiorgánica generan una hipotensión cada vez mayor que aumenta la isquemia, perpetuando un círculo vicioso que se convierte en irreversible16,26. Alcanzado este punto de no retorno, aunque se restablezca la perfusión tisular mediante las medidas encaminadas a revertir el cuadro, es improbable evitar la muerte del paciente.
Sistemas de clasificación y estratificación pronósticaLa tipificación del paciente en SC tiene el potencial de mejorar los resultados al permitir orientar el manejo, tanto en intensidad como en precocidad27. Tradicionalmente se han utilizado las características clínicas y hemodinámicas para clasificar el SC (fig. 2), sin embargo esta clasificación no se encuentra adaptada al perfil actual de paciente con SC, teniendo una escasa implicación terapéutica. Por otra parte, la escala Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS), diseñada inicialmente para la estratificación de los pacientes con IC avanzada, clasifica los pacientes en 7 niveles en función de su perfil hemodinámico y el grado de daño de órganos diana. En esta clasificación los pacientes con SC tan solo pueden clasificarse en los estadios 1 y 2, por lo que no discrimina de forma adecuada la gravedad del paciente con SC28.
Se han identificado múltiples factores de riesgo de mortalidad en el SC, siendo la gravedad del shock uno de los predictores más potentes y el factor más utilizado en las clasificaciones disponibles27,29. Sin embargo, existe gran heterogeneidad al definir gravedad, siendo la ausencia de estandarización una limitación tanto para la comunicación entre equipos asistenciales como en investigación para comparar resultados.
De los parámetros individuales de gravedad asociados al pronóstico del SC destacan:
- 1.
Grado de hipoperfusión. Concentraciones mayores de 4-5mmol/l de lactato al ingreso conllevan peor pronóstico, en especial si son superiores a 10mmol/l. También se ha asociado a mal pronóstico su falta de aclaramiento y los niveles de pH más ácidos10,30–33.
- 2.
Situación hemodinámica del paciente. Hipotensión arterial, taquicardia, bajo gasto cardiaco, pérdida de contractilidad (bajo volumen sistólico e índice de trabajo cardiaco), disfunción del ventrículo derecho y congestión sistémica10,28,29,33-35.
- 3.
Intensidad del soporte circulatorio. Implica peor pronóstico la necesidad de más vasoactivos, tanto en número de vasopresores e inotropos como en dosis. Índices como el Vasoactive Inotropic Score o el Norepinephrine Equivalent Dose se han visto asociados a mortalidad, integrando la presión arterial alcanzada y la necesidad de soporte circulatorio mecánico (SCM) como modificador de la dosis de aminas36–38.
- 4.
Parada cardiaca recuperada (PCR). Independiente de su duración y del nivel asistencial en que se produzca, en especial cuando asocia daño anóxico cerebral, implica pronóstico desfavorable aun cuando el shock mejore con el tratamiento13,39,40.
- 5.
Grado de respuesta inflamatoria secundaria41.
Para determinar el pronóstico del SC deben tenerse en cuenta también factores no modificables propios del paciente, donde la edad es el factor de mayor impacto pronóstico. Otras características, como la fragilidad y comorbilidad o el sexo y la raza, tienen un impacto menos consistente entre estudios42–44.
Escala de la Society for Cardiovascular Angiography and InterventionsActualmente, la clasificación más popular en la práctica clínica y estudios de investigación para tipificar a los pacientes en SC es la clasificación de la Society for Cardiovascular Angiography and Interventions (SCAI)13. En ella se propone estratificar los casos en 5 niveles de gravedad (ABCDE) utilizando parámetros que representan la situación clínica, hemodinámica y bioquímica (de perfusión y función orgánica), actuando la PCR recuperada como modificador pronóstico desfavorable que se representa mediante el subtipo A (tabla 1).
Descriptores de los diferentes grados de la clasificación de la Society for Cardiovascular Angiography and Interventions (SCAI)13
| Grado de shock | Exploración física | Hallazgos laboratorio | Parámetros hemodinámicos |
|---|---|---|---|
| A. At risk | • Sin signos de edema pulmonar• Sin signos de hipoperfusión | • Lactato dentro de la normalidad• Función renal normal | • Normotensión• IC≥2,5• SvO2≥65%• Sin vasoactivos |
| B. Beginning | • Ingurgitación yugular• Crepitantes aislados• Sin signos de hipoperfusión | • Lactato dentro de la normalidad• Función renal mínima alteración• BNP elevado | • Hipotensión (PAS<90 o PAM<65mmHg)• Taquicardia (FC>100/min)• IC≥2,2SvO2≥65%• Sin vasoactivos |
| C. Classic | • Ingurgitación yugular• Crepitantes• Signos de hipoperfusión• Necesidad de VNI o CPAP | • Lactato≥2mmol/l• Aumento ×2 de la creatinina basal• BNP elevado• Alteración perfil hepático | • Hipotensión con necesidad de vasoactivos• IC<2,2• PCP>15mmHg• PAPI<1,85• CPO≤0,6 |
| D. Deteriorating | • Igual que en grado C | • Igual que en grado C | • Igual que en grado C con necesidad de múltiples vasopresores o SCM |
| E. Extremis | • Ventilación mecánica invasiva• Cercano a la pérdida de pulso• Necesidad de VM• Necesidad de desfibrilación• Colapso cardiovascular | • Fracaso multiorgánico• pH≤7,2• Lactato≥5mmol/l | • Hipotensión a pesar de soporte de grado C y D• FV/TV refractariaActividad eléctrica sin pulso |
En caso de parada cardiaca, en cualquiera de los grados, se añadiría el subtipo «A».
BNP: péptido natriurético tipo B; CPAP: Presión positiva continua de la vía aérea; CPO: cardiac power output (definido por la fórmula [PAM×gasto cardíaco]/451); FC: frecuencia cardíaca; FV: fibrilación ventricular; IC: índice cardíaco; PAM: presión arterial media; PAPI: índice de pulsatibilidad de la arteria pulmonar, definido como la relación entre la diferencia de la presión sistólica y diastólica de la arteria pulmonar respecto a la presión de la aurícula derecha; PAS: presión arterial sistólica; SCM: soporte circulatorio mecánico; SvO2: saturación venosa mixta de oxígeno; TV: taquicardia ventricular; VNI: ventilación no invasiva.
Existen múltiples estudios que validan la escala en distintos centros y países, aplicada tanto a casos de SC-SCA como SC-NoSCA. En ellos se demuestra que la escala SCAI se correlaciona con el pronóstico, correspondiendo mayor mortalidad a corto y a largo plazo a estadios más altos, incluso cuando se estratifica la población en función del diagnóstico, factores de riesgo no modificables, intensidad de tratamiento, fenotipo de shock y comorbilidad. Esta capacidad se ha demostrado si se utiliza la escala al ingreso, el peor valor en las primeras 24h o incluso el peor durante la estancia. La mortalidad a corto plazo es de un 3% en el estadio A, duplicándose al 7% en el B, por 4 en el C (10-35%) y llegando al 25-68% en el D y 45-85% en el E.
Esta escala podría tener un impacto favorable utilizada como herramienta de triaje, existiendo una ventana de oportunidad para la detección precoz, ajuste de tratamiento o incluso traslado a un centro de referencia para evitar la progresión del SC y mejorar el pronóstico39.
Sin embargo, la escala SCAI todavía presenta controversias por solucionar, como podrían ser la definición de SC normotensivo en el grado B, los puntos de corte de las variables hemodinámicas y de laboratorio utilizadas, el grado de afectación neurológica para introducir el subtipo A en caso de PCR o la utilidad de la escala en otros tipos de shock45.
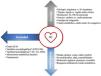
Valoración triaxial de los enfermos en shock cardiogénicoLa revisión de la escala SCAI pone de manifiesto que incluso dentro de cada estadio existen diferentes niveles de gravedad con diferentes pronósticos en función de algunas características del paciente y del cuadro clínico. Estos factores actúan como modificadores del riesgo, por lo que se propone utilizar un modelo de valoración triaxial, donde se tenga en cuenta la gravedad según el estadio SCAI, el fenotipo del shock y los modificadores de riesgo39,45 (fig. 3).
Valoración triaxial de los pacientes en shock cardiogénico (SC).
*Alteraciones ecocardiográficas: fracción de eyección del ventrículo izquierdo (FEVI)<40% y la insuficiencia mitral precoz.
**Alteraciones hemodinámicas: Índice cardíaco (IC)<1,8ml/kg/m2, volumen sistólico indexado (Vsi)<35ml/m2, Cardiac power output (CPO)<0,6W.
VD: ventrículo derecho; VI: ventrículo izquierdo.
El fenotipo del shock se refiere al perfil hemodinámico concreto del paciente. Se define utilizando criterios clínicos, bioquímicos, ecocardiografía y monitorización invasiva, distinguiendo 3 perfiles diferenciados en pronóstico44,46:
- 1.
No congestivo, caracterizado por disfunción izquierda aislada sin congestión y con daño orgánico escaso.
- 2.
Cardiorrenal, caracterizado por disfunción izquierda significativa con daño renal y congestión pulmonar.
- 3.
Cardiometabólico o hemometabólico, donde existe disfunción ventricular derecha, congestión sistémica, acidosis láctica y disfunción multiorgánica.
Utilizando el fenotipo y la escala SCAI la mortalidad progresa desde un 6% en el estadio C no congestivo hasta un 29% en el C cardiometabólico, superando la mortalidad del estadio D no congestivo (17%). También se asocia a peor pronóstico un mayor componente inflamatorio con su correspondiente pérdida de tono vascular periférico. Se ha utilizado en cociente neutrófilo/linfocito (NLR) para estimar la actividad inflamatoria resultando que, siendo el valor en los controles<3,5, la mortalidad se multiplica por 1,05 por cada 3,5 puntos de ascenso de cociente. Los estadios B con inflamación tienen mayor mortalidad que los C sin ella46.
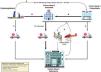
Detección del shock cardiogénicoComo ya se ha descrito, el SC es la forma más grave de IC aguda y se caracteriza por un rápido deterioro que lleva al fracaso multiorgánico secundario a la hipoperfusión tisular. Este proceso puede ser reversible si se identifica precozmente y se instauran las medidas adecuadas14,47. Sin embargo, la detección del SC (fig. 4) puede ser compleja dado que tiene diferentes fases (identificación, evaluación hemodinámica y estratificación), precisando la intervención de diferentes profesionales y/o niveles asistenciales que, en ocasiones, pueden requerir recursos no ubicados en todos los centros que atienden a pacientes críticos48. Como ocurre en otras enfermedades tiempo dependientes (IAM, ictus, trauma y sepsis), para un correcto manejo es necesario establecer criterios de detección precoces y una coordinación intra e interhospitalaria mediante un sistema de código. En este sentido se ha propuesto un modelo de atención en red para el SC, conocido en inglés como Hub and Spoke, en el que, una vez detectado el cuadro, permite de manera rápida adecuar las medidas según las necesidades del paciente (fig. 5). Para ello, es imprescindible una comunicación fluida entre los centros, protocolos consensuados y la presencia de un equipo de transporte cualificado en la atención y traslado de los pacientes en SC49–51. Respecto al centro de referencia (Hub) se obtienen mejores resultados cuando la detección y evaluación se realiza mediante un equipo multidisciplinar (Shock Team) donde están definidos los roles de cada uno de sus miembros (tabla 2), liderado por un especialista en cuidados críticos cardiológicos (Shock-Doc) que coordine las decisiones terapéuticas e intervenga en todo el proceso52–54.
Flujo de pacientes de la red de atención al shock cardiogénico.
A: para lograr la estabilización temprana de un paciente con shock cardiogénico (SC) no asociado a un infarto agudo de miocardio (IAM) diagnosticado fuera del hospital, el paciente puede ser trasladado al hospital de nivel 3 más cercano disponible si el traslado a un centro de nivel 1 o 2 excede los 30minutos, en comparación con el traslado a dicho nivel 3. B: un paciente diagnosticado con SC fuera del entorno hospitalario o que permanece en un centro de nivel 3 debe ser trasladado a un centro de nivel 1 o 2 según los tiempos de traslado, especialmente en el entorno del síndrome coronario agudo. C: un paciente con SC diagnosticado fuera del entorno hospitalario o que permanece en un hospital de nivel 3 puede ser trasladado a un centro de nivel 1 si se anticipa la necesidad de atención de alta complejidad. D: activación del equipo de oxigenación por membrana extracorpórea (ECMO). Una unidad móvil puede ser activada desde el centro de nivel 1 hacia los diferentes centros de referencia disponibles (niveles 2 y 3) si se requiere la implantación de un dispositivo de asistencia circulatoria mecánica de alta complejidad para asegurar un traslado seguro.
PAS: presión arterial sistólica.
Adaptado de Martínez-Sellés et al.50
Miembros y funciones de los componentes del Shock Team
| Miembro del Shock Team | Funciones |
|---|---|
| Extrahospitalaria/urgencias/hospitalización (médico y enfermería responsables) | • Primer contacto con el paciente• Sospecha diagnóstica y manejo inicial• Activación del código SC• Traslados a centros de nivel 2 y 3 |
| UCI cardiológicaIntensivistaEnfermería de críticos | • Coordinación del proceso (Shock-Doc)• Identificación, estratificación y diagnóstico del SC• Tratamiento médico• Seguimiento, planteamiento y decisión precoz del SCM/DAV• Equipo de transporte de pacientes con SCM/DAV (ECMO móvil)• Implante percutáneo de SCM/DAV de corta duración• Monitorización hemodinámica invasiva y soporte orgánico (VM, TCRR)• Control postintervención y postoperatorio• Evaluación neurológica• Evaluación de DAV de larga duración/trasplante cardiaco• Adecuación medidas/ATSV/cuidados al final de la vida/donación de órganos |
| CardiologíaCardiólogo clínicoCardiólogo de insuficiencia cardiaca | • Identificación, estratificación y diagnóstico del SC• Tratamiento médico en cardiología• Seguimiento, planteamiento y decisión precoz del SCM/DAV• Apoyo diagnóstico (ETT/ETE) al implante de SCM/DAV• Seguimiento postintervención y postoperatoria• Evaluación de DAV de larga duración/trasplante cardiaco |
| HemodinámicaHemodinamistaEnfermería intervencionista | • Intervencionismo coronario o estructural• Decisión de implante precoz de SCM/DAV• Implante DAV percutáneo de corta duración• Seguimientos postintervención y retirada de SCM/DAV percutáneos |
| Cirujano cardiovascularEnfermería quirúrgicaAnestesiología | • Decisión del implante precoz de SCM/DAV• Implante percutáneo o quirúrgico de SCM/DAV de corta y media duración• Evaluación de DAV de larga duración/trasplante cardíacoSeguimiento postoperatorio y corrección de complicaciones quirúrgicas• Tratamiento médico, soporte y evaluación hemodinámica durante el implante quirúrgico de DAV y trasplante cardiaco• Evaluación de trasplante cardiaco/DAV de larga duración |
| Equipo de perfusiónEnfermera perfusionista o de cuidados críticos | • Montaje, cebado y conexión de circuito SCM/DAV corta y media duración.• Cambio parcial o total de SCM/DAV de corta y media duración• Traslado intra e interhospitalario (ECMO móvil)• Seguimiento postintervención |
ATSV: adecuación de los tratamientos de soporte vital; DAV: dispositivo de asistencia ventricular; ECMO: membrana de oxigenación extracorpórea; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; SC: shock cardiogénico; SCM: soporte circulatorio mecánico; TCRR: terapia continua de reemplazo renal; VM: ventilación mecánica.
Varias experiencias han demostrado que establecer protocolos de atención basados en la organización de un equipo multidisciplinar con un inicio precoz del SCM, con criterios uniformes y precoces de diagnóstico, reducen la mortalidad asociada al SC50,55,56.
Fase de identificación del paciente en shock cardiogénicoLa detección del SC debe comenzar en el primer contacto médico que presente el paciente, incluido el extrahospitalario, y se debe basar en la constatación de signos clínicos (PAS<90mmHg o PAM<60mmHg, letargia, frialdad, diuresis<30ml/h) y analíticos (lactato sérico>2mmol/l, BNP o NT-proBNP>100 o 300pg/ml, urea y/o creatinina elevados) de hipoperfusión47.
Hay que tener en cuenta que los signos clínicos no son específicos del SC. En ese sentido, pacientes con IC avanzada pueden tener perfiles clínicos y hemodinámicos que emulen el estado de SC sin presentarlo; pacientes hipertensos o en fases precoces del SC donde todavía existe una compensación presora a la hipoperfusión pueden no presentar hipotensión, o en un estado de preshock de alto riesgo puede pasar desapercibido el inminente desarrollo del cuadro shock.
Respecto a los datos analíticos cabe destacar que el lactato, aun siendo un buen indicador del grado de hipoperfusión, de tener un alto valor pronóstico y correlación con el grado de recuperación orgánica y supervivencia, puede verse elevado en otras situaciones (cetoacidosis diabética, traumatismo, insuficiencia hepática, uso de adrenalina, linezolid, propofol…) que deben valorarse en el diagnóstico diferencial57. En el caso del BNP también debemos tener en cuenta que puede verse elevado en una amplia gama de afecciones cardiacas y no cardiacas, y es por ello por lo que se recomienda su realización en casos donde no se dispone un diagnóstico de certeza47. Por otro lado, la troponina puede ser de utilidad para el diagnóstico de SCA. En la tabla 3 se describen las diferentes pruebas diagnósticas a realizar en el paciente en SC.
Pruebas complementarias en pacientes en shock cardiogénico
| Prueba | Momento | Hallazgos | Valor diagnóstico |
|---|---|---|---|
| Lactato | I/D | • ≥2,0mmol/l• ≥5,0mmol/l | • Grado de hipoperfusión/SC |
| ECG | I/D*/A | • Isquemia/lesión miocardio• Trastornos conducción• Arritmias | • SCA• Miocardiopatías• Arritmias |
| Ecocardiograma | I/D*/A | • Función ventricular• Alteraciones segmentarias• Altas presiones VI• Hipertensión pulmonar• Derrame pericárdico• Alteraciones valvulares• Alteraciones mecánicas | • Miocardiopatías• SCA• Miocardiopatía de estrés (Tako-Tsubo)• Congestión pulmonar (EAP)• TEP/congestión• Taponamiento cardiaco• Valvulopatías/endocarditis• CIV/rotura cardiaca/rotura mitral |
| Rx de tóraxEcografía pulmonar | I/D | • Líneas B• Edema alveolar• Infiltrado alveolar• Derrame pleural• Neumotórax | • Congestión pulmonar (EAP)• Infección/neumonía• Insuficiencia cardiaca• Neumotórax |
| Péptidos natriuréticos (BNP, NT-proBNP) | I/A | • BNP>100pg/ml• NT-proBNP>300pg/ml | • Valor predictivo negativo |
| Troponina I | I/Da | • >0,4ng/ml | Daño miocárdico (SCA) |
| Creatinina sérica | I/Da/A | • >1,2mg/dl | Hipoperfusión/SC |
| Iones (sodio, potasio, cloro) | I/Da/A | • Hiponatremia• Hiperpotasemia | Signos de IC crónica |
| Procalcitonina | I | • >0,5ng/ml | • Alto valor predictivo de infección bacteriana |
| TSH | I | • Hipo-hipertiroidismo | |
| Hemograma | I/Da/A | • Anemia | • Signos de IC crónica |
| Estudio de coagulaciónDímero-D | I | • Elevación de tiempos o DD | • Signo de hipoperfusión• DD valor predictivo negativo TEP |
| Gasometría arterial(pH, pO2, pCO2, SatO2) | I/Da | • pH<7,35• Insuficiencia respiratoria (SatO2<90%, pO2<100 mmHg y/o pCO2>45mmHg) | • Hipoperfusión• Congestión pulmonar• Insuficiencia respiratoria |
A: alta; BNP: péptido natriurético tipo B; CIV: comunicación intrventricular; D: durante el ingreso; DD: dímero D; EAP: edema agudo de pulmón; ECG: electrocardiograma; I: ingreso; IC: insuficiencia cardiaca; NT-ProBNP: péptido natriurético tipo B N terminal; pCO2: presión parcial de CO2; pO2: presión parcial de O2; SC: shock cardiogénico; SatO2: saturación arterial de O2; SCA: síndrome coronario agudo; TEP: tromboembolismo pulmonar; TSH: hormona estimulante de la tiroides; VI: ventrículo izquierdo.
Durante todo el proceso de evaluación inicial del SC es imprescindible iniciar un estudio etiológico, que se completará en la siguiente fase, buscando la presencia de una causa precipitante o coexistente potencialmente reversible que se deba tratar de inmediato (código IAM)43,55, o que implique la activación de otras enfermedades tiempo dependientes (código sepsis).
Fase de evaluación hemodinámicaUna vez evidenciados los signos de hipoperfusión es necesario realizar una evaluación estrecha del paciente mediante la monitorización continua del ritmo cardiaco, la frecuencia respiratoria, la saturación de oxígeno, la presión arterial y completar la evaluación etiológica14,58,59. Para ello, se debe realizar un electrocardiograma de 12 derivaciones que pueda demostrar signos de isquemia miocárdica o alteraciones del ritmo cardiaco que justifiquen el cuadro, y un ecocardiograma que identifique posibles causas subyacentes y explique el proceso fisiopatológico asociado43,47. Estas pruebas son imprescindibles y se recomiendan de manera sistemática en la evaluación del paciente en shock, más aún si tenemos en cuenta que si no identificamos y tratamos la causa subyacente el resultado suele ser fatal, pese a que se realice un manejo hemodinámico apropiado del SC60,61.
La evaluación ecocardiográfica inicial, puede establecerse mediante una ecografía a pie de cama62, orientada a realizar un despistaje del tipo de shock presente, realizar una evaluación de la función biventricular, determinar la presencia de enfermedad que condicione el shock (tabla 3) y una primera evaluación hemodinámica que valore la presencia de presiones de llenado ventriculares elevadas14,61. Tras ella, especialmente en casos de empeoramiento progresivo o alto grado SCAI, se debe realizar una evaluación ecocardiográfica (transtorácica o transesofágica) por parte de un experto con competencias avanzadas en ecografía que confirme el cuadro etiológico, evalúe la situación hemodinámica, guie la respuesta a volumen mediante parámetros estáticos y dinámicos61,63,64, ayude a orientar el tratamiento farmacológico y al uso de dispositivos SCM (ECMO) y/o de asistencias ventriculares (balón de contrapulsación, Impella®)65,66. Junto a la evaluación ecocardiográfica, la ecografía pulmonar67 y la radiografía de tórax son de gran utilidad, dado que permiten hacer una evaluación del grado de congestión pulmonar, descartar otras enfermedades que expliquen el cuadro y confirmar la posición de los catéteres y dispositivos cardíacos14.
En casos de inestabilidad hemodinámica y/o progresión del cuadro es recomendable la monitorización arterial invasiva y la inserción de un catéter venoso central que permitan realizar mediciones continuas de presiones, parámetros bioquímicos e iniciar y guiar el tratamiento inicial14,43,68.
Respecto al uso del catéter de la arteria pulmonar para la evaluación inicial del shock es controvertido y probablemente no se debe realizar de manera sistemática, reservándolo para casos seleccionados de pacientes que no respondan a la terapia inicial o en casos en los que sea necesario una mayor precisión en la evaluación del fenotipo de shock para orientar el manejo del paciente12,43.
Fase de estratificaciónComo hemos visto, la estratificación del paciente en SC mediante la escala SCAI y la identificación de los diferentes fenotipos permite una rápida evaluación del riesgo, unifica la comunicación entre grados asistenciales, pudiendo mejorar el pronóstico de los pacientes. Dado que la progresión a lo largo del continuo de los grados SCAI es un proceso dinámico que incorpora nueva información a medida que está disponible, esta fase debe iniciarse desde el primer contacto con el paciente, solapándose en tiempo con las fases de identificación y evaluación hemodinámica (fig. 4).
ConclusionesLos pacientes con SC presentan un riesgo elevado de mortalidad a pesar de los avances terapéuticos. Revertir la hipoperfusión de forma precoz es la piedra angular en el tratamiento de un síndrome heterogéneo en el que las causas no isquémicas han ganado en importancia en los últimos años. La detección precoz y la estratificación pronóstica —basada en la escala SCAI y el reconocimiento de fenotipos específicos— son fundamentales en el manejo del SC. Este enfoque, sumado al modelo de código mediante la fórmula Hub and Spoke permite una atención mediante equipos multidisciplinarios, con protocolos coordinados orientados a la toma de decisiones individualizadas, mejorando la coordinación intra e interhospitalaria, reduciendo la mortalidad.
FinanciaciónNo se recibió financiación para este trabajo y publicación.
AutoríaAl ser un artículo de revisión, todos los autores han contribuido por igual a su redacción. LZ coordinó el documento. Todos los autores han revisado la versión definitiva.
Conflicto de interesesLos autores declaran que no tienen intereses contrapuestos.