Conocer la epidemiología y evolución al alta de los pacientes oncológicos que precisan ingreso en UCI.
DiseñoEstudio descriptivo observacional de datos del registro ENVIN-HELICS combinado con variables registradas específicamente. Se comparan pacientes con y sin neoplasia. Se identifican grupos de pacientes neoplásicos con peor evolución.
ÁmbitoUCI participantes en ENVIN-HELICS del año 2018 con participación voluntaria en el registro oncológico.
PacientesIngresados más de 24horas. Entre estos aquellos diagnosticados de neoplasia en los últimos 5 años.
Variables principalesLas generales epidemiológicas del registro ENVIN-HELICS y variables relacionadas con la neoplasia.
ResultadosEn las 92 UCI con datos completos se seleccionaron 11.796 pacientes, de los que 1.786 (15,1%) son pacientes con neoplasia. La proporción de pacientes con cáncer por unidad fue muy variable (rango: 1-48%). La mortalidad en UCI de los pacientes oncológicos fue superior a los no oncológicos (12,3% versus 8,9%; p<0,001). En pacientes oncológicos predominaron los ingresados en el postoperatorio programado (46,7%) o urgente (15,3%). Los pacientes con proceso patológico médico fueron más graves, con mayor estancia y mortalidad (27, 5%). Aquellos ingresados en UCI por enfermedad no quirúrgica relacionada con el cáncer tuvieron la mortalidad más alta (31,4%).
ConclusiónExiste una gran variabilidad en el porcentaje de pacientes oncológicos en las diferentes UCI. El 46,7% de los pacientes ingresa tras someterse a cirugía programada. La mayor mortalidad corresponde a pacientes con enfermedad médica (27,5%) y a los ingresados por complicaciones relacionadas con el cáncer (31,4%).
To assess the epidemiology and outcome at discharge of cancer patients requiring admission to the Intensive Care Unit (ICU).
DesignA descriptive observational study was made of data from the ENVIN-HELICS registry, combined with specifically compiled variables. Comparisons were made between patients with and without neoplastic disease, and groups of cancer patients with a poorer outcome were identified.
SettingIntensive Care Units participating in ENVIN-HELICS 2018, with voluntary participation in the oncological registry.
PatientsSubjects admitted during over 24hours and diagnosed with cancer in the last 5 years.
Primary endpointsThe general epidemiological endpoints of the ENVIN-HELICS registry and cancer-related variables.
ResultsOf the 92 ICUs with full data, a total of 11,796 patients were selected, of which 1786 (15.1%) were cancer patients. The proportion of cancer patients per Unit proved highly variable (1-48%). In-ICU mortality was higher among the cancer patients than in the non-oncological subjects (12.3% versus 8.9%; P<.001). Elective postoperative (46.7%) or emergency admission (15.3%) predominated in the cancer patients. Patients with medical disease were in more serious condition, with longer stay and greater mortality (27.5%). The patients admitted in ICU due to nonsurgical disease related to cancer exhibited the highest mortality rate (31.4%).
ConclusionsGreat variability was recorded in the percentage of cancer patients in the different ICUs. A total of 46.7% of the patients were admitted after undergoing scheduled surgery. The highest mortality rate corresponded to patients with medical disease (27.5%), and to those admitted due to cancer-related complications (31.4%).
El cáncer es una enfermedad de incidencia creciente y responsable del 25% de la mortalidad global en la población de nuestro país1. La mejora de los tratamientos activos y de cuidados de soporte colaboran en la disminución de la mortalidad asociada al cáncer. De este modo, los pacientes afectados por neoplasias constituyen hoy una población susceptible de ingreso en las unidades de cuidados intensivos, bien sea como parte del tratamiento del cáncer, bien como tratamiento de procesos médicos o quirúrgicos intercurrentes, bien como herramienta clave en el manejo de la toxicidad de los tratamientos oncológicos2.
Esta mejora en la supervivencia obliga a replantearse el papel de la medicina intensiva en este escenario. Distintas asociaciones científicas están interesadas en entender este rol, por lo que se han iniciado contactos entre grupos científicos interesados en el tema3. En nuestro país se firmó un acuerdo de colaboración entre la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) y la Sociedad Española de Oncología Médica (SEOM) por el que se planteó la realización de un registro que proporcione información sobre la epidemiología y los factores relacionados con la mortalidad de los pacientes oncológicos que precisan ingreso en UCI4.
En los últimos años se ha estudiado la supervivencia en UCI de distintos grupos de pacientes oncológicos muy seleccionados5–9 (principalmente hematológicos) y se han hecho recomendaciones sobre las distintas estrategias terapéuticas2,10. También se ha estudiado la evolución de pacientes oncológicos sometidos a determinados procedimientos terapéuticos propios de la medicina intensiva, como ventilación mecánica11–12, oxigenoterapia de alto flujo13, técnicas de depuración extrarrenal14 o incluso sometidos a oxigenación extracorpórea15.
Sin embargo, existen pocos datos epidemiológicos generales sobre el impacto del ingreso de pacientes oncológicos en las UCI. En estudios multicéntricos la proporción de pacientes con neoplasia ingresados en UCI oscila entre el 13% y 20%16–21. No obstante, esta población es enormemente heterogénea, lo que pudiera tener impacto en la atención y cuidados que requieren. Es evidente que la estrecha relación multiprofesional y multidisciplinar es el único camino posible para mejorar el pronóstico de los pacientes críticos con cáncer4,22–26.
El objetivo de este estudio es conocer la epidemiología, los motivos de ingreso, los recursos terapéuticos empleados y la mortalidad de los pacientes con neoplasias malignas según la causa que origine su ingreso en UCI.
Métodos y pacientesSe realiza un estudio observacional tomando como base el registro ENVIN (que denominamos «base ENVIN»). Se incluyeron todos los pacientes ingresados entre el 1 de abril y el 30 de junio del año 2018. Se llevó a cabo una ampliación de datos de pacientes oncológicos asociando una nueva base de datos denominada «base ONCOENVIN». Tres variables comunes (edad, fecha de ingreso y sexo) sirvieron para generar un identificador común que permitió ligar los datos de una base y otra.
Selección de pacientes base ENVINEl registro ENVIN es un registro observacional, de prevalencia de periodo y multicéntrico (nacional) de participación voluntaria. El registro fue desarrollado en 1994 por el Grupo de Estudio de Enfermedades Infecciosas y Sepsis de la SEMICYUC. Su objetivo es registrar la frecuencia y etiología de las infecciones asociadas a dispositivos empleados en la UCI. Adicionalmente se registra el consumo de todos los antimicrobianos empleados durante el periodo de estudio, así como la prevalencia de patógenos multirresistentes relacionados con la colonización e infección en UCI.
Desde el año 1994 la participación voluntaria de distintas UCI ha sido creciente, llegando en el año 2018 a 219 unidades pertenecientes a 185 hospitales. La introducción de datos se hace mediante una aplicación informática disponible en: http://hws.vhebron.net/envin-helics/. El registro ENVIN ha sido aprobado por varios comités de éticos de investigación clínica (CEIC) locales y autonómicos. No se requiere la autorización expresa de los pacientes para la utilización de sus datos, al ser reconocido como un registro de interés para el Sistema Nacional de Salud (año 2014).
Se registró la presencia de neoplasia tanto hematológica como de órgano sólido cuando esta enfermedad fue diagnostica hasta los 5 años previos al ingreso en UCI, o durante el propio ingreso. Solamente en aquellos pacientes que habían activado esta casilla se podía completar los datos de la base ONCOENVIN.
Otros datos recogidos relativos al tamaño de unidades, la metodología del uso de dispositivos y el desarrollo de infecciones se han publicado previamente27–29 y se aportan como material electrónico suplementario.
Selección de pacientes base ONCOENVINPara aquellos pacientes en los que constaba el antecedente de neoplasia (como previa o como diagnóstico durante el ingreso hospitalario) se cumplimentaron de manera voluntaria las variables relacionadas con dicha enfermedad. Se consideró en primer lugar si el ingreso en UCI se debía a causas relacionadas con la neoplasia o no. En cada caso se tuvo en cuenta si la causa de ingreso era para el cuidado postoperatorio inmediato de una cirugía relacionada o no con el cáncer. Entre los pacientes no quirúrgicos se agrupó los pacientes ingresados por complicaciones médicas relacionadas con el cáncer, que incluyeron los siguientes motivos: insuficiencia respiratoria, sepsis/shock séptico, coma, trastornos metabólicos, insuficiencia renal, shock hemorrágico, administración de quimioterapia u otras causas médicas relacionadas con la neoplasia.
En segundo lugar se diferenciaron las neoplasias hematológicas de aquellas de órgano sólido. Las neoplasias hematológicas se separaron en linfomas, leucemias y otro tipo de neoplasias malignas hematológicas. Se registró la localización anatómica de los tumores sólidos. Se estudió asimismo el año en que había sido diagnosticada la neoplasia, excluyendo todos aquellos casos previos al año 2013.
Se tuvo en cuenta el tratamiento antineoplásico que estaban recibiendo los pacientes en el momento del ingreso en UCI. Se clasificaron en tratamiento neoadyuvante (terapia previa al tratamiento principal, generalmente, pero no siempre, quirúrgico), tratamiento adyuvante (tratamiento complementario y posterior al tratamiento principal), tratamiento con intención radical, y tratamiento con primera o sucesivas líneas frente a la enfermedad metastásica. Finalmente agrupamos en tratamiento sintomático a aquellos pacientes a los que no se les administraba ningún tratamiento activo, o que recibieron solo tratamiento de soporte o puramente sintomático (por ejemplo para el dolor).
Por otro lado, también se han registrado los tratamientos especialmente dirigidos frente a neoplasias hematológicas como trasplante alogénico de médula ósea, trasplante autólogo de médula ósea y quimioterapia para leucemia aguda (ya fuera inducción, consolidación o mantenimiento). Finalmente se agrupó en otros tratamientos cuando no se cumplían las definiciones previas, y que puede incluir hormonoterapia, quimioterapia con hipertermia intracavitaria abdominal, así como tratamientos paliativos y que no recibieran ningún tratamiento específico antineoplásico en el momento de su ingreso en UCI.
Durante la estancia del paciente en UCI se registró el desarrollo de neutropenia (menor de 500 neutrófilos por mm3) que no estaba presente al ingreso en UCI, la administración de quimioterapia durante el ingreso en UCI, el síndrome de lisis tumoral según criterios de Cairo y Bishop30, la limitación de los tratamientos de soporte vital (tanto de su retirada como de no inicio de un tratamiento) y el diagnóstico de aspergilosis pulmonar (datos clínicos compatibles más galactomanano sérico o en lavado broncoalveolar o por cultivo de Aspergillus spp. en muestra respiratoria).
Análisis estadísticoAmbas bases, que estaban alojadas en servidores distintos (servidores de Hospital Vall d’Hebron y SEMICYUC respectivamente), fueron fusionadas utilizando el identificador común que no permitía la identificación del paciente. Las variables cualitativas se expresan como porcentaje y las variables cuantitativas como media y desviación estándar o como mediana y rango intercuartílico (p25-p75) cuando la variable no seguía una distribución normal. El análisis bivariante se realizó mediante el test de Chi cuadrado para variables cualitativas y de Mann-Whitney (2 muestras) o Kruskall-Wallis (más de 2 muestras) para las cuantitativas. No se realizó un análisis de los factores relacionados con la mortalidad, pero se estudió la mortalidad en UCI relacionada con el tiempo mediante curvas de Kaplan-Meier aplicadas a la población general y a la diferenciación según el motivo de ingreso y su relación con el cáncer. Se censuró el alta/exitus a los 60 días de estancia en UCI. Para todos los análisis se consideró significativo una p<0,05. El análisis estadístico se realizó mediante el paquete estadístico SPSS de IBM en su versión 23.0.
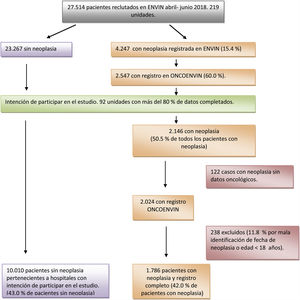
ResultadosEn el año 2018 se registraron en el periodo ENVIN completo (abril-junio) 27.514 pacientes ingresados en alguna de las 219 unidades que participaron ese año en el registro. Un total de 4.247 (15,4%) pacientes cumplían el antecedente de neoplasia. De ellos el 60% de los casos (2.547 pacientes) disponía de los datos completos de la base ONCOENVIN. Puesto que la participación era voluntaria y abierta, se consideró que aquellas unidades que habían introducido en ONCOENVIN menos del 80% de los casos que se habían declarado en ENVIN debían ser excluidos. Hubo 92 unidades que completaron más del 80% de los casos, por lo que sus datos se consideran válidos para el estudio epidemiológico. Ciento veintidós (5,7%) pacientes de estas unidades con intención de participar no tenían los datos oncológicos. Por otro lado, 238 pacientes fueron excluidos por criterios de mala identificación de la fecha de diagnóstico de la neoplasia o por edad inferior a 18 años. Finalmente se estudian 1.786 pacientes con neoplasia y registro completo (42% de los pacientes con neoplasia) frente a 10.010 pacientes sin neoplasia pertenecientes a las unidades con intención de participar (43% de los pacientes sin neoplasia). Por lo tanto, en esta población seleccionada los pacientes oncológicos constituyen el 15,1% del total de pacientes. En la figura 1 se representa el proceso de selección de pacientes para el estudio epidemiológico.
El porcentaje de pacientes oncológicos con respecto al total de ingresos en las 92 unidades seleccionadas es muy variable, con una mediana de 17 pacientes (p25-p75: 10-24,5) por unidad, pero con una proporción que oscila entre el 1% y el 48% de pacientes oncológicos con respecto al total por unidad. Esta variación expresa la diversidad de las características de las UCI participantes, en la que se incluyeron unidades coronarias (con un porcentaje de pacientes oncológicos obviamente muy bajo) y unidades posquirúrgicas de pequeño tamaño con porcentajes de pacientes oncológicos muy elevados. En conjunto, el 87% de las unidades se consideraban polivalentes, con un 3,3% de unidades exclusivamente posquirúrgicas y la misma proporción de unidades de pacientes traumatizados. Había una distribución geográfica uniforme, estando representadas todas las comunidades autónomas y un total de 38 provincias.
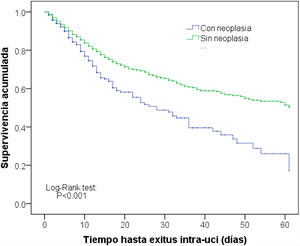
En comparación con los pacientes sin neoplasia, aquellos que tuvieron entre sus antecedentes próximos el diagnóstico de neoplasia fueron en general pacientes mayores, procedentes de plantas de hospitalización, con predominio de antecedente quirúrgico, con mayor gravedad al ingreso, con estancia más corta y con una mortalidad en UCI mayor (12,3% versus 8,5%; p<0,001). Estos datos se muestran en la tabla 1. Las curvas de Kaplan-Meier que reflejan la diferencia temporal de la supervivencia se muestran en la figura 2 (Log-Rank test p<0,001).
Comparativa de pacientes con neoplasia y sin neoplasia ingresados en las unidades seleccionadas
| Variable | Neoplasia | No neoplasia | Valor de p |
|---|---|---|---|
| n=1786 | n=10010 | ||
| (15,1%) | (84,9%) | ||
| Sexo | |||
| Hombres | 1170 (65,5) | 6254 (62,5) | 0,015 |
| Mujeres | 616 (34,5) | 3756 (37,5) | |
| Edad | |||
| Media (DE) | 65,2 (12,5) | 63,2 (15,7) | 0.001 |
| Tamaño hospital | |||
| >500 camas | 900 (50,4) | 5666 (56,6) | <0,001 |
| 200-500 camas | 712 (39,9) | 3426 (34,2) | |
| <200 camas | 174 (9,7) | 918 (9,2) | |
| Origen paciente | |||
| Unidad hospitalización | 1122 (62,8) | 3692 (36,9) | <0,001 |
| Otra UCI | 27 (1,5) | 271 (2,7) | |
| Comunidad | 630 (35,3) | 5941 (59,4) | |
| Institución sociosanitaria | 7 (0,4) | 106 (1,1) | |
| Enfermedad de base | |||
| Coronaria | 79 (4,4) | 1983 (19,8) | <0,001 |
| Médica | 585 (32,8) | 4882 (48,8) | |
| Cirugía programada | 834 (46,7) | 1558 (15,6) | |
| Cirugía urgente | 273 (15,3) | 887 (8,9) | |
| Traumatismo | 15 (0,8) | 700 (7,0) | |
| Cirugía previa al ingreso | 1.130 (63,3) | 2866 (28,6) | <0,001 |
| APACHE II (n=1.639/9.186) | |||
| Media (DE) | 14,9 (7,6) | 14,2 (8,0) | <0,001 |
| SAPS 2 (n=528/3534) | |||
| Media (DE) | 40,2 (19,9) | 36,4 (17,2) | <0,001 |
| Diagnósticos por aparatos | |||
| Cardiocirculatorio | 388 (21,7) | 4985 (50) | <0,001 |
| Respiratorio | 349 (19,5) | 1175 (11,8) | |
| Digestivo | 597 (33,4) | 877 (8,8) | |
| Neurológico | 61 (3,4) | 1438 (14,4) | |
| Renal/genitourinario | 139 (7,7) | 150 (1,5) | |
| Metabólico | 9 (0,5) | 123 (1,2) | |
| Hematológico | 15 (0,8) | 18 (0,1) | |
| Traumatológico | 147 (8,2) | 917 (9,2) | |
| Trasplantes | 14 (0,7) | 109 (1) | |
| Otros | 66 (3,6) | 161 (1,6) | |
| Comorbilidades | |||
| Neutropenia previa al ingreso | 96 (5,4) | 50 (0,5) | <0,001 |
| Diabetes | 352 (19,7) | 2513 (25,1) | <0,001 |
| Insuficiencia renal | 172 (9,6) | 1102 (11,0) | 0,084 |
| Inmunosupresión | 259 (14,5) | 499 (5,0) | <0,001 |
| Cirrosis | 54 (3,0) | 316 (3,2) | 0,766 |
| EPOC | 203 (11,4) | 1225 (12,2) | 0,298 |
| Desnutrición | 214 (12,0) | 530 (5,3) | <0,001 |
| Trasplante | 13 (0,7) | 126 (1,3) | 0,055 |
| Dispositivos empleados durante el ingreso | |||
| Catéter venoso central. | 1.409 (78,9) | 5808 (58,0) | <0,001 |
| Ventilación mecánica invasiva | 751 (42,0) | 3729 (37,3) | <0,001 |
| Sonda vesical | 1.649 (92,3) | 7267 (72,6) | <0,001 |
| Derivación ventricular | 19 (1,1) | 157 (1,6) | 0,105 |
| Depuración extrarrenal | 76 (4,3) | 467 (4,7) | 0,446 |
| Nutrición parenteral | 240 (13,4) | 424 (4,2) | <0,001 |
| ECMO | 1 (0,1) | 18 (0,2) | 0,342 |
| Pacientes con infecciones nosocomiales | |||
| Neumonía asociada a ventilación mecánica | 29 (1,6) | 145 (1,4) | 0,572 |
| Infección urinaria asociada a sondaje vesical | 11 (0,6) | 151 (1,5) | 0,003 |
| Bacteriemia de foco desconocido | 8 (0,4) | 42 (0,4) | 0,865 |
| Bacteriemia secundaria a catéter | 8 (0,4) | 73 (0,7) | 0,185 |
| Bacteriemia secundaria a otros focos | 20 (1,1) | 72 (0,7) | 0,076 |
| Cirugía urgente durante el ingreso | 226 (12,7) | 894 (8,9) | <0,001 |
| Estancia en UCI | |||
| Media (DE) | 6,26 (7,7) | 6,74 (8,5) | <0,001 |
| Exitus | 220 (12,3) | 890 (8,9) | <0,001 |
APACHE: Acute Physiology, Age and Chronic Health Evaluation; DE: desviación estándar; ECMO: oxigenación por membrana extracorpórea; EPOC: enfermedad pulmonar obstructiva crónica; SAPS: Simplified Acute Physiology Score.
Por hacer una aproximación hacia el tipo de paciente ingresado en UCI, y teniendo en cuenta la prevalencia de pacientes quirúrgicos entre los pacientes oncológicos, se ha hecho una distribución según los pacientes tuvieran proceso patológico médico (n=585), o fueran ingresados tras cirugía programada (n=834) o tras cirugía urgente (n=273). Se excluyen los pacientes coronarios y traumatológicos por su escasa representación (5,2% en conjunto) y por no tener influencia para el objetivo del estudio. En general, los pacientes con enfermedad de base médica fueron más graves, con mayores porcentajes de comorbilidades y de complicaciones infecciosas y con una mortalidad significativamente mayor (27%) que los pacientes quirúrgicos programados (2%) o quirúrgicos urgentes (13,2%). El resto de las características diferenciales puede observarse en la tabla 2. Obviamente, los pacientes hematológicos ingresaron con mayor frecuencia por causas médicas (89,6%) que por causas quirúrgicas programadas (3,3%) o urgentes (7,1%). Por el contrario, los pacientes con neoplasia de órganos sólidos ingresaron más por causas quirúrgicas en conjunto (72,1%) que médicas (27,9%).
Análisis comparativo entre pacientes con neoplasia según la enfermedad de base que motiva el ingreso en UCI. Se excluyen pacientes coronarios y traumatológicos
| Variable | Médican=585(34,6%) | Quirúrgica programada n=834(49,3%) | Quirúrgica urgente n=273(16,1%) | Valor de p |
|---|---|---|---|---|
| Sexo | ||||
| Hombre | 395 (67,5) | 514 (61,6) | 184 (67,4) | 0,042 |
| Mujer | 190 (32,5) | 320(38,4) | 89 (32,6) | |
| Edad (años) | ||||
| Media (DE) | 64,3 (12,6) | 64,7 (12,3) | 67,0 (13,5) | 0,003 |
| Tamaño del hospital | ||||
| >500 | 359 (61,4) | 386 (46,3) | 111 (40,7) | <0,001 |
| 200-500 | 189 (32,3) | 347 (41,6) | 131 (48,0) | |
| <200 | 37 (6,3) | 101 (12,1) | 31 (11,4) | |
| Origen paciente | ||||
| Hospitalización | 369 (63,1) | 513 (61,5) | 207 (75,8) | <0,001 |
| Otra UCI | 13 (2,2) | 6 (0,7) | 7 (2,6) | |
| Comunidad | 200 (34,2) | 312 (37,4) | 58 (21,2) | |
| Institucionalizado | 3 (0,5) | 3 (0,4) | 1 (0,4) | |
| Cirugía previa al ingreso | 87 (14,9) | 749 (89,8) | 259 (94,9) | <0,001 |
| APACHE II (n=530/760/258) | ||||
| Mediana (p25-p75) | 18,5 (14-24) | 10,0 (7-14) | 16,0 (12-22) | <0,001 |
| SAPS 2 (n=200/224/81) | ||||
| Mediana (p25-p75) | 47,0 (37-61,5) | 25,0 (18-34) | 49 (39-61) | <0,001 |
| Comorbilidades | ||||
| Neutropenia previa al ingreso | 84 (14,4) | 1 (0,1) | 10 (3,7) | <0,001 |
| Diabetes | 135 (23,1) | 133 (15,9) | 56 (20,5) | 0,003 |
| Insuficiencia renal | 74 (12,6) | 45 (5,4) | 34 (12,5) | <0,001 |
| Inmunosupresión | 181 (30,9) | 43 (5,2) | 25 (9,2) | <0,001 |
| Cirrosis | 18 (3,1) | 20 (2,4) | 12 (4,4) | 0,234 |
| EPOC | 80 (13,7) | 84 (10,1) | 18 (6,6) | 0,005 |
| Desnutrición | 85 (14,5) | 63 (7,6) | 60 (22,0) | <0,001 |
| Trasplante | 3 (0,5) | 3 (0,4) | 6 (2,2) | 0,006 |
| Dispositivos empleados durante el ingreso | ||||
| Catéter venoso central | 465 (79,5) | 645 (77,3) | 255 (93,4) | <0,001 |
| Ventilación mecánica invasiva | 244 (41,7) | 284 (34,1) | 200 (73,3) | <0,001 |
| Sonda vesical | 520 (88,9) | 804 (96,4) | 266 (97,4) | <0,001 |
| Derivación ventricular | 5 (0,9) | 11 (1,3) | 3 (1,1) | 0,716 |
| Depuración extrarrenal | 40 (6,8) | 11 (1,3) | 21 (7,7) | <0,001 |
| Nutrición parenteral | 65 (11,1) | 65 (7,8) | 101 (37,0) | <0,001 |
| ECMO | 0 | 0 | 1 (0,4) | 0,075 |
| Pacientes con infecciones nosocomiales | ||||
| Neumonía asociada a ventilación mecánica | 19 (3,2) | 6 (0,7) | 3 (1,1) | 0,001 |
| Infección urinaria asociada a sondaje vesical | 5 (0,9) | 1 (0,1) | 4 (1,5) | 0,025 |
| Bacteriemia de foco desconocido | 3 (0,5) | 2 (0,2) | 2 (0,7) | 0,490 |
| Bacteriemia secundaria a catéter | 3 (0,5) | 2 (0,2) | 3 (1,1) | 0,196 |
| Bacteriemia secundaria a otros focos | 11 (1,9) | 5 (0,6) | 3 (1,1) | 0,079 |
| Cirugía urgente durante el ingreso | 36 (6,2) | 35 (4,2) | 144 (52,7) | <0,001 |
| Número de antibióticos recibidos en UCI por paciente | ||||
| Mediana (p25-p75) | 2 (1-4) | 1 (0-1) | 2 (1-3) | <0,001 |
| Estancia en UCI | ||||
| Medina (p25-p75) | 5 (3-9) | 3 (2-4) | 5 (3-10) | <0,001 |
| Exitus | 161 (27,5) | 17 (2,0) | 36 (13,2) | <0,001 |
| Motivo de ingreso en relación con el cáncer | ||||
| Relacionado con el cáncer | 362 (62,0) | 786 (94,2) | 209 (76,6) | <0,001 |
| No relacionado con el cáncer | 222 (38,0) | 48 (5,8) | 64 (23,4) | |
| Localización del cáncer | ||||
| Cabeza y cuello | 37 (6,3) | 80 (9,6) | 13 (4,8) | <0,001 |
| Colon/recto | 75 (12,8) | 170 (20,4) | 119 (43,6) | |
| Hígado/biliar/páncreas | 29 (5,0) | 99 (11,9) | 18 (6,6) | |
| Otros digestivo | 30 (5,1) | 62 (7,4) | 26 (9,5) | |
| Broncopulmonar | 88 (15,0) | 74 (8,9) | 6 (2,2) | |
| Renal/urinario | 76 (13,0) | 144 (14,3) | 37 (13,6) | |
| Ginecológico femenino | 43 (7,4) | 68 (8,2) | 26 (9,5) | |
| Sistema nervioso central | 17 (2,9) | 105 (12,6) | 10 (3,7) | |
| Leucemia | 52 (8,9) | 0 | 2 (0,7) | |
| Linfoma | 72 (12,3) | 3 (0,4) | 6 (2,2) | |
| Otros hematológicos | 39 (6,7) | 3 (0,4) | 5 (1,8) | |
| Otros tipos de cáncer OS | 27 (4,6) | 26 (3,1) | 5 (1,8) | |
| Año de diagnóstico del cáncer | ||||
| 2013 | 31 (5,3) | 11 (1,3) | 7 (2,6) | <0,001 |
| 2014 | 42 (7,2) | 32 (3,8) | 8 (2,9) | |
| 2015 | 43 (7,4) | 36 (4,3) | 15 (5,5) | |
| 2016 | 45 (7,7) | 43 (5,2) | 22 (8,1) | |
| 2017 | 142 (24,3) | 158 (18,9) | 43 (15,8) | |
| 2018 | 282 (48,2) | 554 (66,4) | 178 (65,2) | |
| Tratamiento oncológico del paciente al ingreso en UCI | ||||
| Pendiente de iniciar tratamiento | 136 (23,3) | 390 (46,8) | 119 (43,6) | <0,001 |
| Tratamiento neoadyuvante | 33 (5,7) | 167 (20,0) | 29 (10,6) | |
| Tratamiento adyuvante | 56 (9,6) | 50 (6,0) | 17 (6,2) | |
| Tratamiento con QT-RT e intención radical | 73 (12,5) | 29 (3,5) | 15 (5,5) | |
| Tratamiento de enfermedad metastásica | 45 (7,7) | 20 (2,4) | 9 (3,3) | |
| Tratamiento sintomático | 57 (9,8) | 45 (5,4) | 25 (9,2) | |
| Trasplante de médula ósea alogénico | 9 (1,5) | 0 | 0 | |
| Trasplante de médula ósea autólogo | 9 (1,5) | 0 | 0 | |
| Quimioterapia para leucemia aguda | 41 (7,0) | 12 (1,4) | 2 (0,7) | |
| Otros | 125 (21,4) | 121(14,5) | 57 (20,9) | |
| Desarrollo de neutropenia en UCI | 69 (11,8) | 2 (0,2) | 7 (2,6) | <0,001 |
| Quimioterapia en UCI | 27 (4,6) | 1 (0,1) | 1 (0,4) | <0,001 |
| Síndrome de lisis tumoral | 13 (2,2) | 0 | 0 | <0,001 |
| Limitación de tratamientos de soporte vital | 82 (14,0) | 6 (0,7) | 10 (3,7) | <0,001 |
| Probable aspergilosis | 13 (2,2) | 1 (0,1) | 1 (0,4) | <0,001 |
APACHE: Acute Physiology, Age and Chronic Health Evaluation; DE: desviación estándar; ECMO: oxigenación por membrana extracorpórea; EPOC: enfermedad pulmonar obstructiva crónica; OS: órgano sólido; p25-p75: percentiles 25 y 75; QT-RT: quimioterapia-radioterapia; SAPS: Simplified Acute Physiology Score.
Otra forma de abordaje epidemiológico es tener en cuenta el motivo de ingreso en relación con la propia neoplasia. Se dividen en 3 grupos: no relacionado con el cáncer (NRC) n=400; posquirúrgico relacionado con el cáncer (PRC) n=1.006 y complicaciones médicas relacionadas con el cáncer (CMRC) n=379, con la inclusión de pacientes según lo descrito en la metodología. Este último grupo estuvo formado por pacientes más jóvenes, de mayor gravedad, con enfermedad de base predominantemente médica y con un porcentaje alto de utilización de dispositivos como ventilación mecánica (46,2%) o depuración extrarrenal (9,2%). En la tabla 3 se describe las características de estos pacientes, incluyendo localización de la neoplasia, el año del diagnóstico del cáncer y el tratamiento antineoplásico recibido, destacando la ausencia de tratamiento hasta el momento del ingreso en la mayoría de pacientes PRC (49,5%). Por el contrario, haber recibido otros tratamientos distintos a los grupos anteriores es más frecuente en aquellos pacientes ingresados por motivos NRC (41,5%). La neutropenia durante el ingreso, la quimioterapia en UCI o el síndrome de lisis tumoral son más frecuentes en pacientes ingresados por CMRC. En este último grupo es llamativa la proporción de pacientes en los que se lleva a cabo alguna forma de limitación del esfuerzo terapéutico (17,2%) frente a los otros grupos (NRC: 5,8% y PRC: 1,5%; p<0,001). Una probable aspergilosis se diagnosticó en el 2,9% de los pacientes ingresados por CMRC.
Análisis comparativo entre pacientes con neoplasia según el motivo de ingreso en UCI
| Variable | No relacionado con el cáncer(n=400)22,4% | Posquirúrgico relacionado con el cáncer (n=1006)56,4% | Relacionado con complicaciones médicas del cáncer (n=379)21,2% | Valor de p |
|---|---|---|---|---|
| Sexo | ||||
| Hombre | 281 (70,3) | 639 (63,5) | 250 (66,0) | 0,056 |
| Mujer | 119 (29,8) | 367 (36,5) | 129 (34,0) | |
| Edad (años) | ||||
| Media (DE) | 69,0 (11,5) | 65,2 (12,2) | 61,4 (13,3) | <0,001 |
| Tamaño del hospital | ||||
| >500 | 218 (54,4) | 456 (45,3) | 225 (59,4) | <0,001 |
| 200-500 | 146 (36,5) | 429 (42,6) | 137 (36,1) | |
| <200 | 36 (9,1) | 121 (12,0) | 17 (4,5) | |
| Origen paciente | ||||
| Hospitalización | 220 (55,0) | 652 (64,8) | 249 (65,7) | <0,001 |
| Otra UCI | 4 (1,0) | 10 (1,0) | 13 (3,4) | |
| Comunidad | 173 (43,3) | 341 (33,9) | 116 (30,6) | |
| Institucionalizado | 3 (0,8) | 3 (0,3) | 1 (0,3) | |
| Cirugía previa al ingreso | 151 (37,8) | 910 (90,5) | 69 (18,2) | <0,001 |
| APACHE II (n=369/921/349) | ||||
| Mediana (p25-p75) | 16 (11-21) | 11 (8-16) | 19 (15-24) | <0,001 |
| SAPS 2 (n=124/274/130) | ||||
| Mediana (p25-p75) | 46 (32,5-61) | 28 (19-40) | 48 (37-63) | 0,001 |
| Enfermedad de basea | ||||
| Médica | 254 (69,4) | 0 | 331 (90,4) | <0,001 |
| Quirúrgica programada | 48 (13,1) | 781 (81,9) | 5 (1,4) | |
| Quirúrgica urgente | 64 (17,5) | 173 (18,1) | 36 (9,8) | |
| Comorbilidades | ||||
| Neutropenia previa al ingreso | 17 (4,3) | 4 (0,4) | 74 (19,5) | <0,001 |
| Diabetes | 120 (30,0) | 162 (16,1) | 70 (18,5) | <0,001 |
| Insuficiencia renal | 61 (15,3) | 72 (7,2) | 39 (10,3) | <0,001 |
| Inmunosupresión | 63 (15,8) | 64 (6,4) | 131 (34,6) | <0,001 |
| Cirrosis | 17 (4,3) | 30 (3,0) | 7 (1,8) | 0,146 |
| EPOC | 66 (16,5) | 96 (9,5) | 41 (10,8) | 0,001 |
| Desnutrición | 42 (10,5) | 102 (10,1) | 70 (18,5) | <0,001 |
| Trasplante | 3 (0,8) | 9 (0,9) | 1 (0,3) | 0,468 |
| Dispositivos empleados durante el ingreso | ||||
| Catéter venoso central | 263 (65,8) | 816 (81,1) | 329 (86,8) | <0,001 |
| Ventilación mecánica invasiva | 155 (38,8) | 420 (41,7) | 175 (46,2) | <0,001 |
| Sonda vesical | 325 (81,3) | 976 (97,0) | 347 (91,6) | <0,001 |
| Derivación ventricular | 6 (1,5) | 12 (1,2) | 1 (0,3) | 0,203 |
| Depuración extrarrenal | 16 (4,0) | 25 (2,5) | 35 (9,2) | <0,001 |
| Nutrición parenteral | 45 (11,3) | 143 (14,2) | 52 (13,7) | 0,334 |
| ECMO | 0 | 0 | 1 | 0,158 |
| Pacientes con Infecciones nosocomiales | ||||
| Neumonía asociada a ventilación mecánica | 7 (1,8) | 9 (0,9) | 12 (3,2) | 0,010 |
| Infección urinaria asociada a sondaje vesical | 4 (1,0) | 2 (0,2) | 5 (1,3) | 0,032 |
| Bacteriemia de foco desconocido | 2 (0,5) | 5 (0,5) | 1 (0,3) | 0,833 |
| Bacteriemia secundaria a catéter | 2 (0,5) | 3 (0,3) | 3 (0,8) | 0,465 |
| Bacteriemia secundaria a otros focos | 3 (0,8) | 9 (0,9) | 7 (1,8) | 0,240 |
| Cirugía urgente durante el ingreso | 46 (11,5) | 138 (13,7) | 42 (11,1) | 0,308 |
| Número de antibióticos recibidos en UCI por paciente | ||||
| Mediana (p25-p75) | 1,0 (0-2) | 1,0 (1 -3) | 3 (1-4) | <0,001 |
| Estancia en UCI | ||||
| Mediana (p25-p75) | 4 (3-7) | 3 (2-5) | 5 (3-10) | <0,001 |
| Exitus | 51 (12,8) | 50 (5,0) | 119 (31,4) | <0,001 |
| Motivo de ingreso en relación con el cáncer | ||||
| Otros motivos no relacionados | 282 (70,5) | |||
| Posquirúrgicono relacionado | 118 (29,5) | |||
| Postquirúrgico relacionado | 1.006 (100) | |||
| Coma | 17 (4,5) | |||
| Fracaso renal agudo | 12 (3,2) | |||
| Insuficiencia respiratoria | 146 (38,5) | |||
| Sepsis/shock séptico | 138 (36,4) | |||
| Shock hemorrágico | 22 (5,8) | |||
| Otros motivos relacionados | 44 (11,5) | |||
| Localización del cáncer | ||||
| Cabeza y cuello | 24 (6,0) | 85 (8,4) | 13 (4,8) | <0,001 |
| Colon/recto | 83 (20,8) | 258 (25,6) | 119 (43,6) | |
| Hígado/biliar/páncreas | 15 (3,8) | 119 (11,8) | 18 (6,6) | |
| Otros digestivo | 16 (4,0) | 89 (8,8) | 26 (9,5) | |
| Broncopulmonar | 37 (9,3) | 77 (7,7) | 6 (2,2) | |
| Renal/urinario | 112 (28,0) | 150 (14,9) | 37 (13,6) | |
| Ginecológico femenino | 40 (10,0) | 78 (7,8) | 26 (9,5) | |
| Sistema nervioso central | 8 (1,8) | 112 (11,1) | 10 (3,7) | |
| Leucemia | 7 (1,8) | 2 (0,2) | 2 (0,7) | |
| Linfoma | 21 (5,3) | 5 (0,5) | 6 (2,2) | |
| Otros hematológicos | 20 (5,0) | 0 | 5 (1,8) | |
| Otros tipos de cáncer OS | 17 (4,3) | 31 (3,1) | 5 (1,8) | |
| Año de diagnóstico del cáncer | ||||
| 2013 | 40 (10,0) | 9 (0,9) | 11 (2,9) | <0,001 |
| 2014 | 47 (11,8) | 31 (3,1) | 12 (3,2) | |
| 2015 | 53 (13,3) | 34 (3,4) | 14 (3,7) | |
| 2016 | 57 (14,3) | 47 (4,7) | 21 (5,5) | |
| 2017 | 107 (26,8) | 170 (16,9) | 93 (24,5) | |
| 2018 | 96 (24,0) | 715 (71,1) | 228 (60,2) | |
| Tratamiento oncológico del paciente al ingreso en UCI | ||||
| Pendiente de iniciar tratamiento | 67 (16,8) | 498 (49,5) | 103 (27,2) | <0,001 |
| Tratamiento neoadyuvante | 12 (3,0) | 189 (18,8) | 32 (8,4) | |
| Tratamiento adyuvante | 36 (9,0) | 54 (5,4) | 42 (11,1) | |
| Tratamiento con QT-RT e intención radical | 30 (7,5) | 34 (3,4) | 57 (15,0) | |
| Tratamiento de enfermedad metastásica | 10 (2,5) | 35 (2,5) | 42 (11,1) | |
| Tratamiento sintomático | 71 (17,8) | 56 (5,6) | 17 (4,5) | |
| Trasplante de médula ósea alogénico | 1 (0,3) | 1 (0,1) | 7 (1,8) | |
| Trasplante de médula ósea autólogo | 1 (0,3) | 0 | 8 (2,1) | |
| Quimioterapia para leucemia aguda | 6 (1,5) | 14 (1,4) | 36 (9,5) | |
| Otros | 166 (41,5) | 135 (13,4) | 35 (9,2) | |
| Desarrollo de neutropenia en UCI | 6 (1,5) | 6 (0,6) | 67 (17,7) | <0,001 |
| Quimioterapia en UCI | 1 (1,3) | 2 (0,2) | 25 (6,6) | <0,001 |
| Síndrome de lisis tumoral | 0 | 0 | 13 (3,4) | <0,001 |
| Limitación de tratamientos de soporte vital | 23 (5,8) | 15 (1,5) | 65 (17,2) | <0,001 |
| Probable aspergilosis | 1 (0,3) | 2 (0,2) | 11 (2,9) | <0,001 |
APACHE: Acute Physiology, Age and Chronic Health Evaluation; DE: desviación estándar; ECMO: oxigenación por membrana extracorpórea; EPOC: enfermedad pulmonar obstructiva crónica; OS: órgano sólido; p25-p75: percentiles 25 y 75; QT-RT: quimioterapia-radioterapia; SAPS: Simplified Acute Physiology Score.
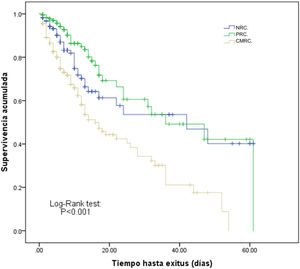
La estancia en UCI de los pacientes ingresados por CMRC fue superior a los otros grupos, así como la mortalidad en UCI (31,4%), que fue significativamente más alta que la de los pacientes ingresados por NRC (12,8%) o PRC (5%) (p<0,001). Desde el punto de vista de la supervivencia global los pacientes ingresados por CMRC se diferenciaron claramente de los otros 2 grupos (Log-Rank test<0,001) como se observa en las curvas de Kaplan-Meier que se representan en la figura 3.
Curvas de Kaplan-Meier de supervivencia entre pacientes según el motivo de ingreso y su relación con el cáncer.
CMRC: motivo de ingreso complicaciones médicas relacionadas con el cáncer; NRC: motivo de ingreso no relacionado con el cáncer; PRC: motivo de ingreso posquirúrgico relacionado con el cáncer.
En el presente trabajo se describe por primera vez en España la epidemiología de los pacientes con neoplasia de órgano sólido o hematológica que requieren ingreso en las UCI. Un 15% de los pacientes ingresados en UCI padecen una neoplasia, pero es remarcable la diversidad en esta proporción dependiendo del tipo de unidad, lo que representa la heterogeneidad de las unidades de críticos españolas. La realización de este estudio multicéntrico, tomando como base las unidades participantes en el registro ENVIN, ha permitido obtener una imagen muy precisa del case-mix de los pacientes con neoplasia ingresados en las UCI, tanto por el número de unidades participantes como por la distribución geográfica. Ninguna de las UCI participantes era una unidad monográfica de pacientes con cáncer. El carácter multicéntrico y voluntario del registro ha condicionado que no todas las UCI participantes en el registro ENVIN hayan completado los datos de los pacientes oncológicos y no se hayan registrado todos los pacientes posibles. La utilización de un criterio arbitrario de tener el registro completo de al menos el 80% de los pacientes con neoplasia reduce el número de UCI participantes, pero en nuestra opinión nos acerca bastante a la realidad epidemiológica de los pacientes oncológicos que requieren ingreso en UCI en nuestro país.
Aunque no es el objetivo de este estudio analizar los factores relacionados con la mortalidad (que será analizado en otro artículo), el fallecimiento en UCI de los pacientes con neoplasia es significativamente superior al de los pacientes sin neoplasia (12,3% versus 8,5%; p<0,001). Sin embargo, por la heterogeneidad de los pacientes oncológicos el dato dice poco sobre las causas que influyen en ella. Las curvas de Kaplan-Meier reflejan bien la diferencia de mortalidad, pero no representan más que un momento (la estancia en UCI) de la evolución de la enfermedad neoplásica, por lo que se les debe dar el valor real que tienen en relación con el número de altas de UCI de pacientes vivos. No se dispone de datos de mortalidad hospitalaria (por no ser obligatorio para el registro ENVIN).
Entre los pacientes con neoplasia, los que ingresan para cuidado postoperatorio constituyen el 62% del total, el mismo porcentaje que el encontrado en la serie europea derivada del estudio SOAP16, y similar a los estudios multicéntricos holandés18 y brasileño19 (56% y 64% respectivamente). En este grupo de pacientes, igual que lo que ocurre en el conjunto de los pacientes críticos29, se diferencian aquellos ingresados en el postoperatorio de forma programada (menor gravedad, estancia y mortalidad) de aquellos ingresados tras cirugía urgente, que son pacientes con mayor gravedad, estancia y mortalidad que es intermedia entre los quirúrgicos programados y los pacientes con enfermedad de base médica. Algunos autores optan por estudiar solamente aquellos pacientes que ingresan de manera no programada, lo que permite una cierta unificación del case-mix17,20, si bien la diferenciación entre pacientes médicos (40,7%) y quirúrgicos urgentes (59,3%) sigue siendo manifiesta, con peor pronóstico de los primeros.
Los pacientes ingresados por causa médica (que suponen el 34,6% de todos los pacientes con cáncer) constituyen un grupo muy heterogéneo, con diferencias entre aquellos que padecen una neoplasia de órgano sólido (72,1%) de los que padecen una neoplasia hematológica (27, 9%). La proporción de pacientes hematológicos ingresados en las UCI en nuestro país es mayor que la encontrada en otras series, que oscila entre el 14,6% y el 17%16,19.
La mortalidad de los pacientes oncológicos médicos (27,5%) es claramente superior a los otros 2 grupos (2% y 13,2% para quirúrgicos programados y urgentes respectivamente), lo que también ha sido descrito en otras series epidemiológicas19. La mortalidad en UCI en la serie multicéntrica holandesa17 fue 30,4% para pacientes médicos y 16,2% para los pacientes quirúrgicos. Por otro lado, es llamativo que la proporción de pacientes en los que se ha realizado una estrategia de limitación del esfuerzo terapéutico es claramente superior (14%) en el grupo de pacientes médicos frente a los otros grupos de pacientes, lo que identifica una población de pacientes más compleja y con enfermedad aguda más grave. Sería interesante estudiar la influencia que tiene el estadio de la enfermedad neoplásica en esta decisión.
Tiene interés describir cuáles son los motivos de ingreso en UCI y su relación con el cáncer. Entre los pacientes quirúrgicos esta relación es alta (94,2% de los programados y 76,6% de los urgentes), mientras que entre los pacientes médicos esta relación es menor, con un alto porcentaje de pacientes que ingresan por motivos no directamente relacionados con el cáncer (38%) y que representan los procesos intercurrentes, que ocurren tanto en el paciente oncológico como en la población no oncológica.
La insuficiencia respiratoria (38,5%) y la sepsis/shock séptico (36,4%) son las causas más frecuentes de ingreso en UCI por CMRC. Este dato no es sorprendente, puesto que el empleo de ventilación mecánica invasiva es más frecuente en este grupo de pacientes, y probablemente lo sea el empleo de vasopresores (que no se ha registrado en este estudio), pero es común en las series publicadas16,19,21. El conjunto de los pacientes que ingresan por motivos relacionados con el cáncer tiene una mortalidad del 31,4%, lo que demuestra la importancia de los fallos orgánicos en la evolución de estos pacientes, que constituyen un subgrupo de pacientes especiales por su elevada mortalidad y consumo de recursos y sobre los que se debate acerca de la posible futilidad de su ingreso.
Con respecto al tratamiento oncológico recibido antes del ingreso en UCI, es llamativo el alto porcentaje de tratamientos sintomáticos (17,8%) u otros tratamientos (41,5%) entre aquellos pacientes que ingresan por motivos no relacionados con el cáncer. Es posible que estos pacientes estén encuadrados en 2 extremos, aquellos que reciben tratamientos paliativos o aquellos libres de enfermedad activa y que no estén recibiendo tratamientos específicos e ingresen en UCI por motivos bien distintos.
Las limitaciones de esta investigación son varias: valorar el estadio de la neoplasia y evaluar la influencia a la hora de tomar o no decisiones terapéuticas resulta complejo. Aunque se ha intentado abarcar todas las posibilidades terapéuticas como una continuidad desde el paciente pendiente de inicio de tratamiento hasta el tratamiento de la enfermedad metastásica, este aspecto no es fácil de definir en el momento puntual que significa el ingreso en UCI. Quizá definiciones más sencillas para el tipo de cáncer (local o metastásico para neoplasias de órgano sólido; alto o bajo grado de malignidad para las hematológicas) hubiera permitido agrupar más los pacientes y analizarlos más fácilmente19, pero siempre quedaría un porcentaje de pacientes en los que no fuera posible determinar el estadio evolutivo de su enfermedad. Hay que considerar también que lo que se ha recogido es la mortalidad en UCI, no la mortalidad hospitalaria o la mortalidad a los 90 días, que para el curso de la enfermedad neoplásica hubiera sido más correcto.
El porcentaje de pacientes con neoplasia e infecciones nosocomiales, incluyendo aspergilosis, ha sido escaso en todos los grupos analizados, si bien no se han calculado las tasas relacionadas con el uso de dispositivos que favorece la infección (como se registra en el ENVIN), por lo que no se puede llegar a conclusiones al respecto. No parece que las infecciones nosocomiales en estos pacientes constituya un problema muy diferente de la población general no neoplásica.
La elección de 5 años como limitación en la definición de cáncer como antecedente personal no deja de ser arbitraria. Es posible que algunos de estos pacientes estén «curados» de su neoplasia en el momento del ingreso en UCI. Se ha adoptado esta definición porque es la empleada en el ENVIN y por las dificultades que puede tener decidir la curación o no de una neoplasia en pacientes que ingresan por otros motivos. También resulta complejo determinar si los motivos de ingreso en UCI tienen que ver o no con la neoplasia. Parece evidente en los extremos (posquirúrgico o un shock séptico en un paciente con neutropenia profunda posquimioterapia), pero puede no serlo tanto en pacientes intermedios. Por otro lado, en las múltiples comparaciones realizadas se han encontrado diferencias estadísticamente significativas como consecuencia del tamaño muestral. Algunas de esas diferencias tienen poco significado clínico y requerirían análisis post-hoc más detallados.
En conclusión, en este trabajo multicéntrico se presenta la epidemiología de los pacientes con antecedentes oncológicos cercanos o cuyo motivo de ingreso es para el tratamiento de la neoplasia o sus complicaciones. Existe una gran variabilidad en el porcentaje de pacientes oncológicos en las diferentes UCI del país, con un predominio de pacientes posquirúrgicos programados (46,7%). La mortalidad global de los pacientes con neoplasia es el 12,3%, pero se identifica una población de pacientes más graves y con mayor mortalidad. En concreto, la mortalidad de los pacientes con enfermedad de base médica es del 27,5%, y la de aquellos pacientes que ingresan por complicaciones médicas relacionadas con el cáncer es aún superior, el 31,4%. Es necesario hacer estudios sobre los factores relacionados con la mortalidad, de manera más específica, en estas poblaciones.
AutoríaPMOA, FAL y RGC son coordinadores del registro ENVIN. JGM, FGV y CBZ forman parte del grupo de trabajo colaborativo SEMICYUC-SEOM. RDN, CRS e IAA son investigadoras principales de sus hospitales y han contribuido con un mayor número de casos. EL diseño del estudio ha sido realizado por el grupo de trabajo SEMICYUC-SEOM. La redacción ha sido realizada por PMOA y corregida por el resto de los autores, que están de acuerdo con su contenido.
FinanciaciónEl registro ENVIN-HELICS ha sido financiado parcialmente durante el año 2018 por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses con respecto al contenido de este manuscrito.
Este trabajo no hubiera sido posible sin la participación de todos los colaboradores (médicos y enfermeras) del registro ENVIN-HELICS en las distintas unidades de cuidados intensivos. Así mismo, agradecemos a las Dras. Sonia Uriona y Yolima Cosio por la administración y secretaría técnica del registro ENVIN-HELICS. Por otra parte, también agradecemos al personal de secretaría de la SEMICYUC, especialmente a Miguel Ángel Ferrero, encargado informático de la base de datos ONCOENVIN. Igualmente, nuestro agradecimiento a Sergi Mojal por su colaboración en la metodología y análisis estadístico.
Raquel Durá Navarro, Hospital General Universitario de Valencia (U. Polivalente). María Carmen Ruano Suarez, Hospital de Cruces (U. Reanimación), Baracaldo, Vizcaya. Inmaculada Alonso Araujo, Hospital General Virgen del Rocío, Sevilla. Ángel Arenzana Seisdedos, Hospital Universitario Virgen Macarena, Sevilla. Alberto Córdoba López, Complejo Hospitalario Universitario de Badajoz (UCI 1). Nuria Camino Redondo, Hospital de Torrejón, Torrejon de Ardoz, Madrid. Sandra Barbadillo Ansorregui, Hospital General de Catalunya, Sant Cugat del Vallés, Barcelona. Lorena Mouriz Fernández, Hospital Universitario Lucus Augusti (U. Reanimación), Lugo. Maria Elena Vilas Otero, Complexo Hospitalario Universitario de Vigo H. Álvaro Cunqueiro (REA 2), Vigo. José Antonio Márquez Alonso, Hospital Rey Juan Carlos, Móstoles, Madrid. Adoración Gema Bueno Blázquez, Clínica Moncloa, Madrid. Ana Abella Alvarez, Hospital del Henares, Coslada, Madrid. Joaquín Lobo Palanco, Complejo Hospitalario de Navarra (UCI-A), Pamplona. Luis Cofiño Castañeda, Hospital Universitario Central de Asturias (U. Polivalente), Oviedo, Asturias. J.C. Montejo González, Hospital Universitario 12 de Octubre, U. Polivalente, Madrid. Miguel Ángel García García, Hospital de Sagunto, Valencia. María Dolores Sandar Núñez, Hospital Jerez de la Frontera, Cádiz. María Teresa Tebar Soto, Hospital de Basurto, U. Polivalente, Bilbao, Vizcaya. Rafael Cabadas Avión, Hospital Povisa, Vigo, Pontevedra. Ricardo Gimeno Costa, Hospital Universitario y Politécnico La Fe (U. Médica),Valencia. José Ángel Berezo García, Hospital Universitario Río Hortega, Valladolid. Fernando García López, Hospital General Universitario de Albacete. Blanca López Matamala, Hospital Universitario del Tajo, Aranjuez, Madrid. Asunción Colomar Ferrá, Hospital Universitario Son Espases, Palma de Mallorca. María Sopetrán Rey García, Complejo Asistencial de Segovia. Belén Cidoncha Calderón, Hospital Don Benito-Villanueva, Badajoz. Sara Alcántara Carmona, Hospital Universitario Puerta de Hierro Majadahonda, Madrid. Eva Manteiga Riestra, Hospital Infanta Cristina, Parla, Madrid. Bernardo Gil Rueda, Hospital General Universitario Morales Meseguer, Murcia. Carlos Gallego González, Hospital Militar Gómez Ulla, Madrid. Roberto Jiménez Sánchez, Hospital General Universitario Santa Lucía, Cartagena, Murcia. Ismael López de Toro Martín-Consuegra, Hospital Virgen de la Salud (U. Polivalente), Toledo. Jessica Souto Higueras, Hospital Sanitas CIMA de Barcelona. Arantxa Lander Azcona, Hospital General San Jorge, Huesca. José María Fuster Lozano, Clínica Vistahermosa, HLA Grupo Hospitalario, Alicante. Paula Vera Artázcoz, Hospital de Sant Pau (U. Polivalente), Barcelona. María José Castro Orjales, Complejo Hospitalario Universitario de Ferrol. H. Arquitecto Marcide, La Coruña. María José Asensio Martín, Hospital Universitario La Paz (U. Polivalente), Madrid. María Antonia Estecha Foncea, Hospital Universitario Virgen de la Victoria, Málaga. Roberto Reig Valero, Hospital General de Castellón. Jesús Priego Sanz, Complexo Hospitalario Universitario de Ourense (U. Polivalente), Susana Sancho Chinesta, Hospital Doctor Peset, Valencia. Jordi Vallés Daunis, Hospital Parc Tauli, Sabadell, Barcelona. Ana Isabel Ezpeleta Galindo, Hospital Royo Villanova, Zaragoza. Braulio Álvarez Martínez, Hospital El Bierzo, Ponferrada, León. Felipe Bobillo de Lamo, Hospital Clínico Universitario de Valladolid, U. Polivalente. Antoni Margarit Ribas, Hospital Nuestra Señora de Meritxell, Escaldes-Engordany, Andorra. Pedro M. Olaechea Astigarraga, Hospital de Galdakao (U. Polivalente), Vizcaya. Juan Carlos Ballesteros Herráez, Hospital Clínico de Salamanca. María Teresa Saldaña Fernández, Hospital Universitario de Fuenlabrada, Madrid. Ángel Sánchez Miralles, Hospital de Sant Joan, Alicante. Rosario Amaya Villar, Hospital de Rehabilitación y Traumatología Virgen del Rocío, Sevilla. Juan Fajardo López-Cuervo, Clínica Santa Isabel, Sevilla. Antonia Socias, Hospital Son Llàtzer, Palma de Mallorca. Alfons Bonet Saris, Clínica Girona. Ana María Díaz Lamas, Complexo Hospitalario Universitario de A Coruña (UCI 5). José Ramón Iruretagoyena Amiano, Hospital de Cruces (U. Polivalente), Baracaldo, Vizcaya. Ingrid Acosta Rivera, Clínica Ruber de Madrid. María Cerón García, Hospital Vega Baja de Orihuela, Alicante. Susana Moradillo González, Hospital Río Carrión, Complejo Hospitalario de Palencia. Paula Rodríguez Pedreira, Hospital Quirónsalud, Barcelona. Eduardo Palencia Herrejón, Hospital Infanta Leonor, Madrid. Carlos López Núñez, Hospital Clínico Universitario Lozano Blesa (U. Médica), Zaragoza. Margarita Mas Lodo, Hospital General, Móstoles, Madrid. Juan Carlos Pardo Talavera, Hospital Quirón Murcia. María Luisa Mora, Hospital Universitario de Canarias (UPCC), Santa Cruz de Tenerife. Ricard Ferrer Roca, Centro Médico Delfos, Barcelona. Eugenia de La Fuente Óconnor, Hospital Universitario Infanta Sofía, San Sebastián de los Reyes, Madrid. Miguel Sánchez García, Hospital Clínico Universitario San Carlos (U. Traumatología), Madrid. Carmen Blanco Huelga, Hospital Marqués de Valdecilla (UCI 1), Santander. María Ángeles Garijo Catalina, Hospital Virgen de la Luz, Cuenca. Adoración Alcalá López, Hospital General Universitario de Elche, Alicante. Marta Ugalde Gutierrez, Hospital de Cruces (U. Quemados), Baracaldo, Vizcaya. María Rosa Navarro Ruiz, Hospital Universitario los Arcos del Mar Menor, San Javier, Murcia. María José Román Millan, Hospital de la Merced, Osuna, Sevilla. Pedro Lara Aguayo, Hospital Infanta Margarita, Cabra, Córdoba. María Herreros Gonzalo, Hospital La Mancha Centro, Alcázar de San Juan, Ciudad Real. Laura Claverias Cabrera, Hospital de Tortosa Verge de la Cinta, Tarragona. José Martos López, Hospital Vithas La Salud de Granada. María Concepción Valdovinos Mahave, Hospital Obispo Polanco, Teruel. Daniel Fontaneda López, Hospital de León (U. Polivalente). María Matachana Martínez, Hospital Juan Cardona, Ferrol, La Coruña. Esther García Sánchez, Hospital Universitario del Sureste, Arganda del Rey, Madrid. Carmen Santarrufina Lluch, Hospital Comarcal de Vinaròs, Castellón. Rafael Garcés González, Hospital de la Ribera, Alzira, Valencia. Sonia Gallego Lara, Hospital San Juan de Dios del Aljarafe, Sevilla. Pilar Martinez Trivez, Hospital de Barbastro, Huesca. Cecília Vilanova Pàmies, Hospital Mateu Orfila, Menorca. Celina Llanos Jorge, Hospital Quirónsalud, Santa Cruz de Tenerife. María José Asensio Martín, Hospital Universitario La Paz (U. Quemados), Madrid. Juan Carlos Montejo Gonzalez, Hospital Universitario 12 de Octubre (U. Trauma y Emergencia), Madrid. Enrique Alemparte Pardavila, Complexo Hospitalario Universitario A Coruña (UCI 6).