Analizar los datos epidemiológicos de las infecciones del tracto urinario relacionadas con sonda uretral (ITU-SU) en pacientes críticos ingresados en UCI españolas para evaluar la necesidad de aplicar un programa de intervención a nivel nacional para disminuir dichas infecciones.
DiseñoAnálisis retrospectivo, no intervencionista, de prevalencia de periodo anual.
ÁmbitoUCI participantes en el registro multicéntrico ENVIN-UCI entre los años 2007-2016.
PacientesPacientes críticos ingresados en UCI con ITU-SU.
Variables principalesTasa de incidencia por 1.000 días de utilización de SU; ratio de uso de SU; proporción de ITU-SU con respecto del total de infecciones relacionadas con asistencia sanitaria (IRAS) controladas en el registro.
ResultadosSe han incluido 187.100 pacientes de los que 137.654 (73,6%) utilizaron SU durante 1.215.673 días (84,4% de los días de estancia en UCI). En 4.539 (3,3%) pacientes sondados se han diagnosticado 4.977 ITU-SU (3,6 episodios por 100 pacientes con SU). La tasa de incidencia de ITU-SU ha disminuido entre los años 2007 y 2016 un 19% (4,69 a 3,8 episodios por 1.000 días de SU), aunque se ha mantenido la ratio de uso de SU (0,84 [0,82-0,86]). La proporción de las ITU-SU ha aumentado desde el 23,3% al 31,9% del total de IRAS controladas.
ConclusionesAunque han disminuido las tasas de ITU-SU estas infecciones han pasado a ser, proporcionalmente, la primera de las IRAS en UCI. Persiste una elevada ratio de utilización de SU en UCI españolas. Existe un espacio de mejora, por lo que un proyecto ITU-ZERO podría ser útil en nuestro país.
To analyze epidemiological data of catheter-associated urinary tract infection (CAUTI) in critically ill patients admitted to Spanish ICUs in order to assess the need of implementing a nationwide intervention program to reduce these infections.
DesignNon-intervention retrospective annual period prevalence analysis.
SettingParticipating ICUs in the ENVIN-UCI multicenter registry between the years 2007-2016.
PatientsCritically ill patients admitted to the ICU with catheter-associated urinary tract infection (CAUTI).
Main variablesIncidence rates per 1,000 catheter-days; urinary catheter utilization ratio; proportion of CAUTIs in relation to total health care-associated infections (HAIs).
ResultsA total of 187,100 patients, 137,654 (73.6%) of whom had a urinary catheter in place during 1,215,673 days (84% of days of ICU stay) were included. In 4,539 (3.3%) patients with urinary catheter, 4,977 CAUTIs were diagnosed (3.6 episodes per 100 patients with urinary catheter). The CAUTI incidence rate showed a 19% decrease between 2007 and 2016 (4.69 to 3.8 episodes per 1,000 catheter-days), although a sustained urinary catheter utilization ratio was observed (0.84 [0.82-0.86]). The proportion of CAUTI increased from 23.3% to 31.9% of all HAIs controlled in the ICU.
ConclusionsAlthough CAUTI rates have declined in recent years, these infections have become proportionally the first HAIs in the ICU. The urinary catheter utilization ratio remains high in Spanish ICUs. There is room for improvement, so that a CAUTI-ZERO project in our country could be useful.
Las infecciones del tracto urinario relacionadas con sonda uretral (ITU-SU) son una de las principales causas de infección relacionada con la asistencia sanitaria (IRAS)1. Su frecuencia se relaciona con la duración de sondaje urinario, la utilización de sistemas de drenaje cerrados y con la calidad de los cuidados del personal sanitario en relación con su inserción y mantenimiento2,3. En los pacientes críticos ingresados en servicios o unidades de cuidados intensivos (UCI) es habitual el empleo de SU para la monitorización de la diuresis horaria como un indicador de la situación hemodinámica. Por ello las ITU-SU son una de las infecciones más frecuentes en dichas áreas4,5.
En España se controlan las IRAS en los pacientes ingresados en UCI desde el año 1994 a través del registro ENVIN-UCI4. Las ITU-SU son una de las infecciones incluidas en la vigilancia además de las bacteriemias relacionadas con catéteres vasculares (BCV) y las neumonías relacionadas con ventilación mecánica (NVM), todas ellas infecciones adquiridas durante la estancia en UCI, en las que se asume la responsabilidad del personal sanitario en su desarrollo4. Durante muchos años el objetivo de los participantes en el registro ENVIN fue determinar la frecuencia, etiología y marcadores de multirresistencia de cada una de las infecciones controladas. Desde el año 2009 se han implementado diferentes proyectos de seguridad destinados a favorecer la aplicación de prácticas seguras en el manejo de los dispositivos invasores relacionados con IRAS con la intención de disminuir las tasas de dichas infecciones. Así los proyectos «Bacteriemia Zero» (BZ)6 y «Neumonía Zero» (NZ)7 han logrado reducir en un 50% las tasas nacionales de BCV y NVM y el «Proyecto RZ»8 ha disminuido en un 20% el número de pacientes que adquieren una bacteria multirresistente durante la estancia en UCI (datos no publicados).
Hasta el momento, en nuestro país, no se ha desarrollado ningún proyecto nacional destinado a disminuir las tasas de ITU-SU en el entorno de pacientes críticos. En este estudio se analiza la evolución de las tasas, etiologías y marcadores de multirresistencia de las ITU-SU en los últimos 10 años, así como la respuesta sistémica de dichas infecciones y la mortalidad cruda durante la estancia en UCI de los pacientes con ITU-SU, con la intención de evaluar la necesidad de desarrollar un proyecto específico para disminuir estas infecciones (Proyecto ITU-Zero).
Material y métodosDiseño. Estudio observacional, multicéntrico, retrospectivo de prevalencia de periodo anual.
Pacientes de estudio. Se han analizado todos los pacientes ingresados más de 24horas en las UCI participantes en el registro ENVIN-UCI que fueron diagnosticados de ITU-SU.
Periodo de análisis. Incluye los meses de abril a junio desde el año 2007 a 2016 (10 años).
Características del registro ENVIN-UCI. El registro ENVIN fue desarrollado en el seno de Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias en el año 1994. Su objetivo era registrar las infecciones relacionadas con el uso de dispositivos invasores diagnosticadas durante la estancia de los pacientes en UCI. Para ello, se diseñó una base de datos que ha ido evolucionando a lo largo de los años. En el año 2004 se realizaron modificaciones para hacerla compatible con el proyecto europeo Hospitals in Europe Link for Infection Control through Surveillance (HELICS). Actualmente la recogida de datos se realiza utilizando la aplicación informática ENVIN-HELICS, que está ubicada en un servidor web y a la cual se accede mediante Internet (http://hws.vhebron.net/envin-helics/). El acceso es libre (utilizando un código individual) y gratuito previa identificación y registro de los responsables de cada UCI. La participación en el registro es voluntaria y la recogida de datos es longitudinal y prospectiva. Desde su inicio la incorporación de UCI ha ido en aumento, llegando en el año 2016 a aportar datos 200 UCI4. La recogida de datos se realiza de forma prospectiva y se incluyen todos los pacientes ingresados en UCI durante más de un día a lo largo de 3 meses (abril a junio). Se consideró más de un día de estancia cuando la diferencia entre la fecha de alta menos la fecha de ingreso en UCI fue mayor de 24horas. Los pacientes ingresados más de una vez en UCI se consideran como diferentes, por lo que un paciente puede estar incluido varias veces en el mismo periodo de vigilancia. El periodo de seguimiento de los sujetos de estudio comprende desde el ingreso en UCI hasta el alta de la UCI, con un periodo máximo de seguimiento de 60 días. Se realizaron 2 auditorías (año 2008 y 2010) que ha permitido evaluar la validez interna de la información incluida9. El registro ENVIN cuenta con la aprobación del Comité de Ética de Investigación Clínica (CEIC) del Hospital del Mar entre otros centros hospitalarios, y ha sido declarado registro de interés para el Sistema Nacional de Salud por el Ministerio de Sanidad, Servicios Sociales e Igualdad.
Definición de infección urinaria relacionada con sonda uretral. Se siguieron los criterios aprobados por el European Centre for Disease Prevention and Control (ECDC)10 y disponibles en el manual del registro ENVIN4 que incluyen la presencia de al menos uno de los siguientes síntomas o signos clínicos no presentes en el momento del sondaje urinario: fiebre mayor de 38°C (excluyendo otras causas de su origen), tensión en la zona suprapúbica o urgencia urinaria o piuria (10 leucocitos/ml o 3 leucocitos/ml a la inspección de una muestra de orina no centrifugada con un objetivo de gran aumento) y uno de los siguientes criterios microbiológicos: a) en pacientes sin tratamiento antibiótico un cultivo de orina con aislamiento de ≥105ufc/ml de no más de 2 microorganismos; o b) en pacientes con tratamiento antibiótico un cultivo de orina con aislamiento de <105ufc/ml de un único microorganismo. Cuando se aisló más de un microrganismo en el urocultivo se consideró que la muestra estaba contaminada.
Variables analizadas. Se han evaluado aquellas variables disponibles en la base de datos del registro ENVIN de interés para el análisis epidemiológico. De los pacientes se ha analizado la mortalidad intra-UCI, definida como la muerte durante la estancia en UCI por cualquier causa y la ratio de uso de SU, definida como la proporción de días en que los pacientes han utilizado SU con respecto al total de días de estancia en UCI. De las infecciones se ha analizado la etiología, el intervalo de aparición con respecto al día de ingreso en UCI (clasificado como≤ o >a 4 días), los marcadores de multirresistencia y la respuesta sistémica asociada con la infección. Los marcadores de multirresistencia fueron los siguientes: Acinetobacter baumannii resistente a imipenem, Escherichia coli resistente a cefotaxima o a ciprofloxacino, Klebsiella pneumoniae resistente a cefotaxima o ciprofloxacino, Pseudomonas aeruginosa resistente a imipenem y Enterococcus spp. resistente a vancomicina. La respuesta sistémica fue evaluada utilizando las definiciones de la Conferencia de consenso de 199111 y las modificaciones incluidas en 200312, expresándose en el texto conjuntamente sepsis grave y shock séptico. Así mismo se incluye el número de bacteriemias nosocomiales secundarias a foco urinario diagnosticadas a partir de las 48horas de ingreso en UCI.
Medidas de frecuencia. Se han utilizado la proporción de incidencia acumulada definida como el número de episodios de ITU-SU dividido por el número de pacientes con SU por 100 y la tasa de infección expresada como número de episodios de ITU-SU por 1.000 días de SU. Para calcular el impacto de las ITU-SU con respecto al total de IRAS controladas en el registro ENVIN se ha calculado la proporción de cada una de ellas con respecto al total de IRAS detectadas. La frecuencia de cada uno de los microorganismos patógenos (MP) identificados en las ITU-SU se expresa como porcentaje con respecto al total de microorganismos identificados. La tasa de los marcadores de multirresistencia se ha calculado como el cociente entre el número de un determinado MP multirresistente dividido por el número total de dicho MP identificado por 100.
Análisis estadístico. La recogida de datos se ha realizado utilizando la aplicación informática ENVIN-UCI, que está ubicada en un servidor web y a la cual se accede mediante Internet. La base de datos (en SQL Server) está en el mismo servidor. El programa dispone de sistemas de seguridad que obligan a cumplimentar las variables definidas como básicas e imposibilitan la introducción de valores ilógicos. Las variables cualitativas se describen con el porcentaje de distribución de cada una de las categorías. Las variables cuantitativas se describen con la media y la desviación estándar cuando siguen una distribución normal, con la mediana y percentiles 25 y 75 en caso contrario. Para analizar las tendencias monótonas (ascendentes y descendentes) de los diversos indicadores se ha utilizado el test de Mann-Kendall, valorándose con significativas diferencias<0,05.
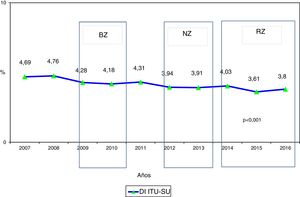
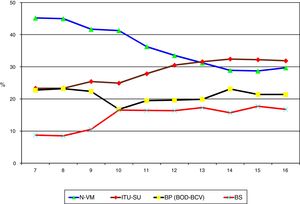
ResultadosSe han incluido 187.100 pacientes, de los que 137.654 (73,6%) utilizaron SU durante 1.215.673 días (84,4% de los días de estancia en UCI). En 4.539 (3,3%) pacientes sondados se han diagnosticado 4.977 ITU-SU (3,6 episodios por 100 pacientes con SU). En la tabla 1 se incluyen el número de pacientes incluidos por año, así como el número de días de estancia, días de utilización de SU, ratio de uso de SU, número de ITU-SU diagnosticadas y tasa de ITU-SU en relación con el número de pacientes sondados. Destaca el incremento progresivo a lo largo de los años de pacientes incluidos en el registro, así como los días de estancia y días de uso de SU. Por el contrario, se observa estabilidad en la ratio de utilización de SU (0,84 [0,82-0,86]), una disminución significativa de la tasa de ITU-SU en relación con el número de pacientes sondados y una disminución de las ITU-SU precoces (≤4 días de ingreso en UCI) (p=0,003). En la figura 1 se incluye la evolución anual de las tasas de ITU-SU, expresadas como DI por 1.000 días de SU, a lo largo de los años analizados y su relación con los proyectos de prevención BZ, NZ y RZ, aplicados en las UCI españolas. Se ha observado una disminución progresiva desde 4,69 hasta 3,80 episodios por 1.000 días de SU en el año 2016 (reducción del 19%) (p<0,001). En la figura 2 se incluye la proporción de cada infección controlada con respecto al total de infecciones identificadas cada año, en la que destaca el progresivo incremento de la proporción de ITU-SU que han ocupado, en los últimos años, el primer lugar entre las IRAS relacionadas con dispositivos invasores.
Evolución de los datos epidemiológicos de las ITU-SU identificadas en UCI españolas entre los años 2007-2016
| 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | p | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Pacientes UCI, n.° | 12.453 | 13.824 | 14.983 | 16.950 | 18.829 | 19.521 | 20.799 | 22.064 | 23.907 | 23.770 | |
| Edad, media (DE), años | 61,7 (16,8) | 61,6 (16,7) | 62,3 (16,5) | 62,3 (16,3) | 62,7 (16,2) | 62,9 (16,2) | 63,2 (15,9) | 62,9 (15,9) | 63,3 (15,9) | 63,2 (15,8) | |
| Sexo, hombre, n.° (%) | 8.270 (66,4) | 9.091 (65,8) | 9.656 (64,5) | 11.075 (65,3) | 12.416 (65,9) | 12.756 (65,4) | 13.445 (64,6) | 14.428 (65,4) | 15.465 (64,7) | 15.299 (64,4) | |
| APACHE II, media (DE) | 14,2 (8,2) | 14,1 (8,2) | 14,4 (8,4) | 14,5 (8,3) | 14,8 (8,4) | 14,8 (8,2) | 14,6 (8,1) | 14,6 (8,2) | 14,7 (8,0) | 14,8 (8,2) | |
| Días de estancia, n.° | 102.974 | 107.610 | 125.804 | 136.407 | 142.954 | 154.625 | 157.476 | 162.678 | 173.949 | 175.995 | |
| Pacientes con SU, n.° (%) | 9.024 (72,5) | 10.421 (75,4) | 11.258 (75,1) | 12.052 (71,1) | 13.659 (72,5) | 14.160 (72,5) | 15.230 (73,2) | 16.071 (72,8) | 17.617 (73,7) | 18.162 (76,4) | |
| Días de SU, n.° | 85.941 | 92.098 | 105.389 | 112.407 | 120.859 | 130.635 | 134.034 | 138.352 | 145.398 | 150.560 | |
| Ratio de uso SU (%) | 0,83 | 0,86 | 0,84 | 0,82 | 0,85 | 0,84 | 0,85 | 0,85 | 0,84 | 0,86 | 0,283 |
| Pacientes ITU-SU, n.° | 370 | 394 | 404 | 418 | 476 | 472 | 476 | 513 | 484 | 532 | |
| Edad, media (DE), años | 62,2 (16,6) | 60,6 (16,9) | 63,6 (15,6) | 61,6 (16,4) | 62,9 (16,0) | 63,3 (15,2) | 63,5 (14,7) | 63,6 (14,7) | 63,2 (15,8) | 62,7 (15,4) | |
| Sexo, hombre, n.° (%) | 202 (54,6) | 216 (55,6) | 202 (50,0) | 215 (51,4) | 270 (56,7) | 246 (52,1) | 259 (54,4) | 289 (56,3) | 254 (52,5) | 270 (50,8) | |
| APACHE II, media (DE) | 19,2 (7,6) | 17,9 (8,1) | 19,4 (8,1) | 18,1 (7,7) | 19,6 (7,9) | 19,1 (7,9) | 19,6 (7,9) | 18,8 (8,0) | 19,6 (8,3) | 19,4 (8,1) | |
| ITU-SU, n.° | 403 | 438 | 451 | 470 | 521 | 515 | 524 | 558 | 525 | 572 | |
| ITU-SU/pacientes con SU (%) | 4,47 | 4,20 | 4,01 | 3,90 | 3,81 | 3,64 | 3,44 | 3,47 | 2,98 | 3,15 | <0,001 |
| Sepsis grave/shock séptico n.° (%a) | 52 (12,9) | 58 (13,3) | 58 (12,9) | 66 (14,0) | 82 (15,7) | 68 (13,2) | 45 (8,6) | 44 (7,9) | 37 (7,0) | 48 (8,4) | 0,125 |
| Bacteriemia nosocomial secundaria de origen urinario, n.° (%ade ITU-SU) | 49 (12,2) | 47 (10,7) | 28 (6,2) | 48 (10,2) | 48 (9,2) | 38 (7,4) | 35 (6,7) | 50 (9,0) | 43 (8,2) | 46 (8,1) | 0,010 |
| Más de 4 d. de estancia UCI previos a ITU-SU, n.° (%a) | 342 (84,9) | 370 (84,5) | 391 (86,7) | 408 (86,8) | 463 (88,9) | 463 (89,9) | 459 (87,6) | 494 (88,5) | 468 (89,1) | 512 (89,5) | 0,003 |
| ≤4 días | 61 (15,1) | 68 (15,5) | 60 (13,3) | 62 (13,2) | 58 (11,1) | 52 (10,1) | 65 (12,4) | 64 (11,5) | 57 (10,9) | 60 (10,5) | |
| >4 días | 342 (84,9) | 370 (84,5) | 391 (86,7) | 408 (86,8) | 463 (88,9) | 463 (89,9) | 459 (87,6) | 494 (88,5) | 468 (89,1) | 512 (89,5) | |
| Mortalidad intra-UCI, n.° (%b) | 92 (24,9) | 69 (17,5) | 102 (25,2) | 88 (21,1) | 101 (21,1) | 98 (20,8) | 101 (21,2) | 102 (19,9) | 91 (18,8)) | 97 (18,2) | 0,094 |
APACHE: Acute Physiology and Chronic Health Evaluation; DE: desviación estandar; ITU-SU: infección del tracto urinario relacionada con sonda uretral; SU: sonda uretral; UCI: unidad de cuidados intensivos.
Evolución de la proporción de cada una de las IRAS con respecto al total de las IRAS controladas en el registro ENVIN-UCI. N-VM: neumonía relacionada con ventilación mecánica; ITU-SU: infección del tracto urinario relacionada con sonda uretral; BP: bacteriemia primaria; BOD: bacteriemia de origen desconocido; BCV: bacteriemia relacionada con catéter vascular; IRAS: infecciones relacionadas con la asistencia sanitaria; ENVIN-UCI: Estudio Nacional de Vigilancia de Infección Nosocomial en Unidades de Cuidados Intensivos.
La evolución de la etiología de las ITU-SU a lo largo de los años se incluye en la tabla 2. Predominan las bacterias gram negativas (BGN) que han incrementado su presencia a lo largo de los años (desde el 55,8% en el año 2007 al 63,3% en el año 2016; p=0,001). E. coli continúa siendo el más frecuente patógeno identificado (25%), seguido de P. aeruginosa (12%). Destaca el progresivo aumento de Klebsiella pneumoniae en los últimos años (9%) y la disminución de A. baumannii (menos del 2%). Los CGP se mantienen en torno al 20% predominando E. faecalis. Se ha observado un incremento de los aislamientos de Enterococcus faecium que han pasado del 1,5% a más de 4% del total de los aislados. Por el contrario, los hongos han disminuido en su protagonismo pasando del 25,2% en el año 2007 a 17,2% en el año 2016 (p<0,001), en especial Candida albicans que ha disminuido su presencia desde 12,3% al 8,9%.
Evolución de los microorganismos patógenos responsables de ITU-SU en pacientes críticos clasificados por grupos
| 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | p | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| N.° de patógenos | 389 | 436 | 433 | 469 | 523 | 519 | 540 | 570 | 561 | 605 | |
| BGN | 217 (55,8) | 248 (56,9) | 239 (55,2) | 266 (56,7) | 314 (60,0) | 307 (59,2) | 324 (60,0) | 380 (66,7) | 352 (62,7) | 383 (63,3) | 0,001 |
| E. coli | 102 (26,2) | 113 (25,9) | 111 (25,5) | 125 (26,7) | 132 (25,2) | 135 (26,0) | 136 (25,0) | 167 (29,3) | 140 (25,0) | 153 (25,3) | |
| P. aeruginosa | 45 (11,6) | 60 (13,8) | 41 (9,5) | 51 (10,9) | 65 (12,4) | 74 (14,3) | 65 (12,0) | 83 (14,6) | 63 (12,3) | 76 (12,6) | |
| K. pneumoniae | 12 (3,1) | 21 (4,8) | 22 (5,1) | 25 (5,3) | 45 (8,6) | 30 (5,8) | 39 (7,2) | 48 (8,4) | 61 (10,9) | 48 (7,9) | |
| A. baumannii | 19 (4,9) | 6 (1,4) | 11 (2,5) | 14 (3,0) | 12 (2,3) | 7 (1,4) | 8 (1,5) | 5 (0,9) | 9 (1,6) | 8 (1,3) | |
| CGP | 71 (18,3) | 85 (19,5) | 87 (20,1) | 81 (17,3) | 104 (19,9) | 108 (20,8) | 109 (20,2) | 98 (17,2) | 112 (20,0) | 117 (19,3) | 0,197 |
| E. faecalis | 38 (9,8) | 46 (10,6) | 52 (12,0) | 37 (7,9) | 65 (12,4) | 72 (13,9) | 54 (10) | 50 (8,8) | 69 (12,3) | 70 (11,6) | |
| E. faecium | 6 (1,5) | 9 (2,1) | 9 (2,1) | 21 (4,5) | 18 (3,4) | 20 (3,8) | 26 (4,8) | 30 (5,3) | 25 (4,5) | 26 (4,3) | |
| Hongos | 98 (25,2) | 103 (23,6) | 105 (24,3) | 119 (25,4) | 104 (19,9) | 104 (20,0) | 106 (19,6) | 91 (16,0) | 97 (17,3) | 104 (17,2) | <0,001 |
| C. albicans | 48 (12,3) | 51 (11,7) | 54 (12,5) | 71 (15,1) | 54 (10,3) | 53 (10,2) | 55 (10,2) | 56 (9,8) | 53 (9,4) | 54 (8,9) | |
| C. glabrata | 13 (3,3) | 14 (3,2) | 21 (4,9) | 16 (3,4) | 24 (4,6) | 14 (2,7) | 19 (3,5) | 18 (3,2) | 15 (2,7) | 16 (2,6) |
BGN: bacilos gramnegativos; CGP: cocos grampositivos.
La evolución de los marcadores de multirresistencia de los principales patógenos responsables de las ITU-SU se incluyen en la tabla 3. Destaca la elevada tasa de resistencia de los aislados de A. baumannii frente a imipenem-cilastatina a lo largo de los años (entre 60-100%) y de K. pneumoniae frente a cefotaxima (entre 46% y 59%) y ciprofloxacino (entre 50-62%). Por el contrario, las cepas de enterococos resistentes a vancomicina han sido muy poco frecuentes.
Evolución de los marcadores de resistencia en los principales patógenos responsables de ITU-SU
| N.° (% cepas R) | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 |
|---|---|---|---|---|---|---|---|---|---|---|
| A.baumannii R. a imipenem | 15 (94,7) | 5 (60,0) | 11 (63,6) | 12 (100) | 12 (66,7) | 6 (66,7) | 7 (100) | 5 (100) | 9 (66,7) | 7 (100) |
| E. coli R. a cefotaxima | 81 (12,4) | 92 (13,0) | 99 (16,2) | 99 (12,1) | 119 (18,5) | 118 (15,3) | 109 (17,4) | 172 (15,1) | 122 (15,6) | 137 (11,2) |
| E. coli R. a ciprofloxacino | 82 (35,4) | 101 (31,7) | 101 (36,6) | 105 (37,1) | 121 (45,5) | 130 (36,9) | 116 (40,5) | 177 (36,7) | 131 (30,5) | 137 (21,5) |
| K. pneumoniae R. a cefotaxima | ND | ND) | ND) | ND) | ND | 29 (58,6) | 35 (45,7) | 46 (50,0) | 57 (54,4) | 45 (61,5) |
| K. pneumoniae R. a ciprofloxacino | ND | ND | ND | ND) | ND | 29 (62,1) | 37 (51,3) | 50 (60,0) | 57 (50,9) | 45 (64,3) |
| P. aeruginosa R. a imipenem | 31 (25,8) | 50 (26,0) | 36 (30,6) | 33 (36,4) | 51 (27,5) | 61 (39,3) | 54 (42,6) | 68 (47,1) | 49 (36,7) | 74 (31,8) |
| E. faecalisa/E. faecium R. a vancomicina | 24a (0) | 36a (0) | 48a (0) | 28a (3,6) | 47a (0) | 77 (1,3) | 61 (0) | 80 (0) | 73 (0) | 88 (0) |
ND: no disponible; r.: resistente.
La respuesta sistémica de estas infecciones, así como la mortalidad cruda durante el ingreso en UCI, ha disminuido de forma no significativa a lo largo de los años oscilando las ITU-SU que han cursado con sepsis grave o shock séptico alrededor del 10%, y la mortalidad intra-UCI alrededor del 19% (tabla 1). Así mismo, se ha observado una disminución de las bacteriemias nosocomiales adquiridas en UCI de foco urinario que han disminuido del 12,2% al 8,1% entre los años analizados (p=0,01).
DiscusiónEn este estudio se ha demostrado una disminución del 19% de la tasa de ITU-SU a nivel nacional entre los años 2007 y 2016. La reducción de las ITU-SU se ha acompañado de un retraso en su diagnóstico con respecto al día de ingreso en UCI, y a un incremento proporcional de BGN en la etiología de las mismas, asociado con elevada presencia de resistencias en los BGN más frecuentemente identificados. La disminución de la tasa de ITU-SU se ha producido sin que se haya realizado ninguna intervención específica para su prevención, aunque ha coincidido con la aplicación a nivel nacional de los proyectos de seguridad en pacientes críticos (Proyecto Bacteriemia Zero, Proyecto Neumonía Zero y Proyecto Resistencia Zero). En estos proyectos se ha hecho especial énfasis en manejar los dispositivos invasores con medidas de asepsia, y se ha profundizado en los conceptos de seguridad de los pacientes hospitalizados, uno de cuyos principales mensajes es que las IRAS deben considerarse como un efecto adverso, de las que son responsables el personal sanitario que atiende a los pacientes.
A pesar de la reducción de las ITU-SU observada en nuestro estudio la proporción de estas infecciones en relación con el total de infecciones relacionadas con dispositivos invasores en las UCI (controladas en el registro ENVIN) ha aumentado hasta convertirse en la más frecuente de todas ellas. Ello se debe al éxito logrado con los proyectos de seguridad que han permitido reducir a la mitad las tasas de BCV y NVM6,7.
Sin embargo, aunque se ha logrado reducir en el año 2016 la tasa de ITU-SU a 3,8 episodios por 1.000 días de SU, y han mejorado las tasas alcanzadas en la primera década de los 200013, su frecuencia continúa siendo mayor que la de otros estudios epidemiológicos nacionales publicados recientemente. El National Healthcare Safety Network Report en su informe anual, con los datos comunicados por los hospitales americanos en el año 2013, presenta tasas que oscilan desde 1,3-1,7 episodios por 1.000 días de SU en UCI médico-quirúrgicas hasta 4,5-5,3 episodios por 1.000 días de SU en UCI neurológicas, neuroquirúrgicas o de pacientes quemados5. En un reciente estudio de intervención en más de 900 unidades de hospitalización, de las que el 40,3% eran UCI, en los estados de Columbia y Puerto Rico (EE. UU.) se han comunicado tasas de ITU-SU en las UCI entre 2,48-2,50 episodios por 1.000 días de SU, sin que el programa de intervención aplicado haya sido efectivo para reducir dichas tasas13. En Alemania el Krankenhaus Infektions Surveillance System ha publicado las tasas de ITU-SU en UCI diferenciando 3 periodos entre 1997 y 2005 con DI que han disminuido desde 1,46 a 0,57 episodios por 1.000 días de SU14. Por el contrario, nuestros datos son mejores que los publicados por el International Nosocomial Infection Control Consortium report, que incluye datos de UCI de 50 países entre los años 2010-2015, cuya tasa global de ITU-SU fue de 5,1 episodios por 1.000 días de SU15, o los del Italian Nosocomial Infection Surveillance in Intensive Care Units con tasas de ITU-SU en los años 2006-2007 entre 6,6 y 12 episodios por 1.000 días de SU16. En nuestro caso las UCI participantes en el registro ENVIN son mayoritariamente polivalentes, en la que predominan los pacientes médico-quirúrgicos en los que las tasas de los mejores registros son inferiores a 2,5 episodios por 1.000 días de SU.
La ratio de uso de SU en nuestro estudio ha sido muy superior a la publicada por el HNSN5. Mientras que en las UCI españolas la ratio de empleo de SU es de 0,84 en los hospitales americanos oscila entre 0,53-0,68 en las unidades médico quirúrgicas y 0,50-0,75 en la UCI neurológicas, neuroquirúrgicas o de quemados. En otros estudios se han reportado ratios de empleo de SU superiores al 90%17. Los motivos de estas diferencias no se han estudiado y pueden relacionarse con las características de los pacientes ingresados (a mayor gravedad mayor necesidad de monitorización del gasto urinario), con presión asistencial (altas precoces con escasos periodos libres de SU) o con bajo cumplimiento de la recomendación de retirada precoz de la SU. La ratio de uso de SU en nuestros pacientes identifica la retirada de la SU como un elemento de mejora.
Los BGN, en especial E. coli, son los patógenos predominantes en la mayoría de estudios epidemiológicos18. En el nuestro E. coli ha sido la bacteria más frecuentemente identificada, aunque en otros estudios han predominado A. baumannii y P. aeruginosa17. En los últimos años se observó un incremento de BGN a expensas de K. pneumoniae, que ha aumentado su protagonismo en más del doble en estas infecciones (desde el 4,5% al 10,2%). La presencia de este patógeno se ha observado simultáneamente en otros focos de infección y lo identifica como un patógeno emergente en la flora endógena de muchas UCI. Así mismo, las ITU-SU por CGP han superado a los hongos que, en los últimos años, han reducido su presencia. Es posible que en la reducción de los hongos haya influido una mejor clasificación de las candidurias asintomáticas. A pesar de ello, Candida albicans se mantiene en torno al 10% de los aislamientos en esta infección. Entre los CGP predomina Enterococcus faecalis, pero el mayor incremento se ha observado en E. faecium que ha duplicado su presencia.
Es un hecho conocido que la presencia de bacterias multirresistentes en las ITU-SU está aumentando18. En nuestro estudio las cepas de K. pneumoniae resistentes a cefotaxima y ciprofloxacino superan el 60%, las de A. baumannii son resistentes a imipenem entre el 60% y el 100% y las de E. coli son resistentes a ciprofloxacino en más del 30%, lo que obliga a la utilización de antibióticos alternativos en muchas ocasiones como tratamiento de rescate de un primer tratamiento empírico inadecuado.
El impacto sistémico de esta infección y la mortalidad cruda intra-UCI es baja comparada con la de otras IRAS identificadas en pacientes críticos19. Sin embargo, su presencia se ha asociado con un aumento del riesgo de muerte, prolongación de la estancia20 y con un incremento de recursos para su tratamiento21,22. Debido a ello numerosas instituciones sanitarias y sociedades científicas han publicado recomendaciones y promocionado estudios para reducir su presencia13,14,18,23–27. Los resultados publicados de estas experiencias son controvertidos. Mientras que la aplicación una a una de las diferentes medidas preventivas no ha demostrado disminuciones sostenidas de las ITU-SU28, la aplicación de paquetes de medidas ha sido más efectiva, en especial cuando el punto de partida es elevado27,29.
La principal limitación de nuestro estudio reside en que la información procede de un registro multicéntrico de participación voluntaria, por lo que puede existir un sesgo de selección, ya que no todas las UCI han aportado datos durante todo el periodo analizado. Por otro lado, dadas las dificultades para establecer el diagnóstico de ITU-SU en pacientes críticos, durante el periodo analizado se han realizado talleres para homogeneizar definiciones que pueden haber modificado la valoración de las bacteriurias y candidurias asintomáticas.
Se puede concluir que la ITU-SU se ha convertido en las UCI españolas en la principal y más frecuente IRAS tras la reducción sostenida de las BCV y NVM lograda con la implantación de los proyectos BZ y NZ. Este hecho, asociado con la elevada ratio de uso de SU durante la estancia y la presencia de tasas superiores a las de otros registros epidemiológicos en UCI justifican la necesidad de un plan de intervención, siguiendo la estructura de los proyectos de seguridad en pacientes críticos, que identifique un paquete de medidas para reducir su frecuencia, por debajo de 2,7 episodios por 1.000 días de SU.
Contribución de los autoresLa redacción del artículo ha sido realizada por FAL y todos los autores han contribuido a la valoración del contenido aportando sus comentarios. Todos ellos forman parte del equipo directivo del registro ENVIN-UCI y han contribuido a los análisis anuales de la información publicada en la web: http://hws.vhebron.net/envin-helics/
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en la elaboración del presente artículo.
A todos los profesionales, médicos y de enfermería, que han colaborado entre los años 2007 y 2016 en el registro ENVIN-HELICS aportando la información que ha sido analizada en este estudio. Todos ellos son coautores de este trabajo y sus nombres constan en los informes anuales del registro ENVIN, disponibles en la web: http://hws.vhebron.net/envin-helics/. Así mismo expresamos nuestro agradecimiento a las Dras. Sonia Uriona y Susana Otero por la administración y secretaría del registro ENVIN-HELICS.