La epidemiología de las infecciones por Clostridium difficile (ICD) en pacientes críticos es escasa y centrada en estudios limitados en tiempo y/o en brotes epidémicos.
ObjetivoDescribir las características y los factores de riesgo de pacientes críticos ingresados en UCI con ICD, así como los tratamientos utilizados para su control.
Material y métodoAnálisis retrospectivo de pacientes incluidos en el registro ENVIN-UCI con ICD en el año 2012. Los pacientes se han seguido hasta 72h después de su alta de UCI. Se ha cumplimentado un cuaderno de recogida de datos, en el que se incluyen variables demográficas, factores de riesgo relacionados con Clostridium difficile, tratamiento y evolución. Los aislamientos se han clasificado por su origen en comunitarios, nosocomiales extra-UCI y nosocomiales intra-UCI en función del día de aislamiento. Se presentan las tasas por episodios por 10.000 días de estancia en UCI. Se describe la mortalidad global intra-UCI y hospitalaria.
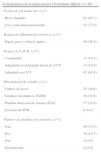
ResultadosSe han detectado 68 episodios de ICD en 33 (19,1%) UCI de las 173 participantes en el registro (2,1 episodios por 10.000 días de estancia-UCI). En 45 (66,2%) casos eran hombres, con edad media de 63,4 (16,4) años, APACHE II al ingreso de 19,9 (7,4) y enfermedad de base médica 44 (64,7%). En 62 (91,2%) ocasiones presentaron más de 3 deposiciones líquidas/día y en 40 (58,8%) se asoció con sepsis severa o shock séptico. En 13 (19,1%) ocasiones fue de origen comunitario, en 13 (19,1%) de origen nosocomial extra-UCI y en 42 (61,8%) de origen intra-UCI. Factores de riesgo: edad>64 años 39 (57,4%), ingreso previo hospital (3 meses) 32 (45,6%), antimicrobianos (7 días previos) 57 (83,8%), nutrición enteral 23 (33,8%) e inhibidores H2 39 (57,4%). Siguieron tratamiento inicial combinado 18 (26,5%) casos y se ha utilizado metronidazol en 60 (88,2%) y vancomicina en 31 (45,6%) casos. Hubo mortalidad global intra-UCI en 17 (25,0%) casos y hospitalaria de 19 (27,9%).
ConclusionesLa tasa de ICD en pacientes ingresados en UCI es baja y afecta a pacientes con elevada gravedad y mortalidad. La presencia de ICD es un marcador de mal pronóstico.
Data on the epidemiology of infections caused by Clostridium difficile (CDI) in critically ill patients are scarce and center on studies with a limited time framework and/or epidemic outbreaks.
ObjectiveTo describe the characteristics and risk factors of critically ill patients admitted to the ICU with CDI, as well as the treatments used for the control of such infections.
Material and methodsA retrospective study was made of patients included in the ENVIN-ICU registry with CDI in 2012. Patients were followed up to 72h after discharge from the ICU. A case report form was used to record the following data: demographic variables, risk factors related to CDI, treatment and outcome. Infections were classified as community-acquired, nosocomial out-ICU and nosocomial in-ICU, according to the day on which Clostridium difficile isolates were obtained. Infection rates as episodes per 10,000 days of ICU stay are presented. The global in-ICU and hospital mortality rates were calculated.
ResultsSixty-eight episodes of CDI in 33 out of a total of 173 ICUs participating in the registry were recorded (19.1%) (2.1 episodes per 10,000 days of ICU stay). Forty-five patients were men (66.2%), with a mean (SD) age of 63.4 (16.4) years, a mean APACHE II score on ICU admission of 19.9 (7.4), and an underlying medical condition in 44 (64.7%). Sixty-two patients (91.2%) presented more than 3 liquid depositions/day, 40 (58.8%) in association with severe sepsis or septic shock. Community-acquired infection occurred in 13 patients (19.1%), nosocomial out-ICU infection in 13 (19.1%), and in-ICU infection in 42 (61.8%). Risk factors included age>64 years in 39 cases (57.4%), previous hospital admission (3 months) in 32 (45.6%), use of antimicrobials (previous 7 days) in 57 (83.8%), enteral nutrition in 23 (33.8%), and the use of H2 inhibitors in 39 (57.4%). Initial combined treatment was administered to 18 patients (26.5%). Metronidazole was used in 60 (88.2%) and vancomycin in 31 (45.6%). The in-ICU mortality rate was 25.0% (n=17), with a hospital mortality 27.9% (n=19).
ConclusionsThe rate of ICD in ICU patients is low, the infection affects severely ill patients, and is associated with high mortality. The presence of CDI is a marker of poor prognosis.
Las infecciones por Clostridium difficile (C. difficile) (ICD) se diagnostican generalmente por la presencia de diarreas líquidas persistentes en las que se identifica C. difficile en una muestra de heces mediante la aplicación de alguna de las diferentes técnicas diagnósticas disponibles, y en menos ocasiones por hallazgos colonoscópicos o histopatológicos que evidencian la presencia de colitis seudomembranosa1. Su importancia radica en que C. difficile puede estar presente en el 20-30% de los casos de diarrea asociada al empleo de antimicrobianos2. Existen pocos datos epidemiológicos sobre su prevalencia en pacientes hospitalizados, y menos aún en pacientes críticos ingresados en servicios o unidades de cuidados intensivos (UCI). Un estudio realizado entre 1997 y 2005 en hospitales canadienses identificó una incidencia entre 3,4 y 8,4 casos por 1.000 admisiones en hospitales de agudos y de 3,8 a 9,5 casos por cada 10.000 pacientes-día3,4. La mortalidad atribuida a la ICD es baja (menos del 2%)4,5, aunque el exceso de coste anual estimado en hospitales americanos entre el año 2000 y el 2002 fue de 3.200 millones de dólares/año6.
Los factores de riesgo que se han descrito en relación con las ICD incluyen la edad avanzada (>64 años)7,8, la duración de la hospitalización9, la exposición a agentes antimicrobianos10, la quimioterapia contra el cáncer11,12, la inmunodepresión relacionada con la infección por VIH13, la cirugía gastrointestinal14, la administración de dieta enteral por sonda nasogástrica15 y la administración de fármacos que suprimen el ácido (bloqueadores de la histamina e inhibidores de la bomba de protones)16. Muchos de estos factores están presentes en los pacientes críticos ingresados en UCI. Sin embargo, los registros de infecciones en dichos servicios se han centrado en las infecciones relacionadas con dispositivos invasivos17, por lo que la información sobre las ICD es escasa y limitada a la descripción de brotes epidémicos, y estimaciones de incremento de mortalidad o de costes18–23. El objetivo de este estudio es determinar las características de los pacientes críticos ingresados en UCI españolas, en el año 2012, con ICD, independientemente del origen de la misma, así como describir los factores relacionados con su aparición y las pautas terapéuticas utilizadas para su tratamiento.
MetodologíaDiseñoEstudio retrospectivo, observacional, no intervencionista y multicéntrico en el que han participado de forma voluntaria UCI que colaboran de forma habitual en el registro ENVIN-UCI. Este registro controla anualmente, desde el año 1994, la evolución de las infecciones relacionadas con dispositivos invasivos, su etiología, los marcadores de resistencia y los antimicrobianos utilizados en las UCI españolas (disponible en: http://hws.vhebron.net/envin-helics/).
Definición de casoSe ha definido como caso cualquier paciente ingresados en UCI o en una unidad de pacientes críticos en el que se ha identificado la presencia de C. difficile.
Periodo de análisisSe han incluido todos los pacientes con aislamientos por C. difficile ingresados en las UCI participantes en el registro en el año 2012. Los pacientes fueron seguidos durante toda su estancia en UCI y en las 72h posteriores a su alta de dicho servicio.
Técnicas de detección de Clostridium difficilePara su identificación se han utilizado los métodos habituales de cada laboratorio de Microbiología de los hospitales participantes, que incluyen uno o varios de los siguientes: cultivo de heces, determinación de la enzima glutamato deshidrogenasa, prueba de inmunoanálisis enzimático para las toxinas A y B, estudios de citotoxinas celulares o cultivos toxigénicos, y la prueba de la reacción en cadena de la polimerasa.
Recogida de informaciónPara cada caso se ha cumplimentado un cuaderno de registro de datos en el que se incluyen datos de filiación, fechas de ingreso y alta en el hospital y en la UCI, diagnóstico de ingreso, nivel de gravedad valorado por la escala APACHE II24 y necesidad de cirugía urgente durante el ingreso. Los enfermos fueron clasificados, de acuerdo con el diagnóstico de ingreso, en coronarios, quirúrgicos, traumáticos y médicos17. Los pacientes coronarios fueron aquellos cuyo motivo de ingreso fue un síndrome coronario agudo o crónico con o sin elevación del segmento ST. Los pacientes traumáticos incluían aquellos cuyo motivo de ingreso eran lesiones agudas producidas por un traumatismo. Se incluyeron como pacientes quirúrgicos aquellos cuyo motivo de ingreso fue el control posoperatorio de una intervención programada. Los pacientes médicos eran aquellos cuyo motivo de ingreso no era ninguno de los anteriores, incluyéndose aquellos pacientes que ingresaron después de una intervención quirúrgica no programada.
Así mismo se han registrado las comorbilidades, los dispositivos invasivos, las técnicas y los tratamientos utilizados el día del aislamiento de C. difficile, y los antibióticos utilizados previamente y la duración de los mismos. Las comorbilidades evaluadas han sido inmunodepresión, inmunosupresión, neutropenia y trasplante de órgano sólido. Las instrumentaciones y técnicas controladas han sido ventilación mecánica, sondaje uretral, catéteres venosos centrales, técnicas de depuración extrarrenal, catéter de derivación ventricular, nutrición parenteral, nutrición enteral y cirugía previa. Se han utilizado las siguientes definiciones17: inmunosupresión cuando el paciente ha recibido un tratamiento que disminuye la resistencia a la infección (quimioterapia, radiación, esteroides durante un período largo de tiempo y esteroides a altas dosis, o si tiene una enfermedad lo suficientemente avanzada como para suprimir las defensas contra la infección); neutropenia cuando la presencia de neutrófilos es<500/mm3, e inmunodepresión cuando el paciente ha sido diagnosticado de infección por VIH u otra inmunodeficiencia congénita o adquirida.
El origen de la ICD se ha clasificado como comunitario cuando el paciente presentaba diarreas líquidas e identificación positiva de C. difficile en el momento del ingreso o en las primeras 48h de ingreso en el hospital; nosocomial extra-UCI cuando la clínica y el diagnóstico de ICD se realizó a partir de las 48h de ingreso en el hospital y en las primeras 48h de ingreso en UCI, y nosocomial intra-UCI cuando el diagnóstico se realizó a partir de las 48h de estancia en UCI o en las primeras 72h posteriores a su alta de dicho servicio.
Los factores específicos de riesgo para infección por C. difficile que se han considerado para su análisis han sido: edad superior a 64 años, utilización previa de antimicrobianos durante más de 7 días, hospitalización previa en los 3 meses anteriores, antecedentes de enfermedad por VIH, cirugía gastroduodenal, utilización de quimioterapia en los 3 meses previos, y empleo actual de nutrición enteral y/o inhibidores H2.
Se ha registrado la respuesta sistémica frente a la infección, definida como la presencia de sepsis, sepsis grave o shock séptico no atribuible a otra causa infecciosa. El tratamiento específico administrado para la ICD se ha clasificado como monoterapia cuando el paciente recibió solo un antibiótico para dicha infección (independientemente de que utilizara otros antibióticos para el tratamiento de otras infecciones), y biterapia cuando se administraron 2 de forma simultánea. La respuesta clínica se ha clasificado como curación, mejoría, sin cambios y exitus relacionado con la infección, y la respuesta microbiológica como negativización de cultivos, persistencia, aparición de otro microorganismo en heces y no seguimiento. Los pacientes fueron seguidos hasta el alta del hospital para identificar reinfecciones. Para la clasificación de reinfección se exigió la existencia de curación o mejoría del episodio previo y/o un estudio de heces negativo. La mortalidad global se definió como aquella que se produjo durante la estancia en la UCI o en el hospital por cualquier motivo.
Cálculo de tasasLa frecuencia de ICD se ha definido por el número de episodios registrados en pacientes ingresados en la UCI (independientemente del origen de la misma) por 1.000 pacientes ingresados en la UCI y por 10.000 días de estancia en la UCI. Para el cálculo de las tasas se han considerado solo los pacientes incluidos en el registro ENVIN-UCI en el periodo de vigilancia nacional (meses de abril a junio) ya que se dispone, en dichos meses, del número de pacientes y días de estancia en la UCI a nivel nacional (19.521 pacientes y 150.832 días de estancia en UCI).
Análisis estadísticoLas variables cualitativas se describen con el porcentaje de distribución de cada una de las categorías. Las variables cuantitativas se describen con la media y desviación estándar cuando siguen una distribución normal, y con la mediana y rango, en caso contrario.
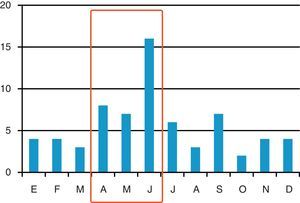
ResultadosSe han incluido 68 pacientes con ICD en 33 (19,1%) UCI de las 173 participantes en el registro ENVIN-UCI (2,1 pacientes por UCI con ICD; mínimo 1, máximo 6). La distribución de los casos a lo largo de los meses se incluye en la figura 1. Las tasas de episodios de ICD referidas al periodo de participación nacional en dicho registro (abril-junio) fueron de 1,59 por 1.000 pacientes ingresados en UCI, y de 2,06 episodios por 10.000 días de estancia en UCI (pacientes-día). En 45 (66,2%) casos eran hombres, con una edad media de 63,4 (16,4) años, APACHE II al ingreso de 19,9 (7,4) y enfermedad de base predominantemente médica en 44 (64,7%) (tabla 1).
Características de los pacientes con infección por Clostridium difficile ingresados en la Unidad de Cuidados Intensivos
| Características de los pacientes | n=68 |
| Edad en años, media (DE) (mín.-máx.) | 63,4 (16,4) (24-87) |
| Sexo, hombre, n (%) | 45 (66,2) |
| APACHE II, media (DE) (mín.-máx.) | 19,9 (7,4) (2-36) |
| Tipo de paciente, n (%) | |
| Médico | 44 (64,7) |
| Quirúrgico | 22 (32,4) |
| Traumático | 2 (2,9) |
| Cirugía urgente, n (%) | 20 (29,4) |
| Procedencia del paciente, n (%) | |
| Domicilio | 30 (44,1) |
| Unidad de hospitalización | 34 (50,0) |
| Otro centro asistencial | 4 (5,9) |
| Días de estancia en el hospital, media (DE) (mín.-máx.) | 40,2 (38,0) (3-179) |
| Días de estancia en UCI, media (DE) (mín.-máx.) | 17,4 (19,9) (1-73) |
| Días de ingreso hospital-aislamiento CD, media (mín.-máx.) | 14,1 (19,9) (0-77) |
| Días ingreso UCI-aislamiento CD, media (mín.-máx.) | 6,5 (13,3) (0-52) |
| Mortalidad intra-UCI global, n (%) | 17 (25,0) |
| Mortalidad hospitalaria global, n (%) | 19 (27,9) |
CD: Clostridium difficile; DE: desviación estándar.
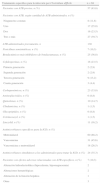
En 62 (91,2%) ocasiones la ICD se asoció con la presencia de un cuadro clínico de deposiciones líquidas, y en 40 (58,8%) existía una respuesta inflamatoria sistémica de sepsis severa o shock séptico. En un caso la ICD evolucionó hasta un cuadro clínico de megacolon tóxico en el que fue necesario un procedimiento quirúrgico de urgencia para su control y tratamiento. En 13 (19,1%) ocasiones la ICD se clasificó como de origen comunitario, en otras 13 (19,1%), de origen nosocomial extra-UCI, y en 42 (61,8%), de origen intra-UCI (tabla 2).
Características de la infección por Clostridium difficile y metodología diagnóstica
| Características de la infección por Clostridium difficile | n=68 |
| Forma de presentación, n (%) | |
| Heces líquidas | 62 (91,1) |
| Tres o más deposiciones/día | 53 (77,9) |
| Respuesta inflamatoria sistémica, n (%) | |
| Sepsis grave o shock séptico | 40 (58.8) |
| Origen de la ICD, n (%) | |
| Comunidad | 13 (19,1) |
| Adquirida en el hospital (fuera de UCI) | 13 (19,1) |
| Adquirida en UCI | 42 (61,8) |
| Metodología de estudio, n (%) | |
| Cultivo de heces | 25 (36,8) |
| Estudios enzimáticos (GDH) | 36 (52,9) |
| Pruebas detección de toxinas (EIA) | 17 (25,0) |
| Técnicas de PCR | 6 (8,8) |
| Número de pruebas por muestra, n (%) | |
| Una | 50 (73,5) |
| Dos | 10 (14,7) |
| Tres | 4 (5,9) |
| Desconocido | 4 (5,9) |
EIA: inmunoanálisis enzimático; ICD: infección por Clostridium difficile; GDH: glutamato deshidrogenasa; PCR: reacción en cadena de la polimerasa; UCI: Unidad de Cuidados Intensivos.
En la tabla 3 se incluyen las comorbilidades y los dispositivos invasivos presentes en los pacientes con ICD, destacando la elevada necesidad de técnicas de monitorización (tabla 4). Los factores específicos relacionados con ICD han sido la edad>64 años en 39 (57,4%) pacientes, el ingreso previo en un hospital (3 meses) en 31 (45,6%), la utilización de antimicrobianos en los 7 días previos al diagnóstico de ICD en 57 (83,8%), y la utilización de nutrición enteral en 23 (33,8%) y de inhibidores H2 en 39 (57,4%) casos, siendo mucho menos frecuentes la quimioterapia (7 pacientes, 10,3%) y la cirugía gastroduodenal (5 pacientes, 7,4%). En 44 (64,8%) pacientes con ICD se identificaron 3 o más factores específicos para desarrollar esta infección. Entre las familias de antimicrobianos utilizados previamente al diagnóstico de ICD destacan los betalactámicos asociados con inhibidores de betalactamasas (36,8%), los carbapenémicos (33,8%) y las cefalosporina (23,5%).
Antecedentes patológicos, dispositivos invasivos y tratamientos complementarios de los pacientes con infección por Clostridium difficile ingresados en la Unidad de Cuidados Intensivos
| n=68 | |
| Antecedentes patológicos, n (%) | |
| Diabetes mellitus | 17 (25,0) |
| EPOC | 12 (17,6) |
| Neoplasia sólida | 8 (11,8) |
| Neoplasia hematológica | 8 (11,8) |
| Cirrosis hepática | 5 (7,4) |
| Insuficiencia renal crónica | 13 (19,1) |
| Trasplante de órgano sólido | 4 (5,9) |
| Trasplante de médula ósea | 1 (1,5) |
| Radioterapia | 2 (3,0) |
| Quimioterapia | 9 (13,2) |
| Neutropenia | 4 (5,9) |
| Inmunodepresión | 12 (17,6) |
| Dispositivos invasivos, n (%) | |
| Catéter venoso central | 54 (79,4) |
| Catéter arterial | 34 (50,0) |
| Ventilación mecánica | 29 (42,6) |
| Sonda uretral | 56 (82,4) |
| Nutrición parenteral | 23 (33,8) |
| Depuración extrarrenal | 7 (10,3) |
| Utilización de ATM más de 7 días | 46 (67,6) |
| Utilización de esteroides, n (%) | 22 (32,4) |
| Cirugía durante el ingreso, n (%) | 17 (25,0) |
EPOC: enfermedad pulmonar obstructiva crónica.
Factores de riesgo relacionados con infección por Clostridium difficile en pacientes ingresados en la Unidad de Cuidados Intensivos
| Factores de riesgo específicos para infección por Clostridium difficile, n (%) | n=68 |
| Edad>64 años | 39 (57,4) |
| Hospitalización previa en los últimos 3 meses | 31 (45,6) |
| Utilización de ATB en los 7 días anteriores | 57 (83,8) |
| Quimioterapia | 7 (10,3) |
| VIH | 1 (1,5) |
| Cirugía gastroduodenal, n (%) | 5 (7,4) |
| Nutrición enteral, n (%) | 23 (33,8) |
| Empleo de inhibidores H2 | 39 (57,4) |
| Número de factores específicos por paciente ICD | |
| 0 | 3 (4,4) |
| 1-2 | 21 (30,9) |
| 3-4 | 39 (57,4) |
| >4 | 5 (7,4) |
ATB: antibióticos; ICD: infección por Clostridium difficile; VIH: virus de la inmunodeficiencia humana.
Se ha indicado tratamiento específico para la ICD en 66 (97,1%) pacientes (tabla 5), utilizando un antibiótico en 42 (61,8%) casos y 2 o más en 24 (35,3%), aunque solo en 18 ocasiones fueron simultáneos. Ha predominado la prescripción de metronidazol en 60 (88,2%) casos y de vancomicina en 31 (45,6). La utilización de estos antibióticos, específicos para el tratamiento de la ICD, se ha acompañado del empleo de otros antimicrobianos para el tratamiento de otras infecciones en 24 (35,3%) ocasiones. Se han identificado 7 (10,3%) pacientes con efectos adversos probable o posiblemente relacionados con la administración de los antimicrobianos específicos para el tratamiento de la ICD, entre los que destacan la presencia de alteraciones hematológicas (2 casos) e hidroelectrolíticas (2 casos) en relación con la utilización de metronidazol, y una severa alteración de la función hepática con el empleo simultáneo de metronidazol y vancomicina. En un caso se cambió el tratamiento inicial debido a los efectos adversos.
Tratamiento específico para la infección por Clostridium difficile en pacientes ingresados en la Unidad de Cuidados Intensivos
| Tratamiento específico para la infección por Clostridium difficile | n=68 |
| Pacientes con ATB previos, n (%) | 57 (83,8) |
| Pacientes con ATB, según cantidad de ATB administrados, n (%) | |
| Ninguno/no constan | 8 (11,8) |
| Uno | 17 (25,0) |
| Dos | 16 (23,5) |
| Tres o más | 27 (39,7) |
| ATB administrados previamente, n | 130 |
| Penicilinas semisintéticas, n (%) | 7 (10,3) |
| Betalactámicos más inhibidores de betalactamasas, n (%) | 25 (36,8) |
| Cefalosporinas, n (%) | 16 (23,5) |
| Primera generación | 2 (2,9) |
| Segunda generación | 2 (2,9) |
| Tercera generación | 9 (13,2) |
| Cuarta generación | 3 (4,4) |
| Carbapenémicos, n (%) | 23 (33,8) |
| Aminoglucósidos, n (%) | 6 (8,8) |
| Quinolonas, n (%) | 10 (14,7) |
| Clindamicina, n (%) | 1 (1,5) |
| Glucopéptidos, n (%) | 6 (8,8) |
| Cotrimoxazol, n (%) | 1 (1,5) |
| Linezolid, n (%) | 11 (16,2) |
| Antimicrobianos específicos para la ICD, n (%) | |
| Metronidazol | 60 (88,2) |
| Vancomicina | 31 (45,6) |
| Vancomicina y metronidazol | 18 (26,5) |
| Antimicrobianos simultáneos a los administrados para tratar la ICD, n (%) | 24 (35,3) |
| Pacientes con efectos adversos relacionadas con ATB específicos, n (%) | 7 (10,3) |
| Alteración hidroelectrolítica (hipocalemia, hipomagnesemia) | 2 |
| Alteraciones hematológicas | 2 |
| Alteración de la función hepática | 1 |
| Otras | 3 |
ATB: antibióticos; ICD: infección por Clostridium difficile.
La respuesta clínica se consideró satisfactoria (curación y/o mejoría) en 51 casos (75,0%), y sin cambios o fracaso en 10 (14,7%), no siendo evaluable en otros 4 (5,9%) casos. Se logró la negativización microbiológica en 37 casos (61,7%), no se realizó seguimiento en 20 (29,4%) y se detectó persistencia en 2 (2,9%). En los pacientes tratados en monoterapia con metronidazol (36) la respuesta satisfactoria fue del 77,8%, con vancomicina (7) del 100% y con ambos antibióticos (18) del 61,1%. Solo se han identificado 2 casos de reinfección. La mortalidad global intra-UCI afectó a 17 (25,0%) pacientes, y otros 2 casos fallecieron en el hospital después del alta de UCI (mortalidad global hospitalaria de 19 [27,9%]. En ningún caso se ha podido relacionar la mortalidad con la ICD >(tablas 5 y 6).
Respuesta clínica y microbiológica al tratamiento específico para la infección por Clostridium difficile en pacientes ingresados en la Unidad de Cuidados Intensivos
| n=68 | |
| Respuesta clínica, n (%) | |
| Curación | 44 (64,7) |
| Mejoría | 7 (10,3) |
| Sin cambios (fallo) | 10 (14,7) |
| No evaluable | 4 (5,9) |
| Respuesta microbiológica, n (%) | |
| Negativización | 37 (61,7) |
| Persistencia | 2 (2,9) |
| Aparición de otros microorganismos | 1 (1,5) |
| No seguimiento | 20 (29,4) |
| Reinfección | 2 (2,9) |
La principal aportación de este estudio ha sido describir las características de los pacientes críticos ingresados en UCI españolas con ICD. En general se trata de pacientes con edad elevada, con enfermedad de base médica y numerosas comorbilidades, con un elevado nivel de gravedad en el momento del ingreso en UCI, que precisan de tratamiento con antibióticos de amplio espectro y que presentan diarreas líquidas, abundantes en la primera semana de estancia en la UCI. En el 62% de los casos se ha identificado su origen en dicha unidad.
Las tasas estimadas de ICD en los meses de abril a junio han sido de 1,6 por 1.000 pacientes ingresados en UCI y de 2,1 episodios por 10.000 estancias en UCI (pacientes-día). La mayoría de los estudios en pacientes de UCI hacen referencia a brotes epidémicos o endemias en uno o varios centros, o a análisis del impacto en la estancia, costes o mortalidad de la presencia de la ICD en una UCI en la que existía una alta proporción de pacientes con esta infección. Recientemente Bouza et al.18 han presentado en el European Congress of Clinical Microbiology and Infectious Diseases from the European Society of Clinical Microbiology and Infectious Diseases (abril de 2013, Berlín, Alemania) la tasa de ICD correspondiente a los últimos 10 años en las 4 UCI de un hospital general. La incidencia global de ICD fue de 13,2 casos por 10.000 días de estancia en UCI, con una clara tendencia a disminuir en los últimos años (de 15,9 en 2003 a 8,8 en 2012). Así mismo han demostrado la existencia de importantes diferencias en las tasas dependiendo de las características de las UCI, siendo las más altas las observadas en las UCI médicas y en la UCI de posoperados de cirugía cardiaca. Zahar et al.19 publicaron un estudio retrospectivo en el que valoran el impacto clínico de la ICD en pacientes ingresados en 3 UCI. Las tasas en su medio fueron de 13,1 casos por 1.000 pacientes (dato calculado) y de 3,6 casos de ICD adquirida en UCI por 1.000 pacientes-día. Lawrence et al.22 analizan de forma retrospectiva el impacto de la presión de colonización del C. difficile como factor de riesgo para desarrollar ICD. Identificaron una tasa de 35,3 nuevos casos por 1.000 pacientes ingresados más de 24h en UCI (dato calculado). En ambos estudios las tasas fueron superiores a las identificadas en nuestro registro. Ello puede ser debido a que en nuestro estudio se incluyen UCI con características y riesgos muy diferentes entre ellas y en las que no existía endemia por este patógeno. De hecho, solo una de cada 5 UCI (19%) que aportan datos al registro ha identificado casos de ICD.
Una posible causa de la disminución del diagnóstico de la ICD en nuestro medio puede ser la ausencia de una metodología de estudio preestablecida. En un estudio en un hospital español se ha demostrado que la aplicación de un programa de control y vigilancia ha duplicado la tasa de ICD25. En ese sentido se ha propuesto a nivel europeo y americano uniformizar la metodología de estudio ante la sospecha de una ICD, proponiéndose su búsqueda en todos los pacientes ingresados en UCI con diarreas consecutivas líquidas definidas como la presencia de 3 o más evacuaciones de heces no formadas en 24h consecutivas (o menos)26,27. Las muestras fecales acuosas, líquidas o no formadas deben ser enviadas con rapidez al Laboratorio de Microbiología para su estudio rutinario, en el que se incluirá la investigación del C. difficile.
En nuestro estudio las pruebas utilizadas para el diagnóstico de ICD han sido las habituales en cada Laboratorio de Microbiología, en las que han predominado los cultivos de heces, la determinación de la enzima glutamato deshidrogenasa, las pruebas de inmunoanálisis enzimático para las toxinas A y B, y, en menos ocasiones, la prueba de reacción en cadena de la polimerasa. Con la intención de homogeneizar la identificación de ICD se ha propuesto una metodología diagnóstica (algoritmo en 2 pasos) que debe adaptarse a las posibilidades de cada laboratorio26,27. Consiste, en primer lugar, en la determinación de la enzima glutamato deshidrogenasa, seguida, cuando es positiva, de la determinación mediante prueba de inmunoanálisis enzimático de las toxinas A y B. Solo cuando estas 2 son negativas se propone una tercera técnica más específica (reacción en cadena de la polimerasa o cultivos toxigénicos) o, como alternativa (más económica), el cultivo de heces y, en caso de positividad, la determinación directa de las toxinas en los aislados.
El tratamiento utilizado ha sido predominantemente en monoterapia con metronidazol y, en menos ocasiones, con vancomicina. La elección de metronidazol de forma preferente evidencia que la forma de presentación de la ICD es valorada como leve o moderada por los clínicos, ya que en las formas graves o complicadas se recomienda el tratamiento con vancomicina oral (o administrada a través del recto, si existe íleo), con o sin metronidazol de forma simultánea1. En una reciente revisión28 se han analizado los estudios que han valorado de forma comparativa la eficacia de los distintos antimicrobianos utilizados para tratar ICD. Todos ellos eran estudios de baja o moderada potencia y ninguno demostró diferencias entre ellos. Hay que destacar que hasta una cuarta parte de los tratamientos utilizados en nuestro estudio se ha realizado en combinación con ambos antibióticos, a pesar de que no existe ninguna evidencia de su efectividad. En 7 (10%) de los casos se han observado reacciones adversas que han sido atribuidas a los antibióticos administrados para el tratamiento de la ICD.
La respuesta clínica a los tratamientos instaurados ha sido valorada de forma satisfactoria (curación o mejoría) en el 75% de los casos. En el resto de las ocasiones no ha sido posible su evaluación o no se han observado cambios en pacientes que han fallecido por progresión de sus enfermedades de base. La mortalidad global intra-UCI ha sido del 25%, y en ningún caso se ha podido relacionar con la ICD. Diferentes estudios han analizado el impacto de la presencia de la ICD en la mortalidad de pacientes críticos. En la mayoría de ellos se demuestra que la presencia de ICD se asocia con una elevada mortalidad global intra-UCI y hospitalaria19–22,29, aunque cuando se realizan estudios comparativos (con pacientes con diarrea sin ICD o casos-control) no se observa ninguna relación entre la presencia de ICD y la mortalidad19,29.
La frecuencia de episodios de recurrencia de ICD se sitúa entre el 6 y el 25%1. La tasa de recurrencia en nuestro estudio ha sido baja, y ello puede ser debido a que una cuarta parte de los enfermos han fallecido, y solo se ha realizado el seguimiento de los pacientes hasta su alta del hospital.
Este estudio presenta importantes limitaciones, como es el hecho de que sea un estudio retrospectivo basado en el análisis de los casos reportados en un registro nacional de participación voluntaria. El registro de la ICD se ha incluido por primera vez en el año 2012, y ello puede haber motivado omisiones en registrar esta infección. Por otro lado, no se ha seguido un protocolo común para solicitar los estudios microbiológicos en pacientes de riesgo, y las pruebas aplicadas a las muestras de heces han variado entre los diferentes hospitales. Así mismo no se ha podido establecer ninguna relación entre la presencia de la ICD y la evolución.
En resumen, el estudio aporta información sobre las características de los pacientes con ICD ingresados en UCI españolas, así como de los tratamientos utilizados, en donde llama la atención que en una cuarta parte de los casos se utilizan 2 antibióticos de forma simultánea. Las tasas calculadas, inferiores a las publicadas por otros autores y a las esperadas atendiendo a los factores de riesgo específicos de ICD en estos enfermos, evidencian que esta infección está infradiagnosticada en los pacientes críticos ingresados en UCI. Es necesario consensuar una metodología de estudio (recogida y traslado de muestras y pruebas específicas en los laboratorios de Microbiología) ante la presencia de pacientes con heces líquidas en nuestro medio.
FinanciaciónM Palomar ha recibido una beca internacinal de Pfizer para el mantenimiento del registro ENVIN-UCI. F Alvarez-Lerma ha recibido una beca de Astella-Farma para la recogida y análisis de los datos referentes a la infección por Clostridium difficile.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosEl ENVIN-UCI es un registro promovido por el Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (GTEI-SEMICYUC), cuyo mantenimiento en el año 2012 se ha realizado gracias a una beca internacional de Pfizer S. A. El listado de centros participantes y los colaboradores en el registro están disponibles en el informe del año 2012, de libre acceso en: http://hws.vhebron.net/envin-helics/. El análisis de los casos de C. difficile se ha realizado en parte con el apoyo de Astella-Farma. Debemos agradecer la colaboración de Sergio Mojal, del Instituto Municipal de Investigación del Hospital del Mar, por su asesoramiento metodológico y análisis estadísticos.
Listado de los médicos responsables de las UCI que han cumplimentando los cuadernos de recogida de datos de los pacientes con ICD: A. Bonet, L. Saló (Clínica Girona); G. Aguilar, C. García Márquez (Hospital Clínico Universitario de Valencia); M.L. Mora, M. Lequona (Complejo Hospitalario Universitario de Canarias); A. Díaz, L. Pita, R. Arrojo (Complexo Hospitalario Universitario A Coruña); J.C. Montejo, M. Catalán (Hospital 12 de Octubre, Madrid); M.J. Castro, F.J. Rodríguez (Hospital Arquitecto Marcide, Ferrol, A Coruña); F. Esteve (Hospital de Bellvitge, Hospitalet de Llobregat, Barcelona); D. Fontaneda Lopez, S. Gutierrez (Hospital de León); E. Antón (Hospital de Manacor); I. Catalán (Hospital de Manresa Altaya, Barcelona); J. Almirall, M. de la Torre (Hospital de Mataró, Barcelona); J.L. Antón, C. Dolera (Hospital de Sant Joan, Alacant); M.B. López, M.B. Estévanez (Hospital del Tajo, Aranjuez, Madrid); J. Amador, M.T. Jurado (Hospital de Terrassa, Barcelona); A. Villasboas, A. Rey (Hospital del Mar, Barcelona); R. Reig (Hospital General de Castellón); A.M. Rodríguez, M. Sánchez Palacios (Hospital Insular de las Palmas, Canarias); B. Gil, N. Llamas (Hospital Morales Massaguer, Murcia); J.A. Cambronero, M. Daguerre (Hospital Príncipe de Asturias, Alcalá de Henares, Madrid); A. Blanco (Hospital Universitario Central de Asturias, Oviedo); J.R. Iruretagoyena, M. Domezaín (Hospital Universitario de Cruces, Vizcaya); A. Abella, F. Gordo (Hospital Universitario de Henares, Madrid); P. Albert de la Cruz, E. García (Hospital Universitario del Sureste, Arganda del Rey, Madrid); S. Alcántara, I. Fernández Simón (Hospital Universitario Puerta de Hierro, Majadahonda, Madrid); A.J. Pontes, J.C. Pozo (Hospital Universitario Reina Sofía, Córdoba); Á. López, C. Susarte (Hospital Universitario Reina Sofía, Murcia); M. Palomar, C. Laborda (Hospital Vall d’Hebron, Barcelona); A. Martinez Pellús, E. Andreu (Hospital Virgen de la Arrixaca, Murcia); M.P. Posada (Hospital Xeral de Vigo); R. Ferrer (Mútua de Terrassa, Barcelona); J.M. Quiroga, M. Sadaba (Hospital de Cabueñes, Gijón); A.M. Mendía Gorostidi (Hospital de Donostia Ntra. Sra. de Aranzazu, San Sebastián); A. Rovira (Hospital General de Hospitalet, Barcelona); H. Abdel-Hadi (Hospital General, Ciudad Real).