La pandemia de la COVID-19 ha supuesto una amenaza de colapso de los servicios hospitalarios y de unidades de cuidado intensivo (UCI), así como una reducción de la dinámica asistencial de pacientes afectados por otras patologías. El objetivo fue desarrollar un modelo matemático diseñado para optimizar las predicciones relacionadas con las necesidades de hospitalización e ingresos en UCI por la COVID-19.
DiseñoEstudio prospectivo.
ÁmbitoProvincia de Granada (España).
PacientesPacientes de COVID-19 hospitalizados, ingresados en UCI, recuperados y fallecidos desde el 15 de marzo hasta el 22 de septiembre del 2020.
IntervencionesDesarrollo de un modelo matemático tipo susceptible, expuesto, infectado y recuperado (SEIR) capaz de predecir la evolución de la pandemia, considerando las medidas de salud pública establecidas.
Variables de interésNúmero de pacientes infectados por SARS-CoV-2, hospitalizados e ingresados en UCI por la COVID-19.
ResultadosA partir de los datos registrados, hemos podido desarrollar un modelo matemático que refleja el flujo de la población entre los diferentes grupos de interés en relación con la COVID-19. Esta herramienta permite analizar diferentes escenarios basados en medidas de restricción socio-sanitarias y pronosticar el número de infectados, hospitalizados e ingresados en UCI.
ConclusionesEl modelo matemático es capaz de proporcionar predicciones sobre la evolución de la COVID-19 con suficiente antelación como para poder conjugar los picos de prevalencia y de necesidades de asistencia hospitalaria y de UCI, con la aparición de ventanas temporales que posibiliten la atención de enfermos no-COVID.
The COVID-19 pandemic has threatened to collapse hospital and ICU services, and it has affected the care programs for non-COVID patients. The objective was to develop a mathematical model designed to optimize predictions related to the need for hospitalization and ICU admission by COVID-19 patients.
DesignProspective study.
SettingProvince of Granada (Spain).
PopulationCOVID-19 patients hospitalized, admitted to ICU, recovered and died from March 15 to September 22, 2020.
Study variablesThe number of patients infected with SARS-CoV-2 and hospitalized or admitted to ICU for COVID-19.
ResultsThe data reported by hospitals was used to develop a mathematical model that reflects the flow of the population among the different interest groups in relation to COVID-19. This tool allows to analyse different scenarios based on socio-health restriction measures, and to forecast the number of people infected, hospitalized and admitted to the ICU.
ConclusionsThe mathematical model is capable of providing predictions on the evolution of the COVID-19 sufficiently in advance as to anticipate the peaks of prevalence and hospital and ICU care demands, and also the appearance of periods in which the care for non-COVID patients could be intensified.
Los coronavirus causan enfermedades respiratorias e intestinales en numerosas especies animales. En humanos, cuatro producen infecciones respiratorias de las vías altas (OC43, HKU1, 229E y NL63) y dos pueden causar síndromes respiratorios severos (SARS-CoV-1 y MERS-CoV)1. Sin embargo, en diciembre de 2019, las autoridades chinas informaron de diferentes casos de síndrome respiratorio en Wuhan que posteriormente fueron atribuidos a infecciones del nuevo coronarivus 2 del síndrome respiratorio agudo (SARS-CoV-2), el agente causante de la enfermedad por coronarivus 2019 (COVID-19)2,3. Desde la declaración de pandemia realizada por la Organización Mundial de la Salud, y hasta el 27 de enero del 2021, se han confirmado 99.363.697 casos acumulados y 2.135.959 fallecimientos en todo el mundo4.
La aplicación de medidas no farmacéuticas, como el distanciamiento social, el empleo de mascarillas faciales, la mejora de los hábitos de higiene, los confinamientos perimetrados, confinamientos domiciliarios, el cierre de servicios no esenciales, las restricciones de movilidad, etc., tienen especial importancia por generar un impacto directo en la velocidad de propagación de la enfermedad5–7. De hecho, los indicadores sobre la evolución de la COVID-19 mejoraron sensiblemente en España a las dos semanas de la declaración institucional de cuarentena del 14 de marzo del 2020, y mostraron, además, cómo en regiones que se encontraban en estadios iniciales de pandemia en el momento del confinamiento, como Ceuta y Melilla, presentaron tasas de defunción muy inferiores respecto a otras que partían de una transmisión más acentuada, como Cataluña. Lo mencionado anteriormente refleja el importante efecto diferencial de las medidas cuando se adoptan de forma temprana8. Además de las consecuencias derivadas de la afectación poblacional por la COVID-19, la pandemia reduce de forma muy importante la dinámica asistencial de pacientes aquejados de otras patologías.
Para conseguir una adecuada planificación, es necesario emplear herramientas que permitan predecir la evolución de la COVID-19 en función de la situación de partida, y de las medidas no farmacéuticas y de salud pública instauradas en cada momento, y que sean capaces de alertar sobre los posibles escenarios de transmisión. Las herramientas deben propiciar el diseño de la aplicación y temporalización de medidas con suficiente antelación como para poder conjugar los picos de prevalencia y de necesidades de asistencia hospitalaria y de unidades de cuidados intensivos (UCI) por la COVID-19, con la aparición de ventanas temporales que posibiliten la atención de enfermos no-COVID.
En el presente artículo, presentamos un modelo matemático diseñado para predecir la dinámica de transmisión de la COVID-19 y las necesidades de hospitalización e ingresos en UCI, que ha sido calibrado y validado, empleando datos proporcionados por los hospitales de la provincia de Granada, los cuales dan conjuntamente una cobertura asistencial a 914.678 habitantes9. Además, presentamos estimaciones de tres escenarios basados en diferentes programas de medidas de contención socio-sanitarias.
Pacientes y métodosPacientesLos datos registrados proceden de los hospitales de la provincia de Granada H.U. Virgen de las Nieves, H.U. Clínico San Cecilio, H.U. Santa Ana en Motril, H.U. de Baza, H. de San Rafael y H.L.A. Inmaculada. Para ello, contamos con la aprobación por parte del Comité de Ética de la Investigación Biomédica de la provincia de Granada dependiente de la Consejería de Salud y Familias de la Junta de Andalucía. Recopilamos el número de hospitalizados, ingresados en UCI, recuperados y fallecidos.
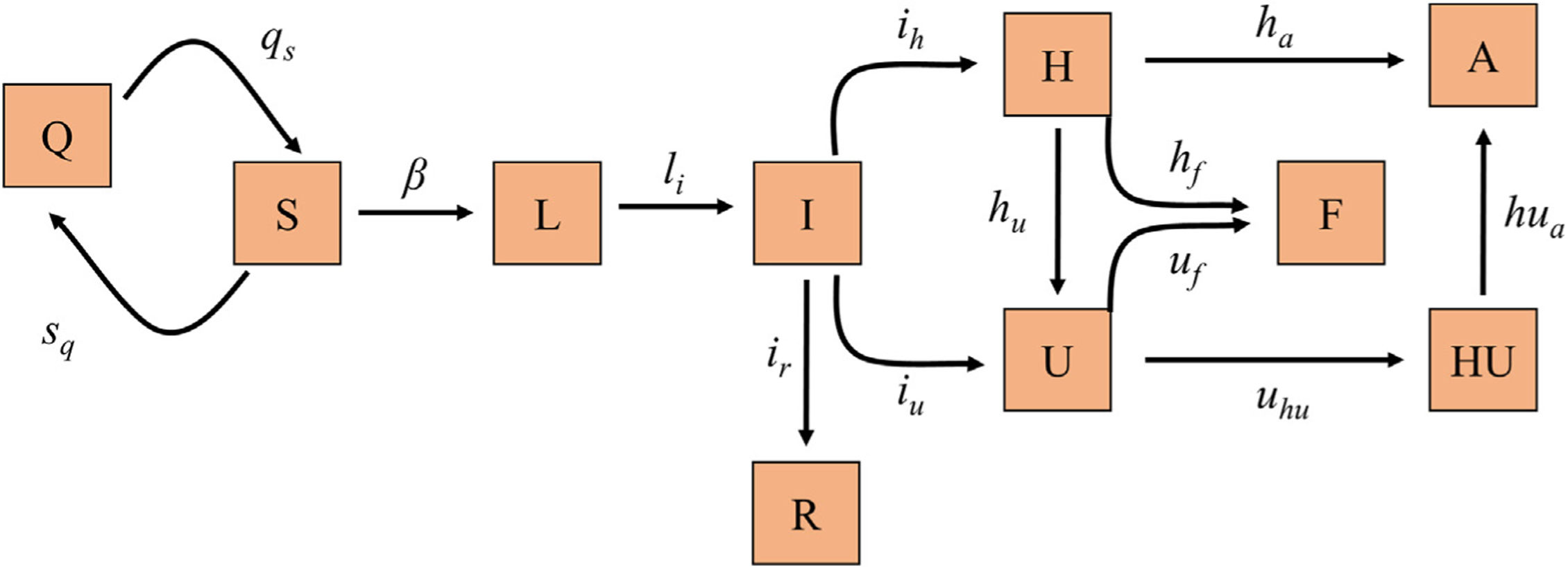
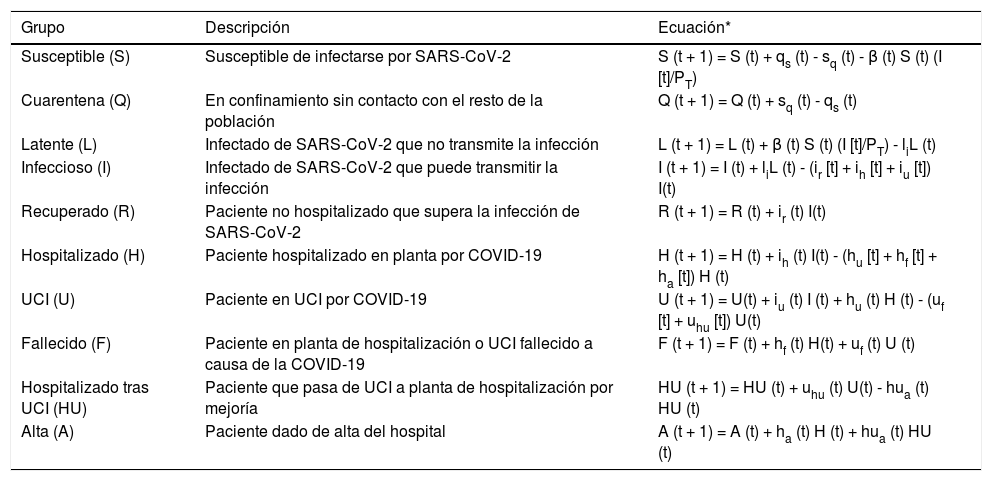
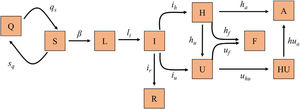
Modelo matemático, calibración y validaciónHemos implementado un modelo susceptible, expuesto, infectado y recuperado (SEIR) diseñado específicamente para describir la dinámica de la epidemia a nivel poblacional y a nivel del circuito hospitalario en relación con los pacientes de COVID-19 (hospitalizaciones en planta y UCI), ya que es el aspecto más limitante a la hora de hacer frente a la pandemia, debido a los recursos materiales y personales que requiere (fig. 1). La tabla 1 recoge los diferentes grupos en los que se puede segregar a la población respecto a la infección y el circuito hospitalario, junto con las ecuaciones en diferencias que describen la dinámica de cada grupo a lo largo del tiempo.
Diagrama del modelo SEIR implementado para la predicción de la transmisión de la COVID-19. Cada caja representa uno de los diferentes grupos en los que se puede segregar a la población respecto a la infección y la enfermedad. Los parámetros de las flechas representan las tasas de transmisión entre los grupos anexos.
A: Alta; F: Fallecido; H: Hospitalizado; HU: Hospitalizado tras UCI; I: Infeccioso; L: Latente; Q: Cuarentena; R: Recuperado; S: Susceptible; U: UCI.
Grupos de población en relación con la infección por el virus SARS-CoV-2 y con la evolución de la COVID-19, y ecuaciones que predicen en cada momento la cuantificación de cada grupo
| Grupo | Descripción | Ecuación* |
|---|---|---|
| Susceptible (S) | Susceptible de infectarse por SARS-CoV-2 | S (t + 1) = S (t) + qs (t) - sq (t) - β (t) S (t) (I [t]/PT) |
| Cuarentena (Q) | En confinamiento sin contacto con el resto de la población | Q (t + 1) = Q (t) + sq (t) - qs (t) |
| Latente (L) | Infectado de SARS-CoV-2 que no transmite la infección | L (t + 1) = L (t) + β (t) S (t) (I [t]/PT) - liL (t) |
| Infeccioso (I) | Infectado de SARS-CoV-2 que puede transmitir la infección | I (t + 1) = I (t) + liL (t) - (ir [t] + ih [t] + iu [t]) I(t) |
| Recuperado (R) | Paciente no hospitalizado que supera la infección de SARS-CoV-2 | R (t + 1) = R (t) + ir (t) I(t) |
| Hospitalizado (H) | Paciente hospitalizado en planta por COVID-19 | H (t + 1) = H (t) + ih (t) I(t) - (hu [t] + hf [t] + ha [t]) H (t) |
| UCI (U) | Paciente en UCI por COVID-19 | U (t + 1) = U(t) + iu (t) I (t) + hu (t) H (t) - (uf [t] + uhu [t]) U(t) |
| Fallecido (F) | Paciente en planta de hospitalización o UCI fallecido a causa de la COVID-19 | F (t + 1) = F (t) + hf (t) H(t) + uf (t) U (t) |
| Hospitalizado tras UCI (HU) | Paciente que pasa de UCI a planta de hospitalización por mejoría | HU (t + 1) = HU (t) + uhu (t) U(t) - hua (t) HU (t) |
| Alta (A) | Paciente dado de alta del hospital | A (t + 1) = A (t) + ha (t) H (t) + hua (t) HU (t) |
qs, sq, li, ir, ih, iu, hu, hf, ha, uf, uhu, hf y hua se corresponden con las tasas de transición entre grupos de sujetos/pacientes. β es la tasa de transmisión entre susceptible (S) e infectado (I), y su valor es proporcional a la magnitud del número básico de reproducción R0, según la expresión: R0 = β/(ir + ih + iu). PT es la población de la provincia de Granada.
El paso entre grupos viene determinado por las tasas de transición qs, sq, li, ir, ih, iu, hu, hf, ha, uf, uhu, hf y hua. β es la tasa de transmisión entre susceptible (S) e infectado (I), y su valor es proporcional a la magnitud del número de reproducción básico R0, según la expresión: R0 = β/(ir + ih + iu). Durante el proceso de calibración del modelo, a partir de los registros hospitalarios, pudimos determinar el valor de las diferentes tasas de transición y de la tasa de transmisión (β) necesarias para que el modelo sea capaz de describir la situación específica de la provincia de Granada, empleando para ello el algoritmo de optimización Novelty Swarm implementado en Python310. El valor de sq y qs se estableció atendiendo al cambio en los flujos de desplazamientos recogidos en el «Informe de Movilidad Local sobre la COVID-19» de Google11, en el período de confinamiento domiciliario decretado por el gobierno español el 14 de marzo del 202012. La calibración se realizó utilizando registros de pacientes hospitalizados, ingresados en UCI, recuperados y fallecidos entre el 15 de marzo y el 22 de septiembre del 2020, y que alcanzó un tamaño muestral total de 1.064 casos. Dado que el modelo también tiene en cuenta a los sujetos que no han sido diagnosticados, para calibrar el número de infectados se han empleado los datos del estudio de seroprevalencia de las provincias españolas para Granada13.
Para obtener un valor robusto de los parámetros, se realizaron 600 procesos de calibración que proporcionaron los correspondientes 600 conjuntos de parámetros que describían la situación epidemiológica específica de la provincia de Granada hasta el 22 de septiembre del 2020. A partir de las 600 estimaciones, obtuvimos la media y el intervalo de confianza del 95% tanto de los parámetros como de las predicciones. Una vez finalizada la calibración, validamos el modelo, comparando los datos predichos con aquellos registrados entre el 23 de septiembre y el 7 de noviembre del 2020, que asciendieron a 956 pacientes.
Predicciones proporcionadas por el modeloGeneramos tres escenarios, atendiendo a medidas no farmacéuticas para simular la evolución más probable de la pandemia, y para determinar las condiciones más favorables para conjugar los picos y valles de prevalencia y de necesidades de hospitalización y de ingresos en UCI. El escenario inicial representa la evolución predicha, tomando en cuenta las restricciones que fueron establecidas para la provincia de Granada cuando se encontraba en nivel 4 fase 2, lo que conllevó el cese temporal de servicios no esenciales, restricción del horario comercial y de movilidad, y confinamiento perimetral14. Estas medidas fueron decretadas para dos semanas a partir del día 10 de noviembre del 2020. En nuestras simulaciones, consideramos que dichas medidas tendrían un impacto que, en el mejor de los casos, podría igualar a la Rt que apareció en Cataluña tras la aplicación de medidas similares establecidas el 30 de octubre del 2020 y cuyo valor se situó en torno a 0,815. Los otros dos escenarios adicionales fueron escogidos entre muchas simulaciones, ya que permiten analizar los efectos de la dilatación temporal de las medidas de contención y el establecimiento de diferentes períodos de restricciones. El modelo ha sido programado para cuantificar en cada escenario el valor esperado diario en cada grupo (S, cuarentena [Q], alta [A], fallecido [F], hospitalizado [H], hospitalizado tras UCI [HU], I, latente [L], recuperado [R], UCI [U]), y el intervalo de confianza del 95% (percentiles 2,5 a 97,5).
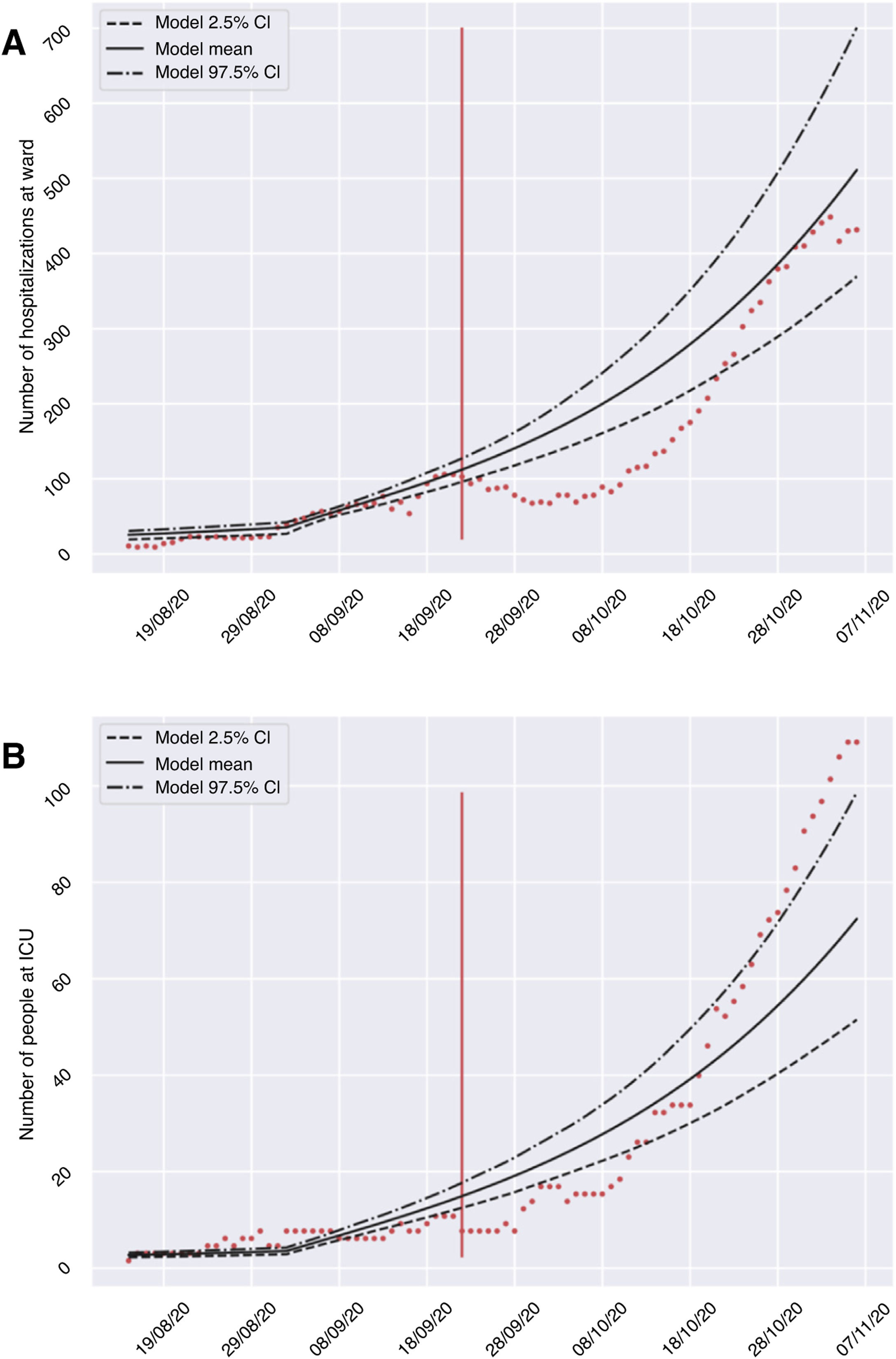
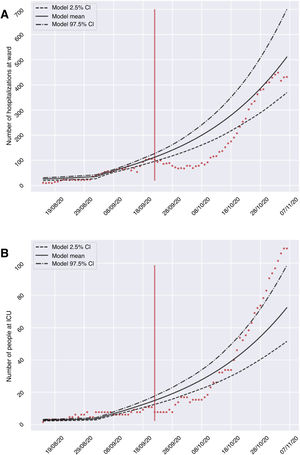
ResultadosEl modelo desarrollado nos permitió establecer diferentes escenarios de aplicación de medidas de restricción y prever la evolución del número de infectados, ingresos hospitalarios y en UCI (tabla 2), considerando una R0 de 0,8. La fase de calibración y validación del modelo mostró la validez de las predicciones proporcionadas tras comparar los casos esperados y registrados de hospitalizaciones e ingresos en UCI durante el período del 23 de septiembre y 7 de noviembre del 2020. En la figura 2 podemos observar que, a pesar de que no todos los recuentos están dentro del intervalo de confianza, el crecimiento de ambas curvas tiene una forma muy similar. Es por ello, que el modelo puede ser capaz de obtener una tendencia clara de la evolución del circuito hospitalario que permita valorar de forma cualitativa la evolución de la pandemia. A continuación, presentamos un resumen de la evolución prevista en los tres escenarios modelizados el día 10 de noviembre del 2020, en el que todas las referencias numéricas representan el resultado de la media ofrecida por el modelo.
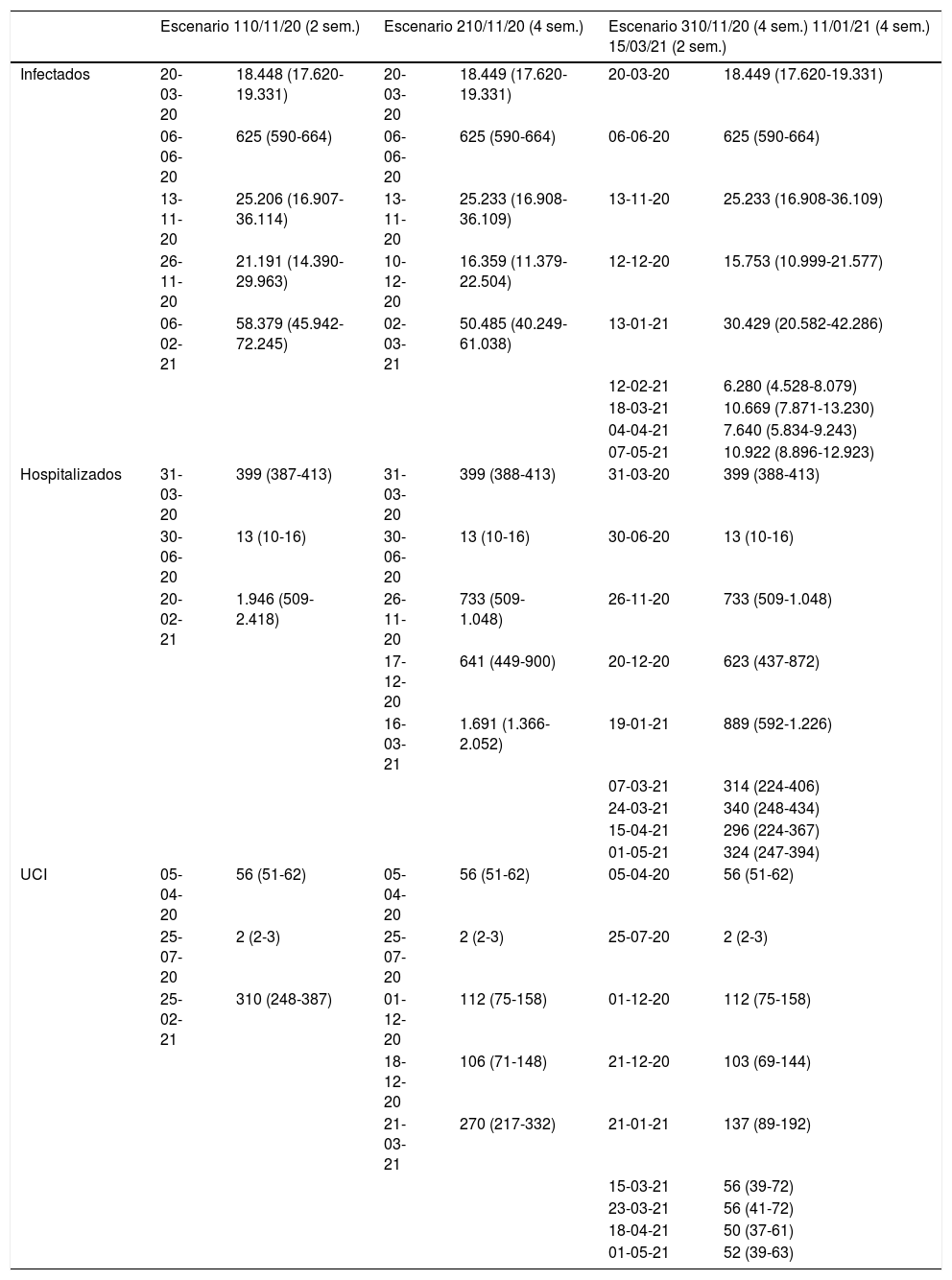
Número de infectados de SARS-CoV-2, hospitalizados e ingresados en UCI previstos por el modelo matemático a fecha de 10 de noviembre del 2020 para tres escenarios que difieren en el calendario y en la duración de la aplicación de medidas de restricción para la provincia de Granada
| Escenario 110/11/20 (2 sem.) | Escenario 210/11/20 (4 sem.) | Escenario 310/11/20 (4 sem.) 11/01/21 (4 sem.) 15/03/21 (2 sem.) | ||||
|---|---|---|---|---|---|---|
| Infectados | 20-03-20 | 18.448 (17.620-19.331) | 20-03-20 | 18.449 (17.620-19.331) | 20-03-20 | 18.449 (17.620-19.331) |
| 06-06-20 | 625 (590-664) | 06-06-20 | 625 (590-664) | 06-06-20 | 625 (590-664) | |
| 13-11-20 | 25.206 (16.907-36.114) | 13-11-20 | 25.233 (16.908-36.109) | 13-11-20 | 25.233 (16.908-36.109) | |
| 26-11-20 | 21.191 (14.390-29.963) | 10-12-20 | 16.359 (11.379-22.504) | 12-12-20 | 15.753 (10.999-21.577) | |
| 06-02-21 | 58.379 (45.942-72.245) | 02-03-21 | 50.485 (40.249-61.038) | 13-01-21 | 30.429 (20.582-42.286) | |
| 12-02-21 | 6.280 (4.528-8.079) | |||||
| 18-03-21 | 10.669 (7.871-13.230) | |||||
| 04-04-21 | 7.640 (5.834-9.243) | |||||
| 07-05-21 | 10.922 (8.896-12.923) | |||||
| Hospitalizados | 31-03-20 | 399 (387-413) | 31-03-20 | 399 (388-413) | 31-03-20 | 399 (388-413) |
| 30-06-20 | 13 (10-16) | 30-06-20 | 13 (10-16) | 30-06-20 | 13 (10-16) | |
| 20-02-21 | 1.946 (509-2.418) | 26-11-20 | 733 (509-1.048) | 26-11-20 | 733 (509-1.048) | |
| 17-12-20 | 641 (449-900) | 20-12-20 | 623 (437-872) | |||
| 16-03-21 | 1.691 (1.366-2.052) | 19-01-21 | 889 (592-1.226) | |||
| 07-03-21 | 314 (224-406) | |||||
| 24-03-21 | 340 (248-434) | |||||
| 15-04-21 | 296 (224-367) | |||||
| 01-05-21 | 324 (247-394) | |||||
| UCI | 05-04-20 | 56 (51-62) | 05-04-20 | 56 (51-62) | 05-04-20 | 56 (51-62) |
| 25-07-20 | 2 (2-3) | 25-07-20 | 2 (2-3) | 25-07-20 | 2 (2-3) | |
| 25-02-21 | 310 (248-387) | 01-12-20 | 112 (75-158) | 01-12-20 | 112 (75-158) | |
| 18-12-20 | 106 (71-148) | 21-12-20 | 103 (69-144) | |||
| 21-03-21 | 270 (217-332) | 21-01-21 | 137 (89-192) | |||
| 15-03-21 | 56 (39-72) | |||||
| 23-03-21 | 56 (41-72) | |||||
| 18-04-21 | 50 (37-61) | |||||
| 01-05-21 | 52 (39-63) | |||||
* Para cada uno de los 3 escenarios se presenta la fecha de implantación y la duración de las medidas de restricción, así como la fecha y el número de pacientes y el intervalo de confianza de infectados, hospitalizados o en UCI correspondientes a los puntos de inflexión, pico (máximos) o valle (mínimos), que aparecerían a lo largo de la predicción.
Sem: semanas; UCI: unidad de cuidados intensivos.
Validación del modelo matemático, comparando el número de hospitalizados (A) e ingresados en UCI (B) en los hospitales de la provincia de Granada durante el período 23 de septiembre y 7 de noviembre del 2020 (puntos rojos), respecto a la media e intervalo de confianza predicho por el modelo para dicho período.
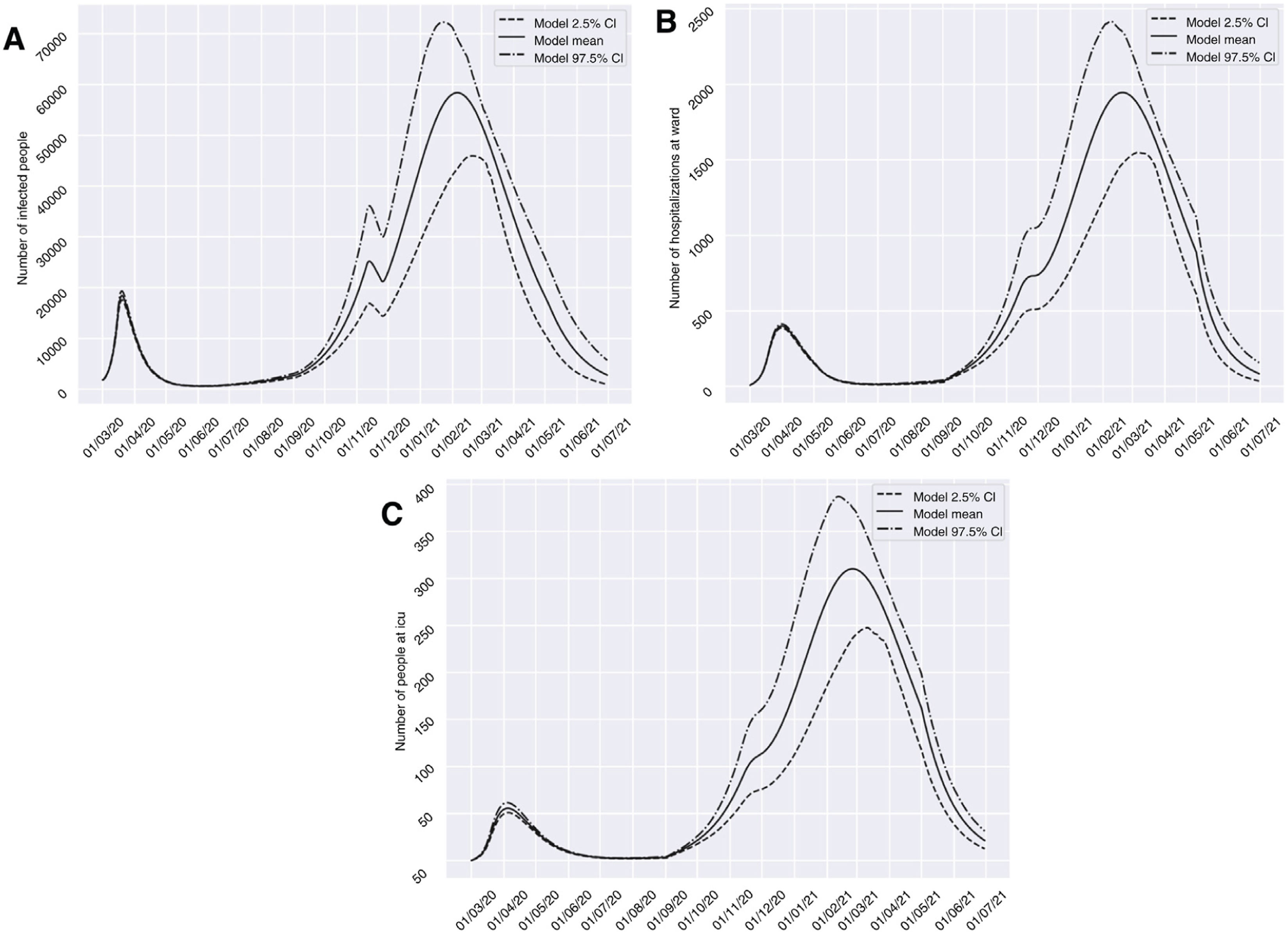
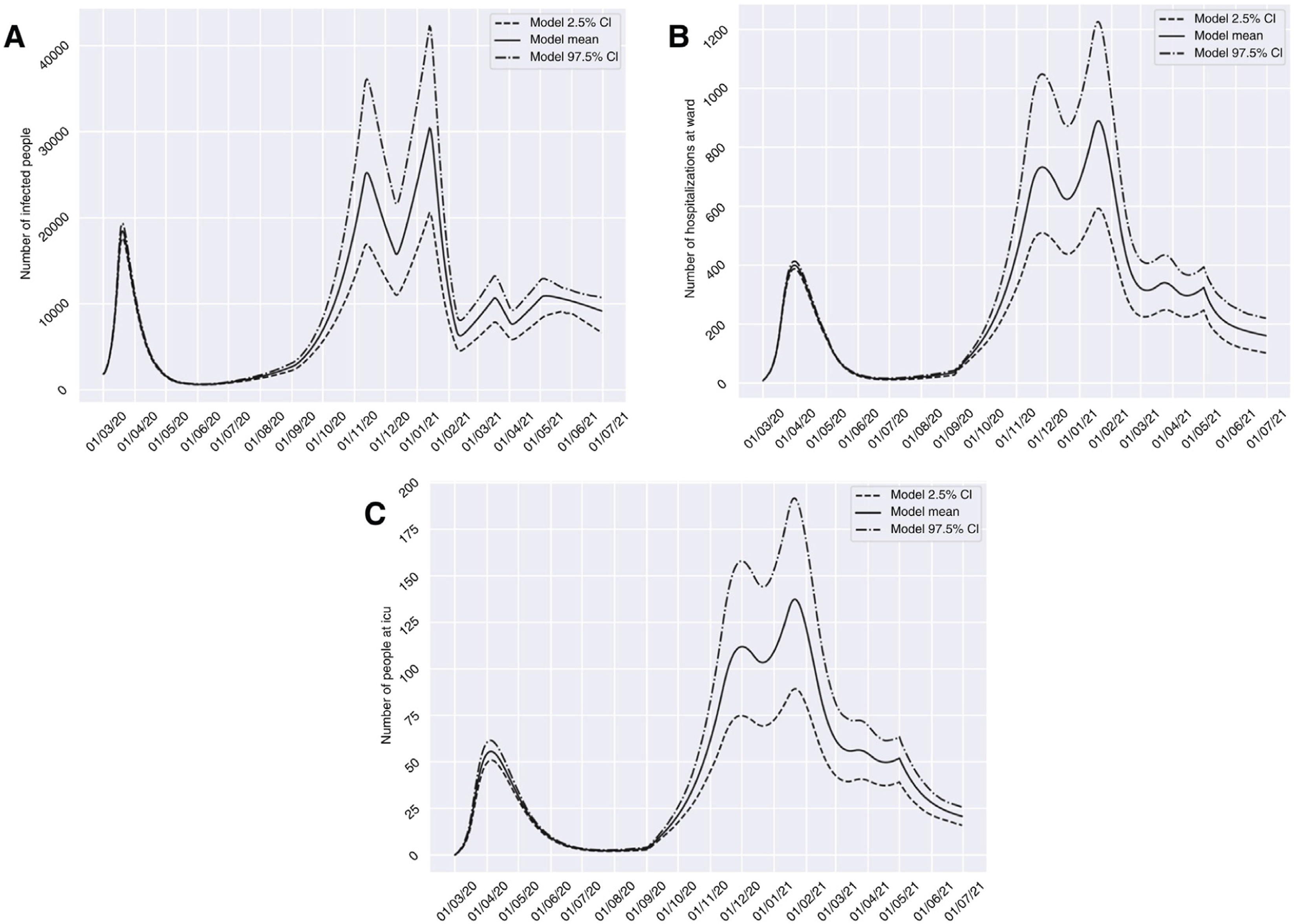
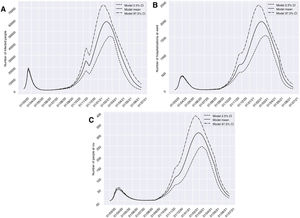
El escenario 1 se correspondería con una situación de restricciones socio-sanitarias similares a las que fueron establecidas durante dos semanas a partir del día 10 de noviembre del 2020 en Granada. En este contexto, el grupo I habría alcanzado un pico de 58.379 afectados el 6 de febrero del 2021, un dato de prevalencia que es más de tres veces superior respecto a lo registrado durante el pico que apareció en marzo (18.448 el 20 de marzo del 2020). Solo encontraríamos una breve reducción de la tendencia de aumento de infectados a finales de octubre (26 de octubre del 2020), antes de volver a experimentar un incremento exponencial de casos. Respecto a los grupos H y U, la medida de restricción de dos semanas no conseguiría generar un valle que reduzca la presión hospitalaria y aparecería un pico de 1.946 (20 de febrero del 2021) y 310 (25 de febrero del 2021) casos, respectivamente. Dicho volumen superaría de forma importante el número de pacientes hospitalizados y en UCI atendidos en el pasado período de marzo a abril del 2020 (fig. 3). Cabe matizar que la presión hospitalaria durante la primea ola, aunque elevada, no llegó a saturar los recursos hospitalarios de la provincia, ya que se decretó confinamiento domiciliario cuando la prevalencia en la provincia se encontraba en sus estadíos iniciales13.
Predicciones de prevalencia de infectados por SARS-CoV-2, hospitalizados e ingresos en UCI para la provincia de Granada considerando 2 semanas de restricciones en servicios no esenciales desde el 10-11-2020 (escenario 1). Se representa el número de infectados (A), hospitalizados (B) e ingresos en UCI (C) a lo largo del tiempo.
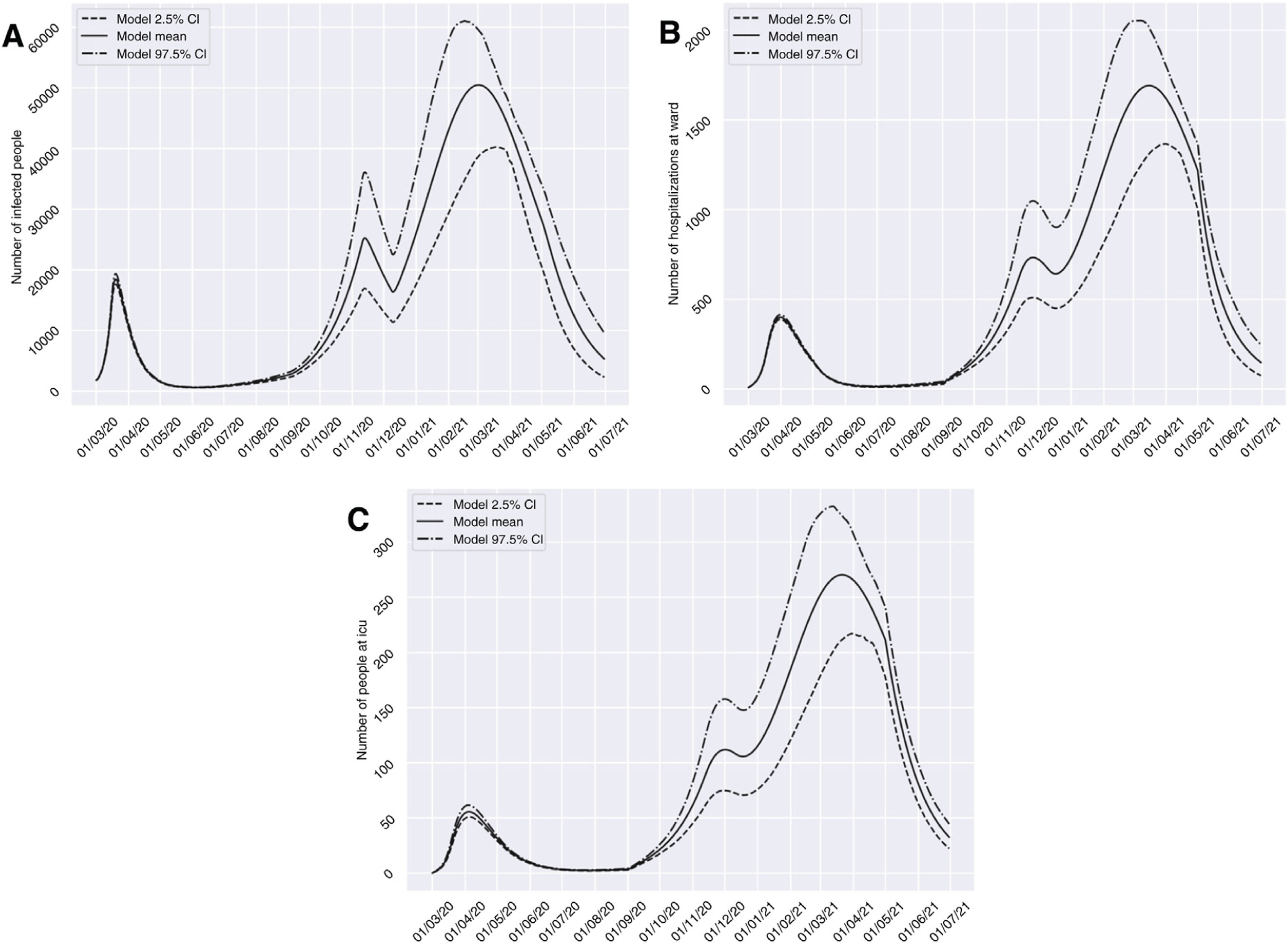
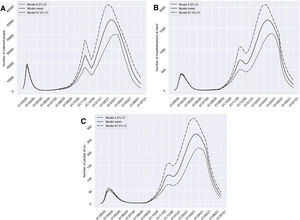
Si consideramos el escenario 2, con una dilatación de las restricciones hasta un total de cuatro semanas desde el 10 de noviembre del 2020, el número de afectados se reduciría durante el período del 13 de noviembre al 10 de diciembre del 2020, pasando de 25.233 a 16.359 casos. No obstante, encontraríamos un pico elevado de prevalencia de 50.485 casos más tarde respecto al pico estimado para el escenario anterior (2 de marzo del 2021). Con respecto al grupo H y U aparecería un comportamiento similar, con una reducción acentuada en el número de casos en los períodos del 26 de noviembre/17 de diciembre del 2020, pasando de 733 (IC 95% 509 a 1.048) a 641 (IC 95% 449 a 900) casos, y del primero al 18 de diciembre del 2020, disminuyendo de 112 (IC 95% 75 a 158) a 106 (IC 95% 71 a 148) casos, respectivamente. En ambos grupos encontraríamos un pico en marzo del 2021, que superaría más de cuatro veces el número de pacientes hospitalizados y en UCI atendidos en el pasado período marzo-abril del 2020 (fig. 4).
Predicciones de prevalencia de infectados por SARS-CoV-2, hospitalizados e ingresos en UCI para la provincia de Granada considerando 4 semanas de restricciones en servicios no esenciales desde el 10-11-2020 (escenario 2). Se representa el número de infectados (A), hospitalizados (B) e ingresos en UCI (C) a lo largo del tiempo.
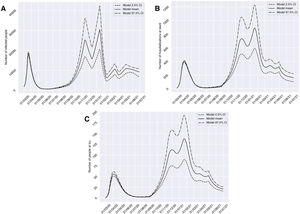
El escenario 3 presenta la evolución de casos, atendiendo a un calendario de aplicación de medidas de restricción socio-sanitaria por fases, que fue escogido después de analizar numerosos escenarios posibles. Este contexto contemplaría tres períodos: cuatro semanas a partir del día 10 de noviembre del 2020 de restricciones en servicios no esenciales; cuatro semanas a partir del día 11 de enero del 2021 con un confinamiento poblacional del 70%; y dos semanas a partir del día 15 de marzo del 2021 de restricciones en servicios no esenciales. Para este escenario, el modelo mostró una evolución creciente y más suave que los anteriores hasta enero, momento en el que encontraríamos 30.429 en el grupo I (13 de enero del 2021), 889 en el H (19 de enero del 2021) y 137 en el U (21de enero del 2021). Además, en diciembre observaríamos una reducción relevante de casos en los tres grupos, que estaría más acentuada en el I, que pasaría de 25.233 casos el 13 de noviembre del 2020 a 15.753 el 12 de diciembre del 2020. A partir de enero, el número de casos se iría reduciendo con puntos alternantes de picos y valles hasta llegar a mayo, cuando aparecerían 10.922 en el grupo I (7 de mayo del 2021), 324 en el H (1 de mayo del 2021) y 52 en el U (1 de mayo del 2021) (fig. 5).
Predicciones de prevalencia de infectados por SARS-CoV-2, hospitalizados e ingresos en UCI para la provincia de Granada considerando: 4 semanas a partir del día 10/11/20 de restricciones en servicios no esenciales; 4 semanas a partir del día 11/01/21 con un confinamiento poblacional del 70%; y 2 semanas a partir del día 15/03/21 de restricciones en servicios no esenciales (escenario 3). Se representa el número de infectados (A), hospitalizados (B) e ingresos en UCI (C) a lo largo del tiempo.
La compleja situación asistencial debido a la actual pandemia COVID-19 se potencia por la importante afectación del normal funcionamiento de la atención sanitaria y hospitalaria16–18, y por el elevado coste de oportunidad que se ha producido en relación con muchas patologías graves que han dejado de atenderse de forma óptima. El adecuado tratamiento y seguimiento de ciertos grupos de pacientes cobra especial importancia debido a que parecen representar comorbilidades correlacionadas con las necesidades de ingresos hospitalarios y en UCI de infectados por SARS-CoV-2, tales como la hipertensión, enfermedades crónicas cardiacas, diabetes, enfermedades crónicas pulmonares y obesidad19.
El control de la primera ola de la COVID-19 se realizó mediante la aplicación de medidas extremas de restricción poblacional al amparo del decreto de estado de alarma del 14 de marzo del 202013. Las medidas establecidas incluyeron un confinamiento domiciliario de siete semanas, seguido de cuatro fases de desconfinamiento hasta alcanzar la llamada «nueva normalidad» el 21 de junio del 202020. Durante este período se produjo una reorganización de los sistemas sanitarios para encajar la atención prioritaria de pacientes COVID-19, sobrepasando ampliamente los límites estratégicos y operacionales de dichos sistemas, y relegando a un segundo plano la atención del resto de patologías graves y no graves que representan la habitual cartera de servicios ofertada por nuestros centros sanitarios, al igual que lo acontecido en otros países de nuestro entorno21–25.
La presencia del virus SARS-CoV-2 en nuestro medio se ha mantenido constante tras la finalización de la primera ola epidémica en España26. Como consecuencia de ello, la endemización de la enfermedad en Europa es un hecho no discutible, alternándose fases temporales de mínima incidencia de la infección, con otras fases de estallido epidémico exponencial27. Este patrón epidemiológico que describe la dinámica temporal de la pandemia COVID-19 se mantendrá, con elevada probabilidad, hasta la suficiente extensión de las campañas de vacunación28 y/o el desarrollo de una apropiada inmunidad poblacional29.
Por todo ello, es necesario disponer de una estrategia conjunta de salud pública, que debe contemplar dos aspectos fundamentales. Por un lado, hay que desarrollar una vía asistencial COVID-19 que asegure una adecuada atención de estos pacientes, tanto en régimen ambulatorio como de ingreso hospitalario o en UCI y, por otro lado, el desarrollo de una vía asistencial no COVID-19, que propicie reducir al máximo el coste de oportunidad relativo al resto de patologías graves, que consiga amortiguar el incremento sustancial de la morbi-mortalidad asociada30–32.
El coste de oportunidad acumulado del resto de patologías graves durante el tiempo que duró las dos primeras oleadas de COVID-19 y la fase de recuperación/normalización de las instituciones sanitarias puso de manifiesto la imposibilidad de mantener una adecuada atención poblacional fuera de la desbordante COVID-19. Esta situación de incapacidad de mantener ambos circuitos (COVID-19/no-COVID), incluso con el refuerzo de las estructuras sanitarias, es un hecho evidenciable por el porcentaje de recursos dirigidos a pacientes COVID-1933. Además, el problema ético derivado de la polarización del sistema hacia el tratamiento de la pandemia ha constituido un importante foco de discusión34–36.
La identificación del comportamiento poblacional del virus en picos y valles resulta de especial trascendencia para una correcta planificación. De forma lógica, y preservando una atención de calidad para los pacientes urgentes/emergentes de las distintas patologías graves, puede organizarse la asistencia como períodos alternantes de focalización asistencial37,38. Así, durante los picos se intensificaría la atención a la COVID-19, reduciendo, proporcionalmente a la magnitud de los mismos, la asistencia sanitaria de las personas estables con otras patologías. Por el contrario, durante las fases de valle, intensificaríamos, por encima del estándar habitual, la actividad clínica dirigida a padecimientos no-COVID, aprovechando plenamente la ventana de oportunidad generada.
En este sentido, el modelo matemático que presentamos en este artículo puede contribuir de manera importante a la toma de decisiones relacionadas con la aplicación de medidas y su calendario. Posibilita la planificación, analizando los escenarios que las distintas estrategias de control pueden generar. El modelo ha sido diseñado para optimizar las predicciones relacionadas con las necesidades de hospitalización y de ingresos en UCI, aspectos más limitantes para mantener una adecuada atención de los circuitos COVID-19 y no-COVID.
Además, el modelo tiene una construcción modular, de manera que es posible incorporar otros grupos en función de la aparición de nuevos factores que influyan de forma importante en la dinámica de transmisión del virus, como podría ser una campaña de vacunación frente al SARS-CoV-239, y su porcentaje de eficacia asociado. La inmunidad comunitaria se definiría con una tasa de 1 – (1 / R0)40. Teniendo en cuenta las tasas de contagio obtenidas mediante el calibrado del modelo, sin la aplicación de medidas drásticas de contención, pero con el uso de mascarillas y distancia social, el porcentaje de población que debe de haber pasado la enfermedad se situaría entre el 28 y el 42%, muy lejos de la cifra de personas que han transitado la enfermedad según el estudio de seroprevalencia13 y la evolución del modelo. Este porcentaje de personas inmunes se podría alcanzar ya sea con individuos que han cursado la enfermedad, o con personas vacunadas siempre y cuando las medidas de protección sanitaria se mantuviesen a lo largo del tiempo. No obstante, será necesario que aumente el porcentaje de población vacunada para poder incluir dicha variable en el modelo que presentamos.
El modelo de previsión epidemiológica que planteamos nos permite evaluar el impacto de las distintas estrategias de restricción poblacional frente a la COVID-19, considerando su duración, intensidad y el contexto basal de incidencia y prevalencia, así como prever el nivel de presión asistencial relativo al número de pacientes hospitalizados e ingresados en UCI. Todo ello, convierte nuestro modelo en una herramienta muy adecuada para diseñar planes de actuación y asistenciales a medio plazo, pudiendo incorporar cronológicamente los eventos de contención para determinar la duración e importancia de los valles de menor presión asistencial COVID-19, que podrían ser aprovechados para la atención de pacientes no-COVID. Además, nuestro modelo puede ser adaptado a otros núcleos poblaciones, realizando una nueva calibración a partir de los correspondientes datos demográficos, de evolución local de la pandemia y de las medidas de política sanitaria que se apliquen, y además debe ser revisado a lo largo del tiempo en función de las modificaciones que se vayan estableciendo en estas.
Limitaciones del modeloEl modelo propuesto es un sistema clásico de ecuaciones en diferencias. Para su construcción, asumimos la hipótesis habitual de población homogénea, de manera que cualquier individuo de la población puede infectar a otro. No se han considerado las características clínicas de los pacientes diferentes a su clasificación descrita en la tabla 1, ni tampoco grupos de edad, aunque las tasas de transmisión, hospitalización y defunción pueden variar en función de los grupos de edad. También, consideramos que la cuarentena se aplica solamente a la población susceptible, cuando latentes, infectados asintomáticos y recuperados también se encuentran en aislamiento. El modelo no tiene en cuenta los fallecidos por la COVID-19 fuera del circuito hospitalario.
Contribución de autoresDiseño del estudio: José Manuel Garrido, David Martínez-Rodríguez, Fernando Rodríguez-Serrano y Rafael Jacinto Villanueva.
Diseño del flujo de pacientes: José Manuel Garrido, David Martínez-Rodríguez, Fernando Rodríguez-Serrano y Rafael Jacinto Villanueva.
Recogida de datos: José Manuel Garrido, Fernando Rodríguez-Serrano, José Miguel Pérez-Villares, Andrea Ferreiro-Marzal y María del Mar Jiménez-Quintana.
Programación del modelo: David Martínez-Rodríguez y Rafael Jacinto Villanueva.
Diseño de escenarios de contención: José Manuel Garrido, David Martínez-Rodríguez, Fernando Rodríguez-Serrano, José Miguel Pérez-Villares, Andrea Ferreiro-Marzal, María del Mar Jiménez-Quintana y Rafael Jacinto Villanueva.
Análisis de resultados: José Manuel Garrido, David Martínez-Rodríguez, Fernando Rodríguez-Serrano, José Miguel Pérez-Villares, Andrea Ferreiro-Marzal, María del Mar Jiménez-Quintana y Rafael Jacinto Villanueva.
Redacción del artículo: José Manuel Garrido y Fernando Rodríguez-Serrano.
Revisión del artículo: José Manuel Garrido, David Martínez-Rodríguez, Fernando Rodríguez-Serrano, José Miguel Pérez-Villares, Andrea Ferreiro-Marzal, María del Mar Jiménez-Quintana y Rafael Jacinto Villanueva.
FinanciaciónEste estudio ha sido financiado por el Ministerio de Economía, Industria y Competitividad de España, la Agencia Estatal de Investigación y el Fondo Europeo de Desarrollo Regional (MTM2017-89664-P); la Unión Europea a través del Programa de Fondos de Desarrollo Regional/Fondo Social Europeo y la Comunidad Valenciana (GJIDI/2018/A/010 y GJIDI/2018/A/009); y la Fundación Ramón Areces, Madrid, Spain (CIVP18A3920).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo de Estudio COVID-19_Granada: José Manuel Garrido Jiménez, Antonio Cansino Osuna, Juan Carlos Carrillo Santos, Cristina Carvajal Pedrosa, María Angeles García Rescalvo, Francisco José Guerrero García, Sebastián Manzanares Galán, Francisco Marti Jiménez, Manuel Enrique Reyes Nadal, Pedro Manuel Ruiz Lorenzo, José Luis Salcedo Lagullón, Indalecio Sánchez-Montesinos García, Fernando Rodríguez-Serrano.