Analizar si la fragilidad puede mejorar la predicción de mortalidad en los pacientes ingresados en UCI tras una cirugía digestiva.
DiseñoEstudio prospectivo, observacional y con seguimiento a 6 meses de una cohorte de pacientes que ingresaron en UCI entre el 1 de junio de 2018 hasta el 1 de junio de 2019.
ÁmbitoUCI quirúrgica de un hospital de tercer nivel.
PacientesSerie de pacientes sucesivos mayores de 70 años que ingresaron en UCI inmediatamente después de una intervención quirúrgica sobre el aparato digestivo. Fueron incluidos 92 pacientes y se excluyeron 2 por pérdida de seguimiento a los 6 meses.
IntervencionesAl ingreso en UCI se estimó gravedad y pronóstico mediante el APACHE II, y fragilidad mediante la Clinical Frailty Scale y el modified Frailty Index.
Variables de interés principalesMortalidad en UCI, intrahospitalaria y a los 6 meses.
ResultadosEl modelo que mejor predice mortalidad en UCI es el APACHE II, con un área bajo la curva ROC (ABC) de 0,89 y una buena calibración. El modelo que combina APACHE II y Clinical Frailty Scale es el que mejor predice mortalidad intrahospitalaria (ABC: 0,82), mejorando significativamente la predicción del APACHE II aislado (ABC: 0,78; Integrated Discrimination Index: 0,04). La fragilidad es un factor predictor de mortalidad a los 6 meses, siendo el modelo que combina la Clinical Frailty Scale y el modified Frailty Index el que ha demostrado mayor discriminación (ABC: 0,84).
ConclusionesLa fragilidad puede complementar al APACHE II mejorando su predicción de mortalidad hospitalaria. Además, ofrece una buena predicción de la mortalidad a los 6 meses de la cirugía. Para la mortalidad en UCI, la fragilidad pierde su poder de predicción mientras que el APACHE II aislado muestra una excelente capacidad predictiva.
To analyze whether frailty can improve the prediction of mortality in patients admitted to the ICU after digestive surgery.
DesignProspective, observational, 6-month follow-up study of a cohort of patients admitted to the ICU between June 1, 2018, and June 1, 2019.
SettingSurgical ICU of a third level hospital.
PatientsSeries of successive patients older than 70 years who were admitted to the ICU immediately after a surgical intervention on the digestive system. 92 patients were included and 2 were excluded due to loss of follow-up at 6 months.
InterventionsUpon admission to the ICU, severity and prognosis were assessed by APACHE II, and fragility by the Clinical Frailty Scale and the modified Frailty Index.
Main variables of interestICU, in-hospital and 6-month mortality.
ResultsThe model that best predicts mortality in the ICU is the APACHE II, with an area under the ROC curve (AUC) of 0.89 and a good calibration. The model that combines APACHE II and Clinical Frailty Scale is the one that best predicts in-hospital mortality (AUC: 0.82), significantly improving the prediction of isolated APACHE II (AUC: 0.78; Integrated Discrimination Index: 0.04). Frailty is a predictor of mortality at 6 months, being the model that combines Clinical Frailty Scale and Frailty Index the one that has shown the greatest discrimination (AUC: 0.84).
ConclusionsFrailty can complement APACHE II by improving its prediction of hospital mortality. Furthermore, it offers a good prediction of mortality 6 months after surgery. For mortality in ICU, frailty loses its predictive power, whereas isolated APACHE II shows excellent predictive capacity.
El progresivo envejecimiento de la población y la mejoría de la atención sanitaria han favorecido que durante los últimos años se haya producido un aumento considerable de la población de pacientes ancianos en las Unidades de Cuidados Intensivos (UCI) de todo el mundo.
Mientras que hace tan solo unas décadas eran muy poco frecuentes los ingresos en UCI de pacientes mayores de 70 o 75 años, actualmente la edad no es, en absoluto, un condicionante para el ingreso en dichas unidades. De esta manera se estima que hasta la cuarta parte de los pacientes ingresados en las UCI en Estados Unidos y Europa tienen más de 80 años1.
En estos pacientes de mayor edad, la cirugía del aparato digestivo, seguida de la cardiopatía isquémica, constituyen en algunas series las causas más frecuentes de ingreso en UCI2–4. En este sentido, los pacientes mayores de 70 años son sometidos a cirugía mayor hasta cuatro veces más que la población menor de 705. Además, se estima que más del 60% de los pacientes quirúrgicos en Estados Unidos son mayores de 65 años6.
Para poder ofrecer una información adecuada sobre el pronóstico esperado en estos pacientes, es importante hacer una estimación lo más fiable posible de la mortalidad, no solo a corto plazo, sino también de la mortalidad hospitalaria y a más largo plazo. Para realizar estas predicciones se suelen emplear escalas de gravedad como el Acute Physiology and Chronic Health Evaluation II (APACHE II) que, mediante un modelo de regresión logística, transforman su valor numérico en una estimación de la probabilidad de mortalidad hospitalaria en el momento de ingreso en UCI7.
Aunque estas escalas predictivas suelen considerar a la edad como un importante factor de riesgo, no tienen en cuenta otros elementos como la fragilidad, que pueden jugar un papel importante en la predicción del pronóstico en los pacientes añosos.
Actualmente se considera a la fragilidad como un síndrome médico asociado al envejecimiento en el que existe una mayor vulnerabilidad para la aparición de discapacidad y otros episodios de salud adversos incluyendo mortalidad, ante la presencia de un factor estresante externo8,9. De esta manera, existe evidencia creciente de que la fragilidad constituye un importante factor de riesgo para la aparición de complicaciones mayores y mortalidad tras una cirugía mayor6,10–13.
En este estudio analizamos si la fragilidad puede mejorar la predicción de mortalidad en los pacientes ingresados en UCI tras una cirugía digestiva. Para ello hemos evaluado la capacidad predictiva del APACHE II con respecto a la mortalidad en tres momentos diferentes (mortalidad en UCI, intrahospitalaria y a los 6 meses) y la hemos comparado con dos escalas de fragilidad ampliamente validadas y con un modelo que combina APACHE II y fragilidad.
Pacientes y métodosEstudio prospectivo, observacional y con seguimiento a 6 meses, realizado en una unidad quirúrgica de cuidados intensivos de un hospital de tercer nivel desde el 1 de junio de 2018 hasta el 1 de junio de 2019. El estudio fue aprobado por la comisión de investigación e innovación y por el comité de ética del centro. Los pacientes incluidos en el estudio, o sus familiares, aceptaron el consentimiento informado verbal.
La cohorte inicial la constituye una serie de pacientes sucesivos mayores de 70 años que ingresaron en la UCI inmediatamente después de una intervención quirúrgica sobre el aparato digestivo, bien sea de manera programada o urgente. Se excluyeron aquellos pacientes quirúrgicos que en su periodo postoperatorio ingresaban procedentes de la planta de hospitalización por presentar alguna complicación (incluyendo reintervención quirúrgica). Asimismo fueron excluidos aquellos que ingresaron en UCI moribundos y/o fallecieron antes de 24h, y aquellos que no completaron el seguimiento al cabo de 6 meses.
El nivel de gravedad y pronóstico al ingreso se estimó mediante la escala APACHE II. Este sistema tiene en cuenta los antecedentes y la edad del paciente, así como el diagnóstico y otras variables clínicas y analíticas7. Está ampliamente validado y es de uso universal en el ámbito del paciente crítico. Estima la mortalidad durante la estancia hospitalaria derivada de la patología que ha propiciado el ingreso en UCI.
Evaluación de la fragilidadLa evaluación de la fragilidad fue realizada por el clínico responsable del paciente durante las primeras h de ingreso en UCI y tras la obtención del consentimiento informado para la participación en el estudio, bien por parte del paciente o de sus familiares en función del nivel de consciencia. Para ello se empleó el índice de fragilidad modificado (mFI)14 y la Clinical Frailty Scale (CFS)15.
-El mFI (tabla 1) está basado en el modelo de fragilidad introducido por Rockwood en 200116. Este modelo considera que un individuo será tanto más frágil conforme mayor sea el número de déficits que ha ido acumulando a lo largo de su vida. Como déficit se entiende tanto la presencia de una alteración clínica o analítica, como la pérdida de capacidad funcional o el deterioro en la esfera social y cognitiva. Este modelo permite cuantificar la fragilidad a través de un índice cuantitativo o frailty index que se obtiene dividiendo el número de déficits presentes entre el número total de déficits contemplados. De esta manera, sus valores son de naturaleza continua y varían entre 0 y 1. Para el cálculo del índice original se contemplaban hasta 70 déficits por paciente, haciendo difícil su aplicación en el ámbito clínico. El mFI utiliza un número más reducido de déficits, seleccionando 11 de los incluidos en la escala original. Fue propuesto y desarrollado por el National Surgical Quality Improvement Program del American College of Surgeons y posteriormente fue validado en otros estudios17,18.
Modified Frailty Index (Índice de fragilidad modificado)
| 1. Diabetes |
| 2. Insuficiencia cardiaca congestiva |
| 3. Hipertensión arterial tratada farmacológicamente |
| 4. Antecedentes de accidente isquémico transitorio |
| 5. No completamente independiente para las actividades básicas de la vida diaria |
| 6. Antecedente de infarto agudo de miocardio |
| 7. Vasculopatía periférica y/o claudicación intermitente |
| 8. Accidente cerebrovascular con secuelas |
| 9. EPOC o neumonías de repetición |
| 10. Antecedente de angina y/o revascularización coronaria percutánea |
| 11. Encefalopatía aguda o delirium de aparición reciente |
Tomada y traducida de: Searle et al.14
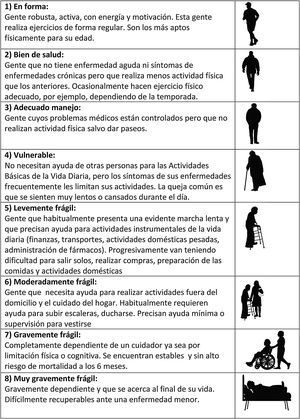
La CFS (fig. 1) hace una evaluación del nivel de fragilidad basándose en el juicio clínico del examinador. Fue propuesta por Rockwood en 2005 y ha demostrado tener buena correlación con el FI19. En función de los datos recogidos en la historia clínica, la exploración física y la entrevista con el paciente, el clínico emplea su razonamiento y juicio clínico para clasificar al paciente en uno de los 8 niveles de fragilidad contemplados, y que varían entre «en forma, robusto» hasta «severamente frágil»8.
Nivel del fragilidad de la Clinical Frailty Scale basándose en el juicio clínico del examinador.
Tomada y traducida de: Rockwood et al.15.
La variable principal a estudio ha sido la incidencia de mortalidad en tres momentos diferentes: mortalidad en UCI, mortalidad intrahospitalaria y mortalidad a los 6 meses de la intervención.
Otras variablesAdemás de variables epidemiológicas como el sexo y la edad de los pacientes, hemos recogido variables clínicas como el carácter de la intervención (urgente o programada), la presencia de complicaciones postoperatorias (reintervención quirúrgica, reingreso en UCI) y los días de estancia en UCI y hospitalaria. También se ha registrado la necesidad de reingreso hospitalario y situación basal (estable, necesidad de cuidador o institucionalizado) a los 6 meses de la intervención.
Análisis estadísticoTodos los análisis estadísticos se han realizado con el software STATA/IC 15.0 (Statacorp LP, College Station, TX).
Las variables continuas se expresan como media y desviación estándar (DE) o mediana y rango intercuartil en función de la normalidad de su distribución evaluada con el test de Saphiro-Wilk. Las variables categóricas se muestran como recuentos y/o porcentajes.
La fragilidad se ha categorizado en tres niveles ordinales (frágil, prefrágil y robusto) en cada una de las escalas. Los puntos de corte del mFI corresponden a los valores 0-0,09 para pacientes robustos, 0,1-0,27 para pacientes prefrágiles y 0,28-1 para pacientes frágiles. En la CFS se han considerado robustos los pacientes con puntuaciones 1 y 2, prefrágiles las puntuaciones 3 y 4 y frágiles aquellos con puntuaciones de 5 o más8. La concordancia entre las dos escalas de fragilidad (CFS e Ifm) a la hora de clasificar a los pacientes como frágiles se evalúa mediante el índice Kappa.
El análisis de las diferencias en la incidencia de mortalidad entre los distintos niveles de fragilidad se ha realizado a través del test de tendencia lineal de Mantel-Haenszel. Para analizar la asociación de la fragilidad con variables continuas como la edad o los días de estancia se ha estudiado la presencia de tendencia lineal entre los diferentes grupos utilizando modelos de regresión lineal simple. La asociación de la fragilidad con el resto de las variables pronósticas se ha calculado mediante regresión logística y se expresa como odss ratio (OR) y su intervalo de confianza del 95%.
Para estudiar el poder de predicción de los distintos modelos analizados, se ha evaluado su calibración y discriminación a través de la prueba de Hosmer-Lemeshow y del área bajo la curva ROC (ABC) respectivamente. La calibración mide la concordancia entre las probabilidades de ocurrencia del evento observadas en la muestra y las predichas por el modelo. La discriminación evalúa el grado en que el modelo distingue entre individuos en los que ocurre el evento y los que no. La comparación entre las áreas bajo la curva ROC de los diferentes modelos se ha llevado a cabo mediante la prueba de DeLong. Para evaluar si el poder de predicción del APACHE II mejora significativamente al añadir alguna de las mediciones de fragilidad hemos empleado la significación del índice integrated discrimination index (IDI).
Para todos los análisis hemos considerado un nivel de significación p<0,05 como estadísticamente significativo.
ResultadosDurante el periodo de estudio se incluyeron 92 pacientes, pero dos de ellos fueron excluidos de los análisis por pérdida de seguimiento a los 6 meses. De los 90 pacientes analizados, 67 fueron hombres (74,4%). La media y la mediana de edad fueron de 77,1 y 76 años (p25-p75: 73-82), comprendiendo un rango de edades desde los 70 hasta los 92 años.
El 57% de las intervenciones se realizaron con carácter electivo, el resto fueron urgentes. Todas las intervenciones electivas fueron tabuladas como complexmajor según la British United Provident Association y con una puntuación de II o III según la American Society of Anesthesiologists, principalmente cirugía hepatobiliopacreática (resección hepática o duodenopancreatectomía) y esofágica.
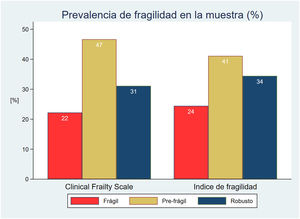
La prevalencia de fragilidad fue similar con ambas escalas en la cohorte inicial de pacientes. De esta manera hubo un 22% de pacientes frágiles con la CFS y un 24% con el IFm (fig. 2). El porcentaje de acuerdo observado a la hora de clasificar a los pacientes como frágiles fue del 77,8%, con una concordancia como mucho moderada entre ellas (índice kappa 0,38).
Los pacientes frágiles presentaron significativamente mayor puntuación de riesgo APACHE II. Esta tendencia lineal fue estadísticamente significativa (p<0,01) para ambas escalas de fragilidad (tabla 2). También hubo una tendencia significativa hacia una edad progresivamente mayor a medida que aumenta la fragilidad con la CFS (p<0,01). Los pacientes frágiles también presentaron mayores estancias en UCI que los prefrágiles o robustos.
Características de los pacientes según su clasificación en las dos escalas de fragilidad
| Clinical Frailty Scale (CFS) | Índice fragilidad modificado (mFI) | |||||||
|---|---|---|---|---|---|---|---|---|
| Frágil | Prefrágil | Robusto | p | Frágil | Prefrágil | Robusto | p | |
| N (%) | 20 (22,2) | 42 (46,7) | 28 (31,1) | 22 (24,4) | 37 (41,1) | 31 (34,5) | ||
| Edad (Años) | 78,5(74-82,5) | 77,5(73-82) | 74,5(72,5-77) | <0,01 | 76(73-82) | 78(73-82) | 75(72-78) | 0,26 |
| APACHE II | 20,5(17-23,5) | 14(10-21) | 9(7-12) | <0,01 | 21(15-23) | 13(10-19) | 10(8-18) | <0,01 |
| Estancia UCI (días) | 5(2,5-10,5) | 6(3-11) | 3(2-4,5) | 0,02 | 5(3-11) | 5(2-8) | 3(2-6) | 0,11 |
| Estancia Hosp. (días) | 19,5(10,5-30,5) | 19(10-45) | 12(8-22) | 0,1 | 17(10-52) | 16(7-29) | 18(9-28) | 0,5 |
En cuanto a la evolución postoperatoria, la tabla 3 muestra las OR de la asociación de los grupos de pacientes frágiles y prefrágiles con respecto al reingreso en UCI, necesidad de reintervención o reingreso en los primeros 6 meses postoperatorios, utilizando el grupo de pacientes robustos como referencia.
Asociación de las escalas de fragilidad con la necesidad de reingreso en UCI, reintervención y reingreso a los 6 meses
| Reingreso UCI | Reintervención | Reingreso 6M | |||||
|---|---|---|---|---|---|---|---|
| OR (IC 95%) | p | OR (IC 95%) | p | OR (IC 95%) | p | ||
| CFS | Robusto | ref. | ref. | ref. | |||
| Prefrágil | 4,61 (0,94-22,72) | 0,06 | 8,82 (2,6--30,03) | <0,01 | 1,63 (0,50-5,35) | 0,42 | |
| Frágil | 4,33 (0,75-25,15) | 0,1 | 11,14 (2,74-45,26) | <0,01 | 1,15 (0,27-4,96) | 0,19 | |
| mFI | Robusto | ref. | ref. | ref. | |||
| Prefrágil | 2,18 (0,51-9,26) | 0,20 | 1,99 (0,74-5,4) | 0,17 | 0,79 (0,26-2,44) | 0,69 | |
| Frágil | 5,33 (1,22-23,3) | 0,03 | 3,68 (1,16-11,6) | 0,03 | 0,64 (0,17-2,46) | 0,52 | |
Odds ratio calculadas mediante análisis de regresión logística univariante, comparando los pacientes frágiles y prefrágiles con el grupo de referencia (ref.).
CFS: Clinical Frailty Scale; mFI: Índice de fragilidad modificado.
La mortalidad global observada fue del 25,5% en UCI (23 pacientes); del 37,7% (34 pacientes) hospitalaria y del 44,4% (40 pacientes) a los 6 meses de la intervención.
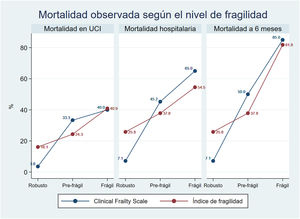
Hubo una clara y estadísticamente significativa tendencia lineal hacia una mayor mortalidad a medida que el nivel de fragilidad iba en aumento, tanto en UCI como intrahospitalaria y a los 6 meses (p<0,01) (fig. 3).
Esta asociación entre fragilidad y mortalidad fue independiente de la edad de los pacientes, manteniéndose estadísticamente significativa en los modelos de regresión bivariables ajustados por la edad, que evaluaban las tres mortalidades, tanto para la CFS como para el Ifm.
Capacidad predictiva de los distintos modelos evaluadosTodos los modelos analizados han demostrado una buena calibración (significación de la prueba de Hosmer-Lemeshow>0,05) para los episodios estudiados, con excepción de la CFS (HL: 0,024) y el mFI (HL: 0,05) a la hora de predecir mortalidad intrahospitalaria.
Con respecto al poder de discriminación, la tabla 4 resume las áreas bajo la curva ROC tanto del APACHE II, como de las escalas de fragilidad y de una combinación de ambos. Para realizar las comparaciones se ha utilizado como referencia el área bajo la curva del APACHE II.
Comparación del poder de discriminación (área bajo la curva ROC) del APACHE II, CFS, mFI y de los distintos modelos combinados
| Éxitus UCIa | Éxitus HOSPb | Éxitus 6Mc | |||||
|---|---|---|---|---|---|---|---|
| AUC (IC 95%) | p* | AUC (IC 95%) | p* | AUC (IC 95%) | p* | ||
| APACHE II | 0,89 (0,81-0,97) | 0,78 (0,68-0,88) | 0,74 (0,63-0,85) | ||||
| Modelo fragilidad | IFm | 0,69 (0,57-0,82) | <0,01 | 0,68 (0,57-0,80) | 0,14 | 0,78 (0,69-0,88) | 0,52 |
| CFS | 0,77 (0,67-0,87) | 0,02 | 0,78 (0,68-0,87) | 0,96 | 0,82 (0,74-0,91) | 0,09 | |
| IFm + CFS | 0,77 (0,67-0,88) | 0,03 | 0,77 (0,68-0,87) | 0,93 | 0,84 (0,76-0,92) | 0,05 | |
| Modelo combinado | APACHE + IFm | 0,89 (0,82-0,96) | 1 | 0,78 (0,68-0,88) | 0,84 | 0,83 (0,74-0,91) | 0,04 |
| APACHE + CFS | 0,89 (0,82-0,97) | 1 | 0,82 (0,73-0,91) | 0,10 | 0,83 (0,75-0,92) | 0,01 | |
AUC: área bajo la curva ROC; CFS: Clinical Frailty Scale; IFm: Índice de fragilidad modificado.
p*: significación del test de DeLong comparando cada modelo con el de referencia (APACHE II).
a: éxitus durante la estancia en UCI.
b: éxitus en el periodo intrahospitalario
c: éxitus a los 6 meses del alta hospitalaria.
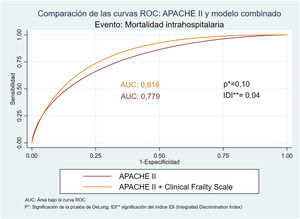
El modelo que mejor capacidad de predicción demuestra en cuanto al éxitus en UCI es el APACHE II (AUC: 0,89; HL: 0,54), mientras que el modelo que combina el APACHE y la CFS ha sido el que mejor predice la mortalidad intrahospitalaria (AUC: 0,82; HL: 0,21). En este modelo, la significación del índice IDI (p<0,05) indica una mejoría significativa del poder predictivo del APACHE II al añadir la escala de fragilidad (fig. 4).
En cuanto a la mortalidad a los 6 meses, la combinación de las dos escalas de fragilidad ha resultado el modelo que ha demostrado mayor discriminación (AUC: 0,84; HL: 0,48), superando el poder predictivo del APACHE II y de las combinaciones de APACHE II y fragilidad.
DiscusiónLos resultados de este estudio señalan a la fragilidad como un importante factor de riesgo que de manera aislada o combinada con el APACHE II puede mejorar la predicción del pronóstico de los pacientes ingresados en UCI tras una cirugía digestiva.
Los pacientes de edad avanzada configuran un grupo muy heterogéneo en cuanto a condición física, capacidad cognitiva, independencia funcional y circunstancias socioeconómicas se refiere. Estas diferencias son las que permiten que, de una manera subjetiva, hagamos una estimación de la edad biológica de los pacientes bien sea añadiendo o quitando años a su verdadera edad cronológica. Aunque estas diferencias siempre se han tenido presentes en el ámbito clínico, no ha sido en la última década cuando se han considerado de un modo más objetivo gracias a la introducción del concepto de fragilidad.
En la actualidad, el concepto de fragilidad cobra especial importancia sobre todo si tenemos en cuenta el aumento de la esperanza de vida y el progresivo envejecimiento de la población. Según datos de 2019 del Instituto Nacional de Estadística20, el 19,1% de los españoles tiene 65 o más años, y el 6,1% son octogenarios, correspondiendo el 55% de las estancias hospitalarias a pacientes en esta franja de edad.
Ante esta realidad, la evidencia acumulada en los últimos años reconoce a la fragilidad como un importante factor de riesgo y la identifica como una herramienta de ayuda al intensivista en su toma de decisiones gracias a su influencia en el pronóstico de los pacientes21. En este sentido, trabajos previos han postulado el uso del mFI22 y de la CFS23 en los pacientes críticos ancianos para predecir morbimortalidad en UCI y/o a corto plazo24.
En el presente estudio hemos confirmado esta asociación de la fragilidad con la mortalidad, tanto en el postoperatorio en UCI, como en el periodo intrahospitalario y a los 6 meses de la intervención. Esta asociación confiere a la fragilidad una capacidad predictiva de mortalidad que puede complementar al APACHE II mejorando sus predicciones del pronóstico en estos pacientes.
Se ha elegido en este trabajo el APACHE II como herramienta de referencia para medir la gravedad por su extendidísimo uso en la medicina intensiva a nivel mundial, habiendo sido validado en diversos escenarios siempre en el ámbito del paciente crítico, incluyendo edades avanzadas25,26 y patología quirúrgica abdominal27,28. En 1985, cuando se diseñó la escala APACHE II, se tuvo en cuenta la edad de los pacientes pero no su nivel de fragilidad. Sin embargo y de acuerdo a la evidencia disponible, en nuestro estudio hemos demostrado que el efecto de la fragilidad sobre la mortalidad es independiente de la edad del paciente. De esta manera, se puede explicar esta complementariedad entre la escala APACHE II que evalúa la gravedad de los pacientes y las diferentes escalas de fragilidad. Además, en la tabla 2 se observa que los pacientes con mayor fragilidad (condición previa al insulto) presentan APACHE II más elevado, es decir, que ante insultos similares, los pacientes frágiles presentan mayor gravedad. Esta realidad podría explicarse porque la fragilidad implica una reserva fisiológica reducida; por ello ante un insulto, tal reserva se agota y el paciente claudica precozmente, traduciéndose en este caso como una puntuación APACHE II más elevada.
Por un lado, el APACHE II ha mostrado una excelente capacidad predictiva en cuanto a la mortalidad en UCI se refiere ya que, con un área bajo la curva ROC de 0,89 y una buena calibración, es superior a la de los modelos de fragilidad. Además, las combinaciones del APACHE II con alguna de las escalas de fragilidad no mejoran las predicciones que realiza el APACHE II de manera aislada con respecto a la mortalidad.
Sin embargo, al analizar la mortalidad a más largo plazo (6 meses tras la cirugía), la escala APACHE II pierde el poder de predicción que presentaba con respecto a la mortalidad en UCI, siendo entonces las escalas de fragilidad, sin combinarlas con el APACHE II, las que muestran una mejor predicción. Posiblemente este hecho se explica porque la fragilidad arroja información acerca de la reserva fisiológica de nuestros pacientes (así se justificaría que los niveles de fragilidad se hayan relacionado con la estancia en UCI, el reingreso en UCI, la necesidad de reintervención y el reingreso en los primeros 6 meses postoperatorios). Además debe tenerse en cuenta que el APACHE II no es una escala diseñada para predecir mortalidad a 6 meses del evento (es decir, tras el alta hospitalaria). Finalmente, aunque se ha demostrado que tras la implementación de determinadas medidas, la fragilidad puede mejorar en un medio plazo29, esta suele ser más estable en el tiempo que la gravedad evaluada a través del APACHE II.
Si nos centramos en la mortalidad hospitalaria, que en sentido estricto es el evento evaluado por el APACHE II, el cual «estima la probabilidad de muerte durante la estancia hospitalaria consecutiva a la causa que pone en riesgo la vida del paciente»7, hemos observado que el modelo que mejor la predice es el que combina el APACHE II con la CFS en lugar del APACHE II por sí solo. Se interpreta así porque la CFS aislada tiene un AUC similar al APACHE II, mientras que la combinación de ambos aumenta el AUC hasta 0,82: aunque este aumento se mantiene en el borde de la significación estadística, el índice IDI es significativo, indicando una mejoría significativa del poder de discriminación del APACHE al añadir la fragilidad como nuevo predictor. Esto no significa que el APACHE II no sea un test adecuado para nuestra muestra, dado que las diferencias observadas entre la mortalidad estimada por el APACHE II y la obtenida en el estudio no son estadísticamente significativas, es decir, este tiene una buena calibración. Sin embargo el modelo combinado, manteniendo también buena calibración, tiene mayor capacidad de discriminación (APACHE II [AUC: 0,77] VS. modelo combinado [AUC: 0,82]). Además consideramos que la CFS es una escala muy apropiada para estimar la fragilidad en pacientes ancianos en estado crítico, puesto que se basa en el juicio clínico, es sencilla, rápida y reproducible, y es empleada por distintas sociedades europeas de medicina intensiva2,3,30. Además es la escala propuesta por la European Society of Intensive Medicine en el Very old Intensive care Patients-2 study: estudio multicéntrico que actualmente se encuentra en curso, cuyo objetivo es el desarrollo de un escore pronóstico para pacientes mayores de 80 años en estado crítico.
Tabulando las probabilidades de éxitus intrahospitalario estimadas con este modelo combinado se ha obtenido la tabla 5. Estas probabilidades se ajustan más a la mortalidad obtenida en nuestro estudio que a las estimadas por el APACHE II de manera aislada. Sería interesante plantear nuevos estudios que pretendan calibrar este modelo combinado en otras poblaciones de pacientes críticos ancianos.
Probabilidades de éxitus intrahospitalario estimadas por el modelo que combina APACHE II y CFS
| Puntuación APACHE II | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | ||
| Clinical Frailty Scale | 1 | 2,7 | 4,6 | 7,9 | 13,2 | 21,1 | 32,1 | 45,5 | 59,6 | 72,2 |
| 2 | 4,3 | 7,4 | 12,3 | 19,9 | 30,4 | 43,6 | 57,7 | 70,6 | 80,9 | |
| 3 | 6,9 | 11,5 | 18,7 | 28,8 | 41,7 | 55,8 | 69 | 79,7 | 87,4 | |
| 4 | 10,7 | 17,5 | 27,2 | 39,8 | 53,8 | 67,3 | 78,4 | 86,5 | 91,9 | |
| 5 | 16,4 | 25,7 | 37,9 | 51,9 | 65,6 | 77,1 | 85,6 | 91,3 | 94,9 | |
| 6 | 24,3 | 36,1 | 50 | 63,8 | 75,7 | 84,6 | 90,6 | 94,5 | 96,8 | |
No obstante, la población incluida en este trabajo, en un intento de partir de una muestra homogénea ha resultado ser reducida. Para darle mayor validez a este nuevo modelo propuesto sería necesario ampliar la evidencia con más estudios analizando otras patologías o incluyendo a un mayor número de pacientes. Por otro lado podría valorarse el combinar el APACHE II u otras escalas pronósticas de gravedad con otras escalas de fragilidad validadas en la literatura, para así intentar conseguir otros modelos más precisos.
En conclusión consideramos de gran importancia tener en cuenta la fragilidad (y no solo la edad) en las escalas pronósticas de gravedad que predicen mortalidad hospitalaria, sobre todo si se aplican sobre pacientes ancianos. De esta manera se podrá disponer de una información más precisa acerca del pronóstico que a su vez, podrá ayudar en la toma de decisiones terapéuticas31.
Autoría/colaboradoresTodos los autores declaran que han participado de forma relevante en el diseño y desarrollo del trabajo, que han aprobado el documento enviado y que asumen la responsabilidad de los contenidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.