En los últimos años ha habido un incremento en el uso de la oxigenación por membrana extracorpórea (ECMO) veno-venosa (VV) y veno-arterial (VA). No obstante, la ECMO no es un tratamiento curativo, es solo un soporte, cardiocirculatorio o respiratorio, hasta que mejora la enfermedad del paciente o como puente a otro tipo de asistencia o a un trasplante. En este contexto, un adecuado tratamiento farmacológico tiene un papel importante en la evolución de los pacientes y la analgosedación es un componente clave1. Sin embargo, el manejo óptimo de la analgesia y sedación en la ECMO no está claramente definido y la práctica diaria varía mucho de unos centros a otros2-5.
A las habituales alteraciones de la farmacocinética en el paciente crítico hay que sumar los cambios inducidos por el uso de ECMO6-9, principalmente derivados de: 1) adsorción o secuestro del fármaco en el circuito. Las tubuladuras suponen el principal lugar donde se produce, aunque faltan datos que comparen los diferentes tipos (impregnadas o no con heparina, albúmina, etc.)6,7. El modelo de oxigenador también puede influir, aunque quizás con un papel menor7. La adsorción depende también de las características fisicoquímicas del fármaco administrado: a mayor lipofilicidad y unión a proteínas plasmáticas, mayor posibilidad de secuestro (tabla 1). Tras horas de funcionamiento, puede producirse una saturación de los puntos de unión del fármaco en el circuito, lo que puede condicionar un riesgo de toxicidad si, una vez superado el fenómeno de adsorción, se mantienen dosis elevadas de forma prolongada6,8. Además, el circuito podría actuar como reservorio, liberando fármaco tras el cese de su administración, lo que prolongaría el efecto residual de la analgosedación y podría influir al intentar la retirada de la ECMO o la ventilación mecánica (VM)6-8. 2) Aumento del volumen de distribución por el circuito, secuestro de fármaco, reanimación hidroelectrolítica inicial y posible respuesta inflamatoria asociada al dispositivo6,8,10. 3) Cambios en el aclaramiento, ya sea por aumento del gasto cardíaco o por la frecuente coexistencia de disfunción renal o hepática.
Características farmacocinéticas de analgésicos, sedantes y cambios observados en estudios con oxigenación por membrana extracorpórea (ECMO)
| Fármacos | Log P | Unión a proteínas (%) | Vd (L/kg) | Consideraciones | Estudios publicados |
|---|---|---|---|---|---|
| Fentanilo | 3,8-4,1 | 80-85 | 4 (3-8) | Pérdidas 67-97% en 24 hHasta el 70% perdido en la primera hora | Shekar K et al. Crit Care 2012;16:R194 (ex vivo)Harthan AA et al. J Pediatr Pharmacol Ther 2014;19:288-95 (ex vivo) |
| Morfina | 0,9 | 35 | 5 | Sin pérdidas significativas(<10-20%) en 24 h | Shekar K et al. Crit Care 2012;16:R194 (ex vivo)Harthan AA et al. J Pediatr Pharmacol Ther 2014;19:288-95 (ex vivo) |
| Remifentanilo | 1,5-1,7 | 70 | 0,35 | Aumento del Vd y aclaramiento en ECMO influido por sexo (↑ mujer) y rpm bomba (lineal) | Yang S et al. Sci Rep 2017;7:16276 (in vivo ECMO-VA) |
| Midazolam | 3,9 | 97 | 1-3 | Pérdidas 81-89% en 24 hHasta el 50% en primeros 30-60 min | Shekar K et al. Crit Care 2012;16:R194 (ex vivo)Harthan AA et al. J Pediatr Pharmacol Ther 2014;19:288-95 (ex vivo)Lemaitre F et al. Crit Care 2015;19:40 (ex vivo) |
| Propofol | 3,8-4,1 | 95-99 | 60 | Pérdidas del 70% en 30min, 89% en5 h y ≈ 100% en 24 h (tubos PVC, oxidación)No ↓ vida media del oxigenador | Lemaitre F et al. Crit Care 2015;19:40 (ex vivo)Hohlfelder B et al. ASAIO J 2017;63:179-84. (in vivo, ECMO-VV y VA)Lamm W et al. Int J Artif Organs 2019;42:233-40 (in vivo, ECMO-VV y VA) |
| Dexmedetomidina | 2,8-3,3 | 94 | 2 | Pérdidas del 30-90% en 24 h¿Tubo de PVC?, ¿oxigenador? | Wagner D et al. Perfusion 2013;28:40-6 (ex vivo)Park J et al. ASAIO J 2017;63:293-8 (in vitro)Dallefeld SH et al. Perfusion 2020;35:209-16 (ex vivo) |
| Ketamina | 2,7-3,3 | 53 | 4 | ¿Moderado secuestro? | Sin estudios farmacocinéticos |
| Tiopental | 2,8-3 | 80 | 1-1,5 | Pérdida del 88% en 24 h | Shekar K et al. Crit Care 2015;19:164 (ex vivo) |
Log P: coeficiente octanol/agua, que determina el grado de lipofilicidad. A mayor lipofilicidad y unión a proteínas mayor posibilidad de adsorción; PVC: cloruro de polivinilo; rpm: revoluciones por minuto; VA: veno-arterial; Vd: volumen de distribución, a menor Vd, mayor influencia farmacocinética de la ECMO; VV: veno-venoso.
Faltan estudios farmacocinéticos que proporcionen recomendaciones sólidas de dosificación. Gran parte de los datos conocidos están obtenidos en modelos in vitro, ex vivo o en población infantil, no siempre extrapolables al paciente crítico adulto. En la tabla 1 se muestran los resultados de algunos estudios experimentales, la mayoría, con circuitos similares a los actuales. Estos trabajos presentan importantes limitaciones. La mayoría son de corta duración (≤24 h), se administra una dosis única de fármaco en un circuito cerrado y, posteriormente, se miden las concentraciones en diferentes periodos de tiempo. No se consideran los efectos del metabolismo ni la eliminación por parte del paciente. Se desconoce el impacto de mantener una infusión continua en la concentración, extracción y saturación de fármaco en el circuito, pero es esperable que los niveles de fármaco aumenten. Además, las diferencias en los tipos de circuito y soluciones de cebado también pueden influir.
¿Hay realmente un aumento en los requerimientos de analgosedación durante la oxigenación por membrana extracorpórea?Al preguntar, aproximadamente el 60% de los encuestados tienen la percepción de que se precisan dosis mayores3. Esto se ha descrito también en pacientes con SDRA, debido a gripe A o a SARS-CoV-2. Es cierto que, al tratarse de enfermos muy graves, muchos con un drive respiratorio elevado y uso frecuente de prono o bloqueantes neuromusculares (BNM), pueden requerir dosis más altas para mantener una VM protectora, pero también influyen otros factores como, por ejemplo, la edad, el grado de respuesta inflamatoria o la aparición de fenómenos de tolerancia.
Hay pocos estudios que evalúen las necesidades de analgosedación en adultos con ECMO y los resultados son contradictorios. En la mayoría, el manejo de la analgosedación se deja a discreción del clínico responsable, sin protocolo específico y, frecuentemente, con monitorización insuficiente. Unos encuentran aumento de requerimientos4,11,12. Por ejemplo, Shekar et al. describen un incremento medio de 29mg/día de morfina y del 10% en la dosis diaria de midazolam, pero, a diferencia de los estudios in vitro, no observan aumento significativo en el fentanilo11. En otros, no se observa aumento de los requerimientos con el tiempo5,13. Estas discrepancias pueden relacionarse con las diferentes indicaciones del ECMO, con la gravedad del paciente, con los protocolos y fármacos empleados. Los primeros estudios se circunscribían a enfermos con SDRA, con sedación profunda prolongada4,12. En cambio, los posteriores incluían también pacientes con ECMO como puente a trasplante, empleaban menos benzodiacepinas y el objetivo era la sedación ligera5,13. En centros con más experiencia hay una tendencia a minimizar la sedación profunda, a buscar una sedación ligera lo más precozmente posible y con menor uso de benzodiacepinas3.
Tampoco está claro que el aumento de las dosis se deba enteramente a factores relacionados con la ECMO. Es posible que pueda influir, especialmente con el uso de algunos fármacos por sus propiedades fisicoquímicas, pero probablemente hay otros motivos más influyentes. De hecho, al analizar los factores asociados con los requerimientos de analgosedación, la variable ECMO no mostró significación estadística12, y sí hubo relación con la gravedad11, edad12 o administración de dosis altas de opioides12. Probablemente, el desarrollo de tolerancia/privación sea más importante que la propia ECMO14,15. Otros factores, como la enfermedad respiratoria o la recuperación de la función orgánica, con el tiempo, también pueden influir.
¿Cómo debería ser la estrategia de analgosedación durante la oxigenación por membrana extracorpórea?Las actuales guías no establecen recomendaciones precisas durante el uso de ECMO1. Las guías ELSO aconsejan más profundidad al inicio y reducir la sedación al mínimo una vez estabilizado el paciente (https://www.elso.org/ecmo-resources/elso-ecmo-guidelines.aspx). En la guía de analgosedación de la Federación Panamericana e Ibérica del 2020 se propone el uso de opioides menos lipofílicos (morfina) y el uso coadyuvante de ketamina16.
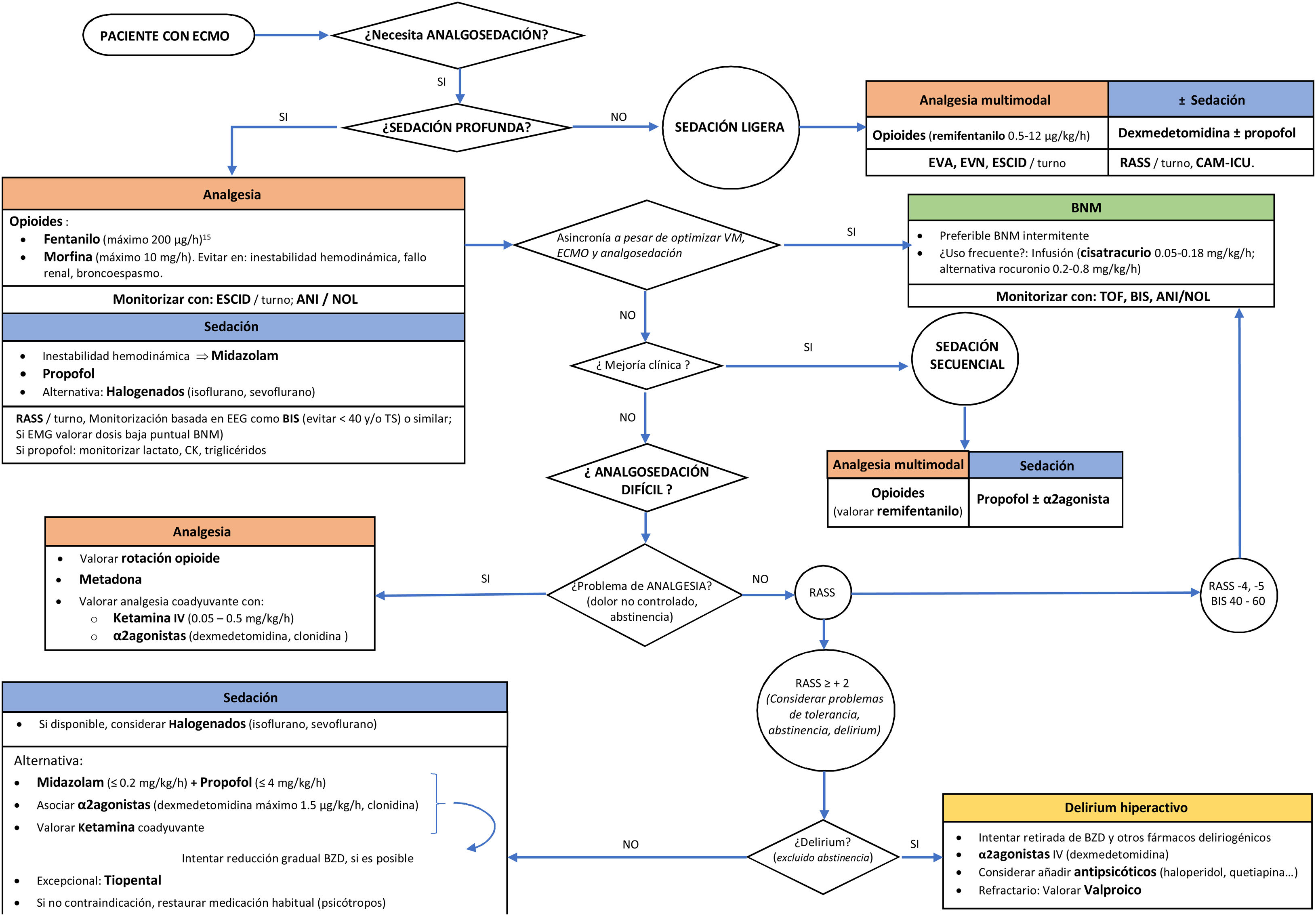
Aunque en la actualidad los estudios son escasos, una opción razonable sería la mostrada en la figura 1. En nuestra opinión, la estrategia de analgosedación debería ser similar a la empleada en otros pacientes críticos de igual gravedad, teniendo en cuenta el posible efecto del dispositivo, aunque, dada la heterogeneidad, hay que ser prudente al interpretar los resultados de los estudios mencionados. Probablemente, la influencia puede ser más relevante al inicio de la terapia o al cambiar de oxigenador (posible secuestro de fármacos), quizás también durante la retirada (posible efecto reservorio), sin olvidar la potencial saturación del circuito durante el tratamiento. Es posible que, para conseguir el objetivo de analgosedación deseado, se necesiten dosis mayores de inicio, pero luego se debe ajustar según respuesta. Es fundamental individualizar el tratamiento, seleccionando adecuadamente los fármacos, en función de sus características y del objetivo de profundidad de analgosedación deseado, además de realizar una monitorización lo más completa posible.
Algoritmo propuesto para analgosedación en pacientes con oxigenación por membrana extracorpórea (ECMO).
ANI®: índice de analgesia nocicepción; BIS®: índice bispectral; BNM: bloqueante neuromuscular; BZD: benzodiacepinas; CAM-ICU: Confusion Assessment Method for the Intensive Care Unit; CK: creatincinasa; EEG: electroencefalograma; EMG: electromiograma; ESCID: escala de conductas indicadoras de dolor; EVA: escala visual analógica; EVN: escala verbal numérica; NOL®: nociception level index; RASS: Richmond Agitation Sedation Scale; TOF: train of four; TS: tasa de supresión electroencefalográfica; VM: ventilación mecánica.
Las guías de analgosedación en el paciente crítico recomiendan minimizar la sedación y mantener una sedación ligera1. Sin embargo, en sujetos con ECMO, la estricta adherencia a estas recomendaciones no siempre es posible. Mantener una sedación superficial y evitar benzodiacepinas puede no ser factible en las primeras fases en pacientes inestables, ya sea con ECMO-VV por SDRA o con ECMO-VA por shock cardiogénico; en cambio, puede ser especialmente importante cuando la indicación de la ECMO es servir de puente al trasplante pulmonar. Muchos pacientes van a requerir un periodo inicial de sedación profunda, e incluso BNM, para conseguir flujos adecuados y una óptima sincronización con la VM. Durante este periodo, con una monitorización adecuada y con el ajuste de los fármacos a los objetivos, se pueden minimizar posibles complicaciones. En cuanto el enfermo mejora o se estabiliza, se debe pasar de forma precoz a una estrategia de sedación secuencial/dinámica para evitar la prolongación de la VM o la estancia en UCI y reducir el riesgo de infección nosocomial y de alteraciones neuromusculares. Algunos pacientes pueden presentar problemas para conseguir los objetivos; en estos casos, hay que descartar la presencia de dolor y valorar también la posible aparición de tolerancia, abstinencia o delirium15. Es importante anticipar los problemas mencionados, ajustando los fármacos al efecto clínico, para lo cual es imprescindible una monitorización estricta. Esto es más fácil cuando la sedación es ligera o moderada, empleando las escalas de dolor (EVN, ESCID), sedación (RASS) y delirium (CAM-ICU). El problema está en pacientes con sedación profunda, más aún si están con BNM. Aquí las escalas tienen limitaciones o no sirven. Actualmente, hay dispositivos para monitorización objetiva del dolor, como el ANI® o NOL®, aunque todavía no hay una evidencia firme sobre su utilidad y faltan estudios que confirmen su validez durante la VM con volúmenes y frecuencias bajas, pero de momento no se dispone de otras opciones1. En sedación profunda, se deberían usar los dispositivos de EEG procesado a pie de cama, para evitar fases de supresión EEG17. La aparición y duración de estas fases se asocia a un incremento en la incidencia de delirium y mortalidad. La monitorización de la matriz espectral puede ayudar a una mejor dosificación y a detectar precozmente complicaciones neurológicas. Durante el BNM, es importante ajustar la profundidad de bloqueo al mínimo necesario y así evitar una denervación farmacológica.
En conclusión, el objetivo es conseguir el bienestar del paciente, facilitar la adaptación a la ECMO y la VM y minimizar las posibles consecuencias adversas. En pacientes con ECMO, el manejo de la analgosedación puede ser un reto. A los cambios farmacocinéticos relacionados con la enfermedad crítica y a los posibles problemas de tolerancia tras uso prolongado de opioides y sedantes, el ECMO añade otras variables (secuestro de fármaco en el circuito, cambios en el volumen de distribución, alteraciones en el aclaramiento), que pueden condicionar la eficacia del tratamiento farmacológico. La influencia de estas alteraciones todavía no se conoce bien y hacen falta futuros estudios prospectivos para generar más evidencia que guíe nuestra práctica. Mientras tanto, parece razonable seguir los mismos principios que en otros pacientes críticos de similar gravedad: individualizar el tratamiento, seleccionar de forma apropiada los fármacos, monitorizar correctamente (precaución sobre todo al inicio, cambio o retirada del ECMO), adecuada analgesia y minimizar la sedación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.