Los pacientes en estado vegetativo (EV) se mantienen generalmente en la misma situación clínica, pero algunos pueden evolucionar a un estado de mínima consciencia (EMC)1,2. Es muy importante diferenciar claramente estas 2 entidades, ya que las decisiones clínicas pueden ser muy diferentes, y plantean distintos dilemas éticos. En el EV permanente, basándose en el daño irreversible, se puede decidir realizar una limitación del tratamiento de soporte vital. En el EMC los pacientes son incapaces de mantener una comunicación funcional, pero ocasionalmente pueden responder a órdenes, emitir alguna palabra, rastrear con la mirada objetos o personas y presentar conductas emocionales, como sonreír, reír e incluso llorar. La exploración neurológica es extremadamente difícil debido a que los movimientos pueden ser muy pequeños, inconsistentes y fácilmente agotables, dando lugar a errores de interpretación diagnóstica3. Se estima que alrededor del 40% de los EV se tratan en realidad de EMC4, lo que evidencia la necesidad de complementar la exploración clínica con otros métodos diagnósticos.
La tomografía por emisión de positrones (PET/TC) es una técnica emergente de neuroimagen que permite diferenciar entre EV y EMC, pero su disponibilidad es todavía limitada y la interpretación puede en ocasiones ser dificultosa5. El PET/TC con 18F-2-fluoro-2-deoxi-D-glucosa (18F-FDG) —análogo radiomarcado de la glucosa— permite estudiar la actividad cerebral. Su captación se relaciona con el transporte intracelular de glucosa y, por lo tanto, valora el metabolismo glucídico regional cerebral, representando una medición in vivo de la integridad neuronal6. En los últimos años, se han publicado estudios que atribuyen patrones metabólicos específicos en pacientes con distintos estados de nivel de consciencia. Los pacientes en EV tienen un marcado hipometabolismo global cortical en la corteza frontal y parietal, mientras que los pacientes en EMC conservan intacto el metabolismo en dichas áreas corticales7–11. Una de las limitaciones del PET/TC, es que requiere trasladar al paciente fuera de la UCI y que el tiempo necesario para realizar la exploración es de aproximadamente 1h. Desde que se inyecta el radiotrazador hasta conseguir la distribución adecuada del radiofármaco son necesarios unos 40-45min y se precisan otros 10-15min para realizar la adquisición de imágenes.
Presentamos un caso clínico donde el PET/TC permitió descartar el diagnóstico de EV. Se trata de un varón de 15 años con parada cardiorrespiratoria en fibrilación ventricular por electrocución. Tras 10min de reanimación cardiopulmonar (RCP) básica es atendido por el servicio de urgencias extrahospitalaria que realizan RCP avanzada durante 15min, precisando 6 descargas con desfibrilador y amiodarona iv. Tras su ingreso en la UCI se inicia hipotermia terapéutica durante 36h. BIS inicial <15 y TC craneal normal. Se retira sedación a las 72h y el paciente obedece órdenes sencillas con una escala de coma de Glasgow de 10. En el día 4 de ingreso deterioro importante del nivel de consciencia y crisis distónicas, con desviación de la mirada hacia la derecha y midriasis reactiva. Se inicia tratamiento anticomicial. El electroencefalograma, los potenciales evocados somatosensoriales del nervio mediano y auditivos de tronco son normales. Se repite TC que descarta lesión isquémico/hemorrágica y la resonancia magnética (RM) cerebral objetiva alteración de señal en los ganglios de la base bilaterales y corteza hipocampal, compatible con encefalopatía anóxica severa. Tras retirada de sedación, estatus distónico, crisis en opistótonos y afectación diencefálica con hiperactividad simpática paroxística, hipertensión arterial, sudoración y taquicardia. Se realiza un SPECT con 99mTc-HMPAO, que demostró hiperperfusión cortical occipital y en ganglios basales. A lo largo de su evolución se realizó tratamiento anticomicial con levetiracetam, ácido valproico, lacosamida, fenobarbital y clonazepam, ensayando sin éxito distintas combinaciones y pautas posológicas. El tratamiento con clonidina, propranolol, morfina y baclofeno controló parcialmente la actividad simpática. Ante el gravísimo estatus distónico que imposibilitaba el manejo y cuidados del paciente se indujo coma barbitúrico con tiopental sódico. Tras la retirada del tiopental las crisis se reprodujeron con la misma frecuencia e intensidad, manteniéndose en estatus. Durante los breves periodos intercrisis, ocasionalmente, algunos observadores percibían que el paciente parecía obedecer órdenes, pero la exploración no era reproducible y existían muchas dudas sobre su nivel de consciencia.
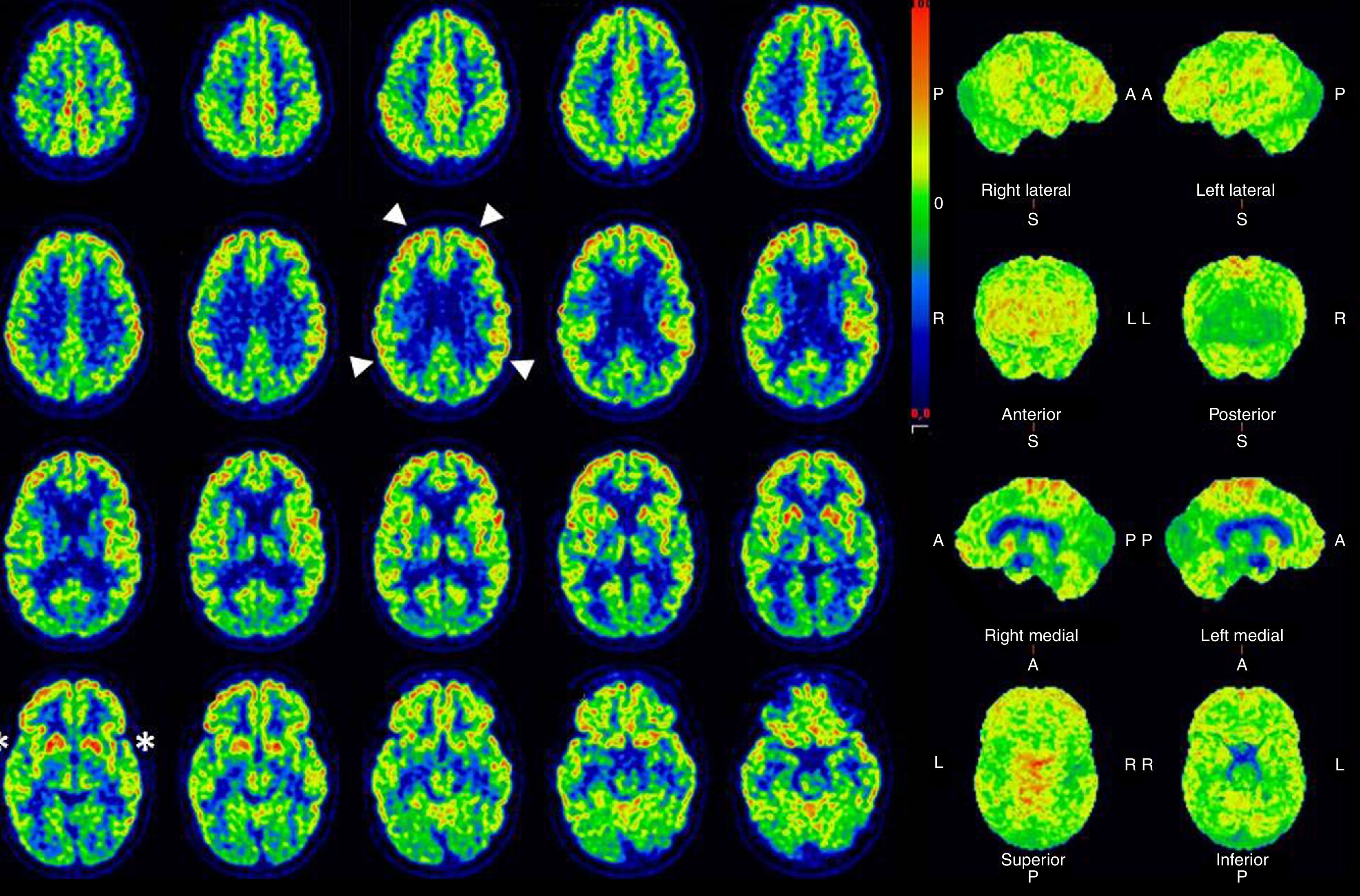
Dada la magnitud y gravedad de las crisis, con presentación continua durante las 24h del día, que requerían profunda sedoanalgesia y relajación, no era posible la valoración de su nivel de consciencia, y en este contexto, para avanzar en la toma de decisiones clínicas, se realizó un PET/TC con 18F-FDG (fig. 1). En el estudio se observó un marcado hipometabolismo de ambos putámenes posteriores, coincidente con la alteración de señal descrita en la RM previa y metabolismo glucídico conservado en los núcleos caudados, de acuerdo a los hallazgos de hiperperfusión en el SPECT. El metabolismo de la corteza fronto-parietal se encontraba dentro de los rangos normales, por lo que de acuerdo a la literatura publicada5 no sugería un patrón metabólico compatible con EV. Puesto que la actividad cortical de consumo de glucosa era normal, se concluyó que la ausencia de contacto con el medio del paciente estaba en relación con el estatus distónico y la sedación empleada para su control.
Ante la refractariedad del cuadro clínico y por recomendación de expertos en trastornos del movimiento y epilepsia se ensayaron nuevas pautas de tratamiento anticomicial, infiltración con toxina botulínica y utilización de diversos fármacos y asociaciones (bromocriptina, gabapentina, dantroleno, piracetam, biperideno, dronabinol más cannabidiol, baclofeno intratecal, olanzapina, hidrato de cloral, trihexifenidilo, clorazepato, perampanel, tetrabenazina, tizanidina, fluoxetina, paroxetina, benzodiacepinas y cisatracurio) sin conseguir el control de las distonías.
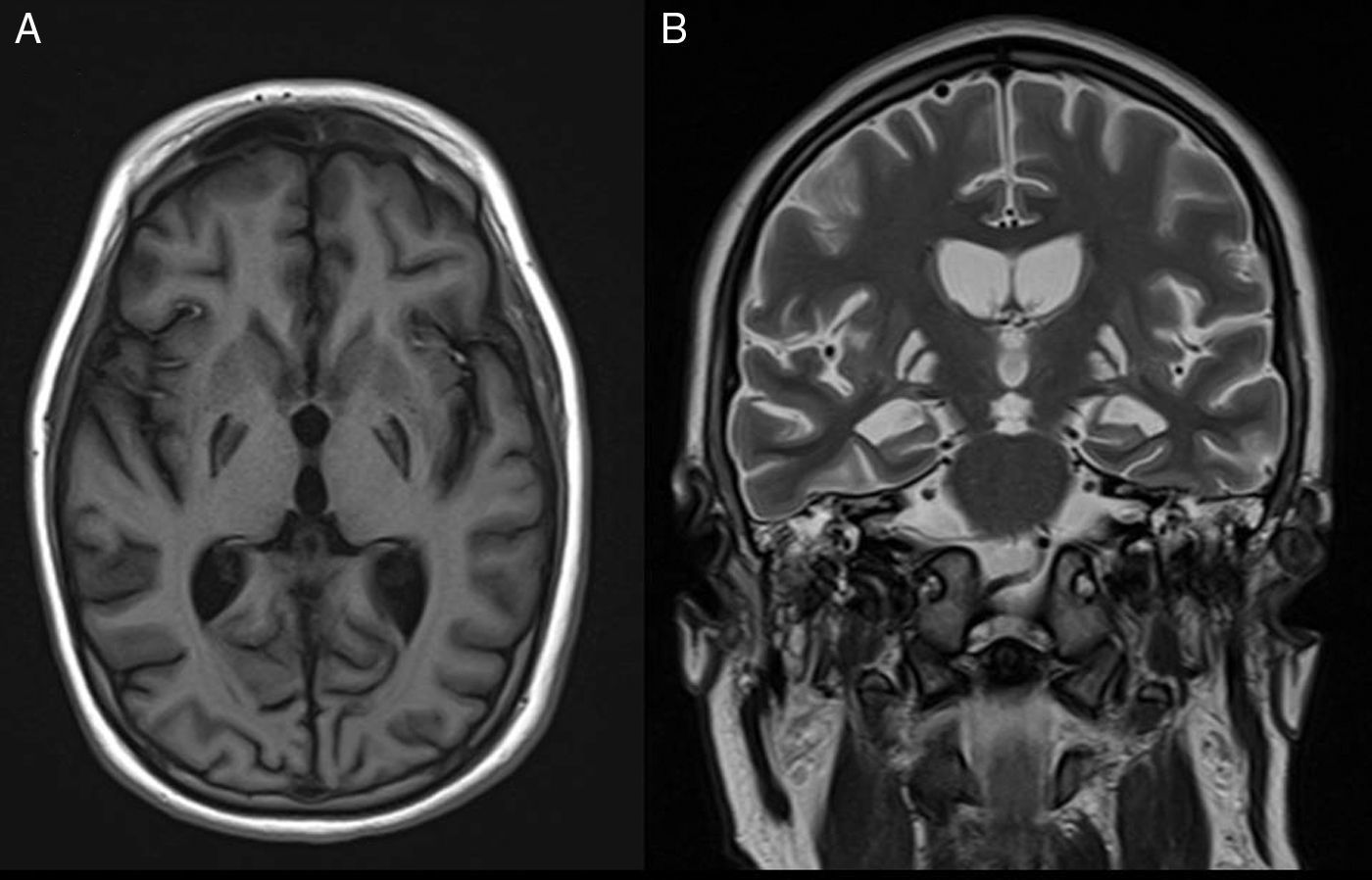
La TC y la RM (fig. 2) de control en el segundo mes de ingreso demuestran una destrucción casi completa de los ganglios basales debido a la electrocución y el daño anóxico. Un nuevo PET/TC realizado a los 6 meses del anterior confirma la destrucción de ganglios basales y la conservación del metabolismo de la corteza frontoparietal. Con el fin de controlar el estatus distónico, se implantaron 2 neuroestimuladores a nivel de ambos tálamos cerebrales que, aunque mejoraron parcialmente la clínica del paciente, tampoco controlaron las crisis totalmente. Una bomba intratecal de morfina permitió descender la dosis de las perfusiones de cisatracurio y benzodiacepinas de forma progresiva hasta su retirada, manteniendo en la actualidad solamente una dosis de 5mg de diazepam cada 8h vía enteral. El estatus distónico es de pésimo pronóstico, ya que todos los estudios de imagen demuestran un catastrófico daño estructural con desaparición casi completa de los ganglios de la base, pero en la actualidad, con los electroestimuladores, la bomba de morfina, las infiltraciones periódicas de toxina botulínica, la rehabilitación y el tratamiento farmacológico con diazepam y baclofeno, sus distonías se controlan aceptablemente.
El paciente se fue de alta de la UCI tras 11 meses de ingreso totalmente consciente, orientado y colaborador, conserva funciones superiores que le permiten jugar al ajedrez, expresa y manifiesta emociones complejas, consigue una cierta coordinación motora que le permite incluso golpear una pelota, e iniciar algunos pasos ayudado, y dentro de las limitaciones por la cánula de traqueostomía se comunica aceptablemente con su familia y los profesionales sanitarios. Actualmente recibe alimentación mediante sonda de gastrostomía percutánea, estando pendiente de valorar por foniatría la decanulación e inicio de dieta oral si la deglución lo permite.
Como conclusión final, el PET/TC con 18F-fluorodeoxiglucosa permite estudiar el metabolismo cerebral y el consumo de glucosa de la corteza cerebral descartando o confirmando un EV, hecho de gran trascendencia a la hora de tomar decisiones clínicas de limitación del tratamiento de soporte vital. El PET/TC se perfila como una herramienta de gran utilidad que ayuda a establecer el pronóstico funcional en los pacientes críticos con daño anóxico, algo de importancia y trascendencia vital en la práctica clínica diaria.
FinanciaciónLos autores no han recibido ningún tipo de financiación para la realización de este trabajo