Evaluar la factibilidad del empleo de la minigammacámara portátil Sentinella®, para el diagnóstico de muerte encefálica (ME).
DiseñoEstudio observacional, prospectivo, de factibilidad.
ÁmbitoUnidad de cuidados intensivos de un hospital de tercer nivel.
PacientesDesde enero a diciembre de 2017 se registraron de forma consecutiva los pacientes mayores de edad que tras su ingreso en unidad de cuidados intensivos fueron diagnosticados de ME según criterios clínicos.
IntervencionesEl procedimiento se realizó a la cabecera del paciente tras la administración intravenosa de tecnecio 99 metaestable-hexametil-propilen-amino-oxima. La ausencia de perfusión a nivel de hemisferios cerebrales y fosa posterior se describía como patrón compatible con ME. Se correlacionó el diagnóstico con doppler transcraneal y/o electroencefalograma.
ResultadosCincuenta y seis pacientes presentaron exploración física compatible con ME. Un 66,1% fueron hombres con una mediana de edad de 60 (RIQ: 51-72) años. La causa más frecuente que precipitó la ME fue el ictus hemorrágico en el 48,2% (27) seguido por traumatismo craneoencefálico grave en el 30,4% (17), ictus isquémico en el 10,7% (6) y encefalopatía anóxica tras parada cardiorrespiratoria en el 7,1% (4). En todos los casos se realizó el diagnóstico clínico de ME y posteriormente una gammagrafía portátil que confirmó dicho diagnóstico en el 100% de los pacientes. Se contrastó el resultado con doppler transcraneal en 46 de ellos que confirmaba la presencia de reverberación diastólica y/o picos sistólicos. En 10 casos se registró el electroencefalograma, con aparición de silencio eléctrico, debido a la ausencia de ventana acústica en el doppler transcraneal.
ConclusionesEl uso de minigammacámara portátil puede resultar una herramienta útil y factible para el diagnóstico de ME.
To evaluate the feasibility of using the Sentinella® portable gamma-camera for the diagnosis of brain death (BD).
DesignA prospective, observational feasibility study was carried out.
SettingIntensive Care Unit of a third level hospital.
PatientsConsecutive recording was made of the adults diagnosed with brain death based on clinical criteria following admission to the Intensive Care Unit in the period from January to December 2017.
InterventionsThe procedure was performed at the patient bedside with the intravenous administration of technetium 99 metastable hexamethylpropylene amine oxime. The absence of perfusion in the cerebral hemispheres and brainstem was described as a pattern consistent with BD. The diagnosis was correlated to the transcranial Doppler and / or electroencephalographic findings.
ResultsA total of 66.1% of the patients were men with an average age of 60 years [IQR: 51-72]. The most frequent causes resulting in BD were hemorrhagic stroke (48.2%, n=27), followed by traumatic brain injury (30.4%, n=17), ischemic stroke (10.7%, n=6) and post-cardiac arrest anoxic encephalopathy (7.1%, n=4). A clinical diagnosis of BD was made in all cases, and the portable gamma-camera confirmed the diagnosis in 100% of the patients with a pattern characterized by the absence of brain perfusion. In addition, the results were compared with the transcranial Doppler findings in 46 patients, confirming the presence of diastolic reverberation and / or systolic peaks. The electroencephalographic tracing was obtained in 10 cases, with the appearance of electrical silence, due to the absence of an acoustic window in the transcranial Doppler study.
ConclusionsA portable gamma-camera could be a useful and feasible tool for the diagnosis of BD.
El diagnóstico de muerte encefálica (ME), entendido como cese irreversible de todas las funciones encefálicas, equivale en la práctica clínica al fallecimiento del individuo y por tanto exige una responsabilidad y una sistemática en la exploración que le confieran una certeza diagnóstica sin margen de error1–3. El rigor de una exploración metódica se detalla en las guías de práctica clínica4 y se regula en España por el RD 1723 de 28 de diciembre de 20125. La norma vigente exige la realización de 2 exploraciones clínicas completas separadas por un periodo de tiempo variable, o una única exploración, acompañada de una prueba complementaria6 con el objetivo de que la duración del proceso diagnóstico resulte tan corta como sea posible, y de esta manera, evitar el deterioro de los órganos, una parada cardiaca inesperada y/o el agotamiento de los familiares7.
Las pruebas complementarias se dividen en aquellas que evalúan la función del encéfalo (electroencefalograma [EEG] y potenciales evocados)8,9 y otras que miden su flujo sanguíneo10–19, mediante la determinación de su circulación vascular y/o de su perfusión tisular (arteriografía, angiorresonancia, angio-TC, gammagrafía y doppler transcraneal [DTC]).
Desde el punto de vista fisiopatológico, la ausencia de flujo sanguíneo intracraneal junto con una exploración clínica compatible representa la ME. Por el contrario, en determinadas circunstancias que impiden que la presión intracraneal supere a la sistémica (craneotomías amplias, derivaciones ventriculares, grandes traumas de la bóveda craneal) algunos pacientes en ME pueden conservar una cantidad variable de circulación sanguínea intracraneal, si bien ineficaz para su función y metabolismo20–22. En este mismo sentido, ciertas situaciones como la sedación profunda, la hipotermia o algunas intoxicaciones, pueden derivar en ausencia reversible de la actividad neuronal determinada por las pruebas funcionales23–25.
Entre las características ideales que debe presentar un test diagnóstico se incluyen26: objetividad y fiabilidad, un alto valor predictivo positivo, gran disponibilidad, bajo coste, reducida invasividad y breve lapso de ejecución para minimizar los tiempos. Otros factores también importantes en caso de ME serían la ausencia de efectos secundarios relevantes en el paciente o sus órganos y no resultar influida por fármacos depresores del sistema nervioso central. Además, debe permitir su realización a pie de cama, no depender del explorador y resultar fácilmente reproducible. En la tabla 1 se han resumido las principales ventajas y limitaciones que presentan cada una de las pruebas instrumentales utilizadas en el diagnóstico de ME.
Características de las pruebas instrumentales utilizadas en el diagnóstico de muerte encefálica
| Prueba instrumental | EEG | PPEE | Arteriografía | DTC | Angio-TC | Gammagrafía |
|---|---|---|---|---|---|---|
| Invasiva | No | No | Sí | No | Poco invasiva | Poco invasiva |
| Especificidad | Baja | Baja | Alta | Alta | Alta | Alta |
| Sensibilidad | Alta | Alta (depende tipo PPEE) | Alta | Alta | Alta | Alta |
| Traslado paciente | No | No | Sí | No | Sí | Sí/No (portátil) |
| Interpretación | Fácil | Difícil | Fácil | Fácil | Fácil | Fácil |
| Otras limitaciones | Artefactos con dispositivos de monitorizaciónNo detecta estructuras subcorticales | Artefactos con dispositivos de monitorizaciónNo útiles en casos de sordera previa y/o fractura de peñasco | Falsos negativos en craniectomía descompresiva y encefalopatía postanóxicaNo valora perfusiónPrecisa sala de radiología vascular | Operador dependienteAusencia de ventana en algunos pacientes (10-20%)Falsos negativos en craniectomía descompresiva y encefalopatía postanóxica | Falsos negativos en craniectomía descompresiva y encefalopatía postanóxica | Precisa Servicio de Medicina Nuclear |
| Necesidad de contraste | No | No | Sí | No | Sí | No |
| Interferencia con sedantes | Sí | No | No | No | No | No |
DTC: doppler transcraneal; EEG: electroencefalograma; PPEE: potenciales evocados.
Dentro de los test diagnósticos disponibles la gammagrafía de perfusión cerebral con trazadores lipofílicos, como tecnecio 99 metaestable-hexametil-propilen-amino-oxima, ha sido ampliamente validada para el diagnóstico de ME. Siempre y cuando el procedimiento cumpla el estándar óptimo de calidad exigido, la gammagrafía se convierte en una prueba segura, fácil de realizar e interpretar y con una sensibilidad y especificidad cercana al 100%27. No obstante, su uso en la actualidad es limitado, principalmente por la dificultad que conlleva trasladar a un paciente crítico hasta el servicio de medicina nuclear.
El objetivo de nuestro estudio fue evaluar la factibilidad del empleo de la minigammacámara portátil (MGP) Sentinella®, para el diagnóstico de ME.
Material y métodosEstudio observacional y prospectivo, realizado en una unidad de cuidados intensivos (UCI) de 32 camas que atiende a pacientes médicos y quirúrgicos en un hospital de tercer nivel y centro de referencia regional para neurocirugía e intervencionismo neurovascular.
Durante un periodo de un año (enero a diciembre 2017) se registraron de forma consecutiva los pacientes mayores de 18 años de edad que tras su ingreso en UCI fueron diagnosticados de ME según criterios clínicos. Todos ellos fueron sometidos a evaluación clínica sistemática y a una exploración complementaria (DTC o EEG según criterio médico). Adicionalmente, se practicó un estudio gammagráfico con MGP para observar la concordancia de los hallazgos encontrados.
Aspectos éticosEl estudio se desarrolló sin interferir ni modificar los cuidados clínicos de cada uno de los casos. Todos los pacientes o sus representantes otorgaron su consentimiento por escrito para la realización del procedimiento mediante un documento de consentimiento informado. La obtención, archivo y uso de la información personal de los pacientes observó la legislación vigente en España (Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal). El presente estudio no ha recibido ningún soporte financiero. El estudio fue aprobado por el comité ético de investigación clínica del centro.
Aspectos técnicosEEG: el EEG se realizó durante 30min de registro y siguiendo las recomendaciones técnicas de la Sociedad Americana de Electrofisiología9. Se utilizó un equipo de 10 canales (Neurofax, Nihon Kohden®).
Doppler transcraneal: el equipo utilizado fue un Multi-Dop® T Digital y en todos los casos la exploración fue realizada por el mismo equipo médico. En todos ellos se procedió a sonorizar a través de la ventana temporal ambas arterias cerebrales medias (circulación anterior) y a través de la ventana suboccipital, las arterias vertebrales y basilar (circulación posterior). Se aceptó como patrón sonográfico de parada circulatoria cerebral la presencia de «flujo diastólico invertido» y el patrón de «espigas sistólicas» siguiendo las recomendaciones de la Task Force de Neurosonología28 y la Sociedad Española de Neurosonología29 sobre el diagnóstico de ME.
Protocolo del estudio gammagráfico de perfusión cerebral con minigammacámara portátilTras el diagnóstico clínico de ME se solicitó la realización de la prueba al Servicio de Medicina Nuclear, existiendo una demora aproximadamente de unos 30min (tiempo que habitualmente se tarda en preparar el radiofármaco y trasladar la MGP a nuestra unidad). El estudio consta de 6 partes:
1. Preparación y control de calidad de radiofármaco: 15 minutos. El hexametil-propilen-amino-oxima se marcó con aproximadamente 1.110megabequerelios (MBq) de solución inyectable de 99mTc-pertecnetato sódico proveniente de un generador de 99 molibdeno/99 tecnecio metaestable. A continuación, se añadió cloruro de cobalto para estabilizar el compuesto marcado. En todos los marcajes se cumplieron las especificaciones para el eluido (preelución 24h y no más de 2h desde elución). El control de calidad de la preparación consistió en inspección visual, conforme en todos los casos, y determinación de pureza radioquímica tras marcaje, mediante radiocromatografía de doble desarrollo, con resultados superiores al 90% de fracción lipofílica en todas las preparaciones. Se utilizó una dosis fija de 925MBq±10% para adultos, preparada inmediatamente antes de su administración.
2. Transporte del radiofármaco: Una vez preparado, su transporte y movimiento fue el mínimo imprescindible y siempre justificado. Para ello se utilizaron jeringas blindadas y contenedores que evitaron la dispersión del material radiactivo al medio y que resultan fácilmente descontaminables. Se utilizaron circuitos de transporte que evitaron en la medida de lo posible la coincidencia con personal ajeno al proceso.
3. Administración del radiotrazador: La inyección del trazador se realizó utilizando una jeringa blindada y en forma de bolus, a través de una vía venosa central, seguida inmediatamente de una inyección de 10cc de suero salino fisiológico.
4. Obtención de las imágenes: Se adquirieron imágenes estáticas de cerebro a los 5min postinyección en ambas proyecciones laterales, usando para ello la MGP Sentinella®. El tiempo de adquisición de cada imagen fue de 300s; para ello se utilizó un colimador tipo Pinhole de 2,5mm de diámetro. La sensibilidad del sistema con este colimador es de 110cpm/μCi (cuentas por minuto/microcurios) a 5cm de distancia y de 38cpm/μCi a 10cm de distancia, y la resolución espacial a los 3, 5 y 10cm es de 5,4; 7,3 y 12,3mm, respectivamente.
5. Análisis de las imágenes: La interpretación de las imágenes fue realizada por médicos especialistas en medicina nuclear. La ausencia de perfusión en hemisferios cerebrales y fosa posterior (signo del «cráneo hueco») se consideraba como el patrón gammagráfico compatible con ME. Cabe resaltar que durante todo el estudio, los pacientes mantuvieron una tensión arterial sistólica superior a 100mmHg, confirmada mediante monitorización arterial.
6. Cuidados posgammagrafía: Los cuidados del paciente no se modificaron por parte del personal de UCI, si bien en la medida de lo posible se evitó el contacto directo (distancia menor de 30cm) durante periodos superiores a 10min en la primera hora tras la realización de la prueba. Esta recomendación se consensuó con el servicio de radioprotección del hospital quien procedió a la realización de un análisis a través de dosimetría de área de la radiación recibida de cada estudio por los trabajadores profesionalmente expuestos (tabla 2). La dosis recibida por paciente de un profesional que permanezca 5min después de la inyección del radiotrazador a una distancia menor de 30cm durante más de 10minutos sería de 9,9microsievert (μSv) lo que equivaldría al 1% del límite de dosis para exposición poblacional en un año (1miliSievert/año) o el 0,0495% del límite de dosis para exposición ocupacional en un año (20miliSievert/año)30.
Radiación recibida de cada estudio por los trabajadores profesionalmente expuestos en función de la distancia al paciente, tiempo de contacto y tiempo tras la inyección del radiotrazador
| Distancia con el paciente tras procedimiento | Contacto(<30 cm) | 1m | 2m | 5m |
|---|---|---|---|---|
| Tasa de dosis (μSv/h) | 60 | 3 | 0,75 | 0,12 |
| Tiempo tras inyección (minutos) | 5 | 5 | 30 | 30 |
| Tiempo en contacto con el paciente (minutos) | 10 | 30 | 60 | 180 |
| Dosis recibida por paciente (μSv) | 9,9 | 1,5 | 0,71 | 0,34 |
| Límite anual público (mSv) | 1mSv/año | |||
| N.o pacientes/año para alcanzar límite anual público | 101 | 673 | 1.413 | 2.943 |
| Dosis promedia de radiación natural en España | 6,5μSv/día | |||
mSv: miliSievert; μSv: microSievert; μSv/h: microSievert/hora.
Los datos se expresaron como medias, medianas o proporciones con sus correspondientes desviaciones estándar o rangos intercuartílicos, según fuera apropiado. Para el soporte y tratamiento de los datos se realizó el paquete estadístico: Statistical Package for the Social Sciences (SPSS) (IBM, Armonk, NY, EE. UU.), en su versión 22.0.
ResultadosDurante el periodo de estudio, 56 pacientes fueron diagnosticados de ME por criterios clínicos. En todos los pacientes se realizó un EEG o DTC (según criterio medico), así como, una gammagrafía con el dispositivo Sentinella® (tabla 3). Una vez confirmada la ME, se obtuvo el consentimiento para la donación de órganos, siendo la tasa de aceptación del 92%.
Principales características demográficas y prueba realizada para el diagnóstico de muerte encefálica
| Edad (mediana [RIQ: «años»]) | 60 [RIQ: 51-72] años |
| Sexo (hombres [%]/mujeres [(%]) | 66,1% (37/56)/33,9% (19/56) |
| Tiempo desde ingreso a ME (mediana [RIQ:«horas»]) | 40 [RIQ: 23, 84]horas |
| Hipertensión arterial (%) | 57,1% (32/56) |
| Diabetes mellitus (%) | 30,4% (17/56) |
| Dislipidemia (%) | 28,6% (16/56) |
| Doppler transcraneal (%) | 82,1% (46/56) |
| Electroencefalograma (%) | 17,8% (10/56) |
| Gammagrafía portátil (%) | 100% (56/56) |
ME: muerte encefálica; RIQ: rango intercuartílico.
La mediana de edad de los pacientes que se diagnosticó de ME fue de 60 [RIQ: 51-72] años, 66,1% fueron de sexo masculino y la patología que determinó en mayor frecuencia la causa de la muerte fue la vascular. De forma detallada encontramos que 17 (30,4%) pacientes ingresaron por traumatismo craneoencefálico grave, 4 pacientes (7,1%) por encefalopatía post-anóxica tras parada cardiaca y 35 pacientes (60,8%) por patología vascular cerebral (isquémica y/o hemorrágica). Entre estos últimos encontramos 2 pacientes con hemorragia subaracnoidea, 6 pacientes con ictus isquémico extenso y 27 pacientes con ictus hemorrágico (tabla 4). La mediana de tiempo desde el ingreso hasta el diagnóstico de ME fue de 40 (RIQ: 23, 84)h.
Se realizó DTC en 46 (82,1%) pacientes, siendo el patrón de flujo observado compatible con ME. En los 10 pacientes restantes fue imposible insonar de manera adecuada tanto la circulación anterior como posterior en ambos hemisferios, motivo por el que se decidió la realización de EEG como prueba diagnóstica complementaria para el diagnóstico. En todos ellos se obtuvo un registro electroencefalográfico sin actividad bioeléctrica cerebral.
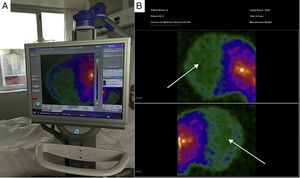
A los 56 pacientes estudiados se les realizó «in situ», a la cabecera del paciente (fig. 1.A), el estudio gammagráfico con la MGP. En todos ellos, se demostró la ausencia de perfusión en hemisferios cerebrales y fosa posterior (signo del «cráneo hueco»), lo que resultaba gammagráficamente compatible con la sospecha clínica de ME (fig. 1.B). Tan solo en un paciente se tuvo que recurrir a realización de proyección anteroposterior y a correlacionar con imagen de TC previa por presentar dudosa aunque mínima actividad en región temporal derecha periférica que correspondía con zona de foco traumático en relación con cefalohematoma, por lo que finalmente se pudo confirmar el diagnóstico de ME. El procedimiento fue bien tolerado, no encontrándose ninguna complicación.
Imagen A: Estudio con minigammacámara portátil (Sentinella®) realizado a la cabecera del paciente. Imagen B: Imágenes en proyección lateral obtenida de minigammacámara portátil (Sentinella®). Señalado con flechas se visualiza la ausencia de captación de radiotrazador tanto en corteza cerebral como en fosa posterior (signo del «cráneo hueco»). Hallazgo gammagráficamente compatible con muerte encefálica.
Las pruebas que ayudan en el diagnóstico de ME generalmente se realizan en pacientes que fallecen por lesión cerebral grave, conectados a un respirador y a múltiples sistemas de monitorización. Establecer un correcto y temprano diagnóstico es muy importante desde el punto de vista clínico y médico-legal, además de tener elevada relevancia para la posibilidad de donación de órganos.
Históricamente se ha considerado la arteriografía cerebral el estándar de referencia en el diagnóstico de ME. Sin embargo, el procedimiento resulta complejo, implica trasladar al paciente a la sala de neurorradiología, puede presentar falsos negativos en craniectomía descompresiva o portadores de drenaje ventricular, y supone administración de contraste con el potencial efecto tóxico sobre los órganos potencialmente trasplantables por lo que progresivamente se ha ido abandonando su uso13. Por otro lado, la realización de angio-TC ha visto aumentada su indicación dada su amplia disponibilidad, sin embargo consideramos que presenta las mismas limitaciones que la arteriografía, pues no evita el traslado del paciente fuera de la UCI, la administración de contraste ni los posibles falsos negativos en situaciones de encefalopatía anóxica o craniectomía descompresiva22, no aportando ventajas respecto al diagnóstico mediante MGP.
En España, y según datos publicados en un estudio descriptivo multicéntrico con 1.844 pacientes diagnosticados de ME en 42 UCI, la exploración complementaria más frecuentemente utilizada es el EEG seguida por el DTC. Esta última se ha convertido en la prueba instrumental no invasiva que ha ganado más popularidad en los últimos años, situándose a la cabeza de los test que evalúan el flujo, a pesar de sus limitaciones conocidas31.
En los trabajos de revisión publicados en los últimos años por grupos de expertos se coincide en señalar que la gammagrafía de perfusión cerebral es una exploración de primera línea, considerada el estándar de referencia. De hecho, en EE. UU. resulta ser el test más utilizado para el diagnóstico de ME32. Una de sus principales ventajas es que se trata de una técnica con una sensibilidad y especificidad cercana al 100%33, junto a su ausencia de interferencia con fármacos sedantes, su poca invasividad y su valoración tanto de flujo cerebral como de su perfusión, haciendo sencilla la interpretación de su imagen34.
Sin embargo, a pesar que su utilidad está ampliamente demostrada en la bibliografía, su uso en nuestro país no se encuentra tan extendido. Una de las principales razones es el traslado del paciente hasta el servicio de medicina nuclear, lo que no resulta práctico ni seguro, así como que no todos los centros disponen de una gammacámara. No obstante, en los últimos años, se han ido perfeccionando dispositivos portátiles, que permiten realizar el estudio a pie de cama35, evitando el traslado fuera de la unidad de críticos. Así pues, el uso de la MGP se ha extendido y presenta resultados probados en detección del ganglio centinela en cirugía de cáncer de mama, tumores de cabeza y cuello, y urológicos36. En el diagnóstico de ME, la experiencia de la MGP todavía es limitada37, pero podría convertirse en un instrumento práctico y fiable como prueba instrumental en el diagnóstico de ME a raíz de los resultados aquí publicados.
El uso de MGP ofrece una información fidedigna acerca del estado de perfusión encefálica en términos de viabilidad neuronal38. Además es importante señalar que la realización e interpretación de la exploración es sencilla, los resultados no están influidos por los factores que habitualmente limitan, dificultan o imposibilitan el diagnóstico clínico, y las imágenes obtenidas quedan registradas en un documento gráfico fácilmente comprensible, incluso para personas sin formación específica previa, siempre y cuando el procedimiento aplicado cumpla el estándar óptimo de calidad exigido39.
En la actualidad, existen 34 equipos similares al nuestro en España, lo cual constituye una parte importante de los servicios de medicina nuclear. Sin embargo su indicación para el diagnóstico de ME todavía es escasa. En 2009, Calvo et al.37 publican el caso clínico de un paciente diagnosticado de ME a través de MGP, destacando la misma como un método diagnóstico útil y abriendo una puerta a la realización de estudios más amplios que permitan determinar la sensibilidad y la especificidad de la técnica. En nuestra investigación la MGP presenta una excelente concordancia con los otros métodos diagnósticos utilizados (exploración clínica, EEG y DTC), no existiendo discrepancias entre los diferentes métodos, y obteniendo una sensibilidad y especificidad del 100%.
Por otra parte, el equipo tiene el tamaño similar a un ecógrafo, lo cual potencialmente permitiría su desplazamiento. Podría resultar interesante el desarrollo de una logística entre centros que permita desplazar la gammacámara portátil y/o el personal necesario para realizar el diagnóstico a distancia desde los centros de referencia.
Una de las limitaciones que se podrían encontrar a la hora de implementar el protocolo estaría en relación con la necesidad de disponer de un servicio de radiofarmacia para preparar el radiofármaco. Sin embargo, para otras indicaciones del procedimiento, muchas comunidades han externalizado la preparación de radioisótopos a empresas que los proporcionan en un breve espacio de tiempo. Además la mayoría de los hospitales que disponen de un servicio de medicina nuclear cuentan con la posibilidad de disponer del radioisótopo y la realización de la exploración no exige de otros equipos de detección especializados ni sofisticados. Por otra parte, es preciso disponer de un médico especialista de medicina nuclear disponible si bien, en su mayor parte, no realizan guardias de presencia física. No obstante, la mayoría de los diagnósticos de ME se realizan en horario de mañana o tarde, permitiendo al personal dar cobertura a este procedimiento en su jornada ordinaria. Cabe destacar que el 92% de los estudios con MGP realizados en nuestro servicio fueron realizados antes de las 20h, y tan solo 2 exploraciones fueron solicitadas fuera de este horario.
Por todo ello, creemos que la MGP representa una interesante alternativa. Debido a su relativa facilidad de interpretación, que se trata de una prueba no operador dependiente, su realización a pie de cama, que no se artefacte por sedantes y la ausencia de toxicidad sobre los órganos potencialmente trasplantables podría considerarse una herramienta útil, factible y segura en el diagnóstico de ME.
FinanciaciónArtículo no financiado.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.